骨关节炎(OA)是一种与年龄相关的慢性炎症性疾病,以滑膜炎和进行性软骨退化为特征。OA的病理进展与活性氧(ROS)的过度产生密切相关,活性氧过量驱动巨噬细胞极化为M1表型和软骨基质分解代谢。因此,靶向消除关节内ROS和调节巨噬细胞极化是缓解OA的有前途的策略。

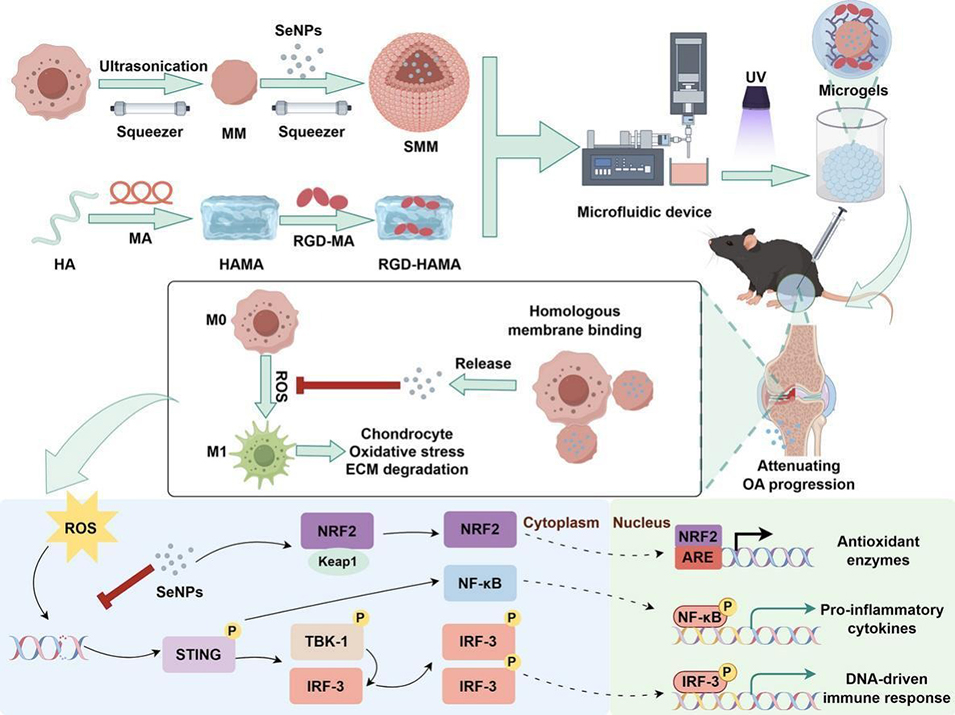
近期,郑州大学第一附属医院研究团队开发出一种级联靶向水凝胶微球系统(SMM@HMs),该系统通过负载巨噬细胞膜包裹硒纳米颗粒的仿生纳米颗粒,实现关节内长效滞留、巨噬细胞精准靶向及活性氧清除,进而调控巨噬细胞极化并保护软骨细胞。相关研究以“Cascade-targeting hydrogel microspheres with biomimetic nanoparticles enable multifaceted anti-inflammatory and antioxidant defense for osteoarthritis management”为题目,发表在期刊《Chemical Engineering Journal》上。
本文要点:
1、本研究通过膜挤出技术提取巨噬细胞膜(MM),随后包裹硒纳米颗粒(SeNPs),构建出仿生纳米颗粒(SMM),借助同源膜融合实现巨噬细胞靶向。
2、以透明质酸(HA)、甲基丙烯酸酐(MA)和RGD肽合成RGD-HAMA水凝胶,通过微流控技术将SMM负载其中,形成微球(SMM@HMs),实现SMM的关节内长效缓释。
3、体内成像系统(IVIS)结果显示,SMM@HMs在关节内的滞留时间延长。释放出的SMM可特异性靶向巨噬细胞并清除活性氧(ROS),进而抑制巨噬细胞向M1型极化。
4、进一步的机制研究表明,SMM@HMs通过刺激Nrf2/GPX4通路抑制巨噬细胞中STING/NF-κB通路、STING/IRF-3通路的激活及炎症因子的表达;此外,其还能通过Nrf2/GPX4轴有效清除细胞内ROS,抑制M1型极化。
5、在软骨细胞层面,经SMM@HMs处理的M1型巨噬细胞所制备的条件培养基,可减轻软骨细胞的氧化应激、线粒体功能障碍与凋亡,同时维持细胞外基质(ECM)代谢稳态。体内实验结果证实,SMM@HMs能减少M1型巨噬细胞浸润,减轻软骨退变。
6、综上,本研究构建的复合微凝胶系统通过时空调控SMM的释放,协同实现特异性靶向、ROS清除、巨噬细胞复极化及ECM保护,为骨关节炎(OA)管理提供了新视角。
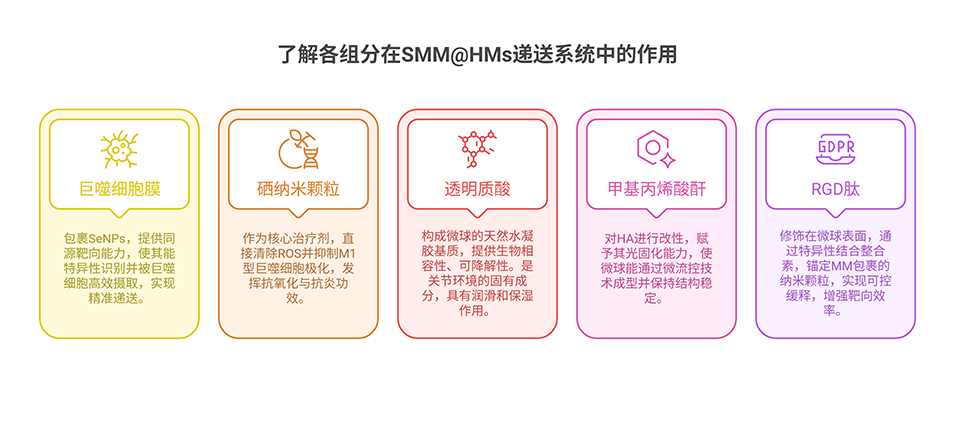
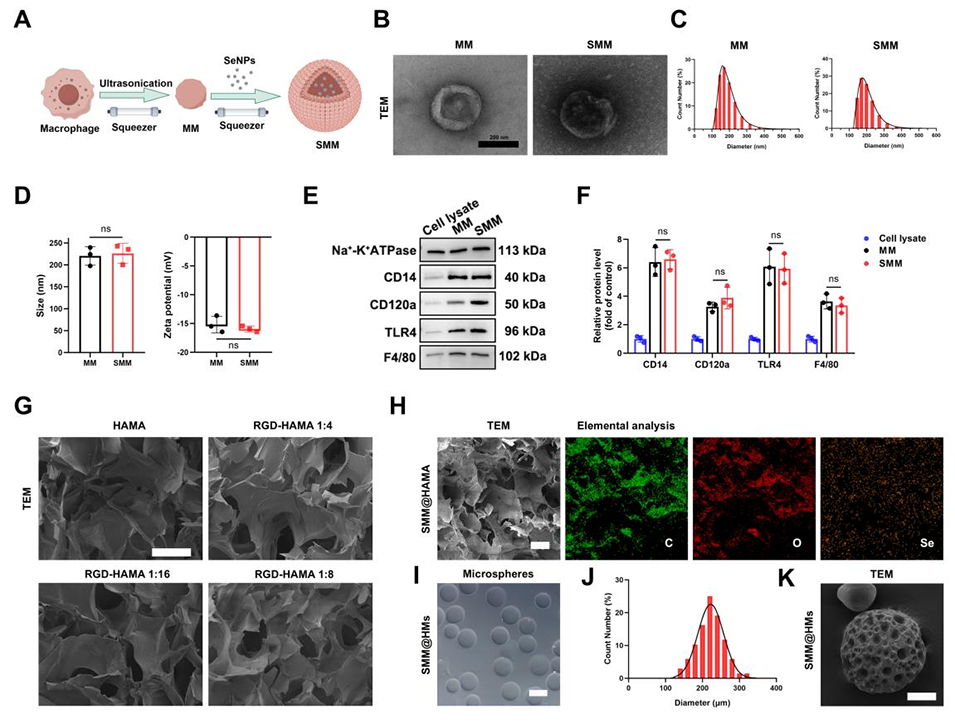
图 1:SMM@HMs 的制备与表征
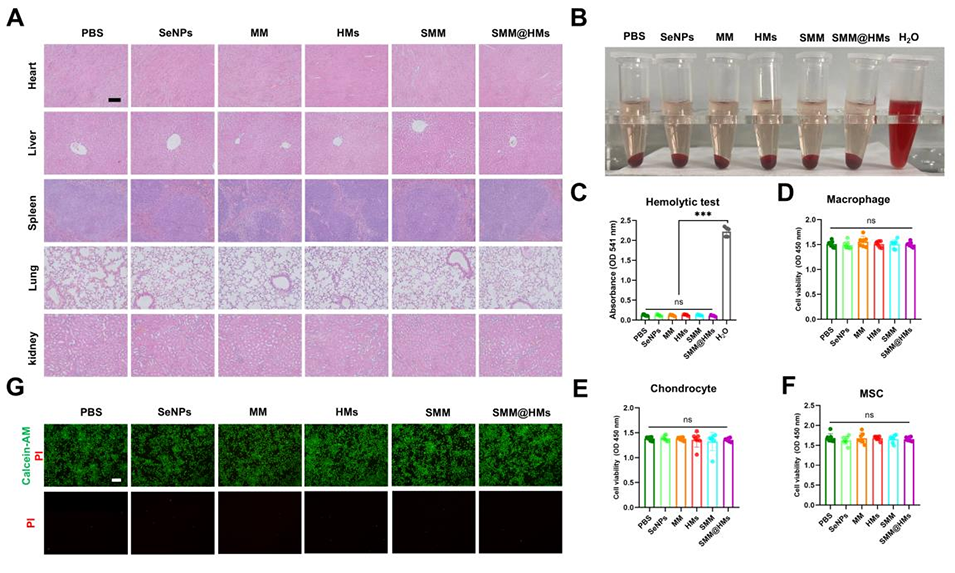
图 2:SMM@HMs 的生物相容性评价
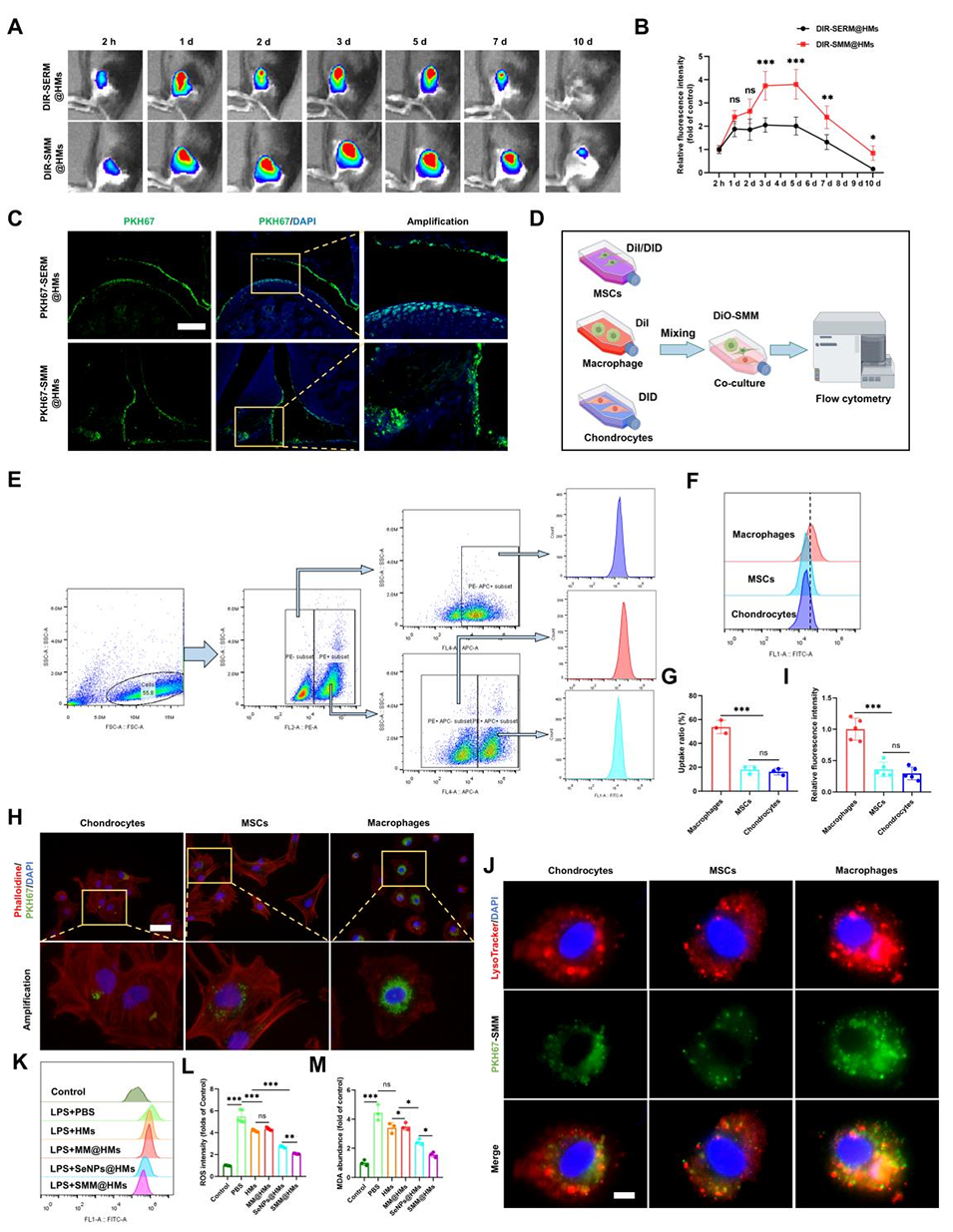
图 3:SMM@HMs 选择性靶向巨噬细胞并清除活性氧(ROS)

图 4:SMM@HMs 通过靶向递送抑制巨噬细胞 M1 型极化

图 5:SMM@HMs 通过激活 Nrf2/GPX4 轴抑制 STING 通路
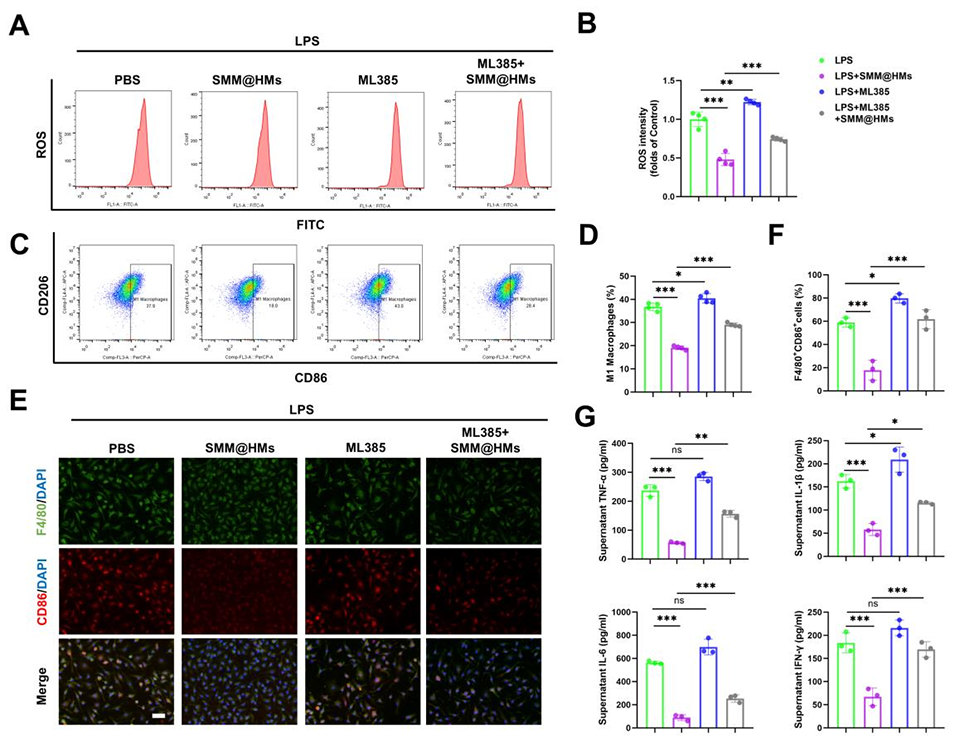
图 6:SMM@HMs 通过激活 Nrf2 清除巨噬细胞内活性氧(ROS)并抑制 M1 型极化
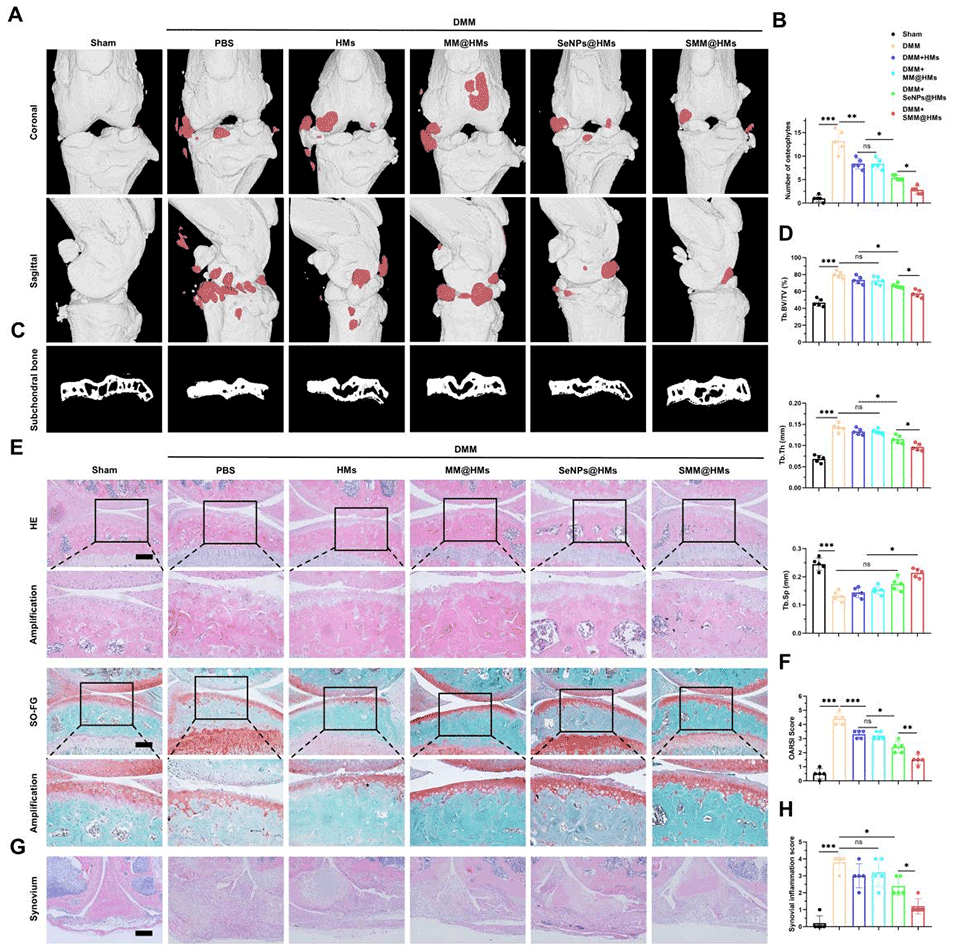
图 7:SMM@HMs 在体内缓解骨关节炎(OA)病理表型
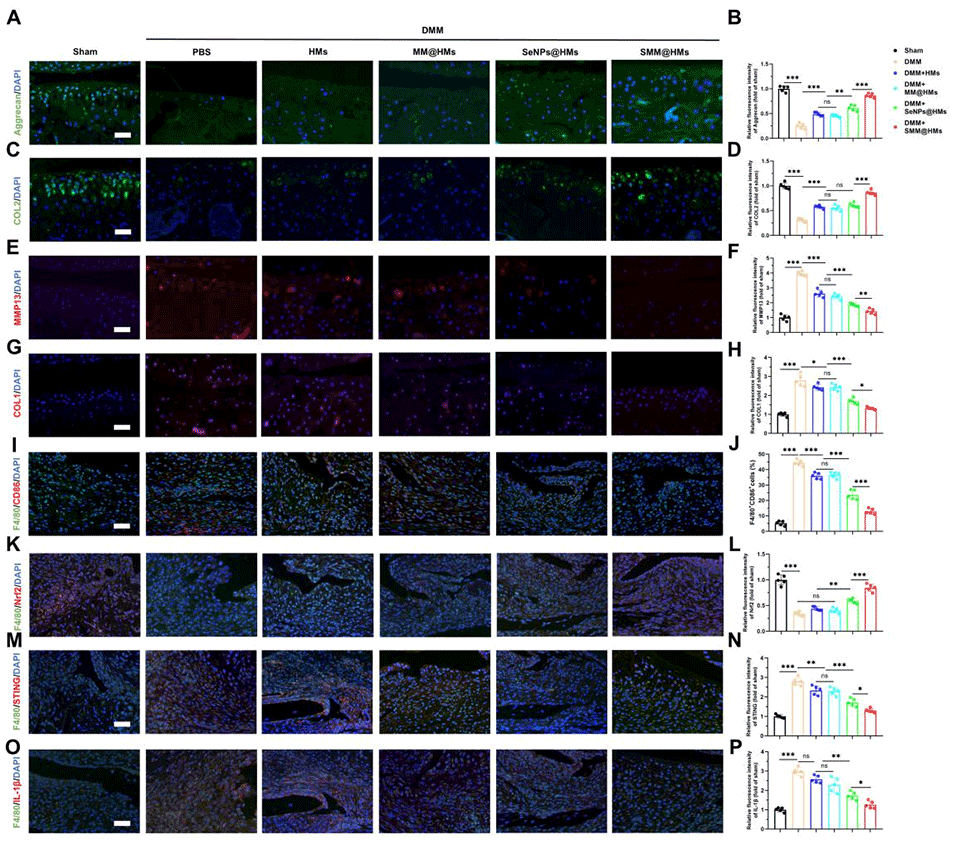
图 8:SMM@HMs 在体内抑制巨噬细胞 M1 型极化并改善细胞外基质(ECM)代谢紊乱
论文链接:https://doi.org/10.1016/j.cej.2025.167490
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














