衣康酸(IA)是一种内源性代谢物,也是天然免疫系统中一种强效的调节剂。然而,由于其高度极性,IA在免疫调节治疗中的应用面临诸多挑战,包括难以实现可控递送以及需要高细胞外浓度才能实现内化,以发挥其细胞内治疗活性。基于微粒(MP)的递送策略通过巨噬细胞的吞噬作用以及随后的胞内聚合物降解释放代谢物,为小分子代谢物的胞内递送提供了一种有前景的解决方案。

近期,有研究人员开发出基于可降解聚酯的衣康酸聚合物微粒(IA-MPs),通过巨噬细胞吞噬作用实现衣康酸靶向胞内递送。该微粒在0.1 mg/百万细胞浓度下可高效内化(>99%)并降解释放衣康酸,显著抑制促炎因子(IL-6、IL-12p40)表达,同时诱导代谢重编程——降低氧化磷酸化依赖并增强糖酵解,重现了内源性衣康酸对琥珀酸脱氢酶(SDH)的抑制机制。相关研究以“Development of Itaconate Polymers Microparticles for Intracellular Regulation of Pro-Inflammatory Macrophage Activation”为题目,发表在期刊《Advanced Healthcare Materials》上。
本文要点:
1、本研究开发了基于可降解聚十二烷基衣康酸酯(poly(IA-DoD))的衣康酸聚合物微粒(IA-MPs),通过乳液法可控制备出目标尺寸(≈1.5 μm)的微粒,旨在解决衣康酸(IA)因高极性和低生物利用度导致的细胞内递送难题。
2、制备的IA-MPs能被脂多糖(LPS)激活的小鼠骨髓源性巨噬细胞(BMDMs)高效吞噬内化,在0.1 mg/百万细胞浓度下,99.96 ± 0.05%的细胞成功摄取微粒,且该浓度下细胞毒性保持较低水平。
3、IA-MPs在巨噬细胞内降解释放IA,有效调节巨噬细胞功能,显著抑制了LPS刺激的BMDMs中关键促炎基因(IL-6, Ccl5, IL-12p40)和蛋白(IL-6)的表达,并降低抗原呈递分子(MHC-II)的表达,其效果与5 mmol/L浓度的游离IA处理相当。
4、IA-MPs处理诱导巨噬细胞发生代谢重编程,表现为对氧化磷酸化(OXPHOS)的依赖性降低和对糖酵解的依赖性增强,这一效应与内源性IA通过抑制琥珀酸脱氢酶(SDH)来阻断TCA循环的机制相一致。
5、该IA-MP平台提供了一种基于巨噬细胞吞噬作用实现IA胞内靶向递送的新策略,为开发治疗炎症性疾病的代谢物递送系统奠定了基础,但其体内疗效和长期行为仍需在未来研究中验证。
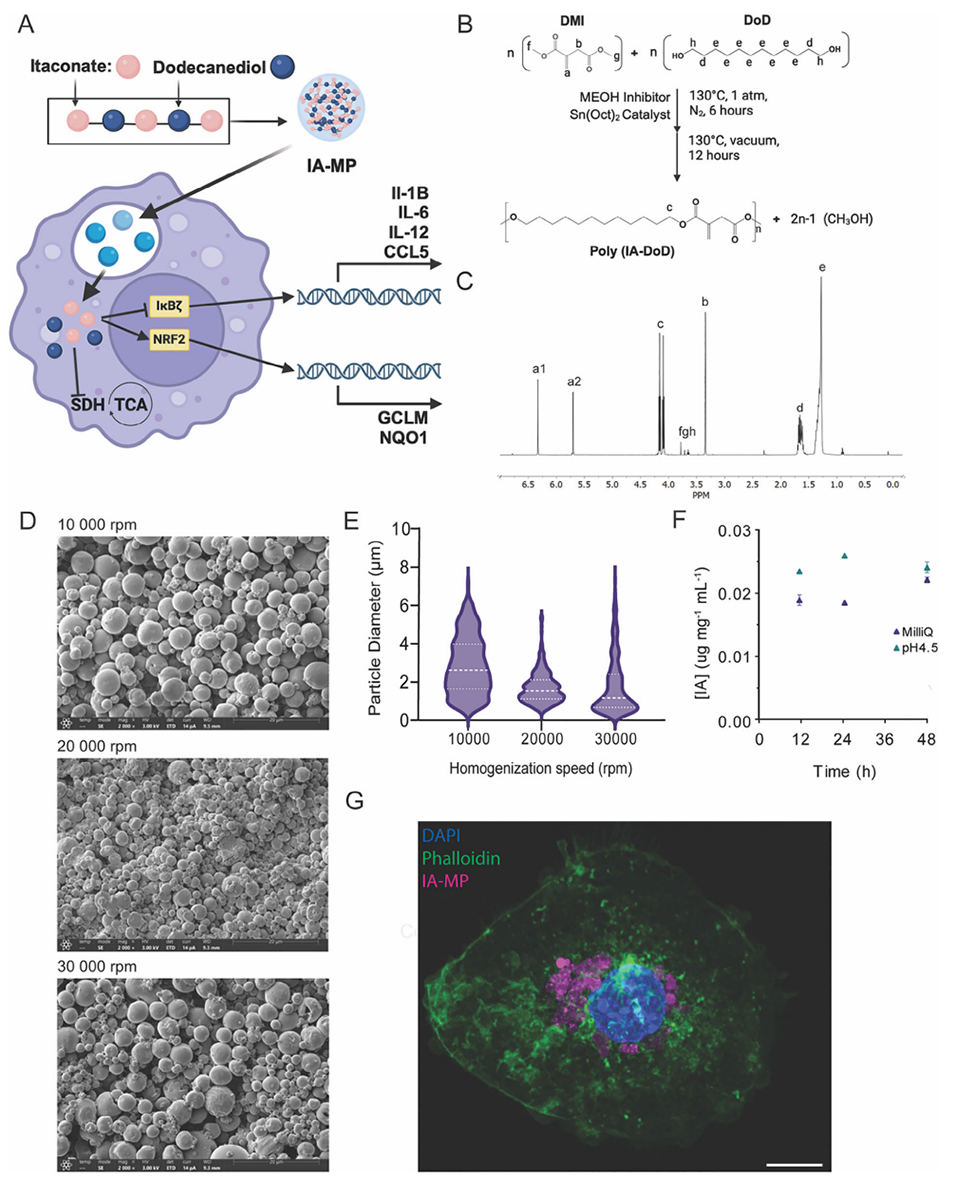
图1.可降解含衣康酯聚合物微粒的开发。
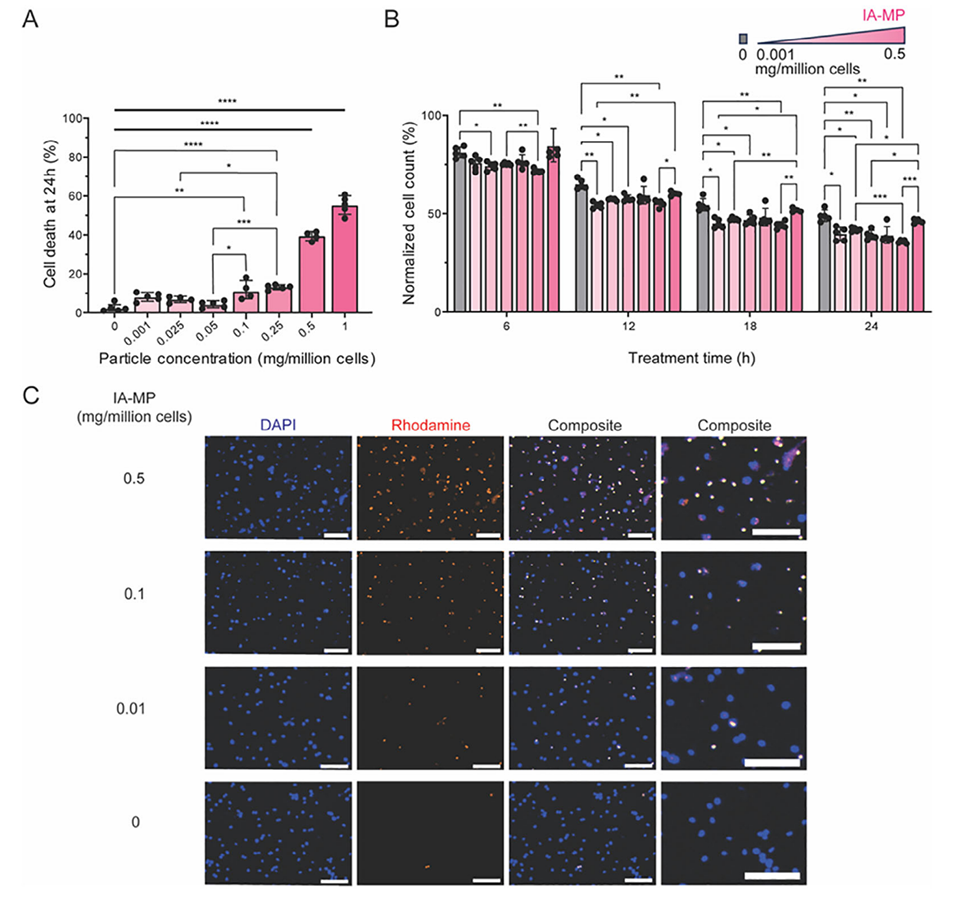
图2.IA-MPs被LPS处理的骨髓源性单核细胞内化且毒性极低。
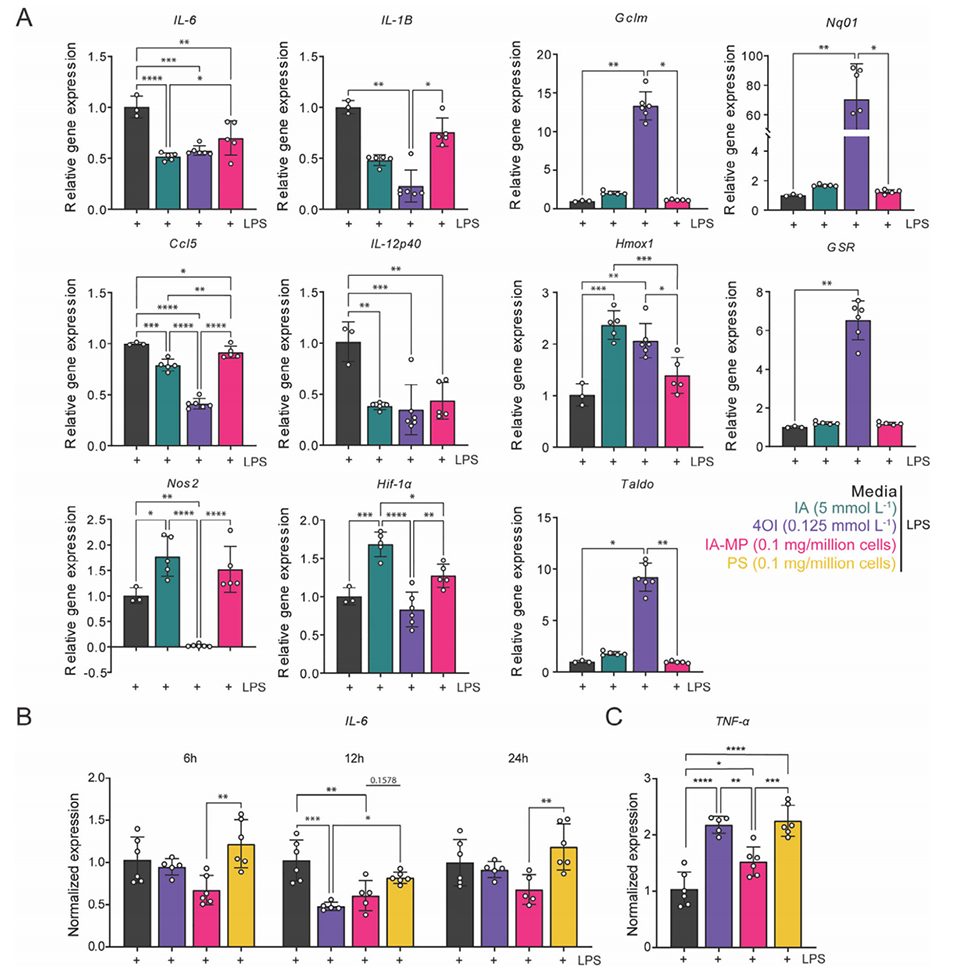
图3.IA-MPs调节炎症巨噬细胞信号。比较BMDM中促炎巨噬细胞标志物的表达。
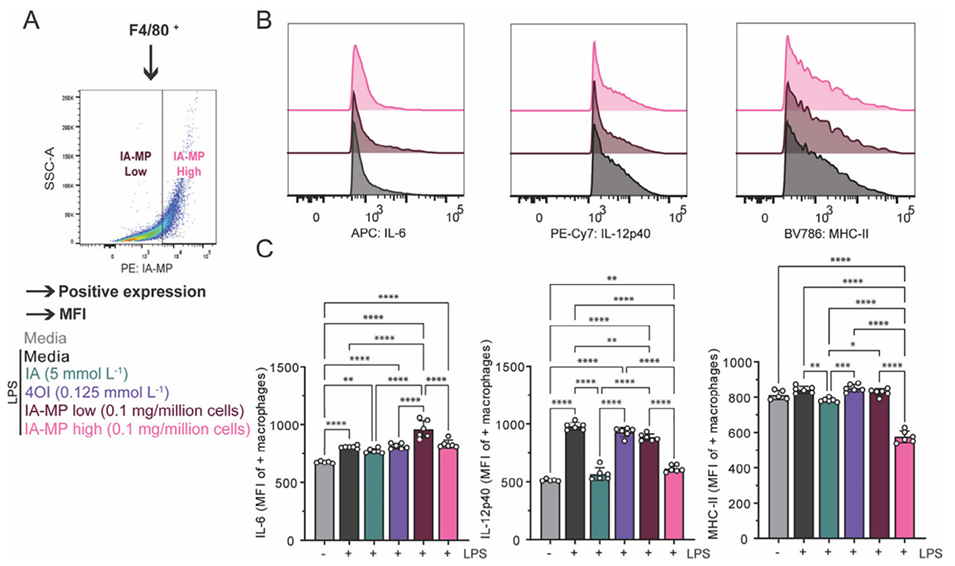
图4.IA-MPs以特异性摄取方式调节炎性巨噬细胞信号传导。
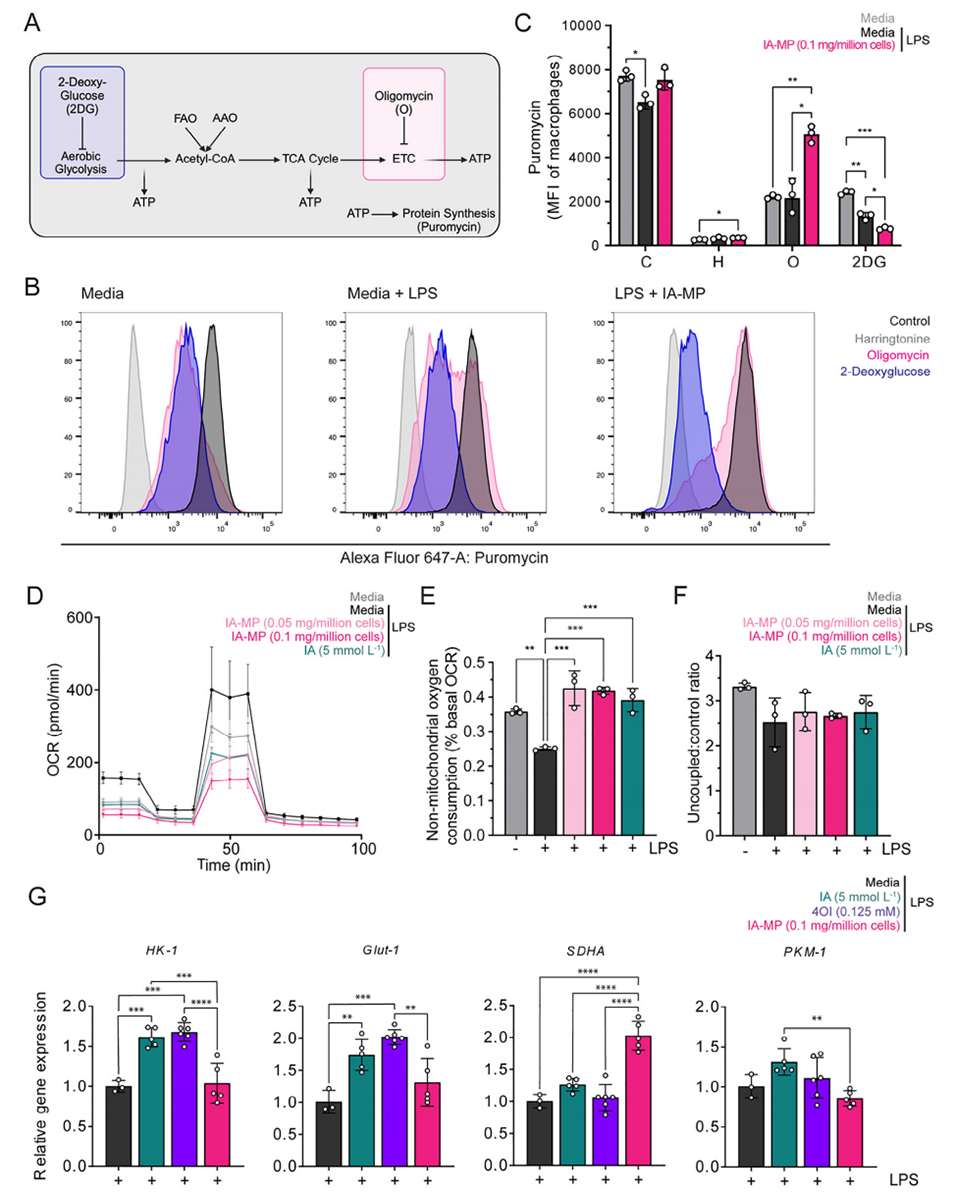
图5.IA-MPs改变巨噬细胞代谢功能。
论文链接:https://doi.org/10.1002/adhm.202405257














