牙周组织中的致病菌和活化免疫细胞持续产生活性氧(ROS)及炎症介质,形成氧化应激微环境,对细胞和组织造成损伤。抗菌策略与活性氧清除对于治疗牙周炎至关重要。

近期,西南医科大学附属口腔医院陶刚副研究员、蔡蕊副教授、黎春晖副教授等人开发了一种基于铁-姜黄素纳米颗粒与光热响应材料的可注射复合微球。该微球通过协同抗菌、清除活性氧及调节巨噬细胞极化等多重机制,在动物实验中显著抑制牙周炎症进展并减少牙槽骨吸收。相关研究以“A multifunctional injectable microsphere with enhanced near-infrared photo-antibacterial, ROS scavenging, and anti-inflammatory properties for periodontitis treatment”为题目,发表于期刊《Theranostics》。
本文要点:
1、本研究采用微流控技术,将铁-姜黄素纳米颗粒(Fe-Cur NPs)包封于甲基丙烯酰化明胶(GelMA)微球中,随后在微球表面修饰聚多巴胺(PDA)层,并结合盐酸米诺环素(MH),构建出多功能复合微球(GM@Fe-Cur/PDA/MH)。
2、GM@Fe-Cur/PDA/MH微球具有优异的黏附性,能够在牙周袋内长期留存以维持其功能。
3、借助PDA的光热特性与MH的协同作用,该微球可有效杀灭细菌并减轻过度免疫反应。
4、此外,在体外氧化应激条件下,其能调控巨噬细胞的M1/M2极化、抑制炎症因子表达并促进成骨蛋白表达。
5、在大鼠牙周炎模型中,GM@Fe-Cur/PDA/MH可有效控制炎症进展并减少牙槽骨流失。其机制可能与调控Nrf2通路清除ROS及抑制NLRP3炎症小体有关。
6、综上所述,GM@Fe-Cur/PDA/MH是一种整合了抗菌、抗氧化、抗炎及减轻骨丢失功能的有效治疗手段,在牙周炎治疗中展现出显著的应用潜力。
该复合微球的多功能协同机制如何突破传统牙周炎治疗的局限性?
传统治疗(如机械清创+局部抗生素)面临三大瓶颈:
1、药物滞留时间短:龈沟液冲刷导致药物快速流失;
2、单一疗效局限:抗生素仅抑菌,无法调控氧化应激与免疫失衡;
3、生物膜屏障:抗生素难以渗透深层菌斑生物膜。
本研究的突破性协同机制:
PDA粘附层→ 解决滞留问题(微球在9 mL/min流速下10分钟保留率>50%);
Fe-Cur NPs → 激活Nrf2通路清除ROS(体外清除率>80%),逆转H2O2对干细胞成骨分化的抑制;
PDA光热+MH抗生素→ 协同破膜杀菌(NIR照射后对 gingivalis杀灭率近100%);
Fe-Cur NPs、PDA层及MH协同调控巨噬细胞极化→ 下调M1型促炎因子(TNF-α/IL-1β降低50%),上调M2型修复因子(IL-10/Arg-1)。
总之,未来牙周炎疗法需从"单一抗菌"转向"微环境多靶点重塑",通过材料设计实现药物递送-免疫调控-组织再生的一体化协同。
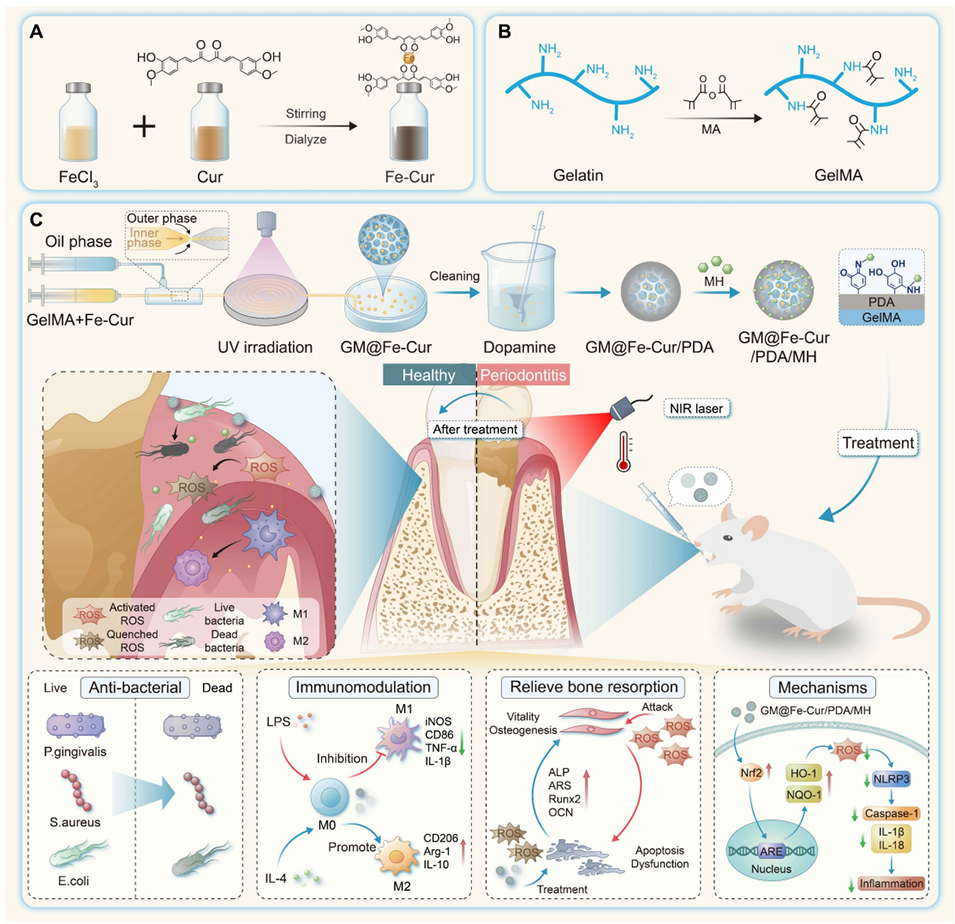
Scheme 1: GM@Fe-Cur/PDA/MH微球的制备过程及牙周炎治疗示意图。(A)铁-姜黄素纳米颗粒(Fe-Cur NPs)的合成示意图。(B)明胶的化学修饰示意图。(C)GM@Fe-Cur/PDA/MH的合成过程及注入牙周袋治疗牙周炎的示意图。
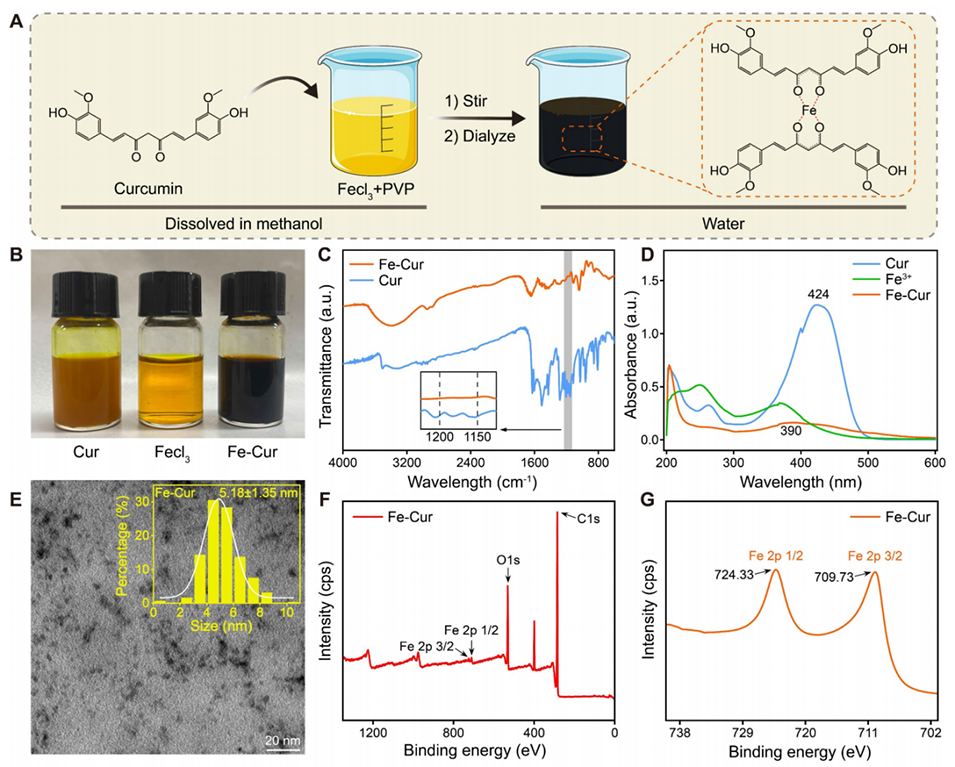
图1:铁-姜黄素纳米颗粒(Fe-Cur NPs)的制备与表征。(A)Fe-Cur NPs的合成示意图。(B)Cur、FeCl3及Fe-Cur NPs溶于甲醇溶液的照片。(C)Cur与Fe-Cur NPs的傅里叶变换红外光谱。(D)Cur、FeC3及Fe-Cur NPs在甲醇中的紫外-可见光谱。(E)Fe-Cur NPs的透射电镜图像及粒径统计图表。(F)Fe-Cur NPs中所有元素的X射线光电子能谱。(G)Fe-Cur NPs中铁元素的X射线光电子能谱。
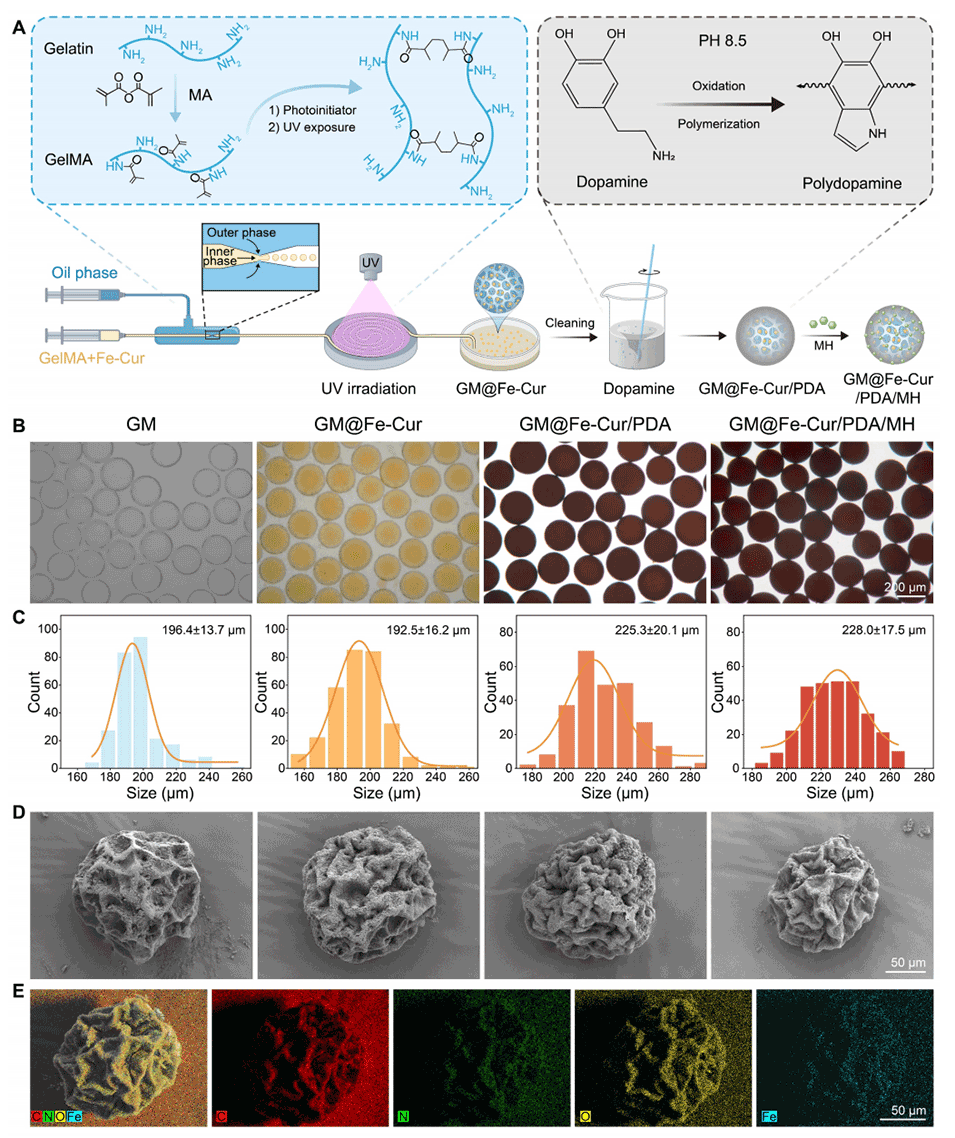
图2:GM@Fe-Cur/PDA/MH的制备与表征。(A)GM@Fe-Cur/PDA/MH的合成过程示意图。(B)四种微球的白光图像。(C)四种微球的粒径分布图表。(D)四种冻干微球样品的扫描电镜图像。(E)GM@Fe-Cur/PDA/MH的元素组成分析。
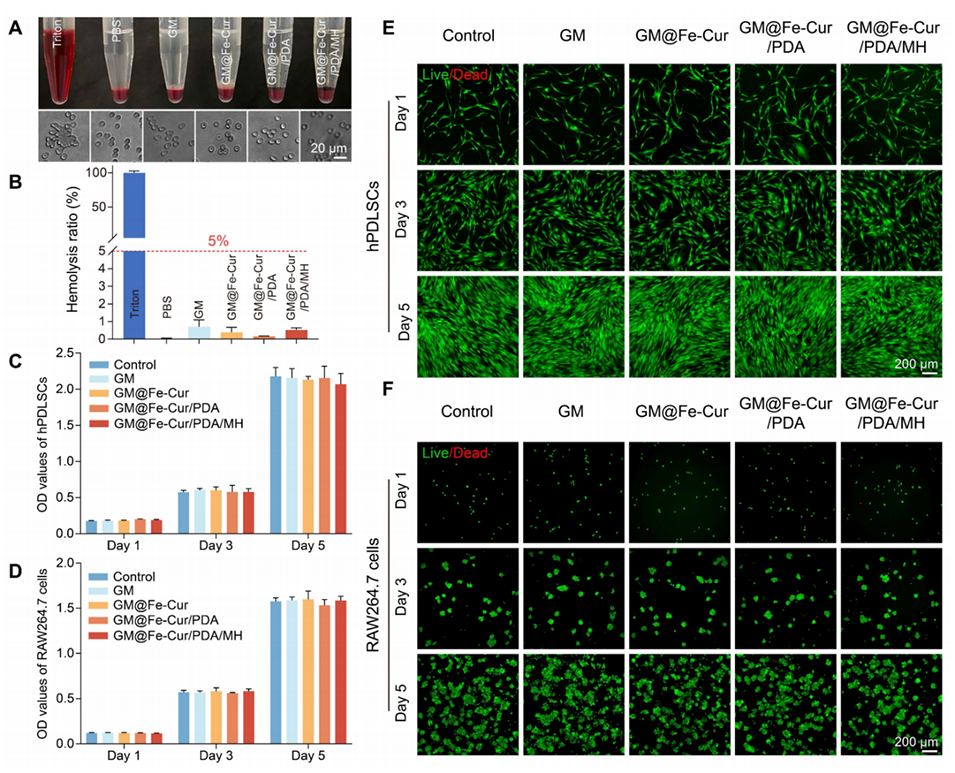
图3:微球的体外血液相容性和细胞相容性。(A)微球与血液孵育后的照片及相应红细胞形态。(B)微球的溶血率。(C)人牙周膜干细胞(hPDLSCs)和(D)RAW264.7细胞在1、3、5天的细胞计数试剂盒(CCK-8)检测结果。(E)hPDLSCs和(F)RAW264.7细胞在1、3、5天的活/死细胞染色荧光图像。
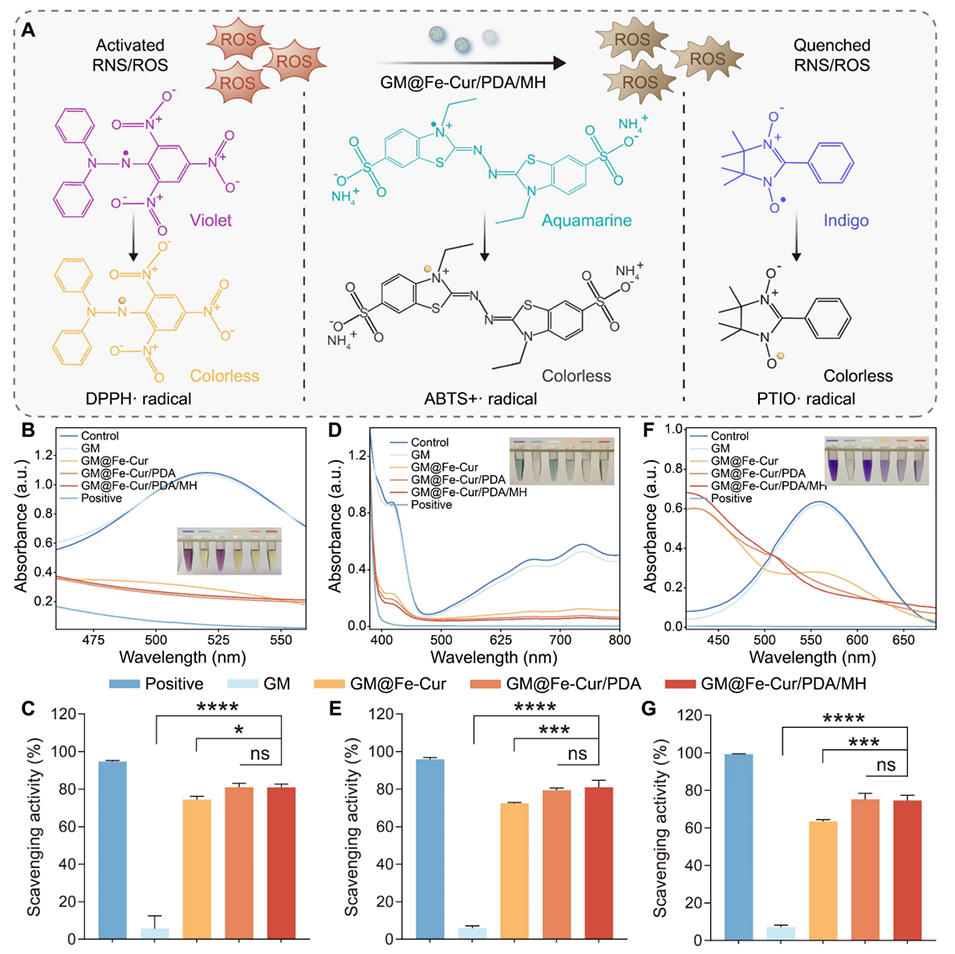
图4:微球的体外自由基清除能力。(A)三种自由基(DPPH・、ABTS+・、PTIO・)清除过程的示意图。(B)DPPH・自由基与微球孵育后的紫外-可见光谱。(C)DPPH・自由基清除率的定量分析。(D)ABTS+・自由基与微球孵育后的紫外-可见光谱。(E)ABTS+・自由基清除率的定量分析。(F)PTIO・自由基与微球孵育后的紫外-可见光谱。(G)PTIO・自由基清除率的定量分析。
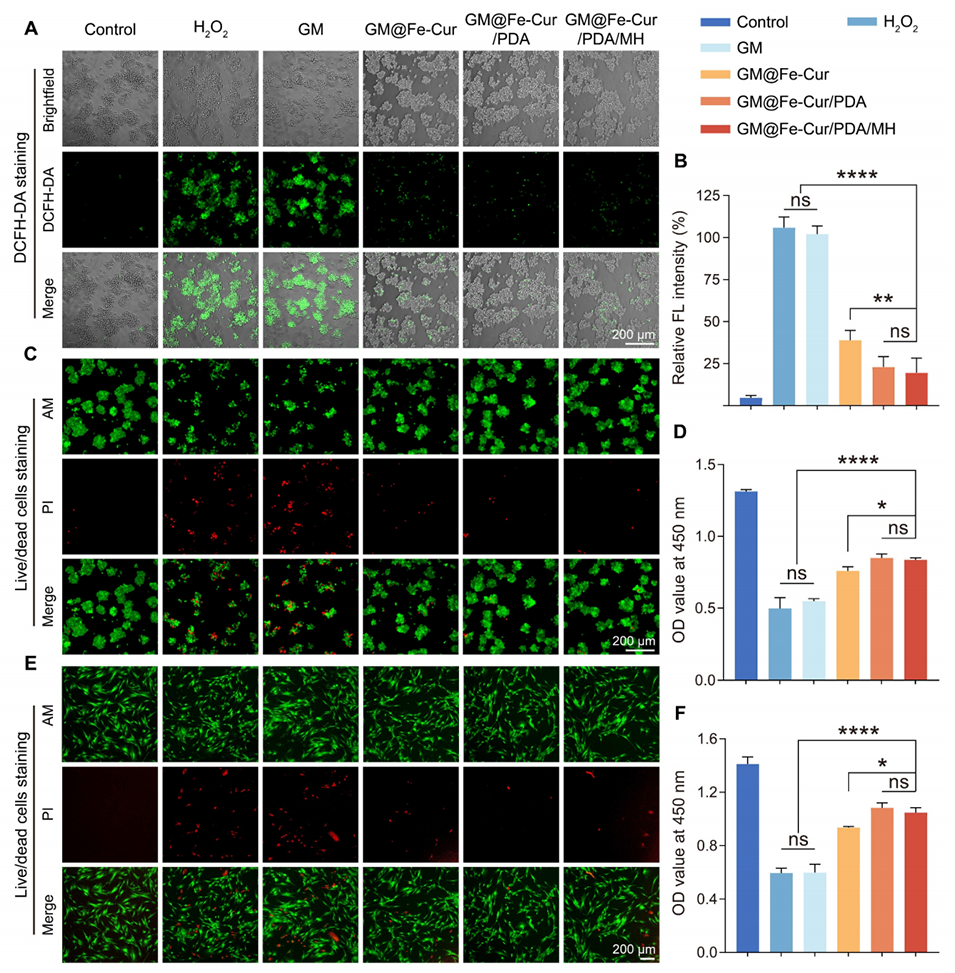
图5:微球在H2O2诱导的氧化应激下对细胞内活性氧(ROS)的清除作用。(A)经不同微球处理后RAW264.7细胞的DCFH-DA染色荧光图像。(B)DCFH-DA荧光强度的定量分析。(C)氧化应激条件下RAW264.7细胞的活/死细胞染色及(D)CCK-8检测结果。(E)氧化应激条件下hPDLSCs的活/死细胞染色及(F)CCK-8检测结果。
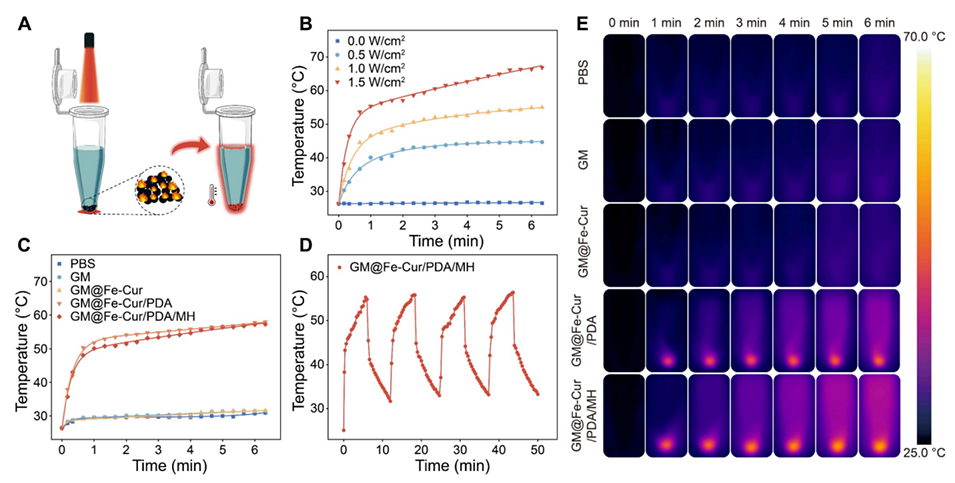
图6:GM@Fe-Cur/PDA/MH的近红外(NIR)光热性能。(A)光热治疗示意图。(B)不同功率下GM@Fe-Cur/PDA/MH的温度变化曲线。(C)磷酸盐缓冲液(PBS)、甲基丙烯酰化明胶微球(GM)、GM@Fe-Cur、GM@Fe-Cur/PDA和GM@Fe-Cur/PDA/MH在1W/cm²近红外激光照射下的温度变化曲线。(D)GM@Fe-Cur/PDA/MH在1W/cm²近红外激光照射四次循环后的光热稳定性。(E)1W/cm²近红外激光照射期间不同微球的红外热成像图。
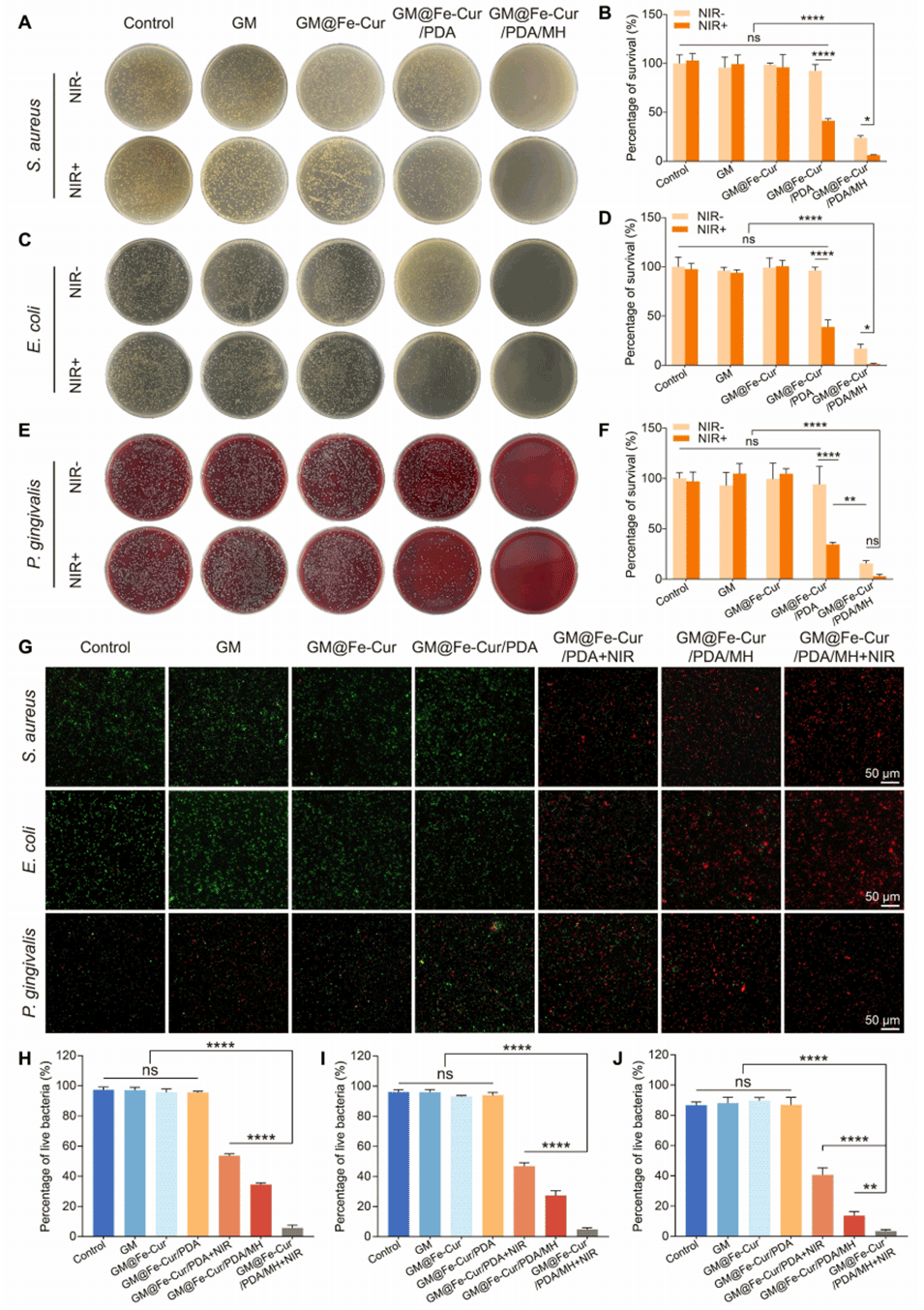
图7:微球的体外抗菌性能。(A)金黄色葡萄球菌(S. aureus)、(C)大肠杆菌(E. coli)和(E)牙龈卟啉单胞菌(P. gingivalis)经不同微球处理后的菌落形成单位照片。对(B)金黄色葡萄球菌、(D)大肠杆菌和(F)牙龈卟啉单胞菌的抗菌活性分析。(G)金黄色葡萄球菌、大肠杆菌和牙龈卟啉单胞菌经不同微球处理后的活/死染色图像。(H)金黄色葡萄球菌、(I)大肠杆菌和(J)牙龈卟啉单胞菌荧光图像的定量分析。
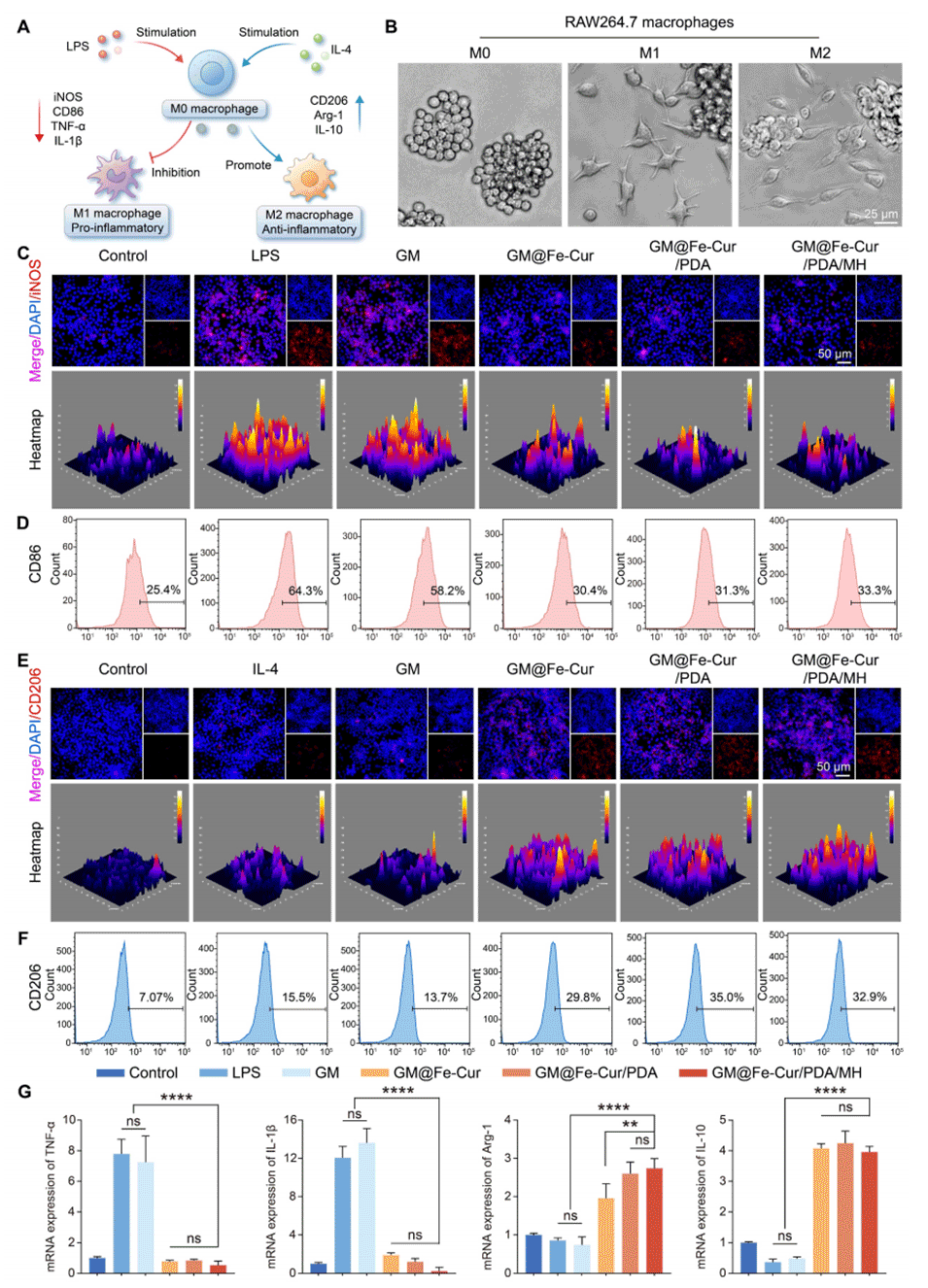
图8:GM@Fe-Cur/PDA/MH对巨噬细胞极化的调控作用。(A)GM@Fe-Cur/PDA/MH抑制M1型巨噬细胞极化同时促进M2型极化的示意图。(B)不同极化条件下RAW264.7细胞的形态变化。(C)M1型(诱导型一氧化氮合酶,iNOS)和(E)M2型(CD206)巨噬细胞标志物的免疫荧光图像。巨噬细胞极化标志物的流式细胞术分析:(D)M1型巨噬细胞的CD86和(F)M2型巨噬细胞的CD206。(G)体外炎症相关细胞因子的mRNA表达水平。
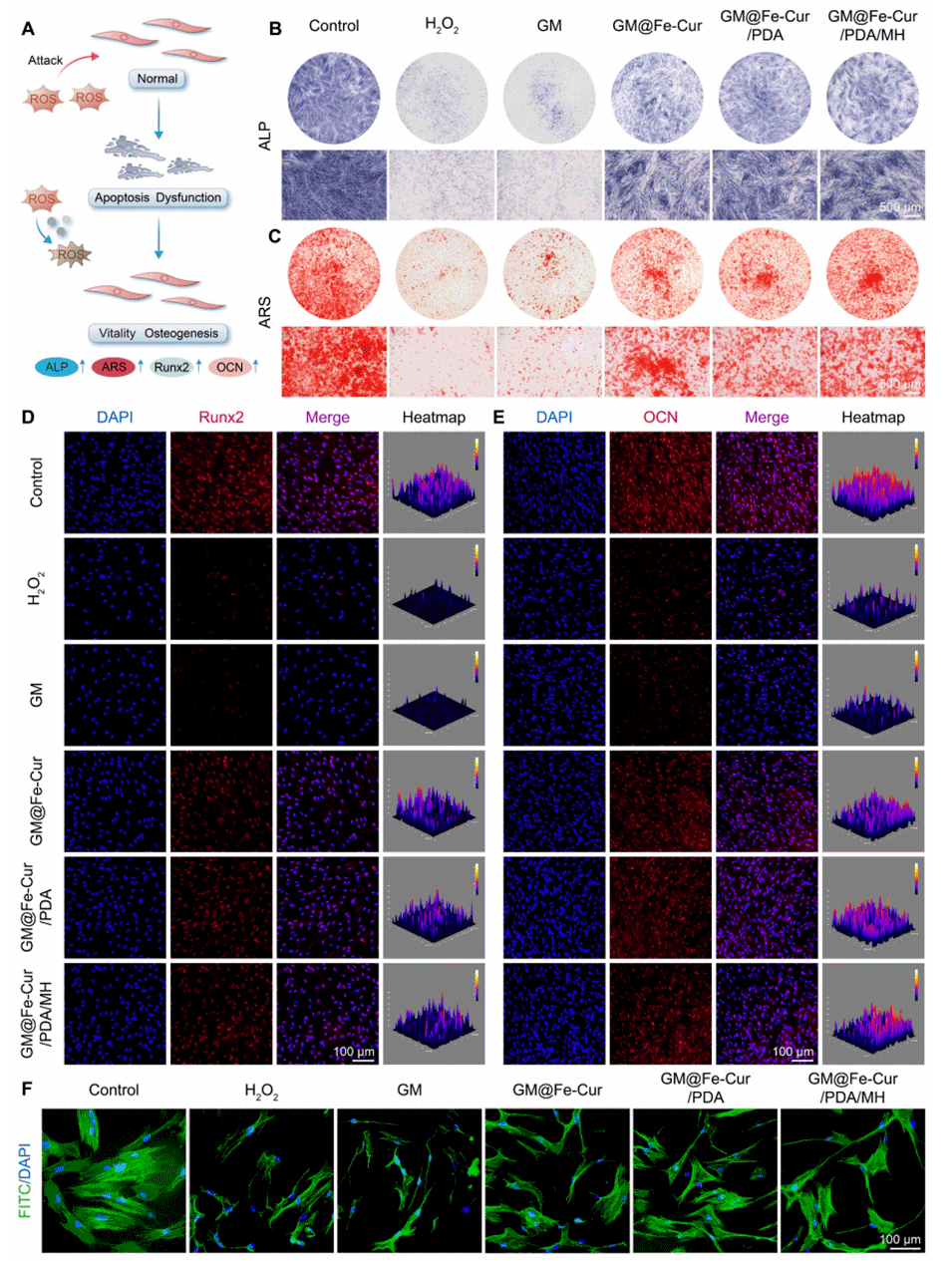
图9:GM@Fe-Cur/PDA/MH在氧化应激条件下对hPDLSCs成骨分化潜能的影响。(A)GM@Fe-Cur/PDA/MH在氧化应激条件下保护hPDLSCs的示意图。(B)hPDLSCs在第7天的碱性磷酸酶(ALP)染色图像。(C)hPDLSCs在第14天的茜素红S(ARS)染色图像。(D)第7天Runx2和(E)第14天骨钙素(OCN)的免疫荧光图像。(F)通过鬼笔环肽染色F-肌动蛋白观察hPDLSCs的细胞形态。
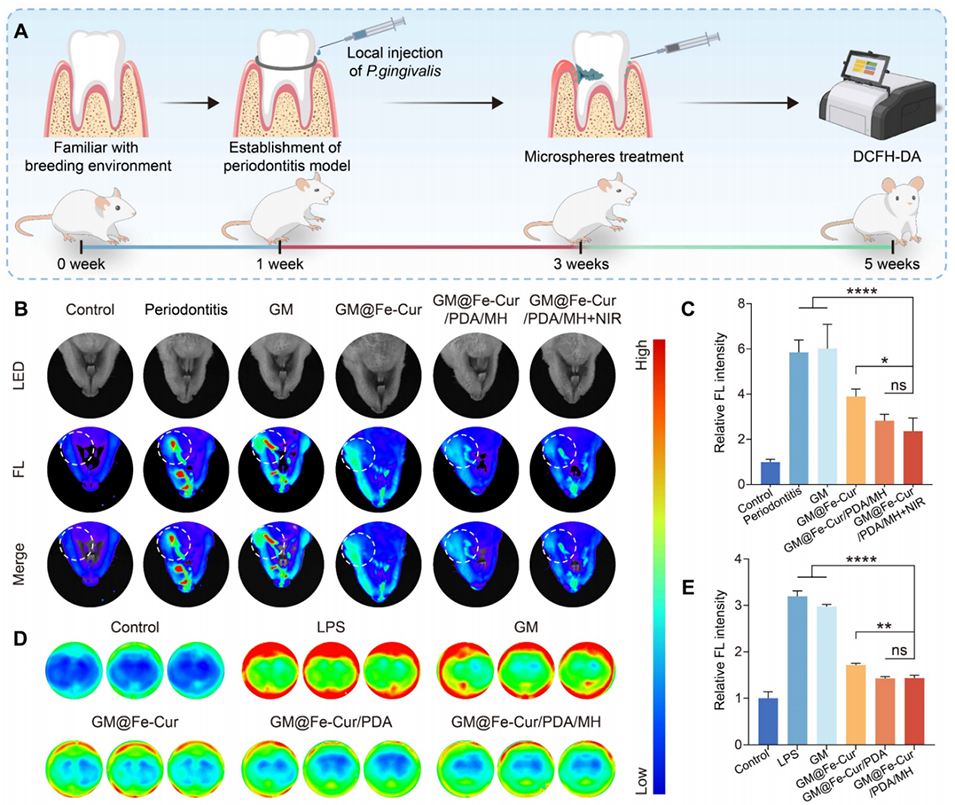
图10:GM@Fe-Cur/PDA/MH在大鼠牙周炎模型中的ROS清除性能。(A)大鼠牙周炎模型构建过程的示意图。(B)微球在大鼠体内ROS清除效果的荧光图像及(C)相应的荧光强度定量分析。(D)微球在脂多糖(LPS)刺激的巨噬细胞中ROS清除效果的荧光图像及(E)相应的荧光强度定量分析。
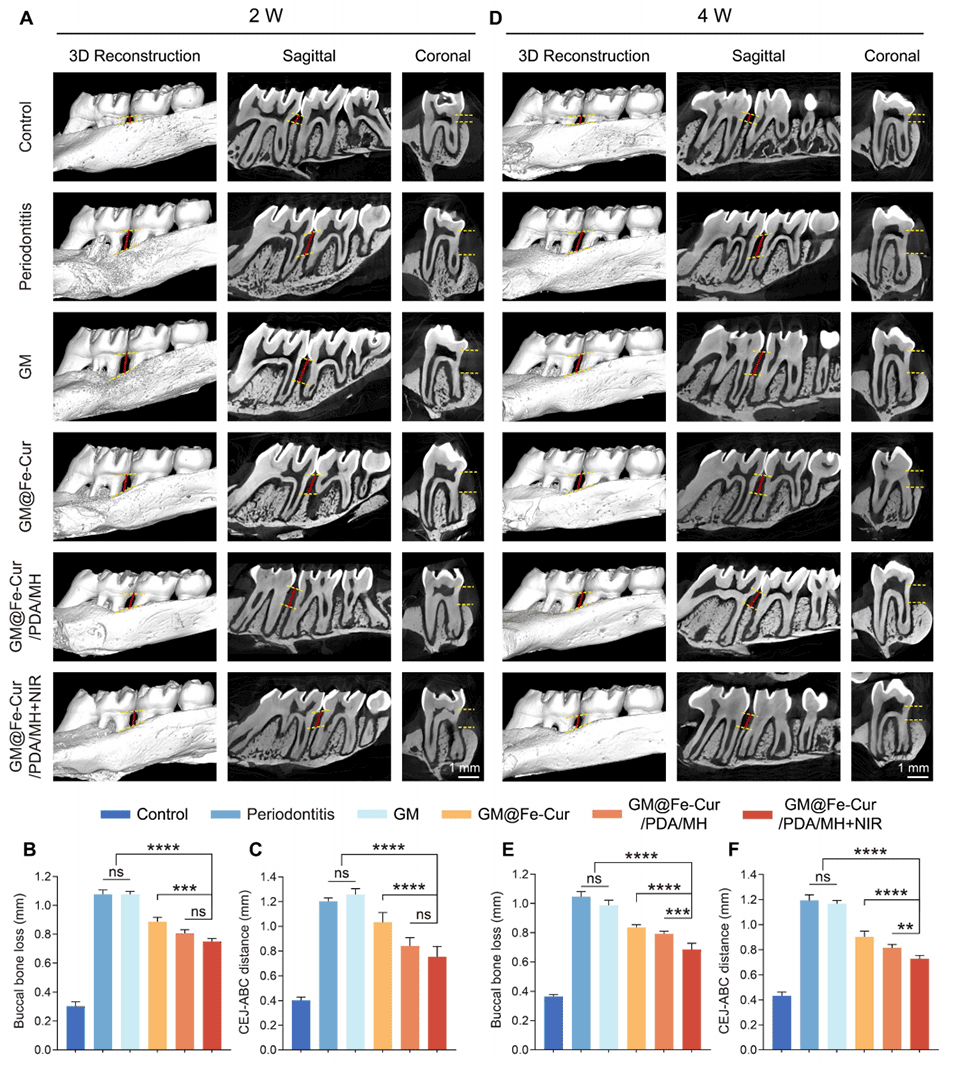
图11:GM@Fe-Cur/PDA/MH减轻结扎诱导的大鼠牙周炎模型中的牙槽骨丢失。(A)微球处理2周后牙周状况的三维重建图、矢状面和冠状面视图。(B)2周后颊侧骨丢失高度的定量分析。(C)2周后釉牙骨质界-牙槽嵴顶(CEJ-ABC)距离分析。(D)处理4周后的三维重建图、矢状面和冠状面视图。(E)4周后颊侧骨丢失高度的定量分析。(F)4周后CEJ-ABC距离分析。
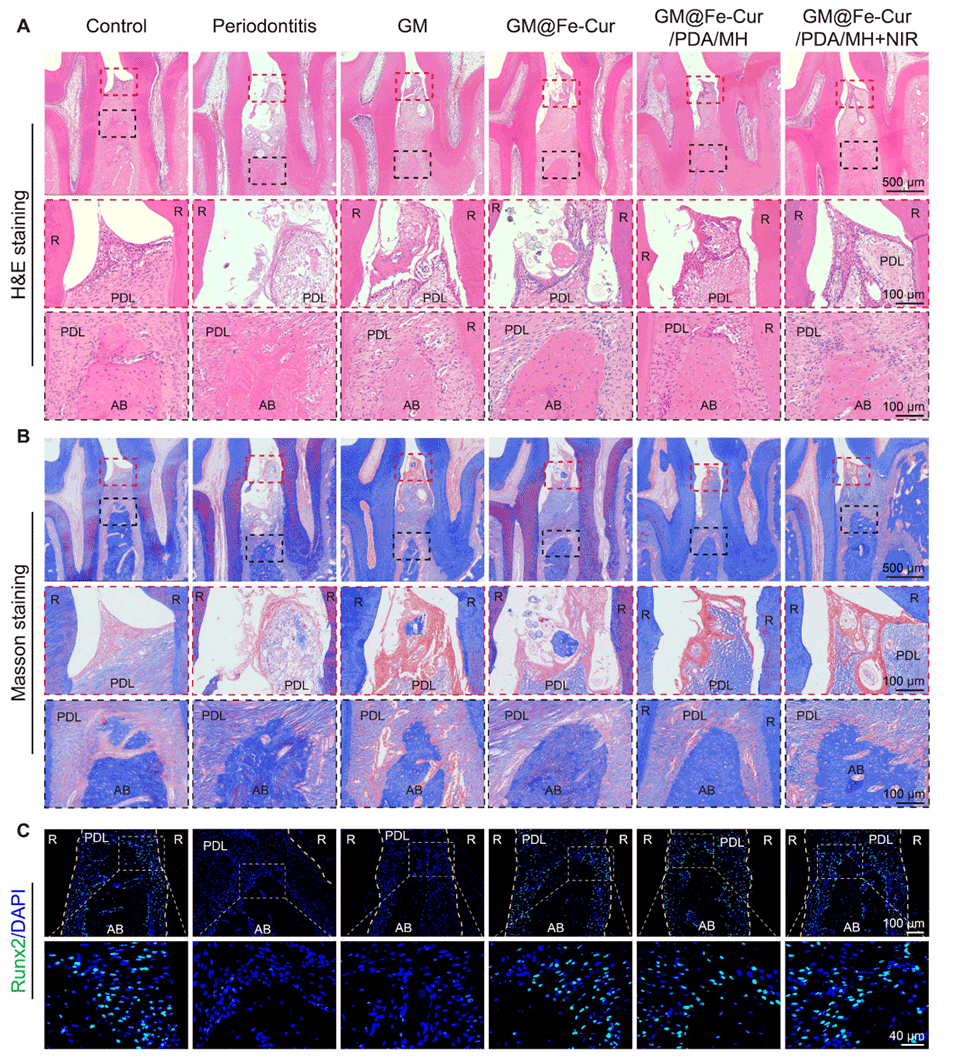
图12:不同微球处理2周后牙周软组织和骨再生的评估。(A)苏木精-伊红(H&E)染色图像。(B)马松三色染色图像。(C)Runx2的免疫荧光染色。(PDL:牙周膜,AB:牙槽骨,R:牙根)。
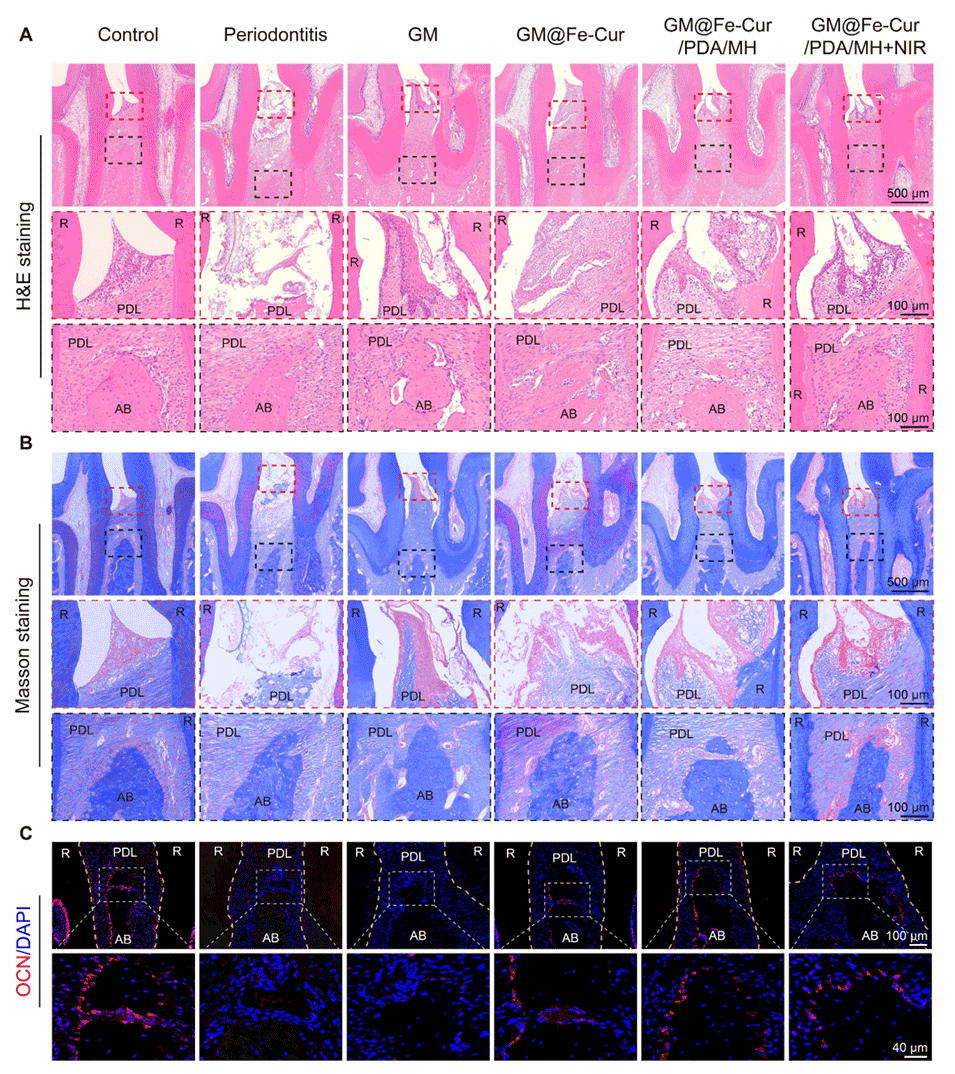
图13:不同微球处理4周后牙周软组织和骨再生的评估。(A)H&E染色图像。(B)马松三色染色图像。(C)OCN的免疫荧光染色。(PDL:牙周膜,AB:牙槽骨,R:牙根)。
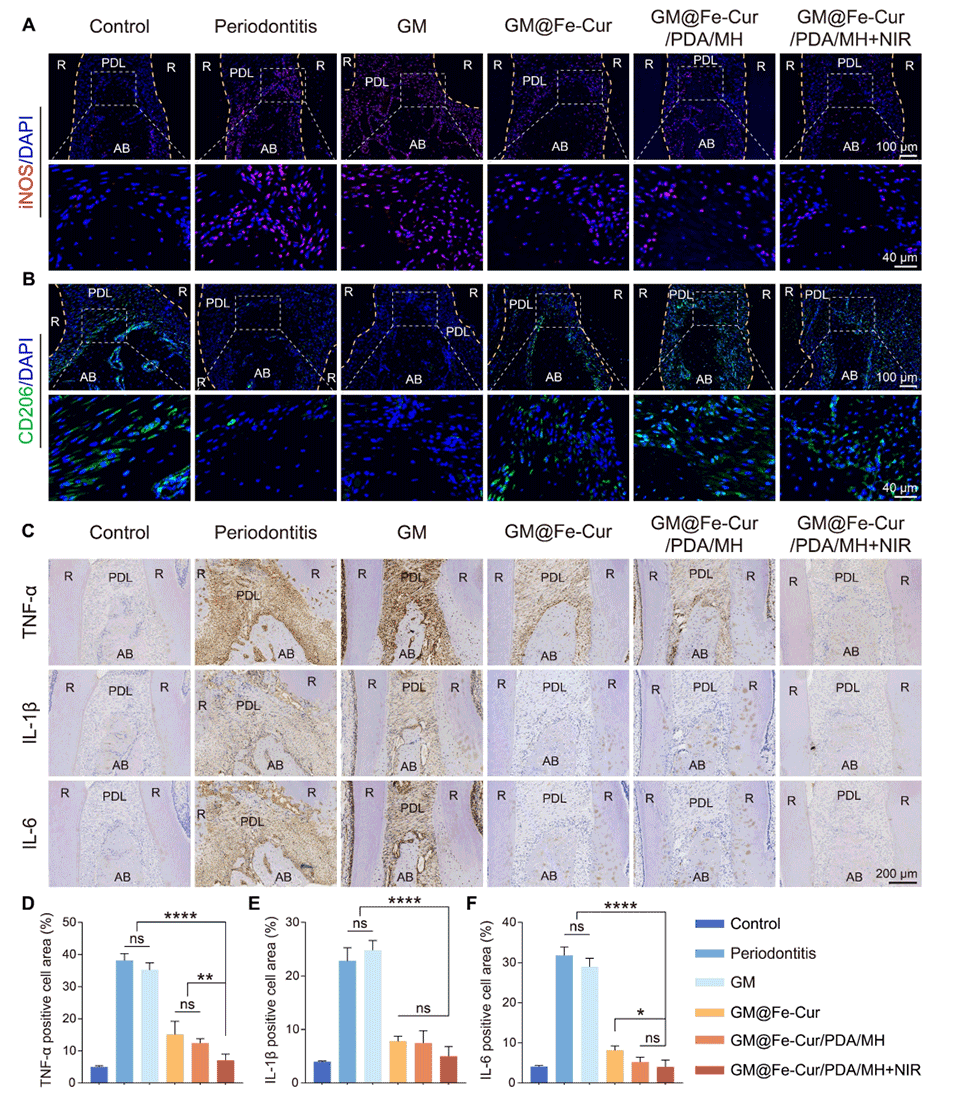
图14:GM@Fe-Cur/PDA/MH改善牙周炎大鼠牙周组织的炎症状态。(A)iNOS的免疫荧光染色。(B)CD206的免疫荧光染色。(C)肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)的免疫组织化学染色。(D)TNF-α、(E)IL-1β和(F)IL-6阳性细胞在免疫组织化学染色中的面积百分比。(PDL:牙周膜,AB:牙槽骨,R:牙根)。
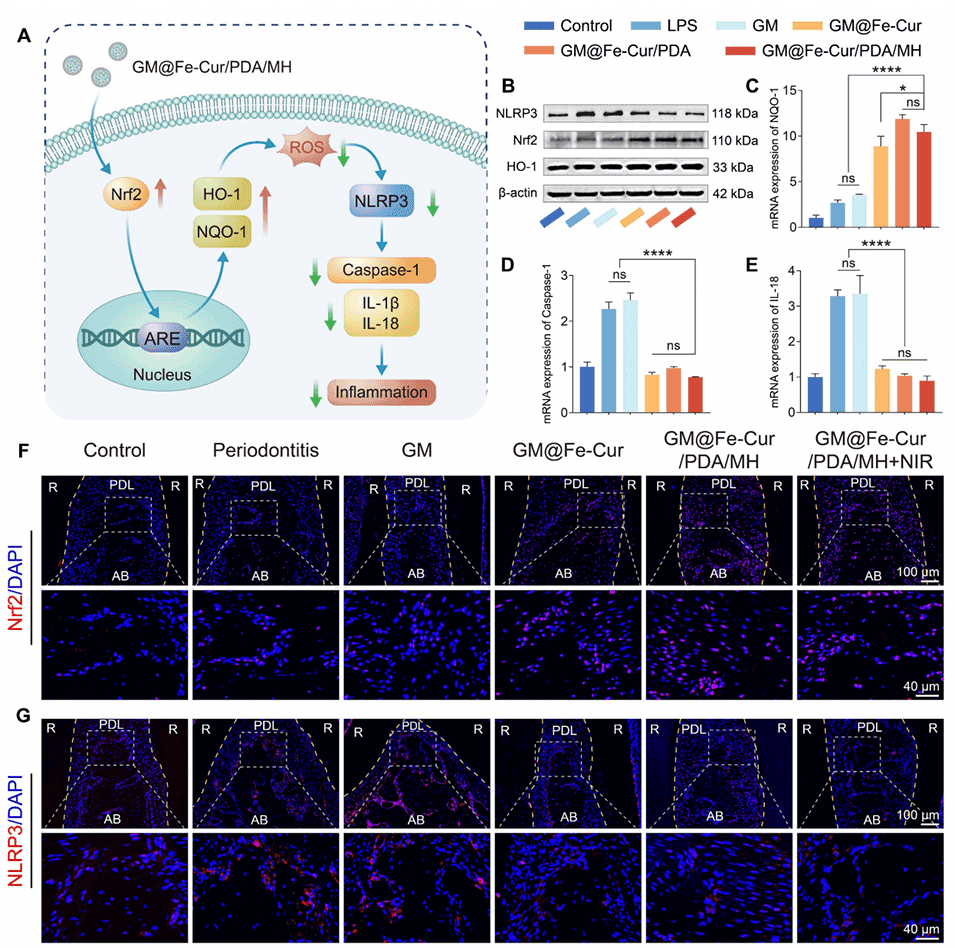
图15:GM@Fe-Cur/PDA/MH的抗炎和抗氧化机制研究。(A)GM@Fe-Cur/PDA/MH的抗氧化和抗炎机制示意图。(B)NLRP3、Nrf2和HO-1的蛋白质印迹分析,以β-肌动蛋白作为内参。(C)体外NQO-1的mRNA表达。(D)体外半胱天冬酶-1(Caspase-1)的mRNA表达。(E)体外IL-18的mRNA表达。(F)体内Nrf2和(G)NLRP3的免疫荧光染色。(PDL:牙周膜,AB:牙槽骨,R:牙根)。
文献:doi: 10.7150/thno.107793














