
导读:
干细胞疗法结合药物递送系统是修复退行性疾病的潜在策略,但生物材料的免疫排斥及退化组织的炎症、氧化应激微环境会导致干细胞凋亡和命运异常,修复效率低下。近期,山东大学齐鲁医院刘新宇教授、赵云鹏副教授、王连雷副教授、高至亮副研究员等人联合研发了一种负载促红细胞生成素的羧甲基壳聚糖/单宁酸水凝胶微球,通过该微球对间充质干细胞进行体外训练,显著提升了干细胞在椎间盘退变修复中的存活、分化及功能发挥。相关研究以“Training of mesenchymal stem cells by using hydrogel microspheres for the repair of intervertebral disc degeneration”为题目,发表在期刊《Chemical Engineering Journal》上。
本文要点:
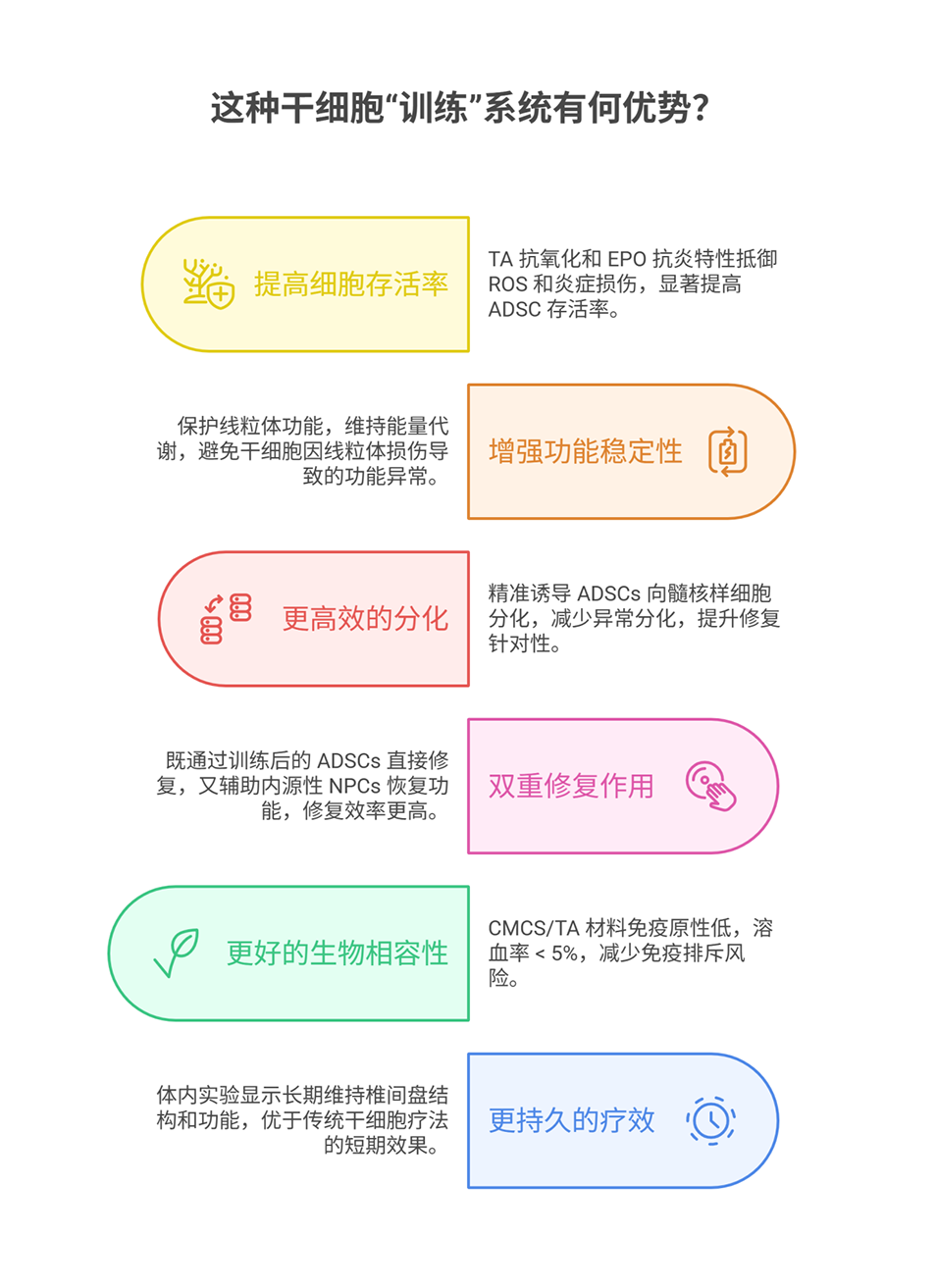
1、本研究构建了一种基于微球的干细胞培养系统,该系统具有集成的线粒体增强和靶向细胞分化能力,可用于修复椎间盘退变。
2、利用微流控装置制备了负载促红细胞生成素(EPO)的羧甲基壳聚糖(CMCS)/单宁酸(TA)微球,以促进细胞黏附和高效药物释放。
3、TA和EPO的递送赋予脂肪间充质干细胞(ADSCs)更强的抗炎和抗活性氧损伤能力,改善线粒体活性,支持其向髓核样表型分化,且经处理的ADSCs能帮助髓核细胞恢复功能。
4、体内实验表明,经CMCS/TA微球处理的ADSCs可保护椎间盘结构,刺激细胞外基质合成,减少免疫排斥。总之,这种基于载药微球的高效细胞培养系统为退行性疾病修复提供了一种有前景的策略。
微流控技术凭借精准操控和微型化特性,在干细胞治疗中展现出多方面优势,尤其适用于干细胞的培养、筛选、递送及治疗效果优化:
1、精准调控微环境:可精确控制干细胞培养的物理(如流速、剪切力)、化学(如营养浓度、生长因子梯度)和生物(如细胞间相互作用)微环境,模拟体内生理状态,提升干细胞增殖、分化的可控性。
2、高效筛选与鉴定:通过微流控芯片的高通量通道设计,可快速筛选具有特定表型或功能的干细胞(如高活性、定向分化能力强的细胞),同时结合实时检测技术(如荧光标记),实现干细胞质量的精准鉴定。
3、靶向递送与定植优化:借助微流控技术制备尺寸均一、负载药物或细胞因子的载体(如本文中的E-MP微球),可实现干细胞的局部精准递送,减少全身扩散,同时载体的结构设计(如孔隙率、表面修饰)能增强干细胞在靶组织的定植与存活。
4、降低免疫排斥风险:微流控制备的生物材料(如本文中天然来源的CMCS/TA微球)具有良好生物相容性,可减少干细胞移植后的免疫反应;同时,通过芯片模拟免疫微环境,可预先评估干细胞的免疫原性,优化治疗方案。
5、微型化与自动化:微流控系统体积小、试剂消耗量少,适合干细胞的小规模精准培养和个性化治疗;自动化操作减少人为误差,提升实验重复性,为干细胞治疗的标准化和临床转化提供支持。
这些优势使微流控技术成为连接干细胞基础研究与临床应用的关键工具,尤其在退行性疾病、组织修复等领域展现出巨大潜力。
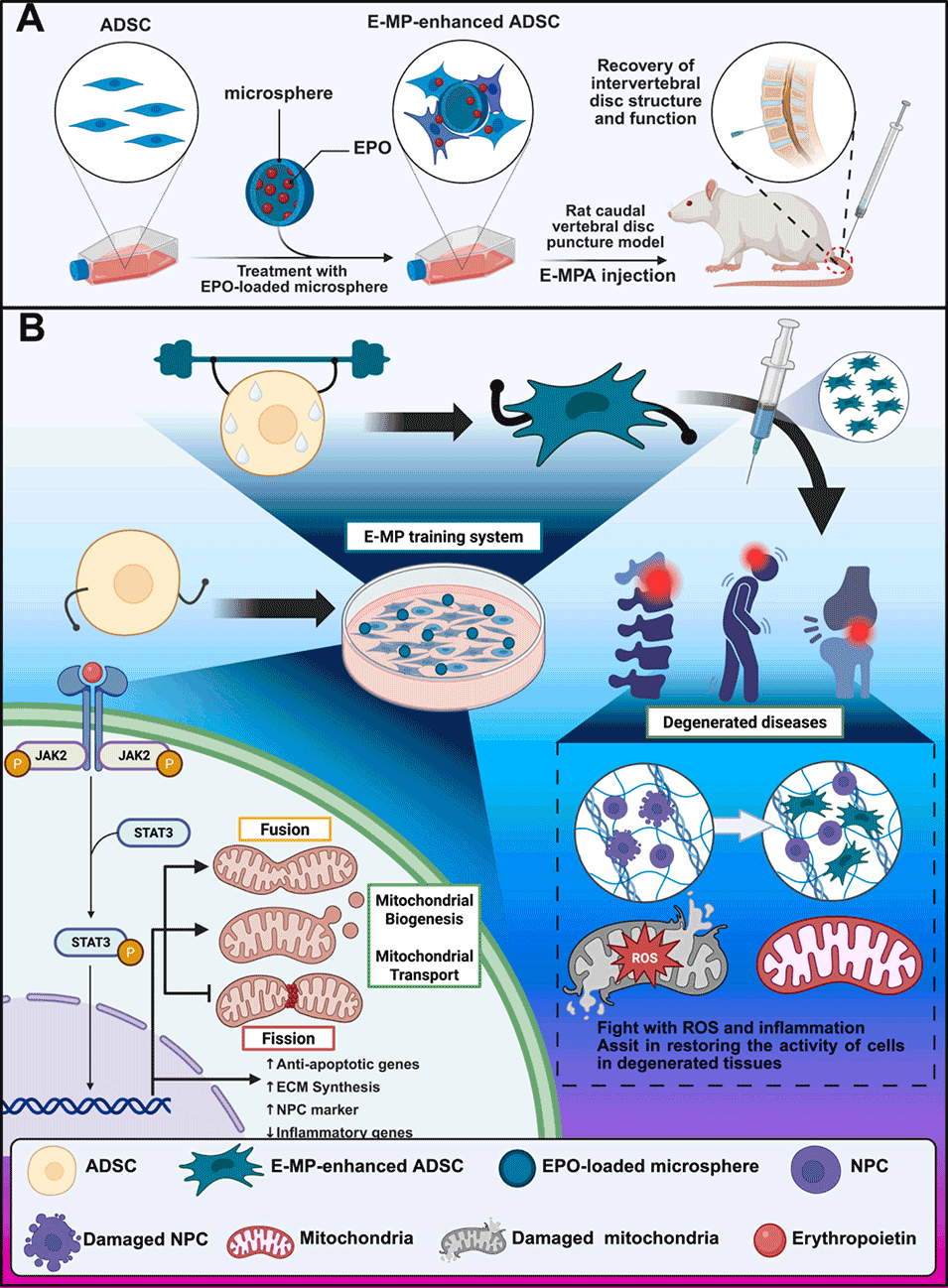
图1.(A)EPO负载水凝胶微球训练系统增强ADSCs修复退行性疾病能力的机制及促进IVDD修复的机制示意图。(B)EPO负载羧甲基壳聚糖(CMCS)/单宁酸(TA)微球(E-MP)增强的ADSCs治疗IVDD的示意图。
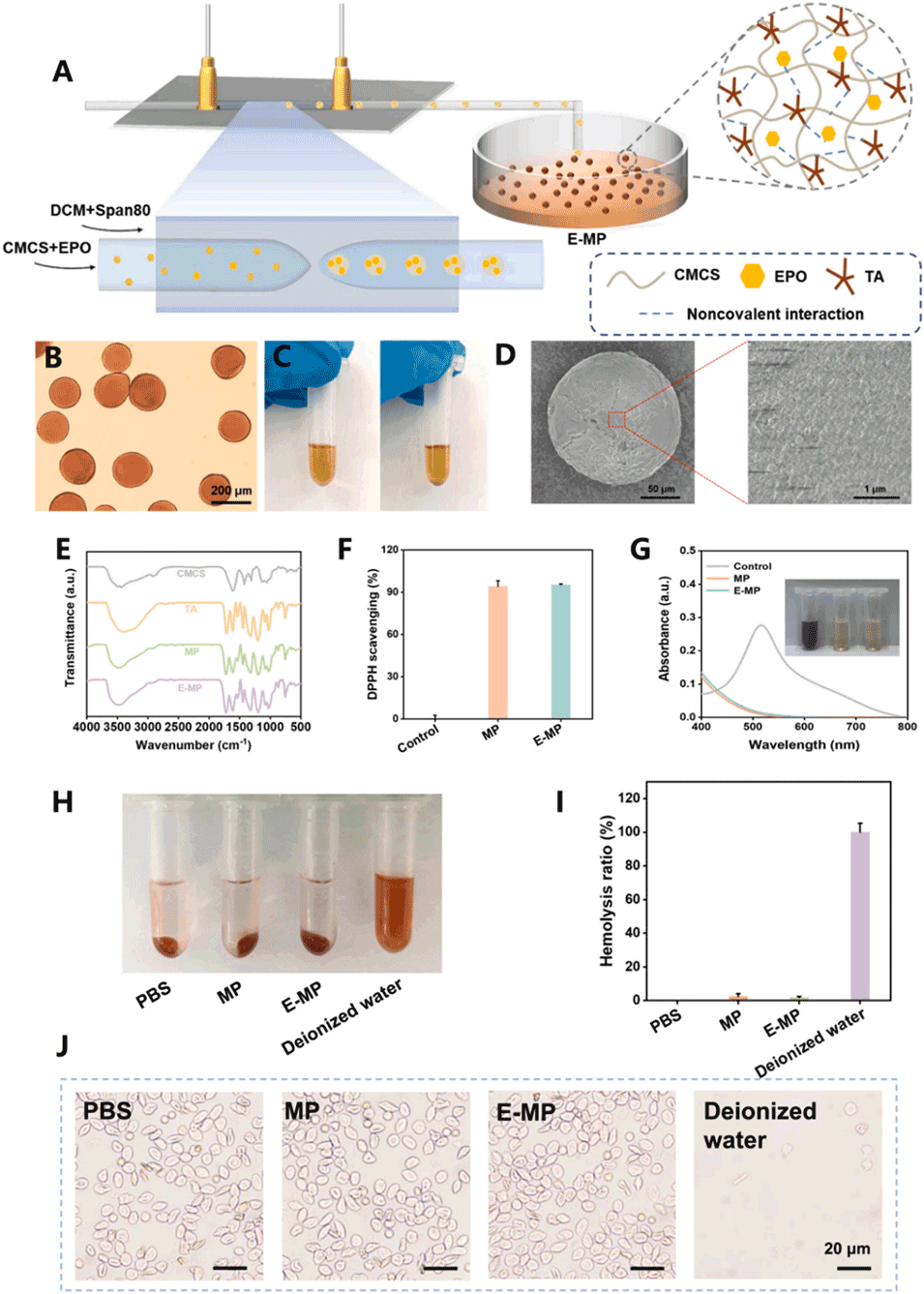
图2. E-MP的制备与表征。(A)通过微流控技术制备E-MP的示意图。(B)单分散E-MP的光学显微图。(C)E-MP悬浮液在轻轻搅拌下的均一性(左)和5分钟沉降后的相分离(右)的宏观观察。(D)扫描电镜(SEM)图像显示球形形态和光滑的表面形貌。(E)CMCS、TA、MPs和E-MP的傅里叶变换红外(FT-IR)光谱,证实无共价相互作用。(F)通过DPPH测定评估的自由基清除能力。(G)MPs与E-MP的紫外-可见吸收光谱比较。(H)经磷酸盐缓冲液(PBS,阴性对照)、水(阳性对照)、MP和E-MP处理的红细胞悬液的照片记录。(I)定量溶血率。(J)不同暴露后红细胞完整性的显微镜观察。
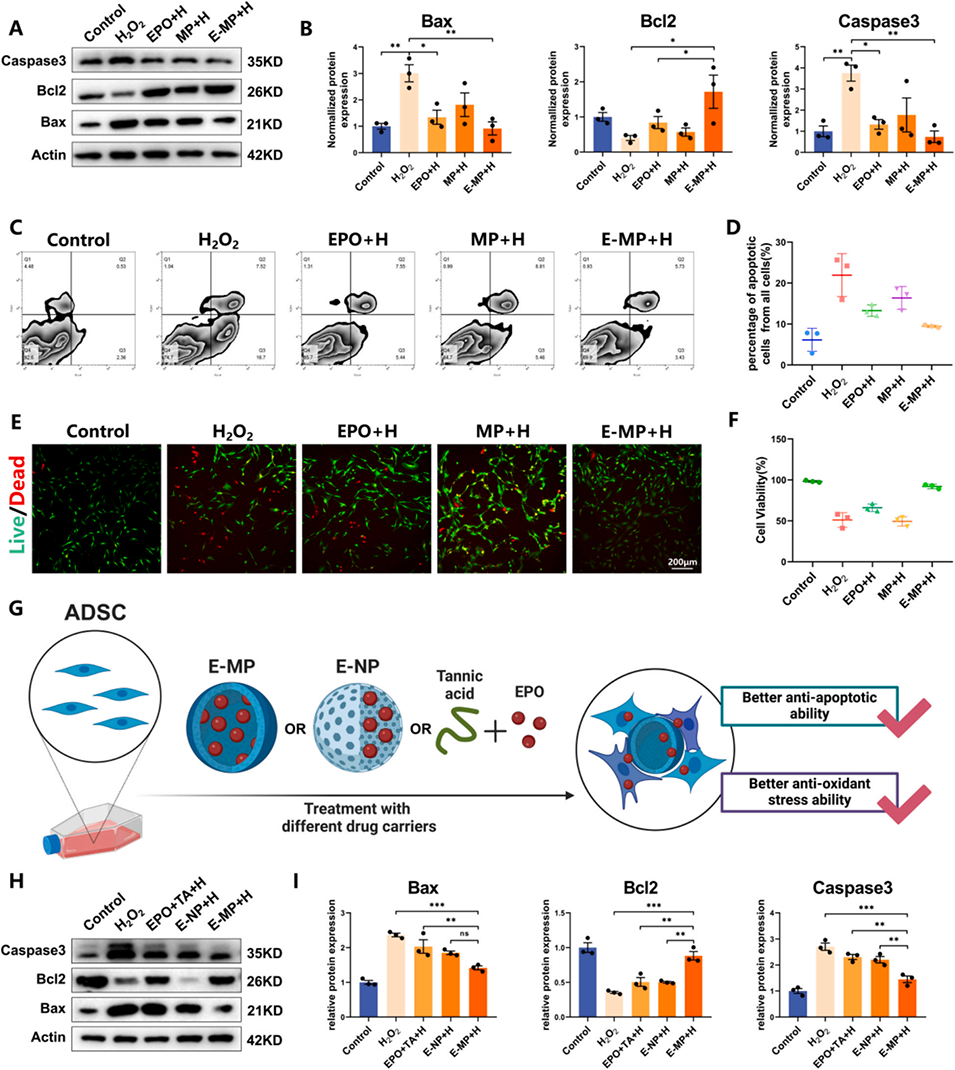
图3. E-MP增强ADSCs在H2O2诱导的氧化应激下的存活能力。(A)H2O2刺激24小时后,经微球或EPO处理的ADSCs的代表性显微图像。(B, C)在H2O2刺激下,用E-MP、MP和EPO培养的大鼠ADSCs中半胱天冬酶-3(Caspase-3)、B细胞淋巴瘤-2(Bcl-2)和Bcl-2相关X蛋白(Bax)表达的蛋白质印迹(WB)分析。(D, E)经H2O2处理或未处理ADSCs凋亡的流式细胞术分析。(F)不同条件下活细胞(绿色)和死细胞(红色)的荧光成像。(G)三种不同药物载体(EPO负载微球、EPO负载纳米颗粒(E-NPs)以及仅单宁酸和EPO)增强ADSCs效能的示意图。(H, I)在H2O2刺激下,经E-MP、E-NPs和EPO+TA处理的大鼠ADSCs中Caspase-3、Bcl-2和Bax表达的WB分析。数据表示为平均值±标准差;与H2O2组或E-MP+H组相比,*p<0.05,*p<0.01,*p<0.001和*p<0.0001。
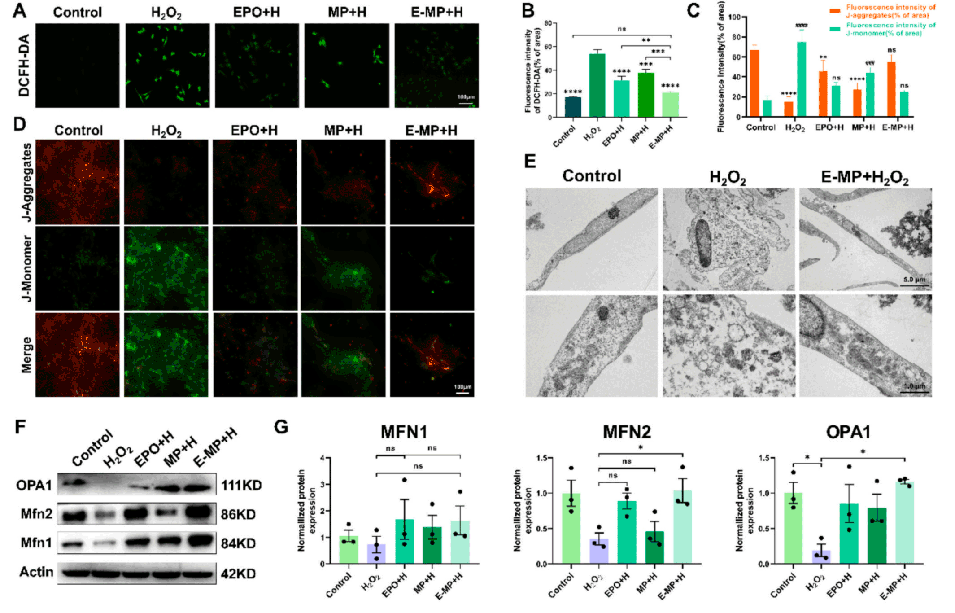
图4. E-MP通过减轻氧化应激和增强线粒体生物发生,对H2O2刺激的ADSCs的线粒体功能具有保护作用。(A, B)不同实验组中H2O2处理后ADSCs内ROS水平的DCFH-DA染色。(C, D)H2O2处理后各组ADSCs线粒体膜电位的JC-1染色检测。(E)通过透射电镜(TEM)观察细胞形态和线粒体。(F, G)在H2O2刺激下,用E-MP、MP和EPO培养的大鼠ADSCs中线粒体融合蛋白1(MFN1)、线粒体融合蛋白2(MFN2)和视神经萎缩蛋白1(OPA1)的WB检测。数据表示为平均值±标准差;与对照组、H2O2组或E-MP+H组相比,*p<0.05,*p<0.01,*p<0.001和*p<0.0001。
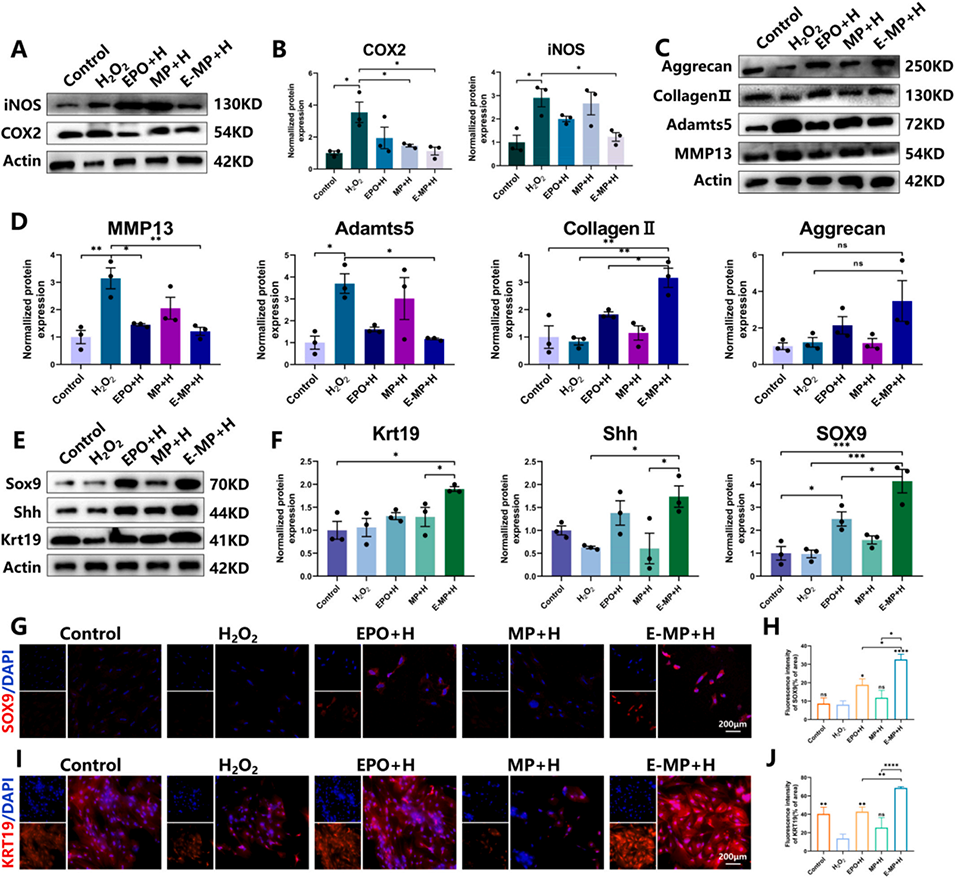
图5. E-MP增强ADSCs的抗炎反应、细胞外基质(ECM)合成和髓核样分化。(A-D)在氧化应激条件下,用E-MP培养的大鼠ADSCs中MMP-13、ADAMTS5、COX-2、iNOS、Ⅱ型胶原蛋白和聚集蛋白聚糖的WB分析。(E, F)经E-MP处理的ADSCs中Sox9、Shh和KRT19表达的WB分析。(G-J)各实验组ADSCs中Sox9和KRT19的免疫荧光染色。数据表示为平均值±标准差;与H2O2组或E-MP+H组相比,*p<0.05,*p<0.01,*p<0.001和*p<0.0001。
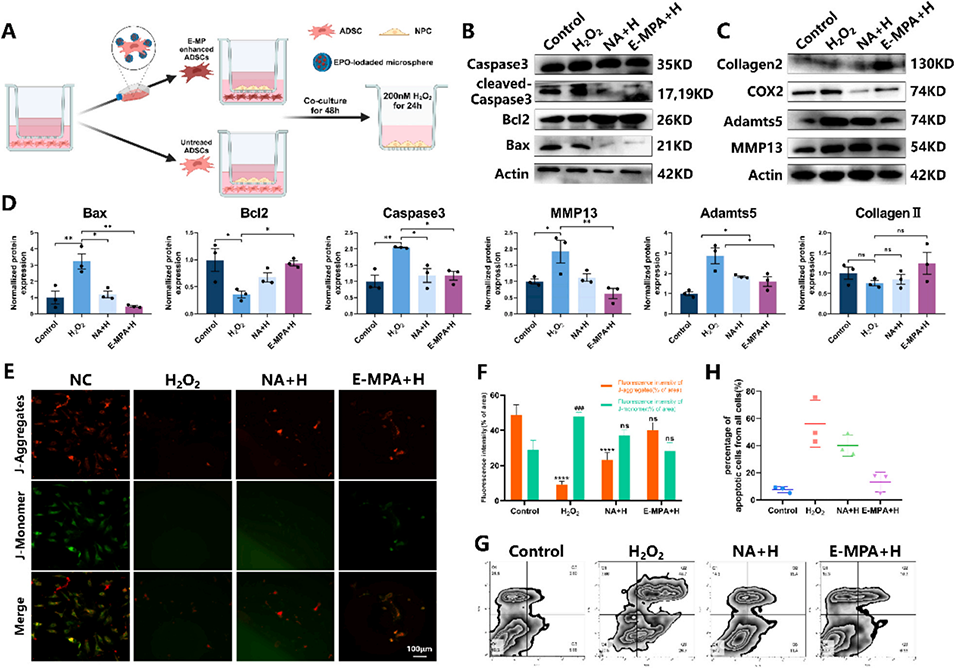
图6. E-MP训练的ADSCs在H2O2刺激下增强髓核细胞(NPCs)的活性。(A)ADSCs与NPCs共培养系统的示意图。(B-D)与ADSCs共培养的大鼠NPCs中Bax、Bcl2、Caspase-3、MMP-13、Adamts5、COX-2和Ⅱ型胶原蛋白表达的WB分析。(E, F)H2O2处理后NPCs线粒体膜电位的JC-1染色评估。(G, H)不同处理条件下NPC凋亡的流式细胞术分析。数据表示为平均值±标准差;与H2O2组或E-MP+H组相比,*p<0.05,*p<0.01和*p<0.001。
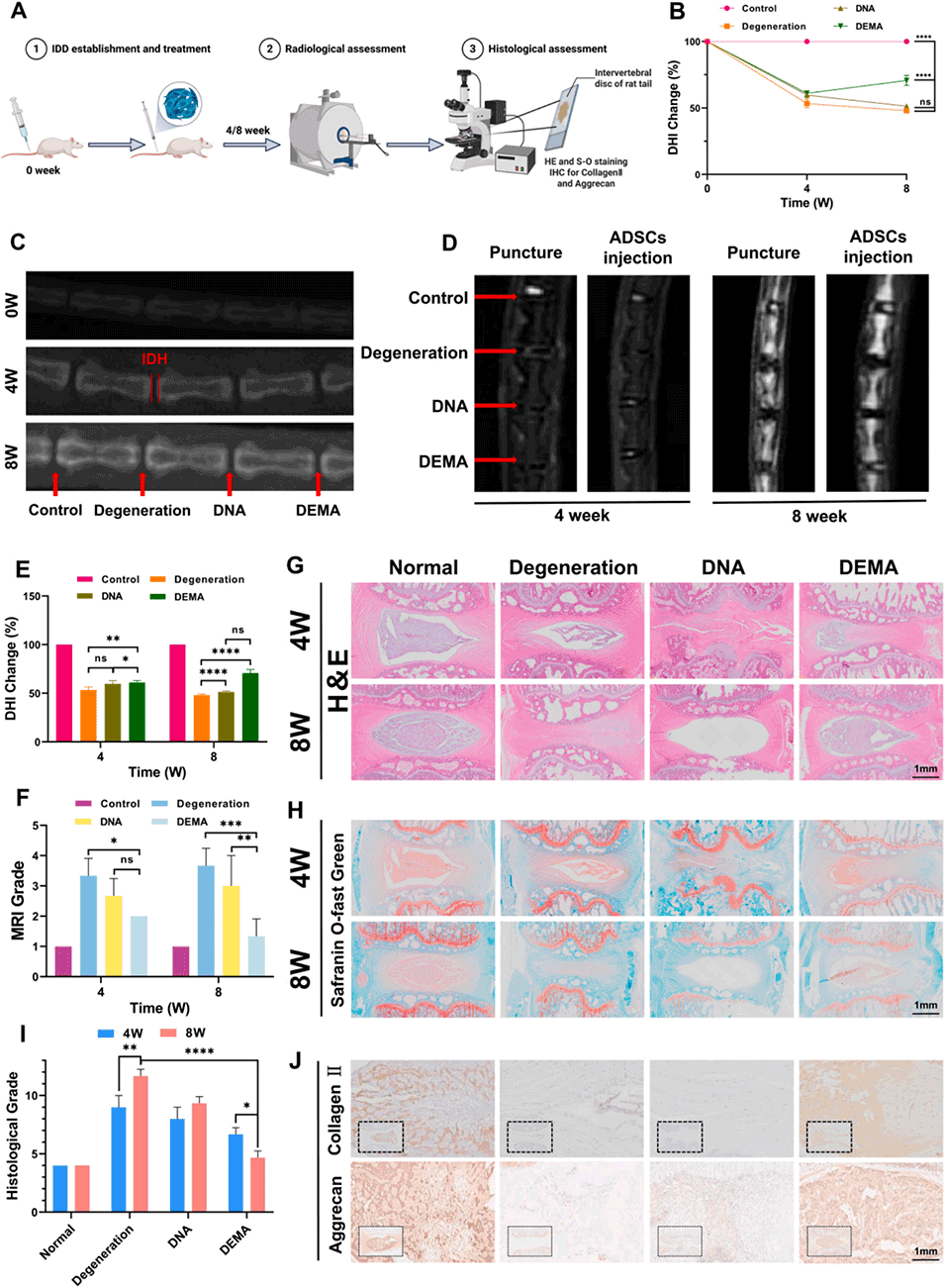
图7.在大鼠IVDD模型中的体内治疗效果。(A)E-MP增强的ADSCs治疗大鼠IVDD的示意图。(B-D)ADSCs注射后4周或8周的椎间盘高度指数(DHI)变化。(E, F)ADSCs注射后4周或8周的磁共振成像(MRI)分级变化。(G)大鼠椎间盘切片的苏木精-伊红(H&E)染色。(H)大鼠椎间盘切片的番红固绿染色。(I)大鼠椎间盘样本的组织学分级。(J)大鼠椎间盘切片中聚集蛋白聚糖和Ⅱ型胶原蛋白的免疫组织化学(IHC)染色。数据表示为平均值±标准差;与退变组或E-MP增强的ADSCs(DEMA)组相比,*p<0.05,*p<0.01,*p<0.001和*p<0.0001。
论文链接:https://doi.org/10.1016/j.cej.2025.165312














