多孔纳米纤维微球(PNMs)结合了仿生形态、可调结构和可注射性,为组织再生提供了一种多功能微创策略。虽然自组装和同轴电喷雾技术已被用于PNM制造,但这些方法在成分多样性和生产可扩展性方面存在局限。

近期,美国内布拉斯加大学医学中心谢敬伟教授团队开发出一种创新的3D打印微流控平台,用于高效制备结构可精确调控的多孔纳米纤维微球(PNMs)。该平台成功实现了PNM的大规模生产与生物活性多肽功能化修饰,并在体外细胞实验及大鼠皮下植入模型中显著促进了成骨、血管生成,抑制了炎症反应,展现出优异的组织整合与再生能力。相关研究以“3D‐Printed Microfluidic Platform for Creating Porous Nanofibrous Microspheres to Regulate Cell Response and Enhance Tissue Regeneration”为题,发表在著名国际学术期刊《Small》上。
本文要点:
1、本研究开发了一种3D打印微流控平台,用于大规模制备结构可调的多孔纳米纤维微球(PNMs)。
2、该平台通过整合34G注射针头解决微通道堵塞问题,并利用内/外气流与纳米纤维悬浮液的协同作用,精准调控PNMs的尺寸(700–1200 μm)、孔隙结构与形貌。
3、功能化方面,通过紫外交联将BMP-2(成骨)、QK(促血管)和AF-1(抗炎)多肽修饰至PNMs表面,实现多肽的可控缓释(释放率与交联时间负相关)。
4、体外实验表明,BMP-2-PNMs显著增强人骨髓基质细胞的成骨分化;QK-PNMs促进人脐静脉内皮细胞形成微血管网络;AF-1-PNMs有效抑制巨噬细胞炎症因子释放。
5、大鼠皮下植入实验显示,PNMs在14天内实现完全的细胞渗透和组织整合,且纤维化反应极低。该技术为组织再生提供了可定制化、可注射的多功能平台。
相比传统方法,3D打印微流控平台制备PNMs的核心优势是什么?
① 规模化生产:效率达约1700个/分钟,远超自组装的劳动密集型模式和电喷雾的低流速限制;
②结构可控:通过调节Qi、Qo、Qs可精准控制PNMs的尺寸(700-1200μm)、孔径(80-180μm)和孔隙数量(6-15个);
③成分灵活性:不受限于特定聚合物(如自组装依赖星形聚合物),可兼容PLGA、GelMA等多种材料。
该3D打印微流控平台的原理基于微流控液滴生成技术与气动调控多孔结构的结合,通过精确控制流体动力学参数实现多孔纳米纤维微球(PNMs)的可控制备。其创新点如下:
1、混合3D打印设计:
采用DLP 3D打印树脂主体结构,集成34G金属针头作为微米级内层通道,解决3D打印分辨率限制。
2、高通量生产:
在优化参数下(Qi= 2 mL/min,Qo = 12 L/min,Qs = 1 mL/min),平台每秒生成29±929±0.9个PNMs(约1700个/分钟),支持规模化生产。
3、生物功能化:
UV交联修饰:通过GelMA的甲基丙烯酰基与活性肽(BMP-2/QK/AF-1)的OCTAL基团光交联,实现肽的定向固定。
可控释放:UV交联时间(3–20分钟)调节肽释放动力学(如20分钟交联后10天内释放<10%)。
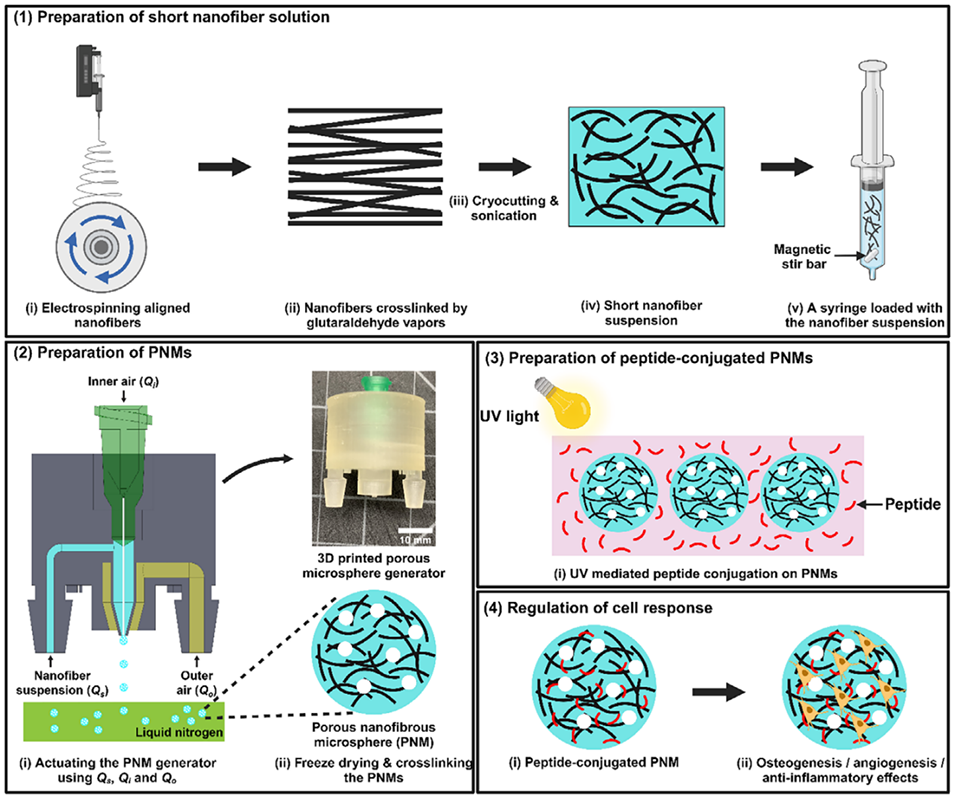
图1.肽偶联PNMs的制备流程及其在调节细胞反应中应用的示意图。1)短纳米纤维悬浮液的制备:对定向电纺PLGA:GelMA纤维膜进行冷冻切割,并将短纳米纤维与明胶均质化。2)PNMs的制备:通过3D打印多孔微球发生器控制纳米纤维悬浮液、内部空气和外部空气的流速,经冷冻干燥和戊二醛(GA)交联处理。3)肽偶联PNMs的制备:利用紫外交联将BMP-2、QK或AF-1肽固定在PNMs上。4)细胞反应调节:偶联BMP-2、QK和AF-1肽的PNMs分别可促进人骨髓基质细胞(hBMSCs)成骨、人脐静脉内皮细胞(HUVECs)血管生成,并对巨噬细胞发挥抗炎作用。
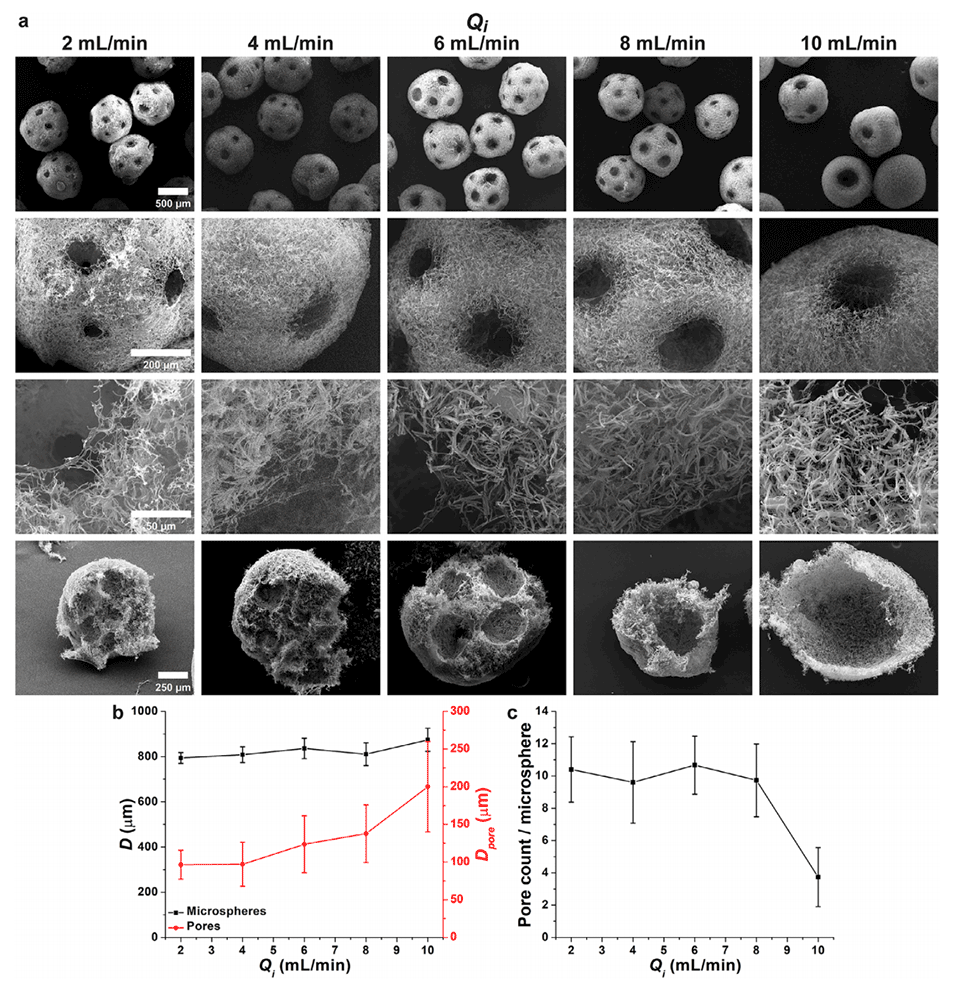
图2.内部空气流速(Qi)对PNMs形态和尺寸的影响。a)PNMs的扫描电子显微镜(SEM)图像,底部为横截面视图。b)PNMs直径(D)和孔隙直径(Dpore)随Qi的变化。c)每个微球的孔隙数量。外部空气流速(Qo)和纳米纤维悬浮液流速(Qs)分别维持在12和1mL/min。(n=15)
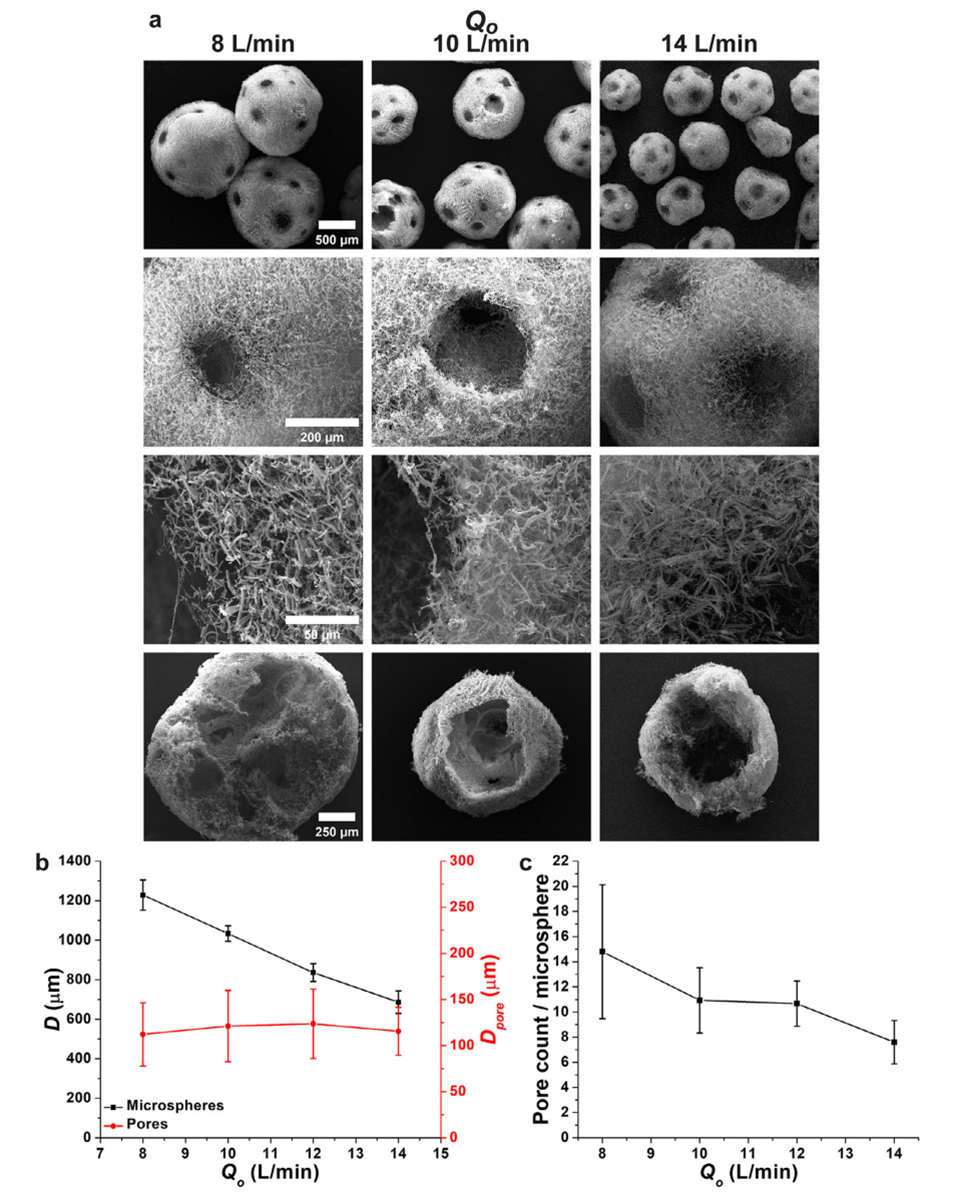
图3.外部空气流速(Qo)对PNMs形态和尺寸的影响。a)PNMs的SEM图像,底部为横截面视图。b)PNMs直径(D)和孔隙直径(Dpore)随Qo的变化。c)每个微球的孔隙数量。内部空气流速(Qi)和纳米纤维悬浮液流速(Qs)分别维持在6和1mL/min。(n=15)
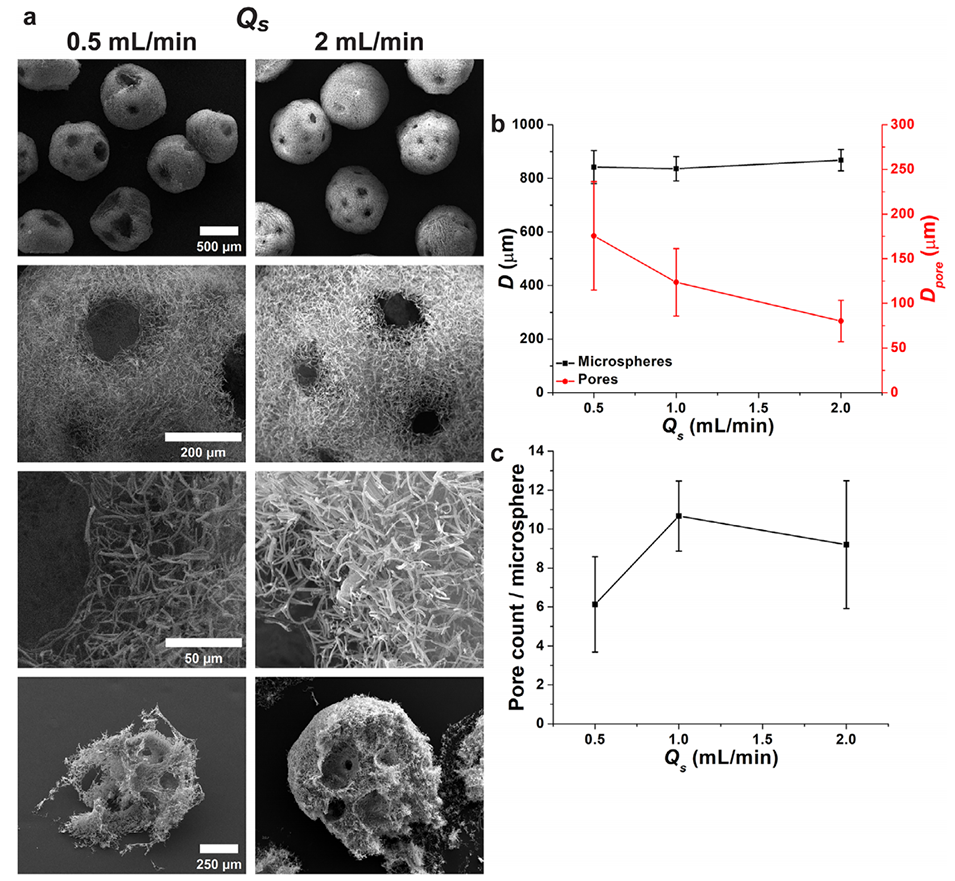
图4.纳米纤维悬浮液流速(Qs)对PNMs形态和尺寸的影响。a)PNMs的SEM图像,底部为横截面视图。b)PNMs直径(D)和孔隙直径(Dpore)随Qs的变化。c)每个微球的孔隙数量。外部空气流速(Qo)和内部空气流速(Qi)分别维持在12和6mL/min。(n=15)
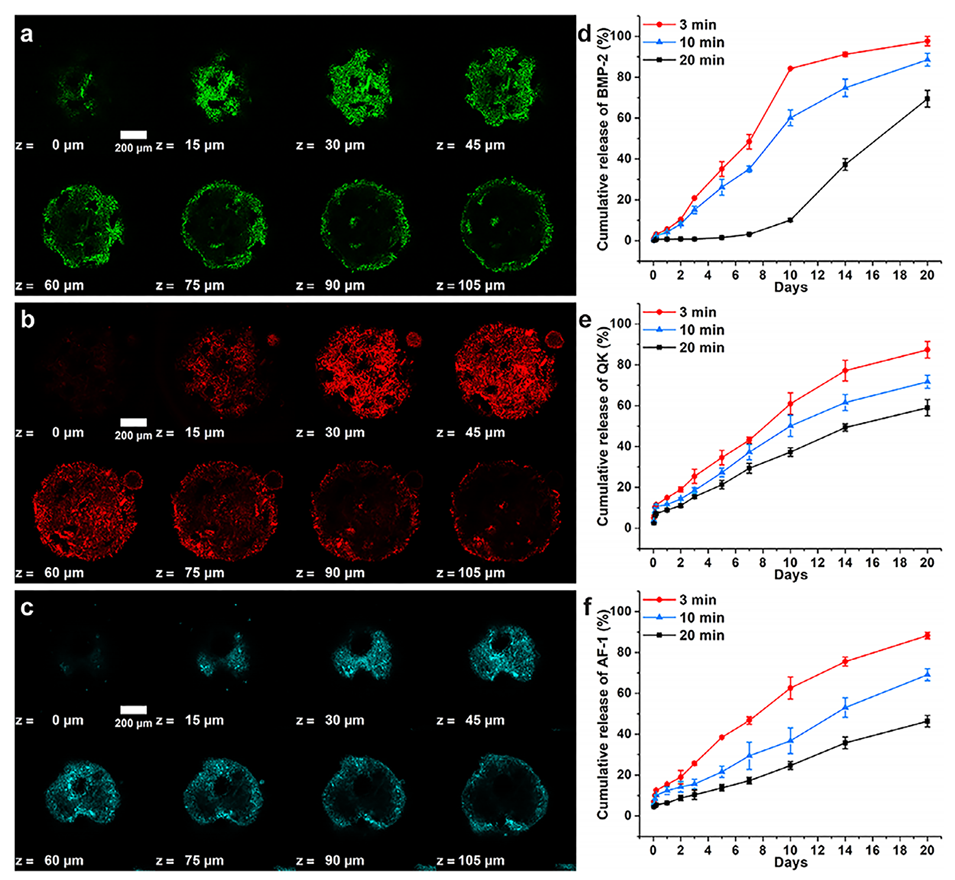
图5.偶联BMP-2、QK和AF-1肽的PNMs。a–c)偶联BMP-2(a)、QK(b)和AF-1(c)肽的PNMs的Z-stack共聚焦显微镜图像。荧光图像显示肽在PNMs上的分布:绿色为BMP-2肽,红色为QK肽,青色为AF-1肽。d–f)BMP-2(d)、QK(e)和AF-1(f)肽从偶联PNMs中的累积释放曲线,以紫外交联时间为变量。(n=2)
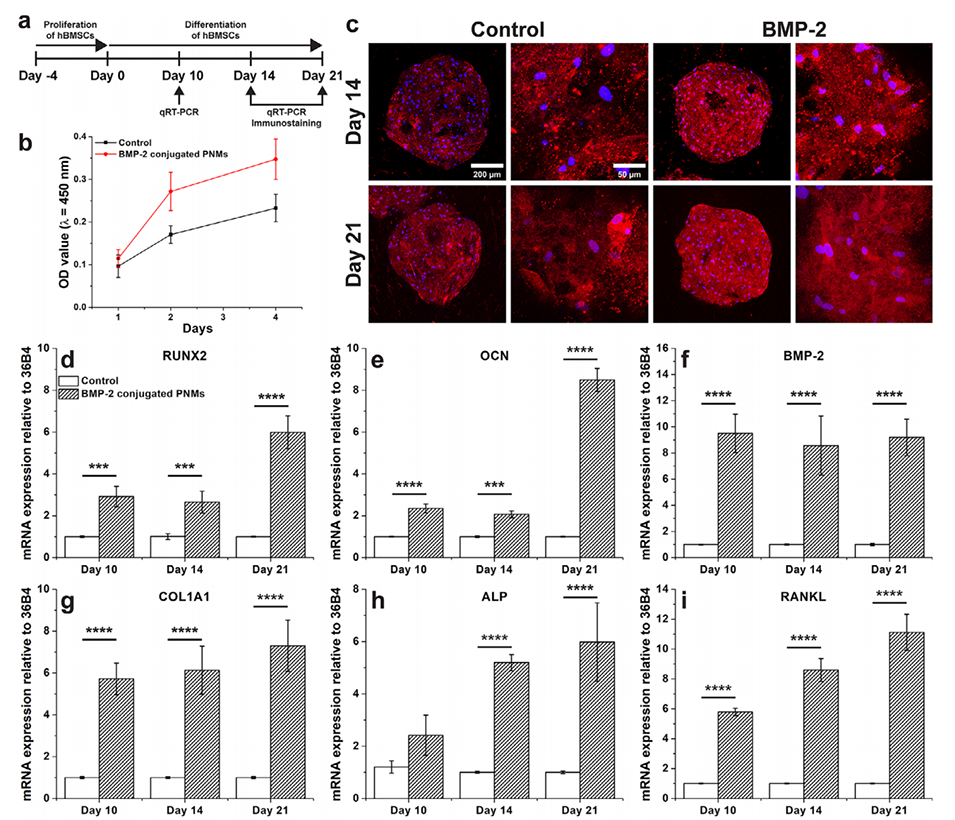
图6.接种于PNMs上的hBMSCs的成骨分化。a)实验设计示意图:成骨分化前hBMSCs在PNMs上培养4天以进行增殖。b)hBMSCs在对照组和BMP-2偶联PNMs上的增殖情况。(n=3)c)共聚焦显微镜图像显示培养14和21天后hBMSCs中骨钙素的表达(有无BMP-2肽偶联)。红色:骨钙素;蓝色:DAPI。d–i)成骨标志物的mRNA表达水平,包括RUNX2(d)、OCN(e)、BMP-2(f)、COL1A1(g)、ALP(h)和RANKL(i)。(n=4,****:p≤0.0001,***:p≤0.001,**:p≤0.01,*:p≤0.05)
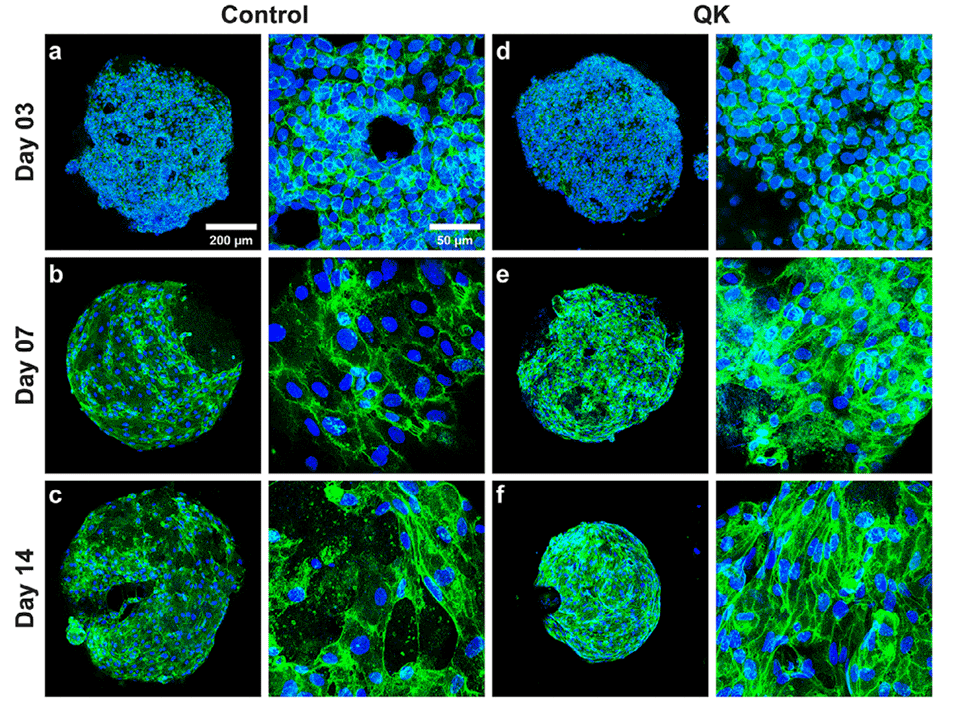
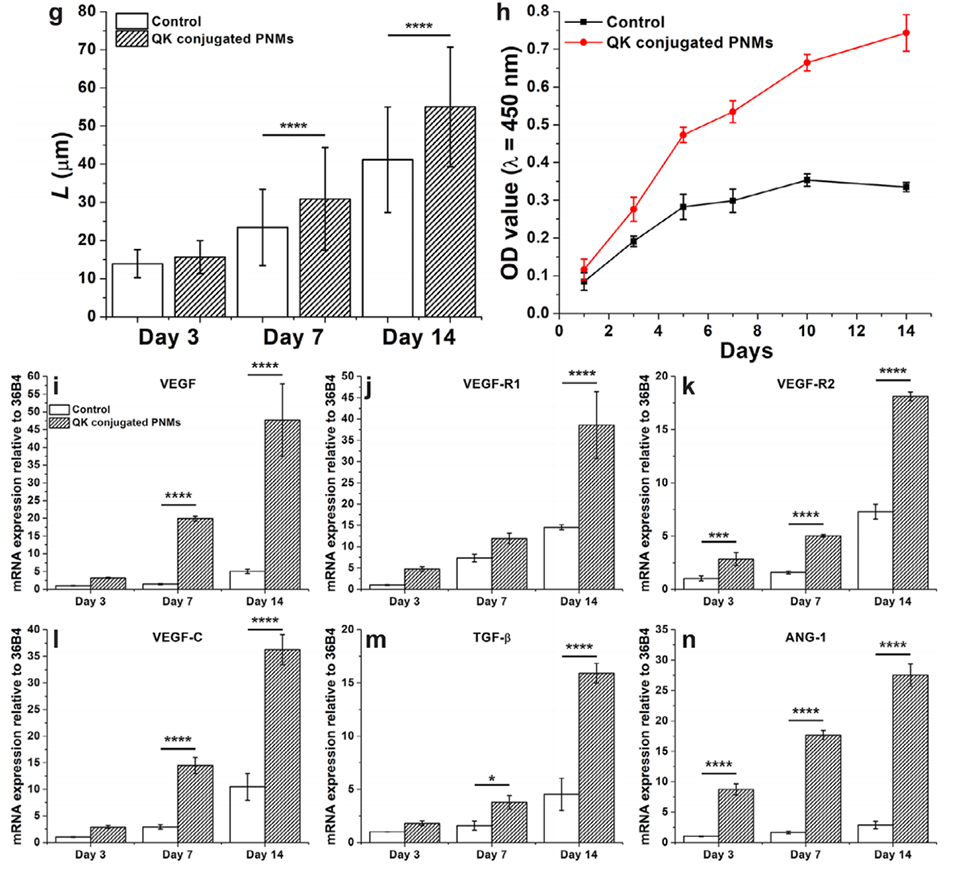
图7.接种于未偶联和偶联QK肽的PNMs上的HUVECs的血管生成分化。a–f)共聚焦显微镜图像显示培养3、7和14天后HUVECs中CD31的表达(有无QK肽偶联)。绿色:CD31;蓝色:DAPI。g)HUVECs长轴长度随培养时间的变化。(n = 35–248个细胞)h)HUVECs在对照组和QK偶联PNMs上的增殖情况(n=3)。i–n)血管生成标志物的mRNA表达水平,包括VEGF(i)、VEGF-R1(j)、VEGF-R2(k)、VEGF-C(l)、TGF-β(m)和ANG-1(n)。(n=4,****:p≤0.0001,***:p≤0.001,**:p≤0.01,*:p≤0.05)
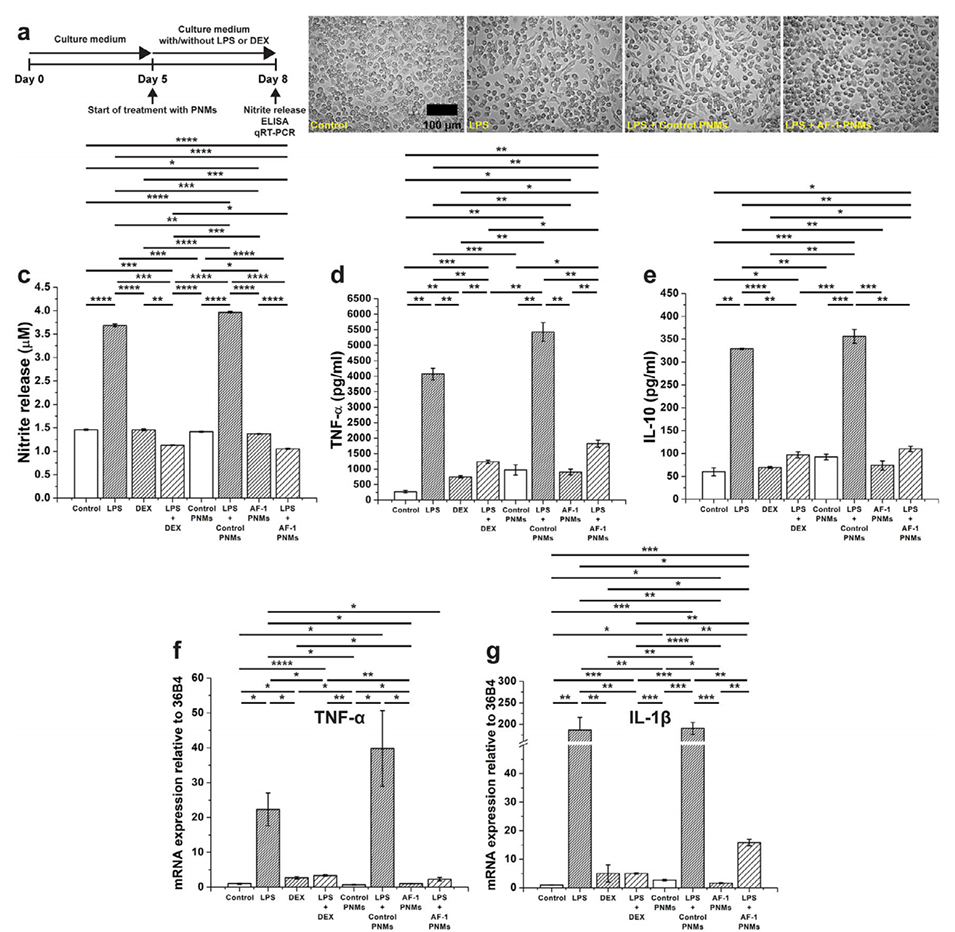
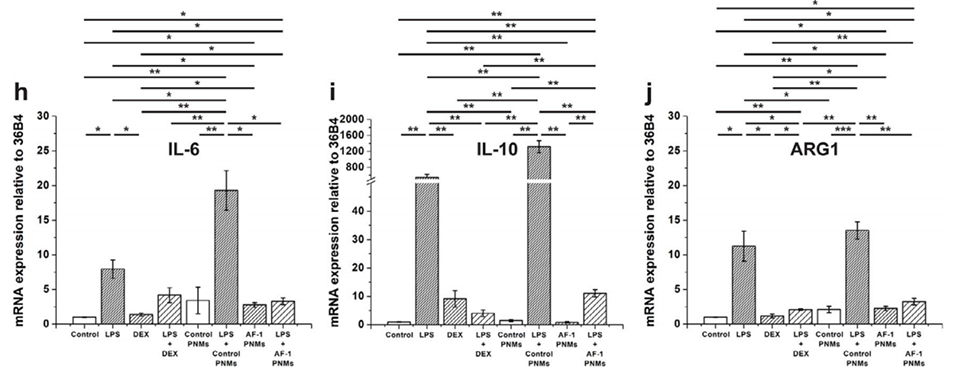
图8. AF-1肽偶联 PNMs(AF-1 PNMs)的抗炎作用。a)实验设计示意图:将人单核细胞培养5天分化为巨噬细胞,从第5天起,向培养基中加入脂多糖(LPS)、地塞米松(DEX)、LPS与DEX的混合物等外源性因子,并开始用PNMs进行处理。b)经LPS和PNMs处理的巨噬细胞的代表性显微镜图像。c)采用格里斯试剂法(Greiss assay)测定亚硝酸盐释放量。d-e)通过酶联免疫吸附测定(ELISA)定量检测TNF-α(d)和IL-10(e)的水平。f-j)炎症标志物的mRNA表达水平,包括TNF-α(f)、IL-1β(g)、IL-6(h)、IL-10(i)和ARG1(j)。(n=4,****:p≤0.0001,***:p≤0.001,**:p≤0.01,*:p≤0.05)
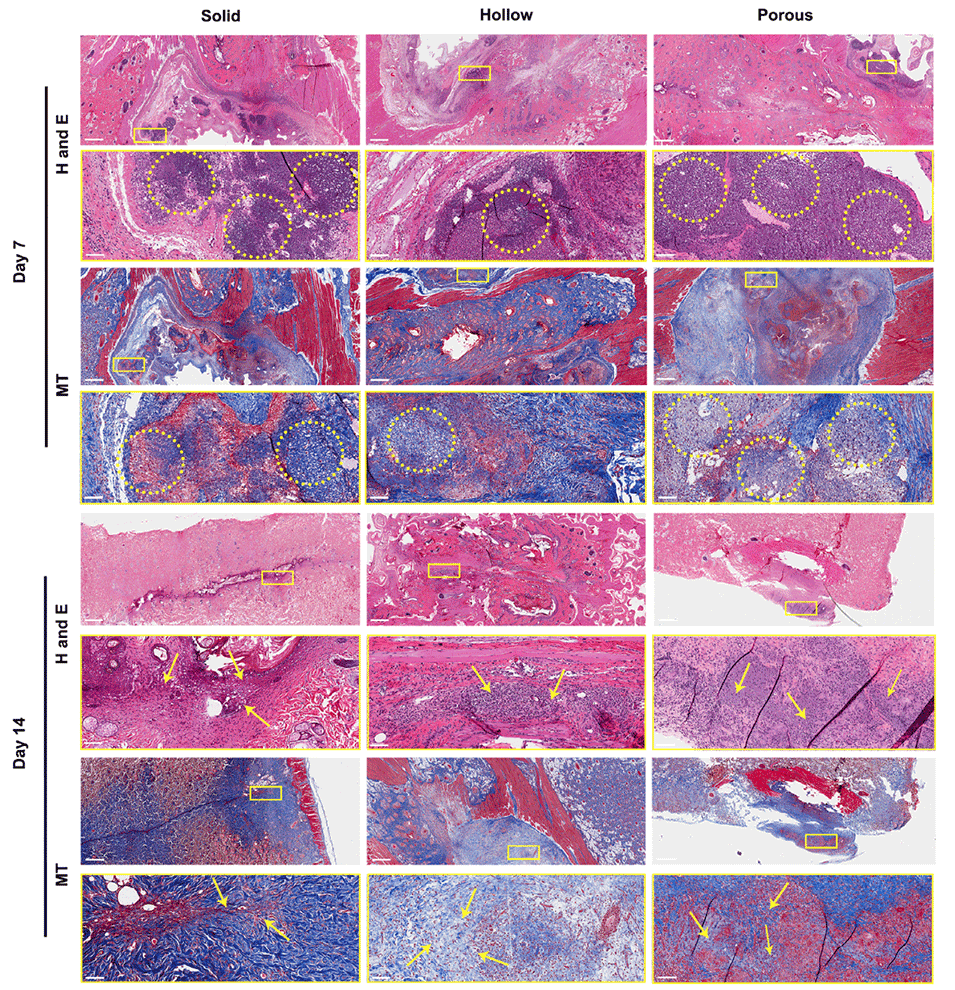
图9.微球在大鼠体内的皮下植入实验。代表性的苏木精-伊红(H&E)染色(前两行)和马松三色(MT)染色(后两行)图像显示第7天时实心、中空和多孔纳米纤维微球(黄色圆圈)的存在及其在第14天的完全整合。黄色箭头:微球位置。比例尺:1mm(低倍镜,上行),100μm(高倍镜,下行)。
论文链接:https://doi.org/10.1002/smll.202502033














