
导读:
多组分纳米颗粒作为广谱抗菌剂可对抗细菌/真菌感染并抑制耐药性,但其传统批量制备效率低、难以规模化。近期,墨尔本大学格雷姆·克拉克研究所团队开发了一种基于微流控技术的水相制备方法,可快速合成以硒为核心、抗菌肽为涂层的多组分纳米颗粒,其在尺寸、形态及抗菌性能上与传统批量合成产物相当,且制备效率显著提升,易于规模化生产。相关研究以“Microfluidics enables rapid and facile fabrication of multi-component antimicrobial nanoparticles”为题目,发表在期刊《Chemical Engineering Journal》上。
本文要点:
1、本研究开发了一种基于微流控技术的连续流合成工艺,可在水相中快速制备硒核-抗菌肽(ε-PL)复合纳米颗粒(Se NP-ε-PL)。
2、通过选用聚乙烯醇(PVA)或海藻酸钠作为稳定剂,实现了颗粒Zeta电位(+6.3至+32.3 mV)和抗菌肽负载量的精准调控。
3、该工艺仅需5分钟完成硒纳米核合成、10分钟吸附抗菌肽,总耗时66–76分钟,较批量法缩短69–86%。
4、所得球形颗粒粒径约60 nm,形貌均一,且PVA稳定体系对大肠杆菌的抗菌活性与批量法制备颗粒相当。该技术为规模化生产高效抗菌纳米颗粒提供了新途径。

图1. Se NP和Se NP-ε-PL的微流控制备流程示意图。

图2.分散在水中的Se NPs的特性。(a)平均尺寸。(b)多分散指数(PDI)。(c)平均zeta电位。(误差棒代表标准差,n=3次独立重复实验,采用双向方差分析及Tukey多重比较检验,*=p≤0.05)。
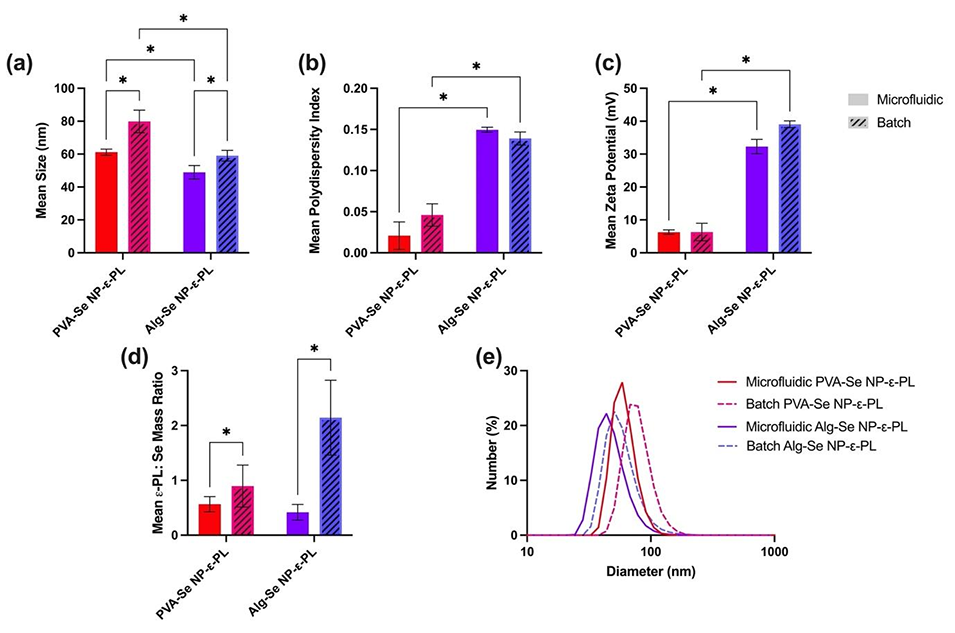
图3.分散在水中的Se NP-ε-PLs。(a)尺寸。(b)多分散指数(PDI)。(c)zeta电位。(d)ε-PL与硒的质量比。(e)尺寸分布。(误差棒代表标准差,n=3次独立重复实验,(a-d)采用双向方差分析及Tukey多重比较检验,*=p≤0.05)。

图4. Se NP-ε-PL表征。透射电镜(TEM)图像:(a)微流控制备的PVA-Se NP-ε-PL。(b)微流控制备的Alg-Se NP-ε-PL。(c)批量制备的PVA-Se NP-ε-PL。(d)批量制备的Alg-Se NP-ε-PL。拉曼光谱:(e)批量制备的Se NP-ε-PL。(f)微流控制备的Se NP-ε-PL。
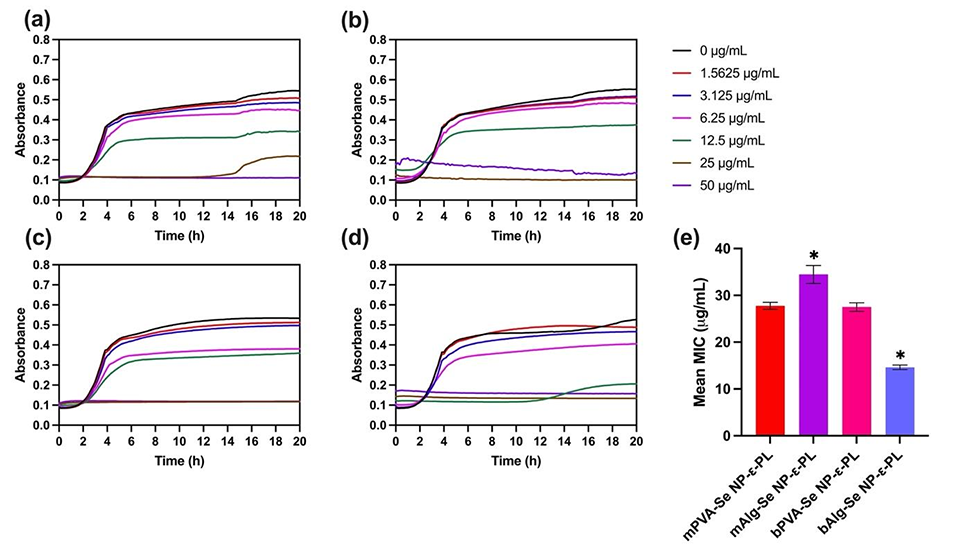
图5.不同浓度的(a)微流控PVA-Se NP-ε-PL、(b)微流控Alg-Se NP-ε-PL、(c)批量PVA-Se NP-ε-PL、(d)批量Alg-Se NP-ε-PL处理大肠杆菌的生长曲线。(e)每种Se NP-ε-PL对大肠杆菌的最小抑菌浓度(MIC)。(误差棒代表标准差,n=3次独立重复实验,(e)采用单向方差分析及Tukey多重比较检验,*=p≤0.05)。
论文链接:https://doi.org/10.1016/j.cej.2025.165807














