
导读:
口服胰岛素治疗糖尿病虽便捷,但存在纳米颗粒“易进入难胞吐”、胰岛素在肝脏积累不足及“闭环”系统复杂这三大问题。近期,中国药科大学钱红亮教授、陈维教授、黄德春教授等人设计了一种肠溶性胆汁酸聚合物(PUDCA)微胶囊系统(UCP-CMs@IA),通过微流体技术将三肽修饰的两性离子纳米颗粒(CP-CMs@IA)包裹其中,用于口服肝脏靶向的胰岛素缓释。实验结果表明,这种新型递送系统能够有效提高胰岛素的口服生物利用度,解决胰岛素颗粒在肠道中的胞吐难题,并在肝脏中建立胰岛素储备,以响应血糖波动,从而为糖尿病的口服治疗提供了一种创新策略。相关研究以“Enterosoluble microcapsules embedded with tripeptide-modified zwitterionic nanosystems to overcome intestinal barriers for intact exocytosis and hepatic-targeted gradual insulin delivery”为题,发表在期刊《Chemical Engineering Journal》上。
本文要点:
1、本研究利用微流控技术设计了肠溶性胆汁酸聚合物(PUDCA)微胶囊(UCP-CMs@IA),其包裹电荷可转换三肽(PEP)修饰的两性离子纳米颗粒(CP-CMs@IA),用于口服肝靶向逐步释放胰岛素。
2、肠溶性PUDCA微胶囊因胆汁酸在低pH下的质子化和电离特性,能抵抗胃酸侵袭,并在肠道释放CP-CMs@IA。
3、两性离子修饰使CP-CMs@IA能突破黏液和肠上皮屏障,而PEP部分可促进其高效的肠道细胞内运输并完整出胞。
4、带正电的PEP通过表面伪装策略附着于胰岛素颗粒,使CP-CMs@IA实现约79.4%的超高胰岛素负载及逐步释放能力,无需葡萄糖响应组件。
5、PEP部分在肝脏建立胰岛素储备库,可对血糖波动做出强烈响应。
6、结果显示,口服UCP-CMs@IA能维持正常血糖达一天,为口服糖尿病治疗提供了有前景的策略。
微流控技术制备肠溶性胆汁酸聚合物(PUDCA)微胶囊的原理基于多相流体在微通道内的精确操控,结合材料的理化特性实现微胶囊的可控成型,具体如下:
多相流体的界面作用与微液滴形成
以分散相和连续相两种互不相溶的流体为基础:
分散相:含20mg/mL肠溶性聚合熊去氧胆酸(PUDCA)的碳酸二甲酯(DMC)溶液,其中分散有负载胰岛素的纳米颗粒(如CP-CMs@IA),并添加5wt%司盘80(表面活性剂)以稳定相界面。
连续相:1%(w/v)聚乙烯醇(PVA)水溶液,作为分散相的载体。
通过注射器泵精确调节两种流体的流速,使分散相在微通道内被连续相对称且持续地剪切,形成均匀的水包油(O/W)型微液滴。微通道的几何结构和流速控制确保液滴尺寸均一(本研究中微胶囊直径约20μm)。
肠溶性材料的pH响应机制
PUDCA(胆汁酸聚合物)具有质子化和电离潜能:在低pH环境(如胃内,pH1.2)中,胆汁酸基团发生质子化,通过多价结合增强分子间相互作用,使微胶囊结构稳定,抵抗胃酸侵蚀;在较高pH环境(如肠道,pH6.8)中,电离作用增强,微胶囊结构破裂,释放内部包裹的纳米颗粒。
这一特性保证了微胶囊在胃部不降解,仅在肠道环境中触发释放,实现胰岛素的靶向递送。
微胶囊的固化与纯化
形成的微液滴被收集到PVA溶液中,通过三次水洗去除残留的PVA,获得PUDCA微胶囊(如UCP-CMs@IA)。
倒置光学显微镜可实时监测微液滴的形成过程,确保微胶囊的形态和尺寸符合设计要求。
综上,微流控技术通过精确控制流体界面作用实现微胶囊的均一成型,而PUDCA的pH响应特性赋予微胶囊肠溶性,两者结合使微胶囊能高效保护胰岛素并在肠道精准释放,为口服胰岛素递送提供了核心载体。
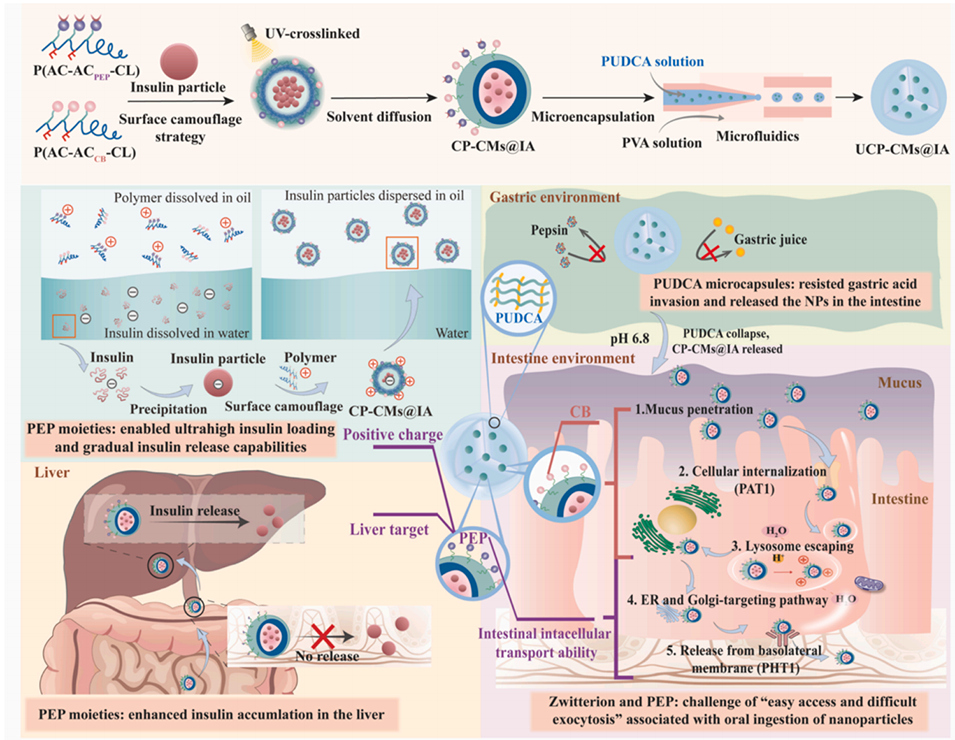
Scheme 1. 肠溶性微胶囊嵌入三肽修饰的两性离子纳米系统,克服肠道屏障,实现完整的胞外分泌和肝脏靶向胰岛素的逐渐递送。
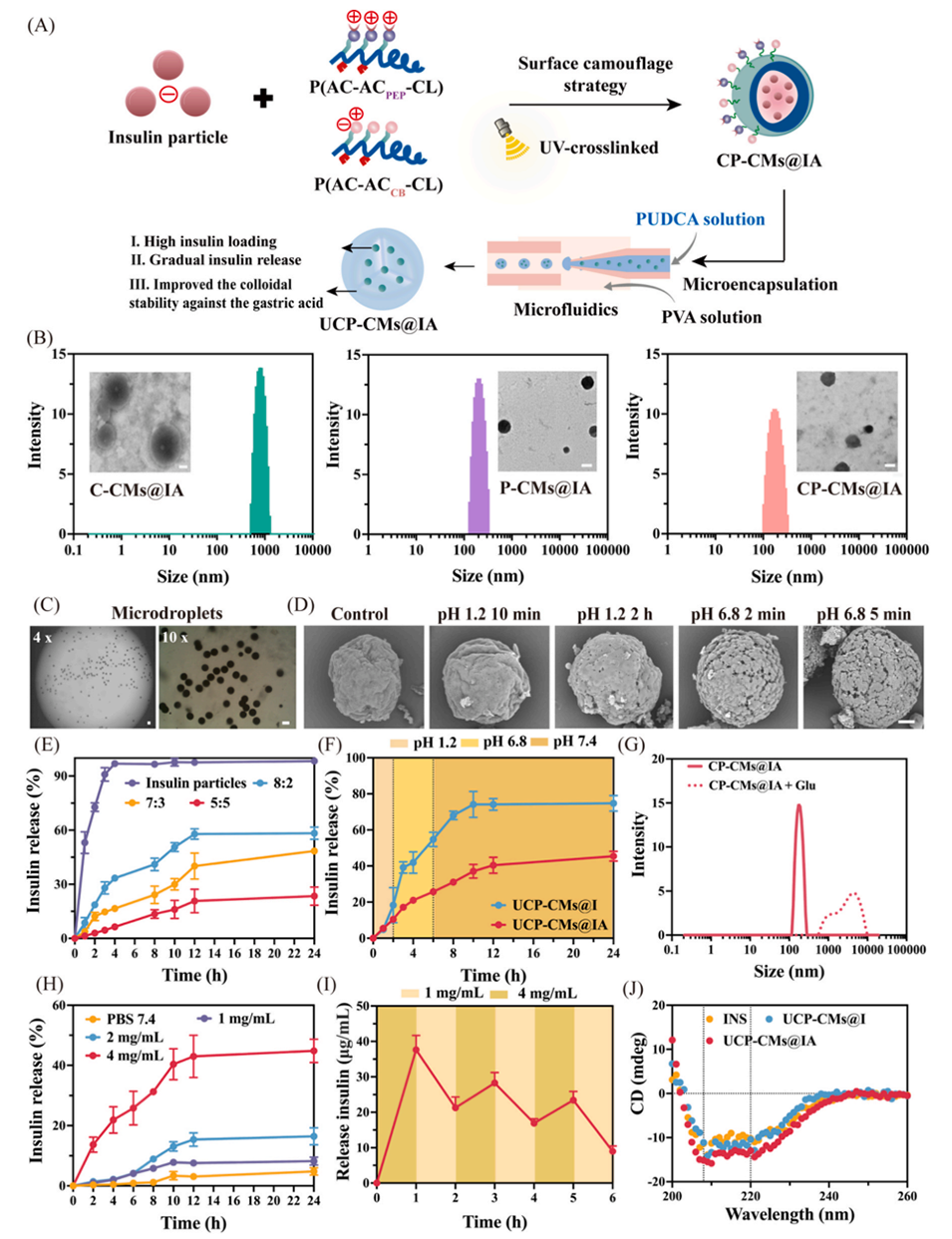
图1.(A)CP-CMs@IA纳米颗粒和UCP-CMs@IA微胶囊的制备过程。(B)C-CMs@IA、P-CMs@IA和CP-CMs@IA的透射电镜(TEM)与动态光散射(DLS)图像,比例尺:200nm。(C)微流控技术制备的微胶囊倒置显微镜图像,比例尺:20µm。(D)扫描电镜(SEM)图像显示微胶囊在pH1.2和pH6.8条件下的降解情况,比例尺:10µm。(E)胰岛素与聚合物重量比对CP-CMs@IA在pH6.8条件下释放模式的影响。(F)模拟口服给药,在不同pH条件下评估的体外胰岛素累积释放曲线。(G)CP-CMs@IA在高血糖条件下的粒径和形态变化。(H)CP-CMs@IA在不同葡萄糖浓度的PBS中的胰岛素累积释放量。(I)CP-CMs@IA在不同葡萄糖浓度下的脉冲释放模式。(J)UCP-CMs@I和UCP-CMs@IA释放的胰岛素的圆二色(CD)光谱。统计数据以平均值±标准差表示(n=5)。
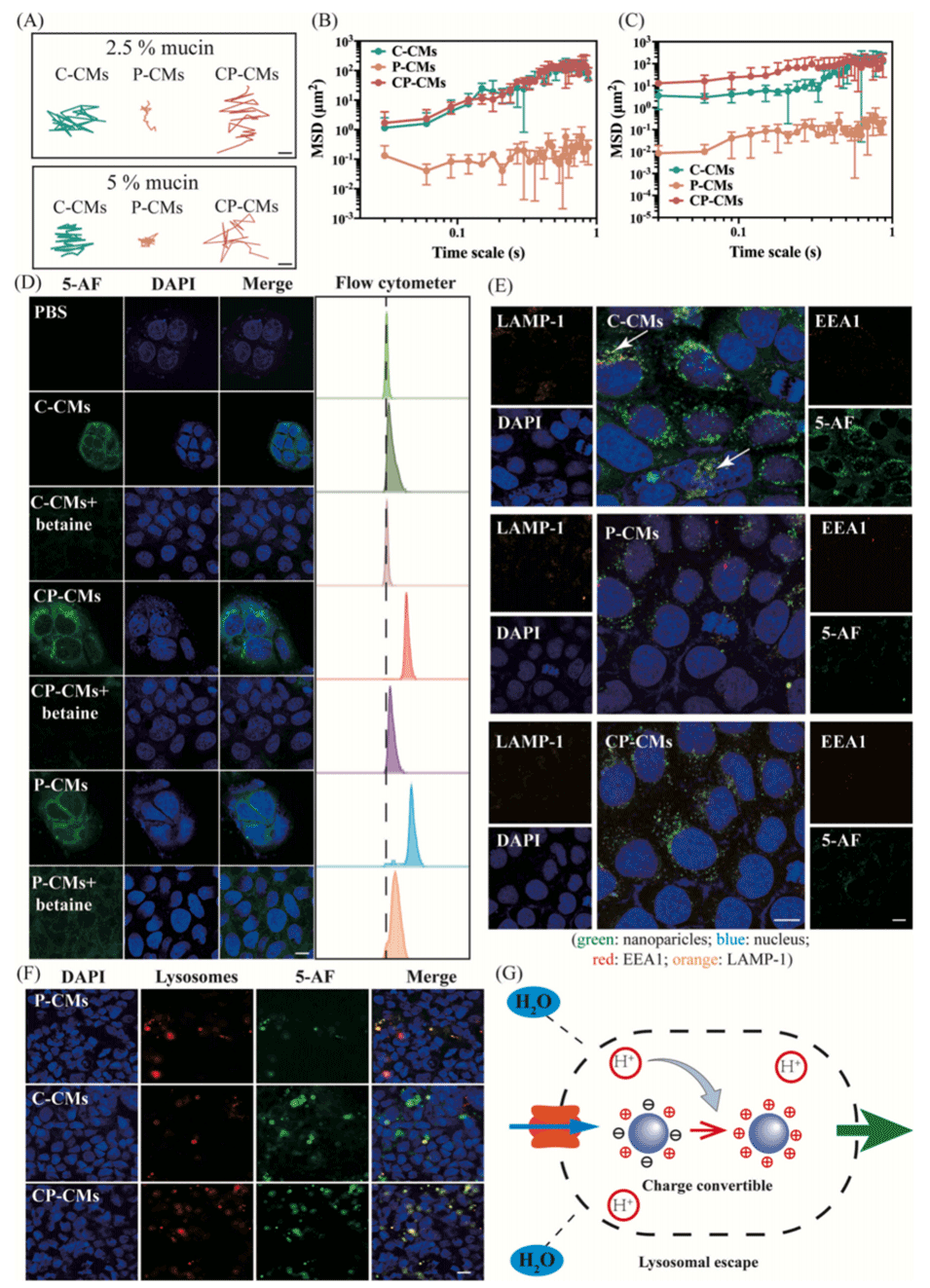
图2.(A)C-CMs、P-CMs和CP-CMs在肠黏液中1秒时的代表性轨迹,比例尺:0.1μm。含2.5%黏蛋白(B)和5%黏蛋白(C)时纳米颗粒的均方位移(MSD)随时间尺度的变化,n=100。(D)经甜菜碱处理或未处理的C-CMs、P-CMs和CP-CMs的细胞摄取共聚焦激光扫描显微镜(CLSM)图像,比例尺:50.0μm。(E)C-CMs、P-CMs和CP-CMs与内体(红色)和溶酶体(橙色)相互作用的CLSM图像,比例尺:10.0μm。(F)暴露于巴佛洛霉素A1后溶酶体共定位的CLSM图像,比例尺:10.0μm。(G)电荷转换纳米颗粒引起的质子海绵效应示意图。统计数据以平均值±标准差表示(n=5)。
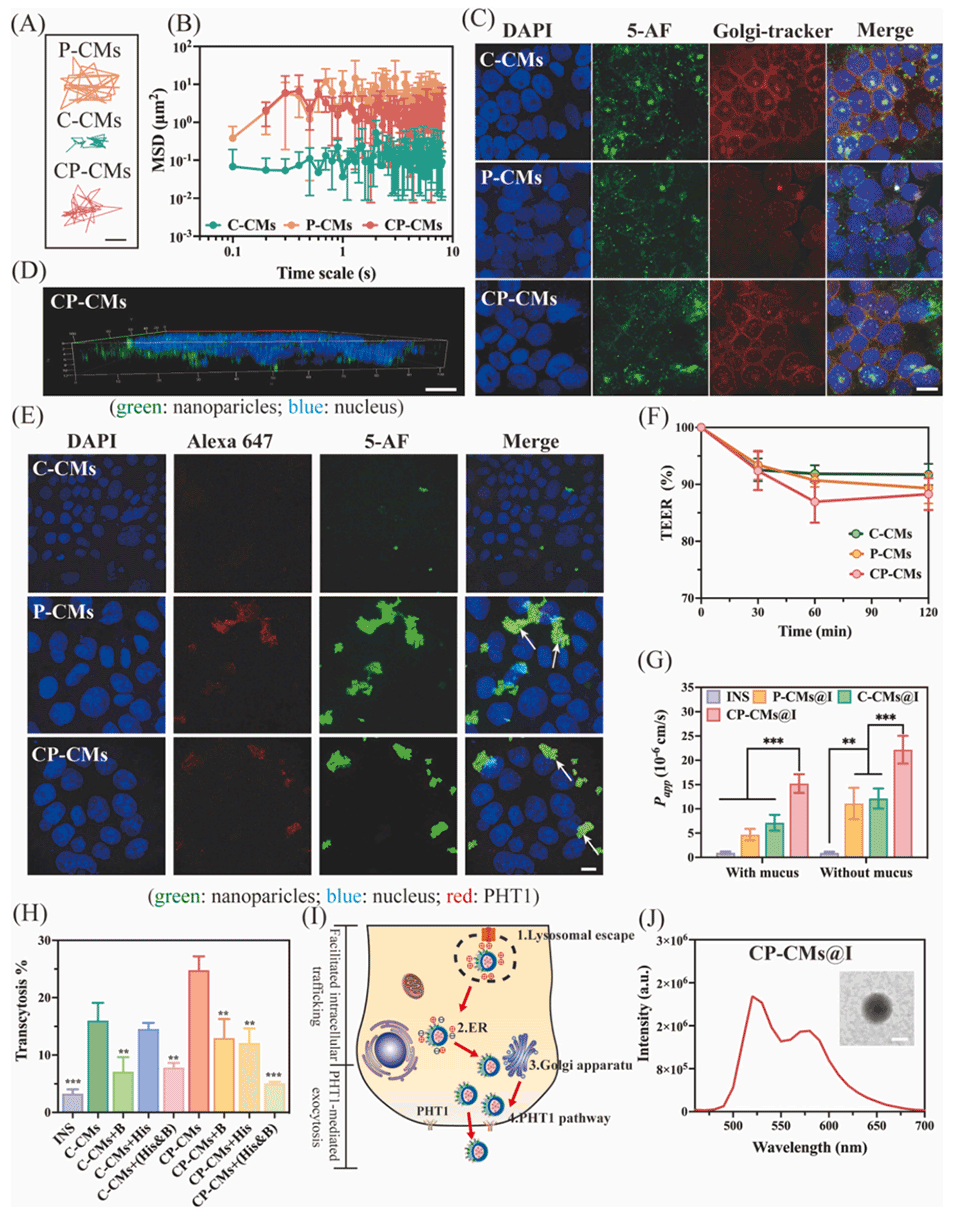
图3.(A)各种纳米颗粒在模拟细胞内介质中1秒时的代表性轨迹,比例尺:0.1μm。(B)纳米颗粒的均方位移(MSD)随时间尺度的变化,n=100。(C)C-CMs、P-CMs和CP-CMs与高尔基体孵育4小时后的CLSM共定位图像,比例尺:20μm。(D)Caco-2细胞单层与CP-CMs孵育的CLSM图像,比例尺:10μm。(E)P-CMs、C-CMs和CP-CMs与PHT1孵育4小时后的CLSM共定位图像,比例尺:20μm。(F)P-CMs、C-CMs和CP-CMs对Caco-2细胞单层跨上皮电阻(TEER)值的影响。(G)胰岛素(INS)、P-CMs@I、C-CMs@I和CP-CMs@I在Caco-2细胞单层中的表观渗透系数(Papp)值。(H)CP-CMs和C-CMs在有或无组氨酸(His)或甜菜碱(B)存在时穿过Caco-2细胞单层的转胞吞效率。(I)CP-CMs细胞内转运和胞吐的拟议途径示意图。(J)孵育4小时后从基底外侧获得的CP-CMs的荧光共振能量转移(FRET)现象和TEM图像,比例尺:200nm。统计数据以平均值±标准差表示(n=3),统计学显著性用**P<0.01和***P<0.001表示。
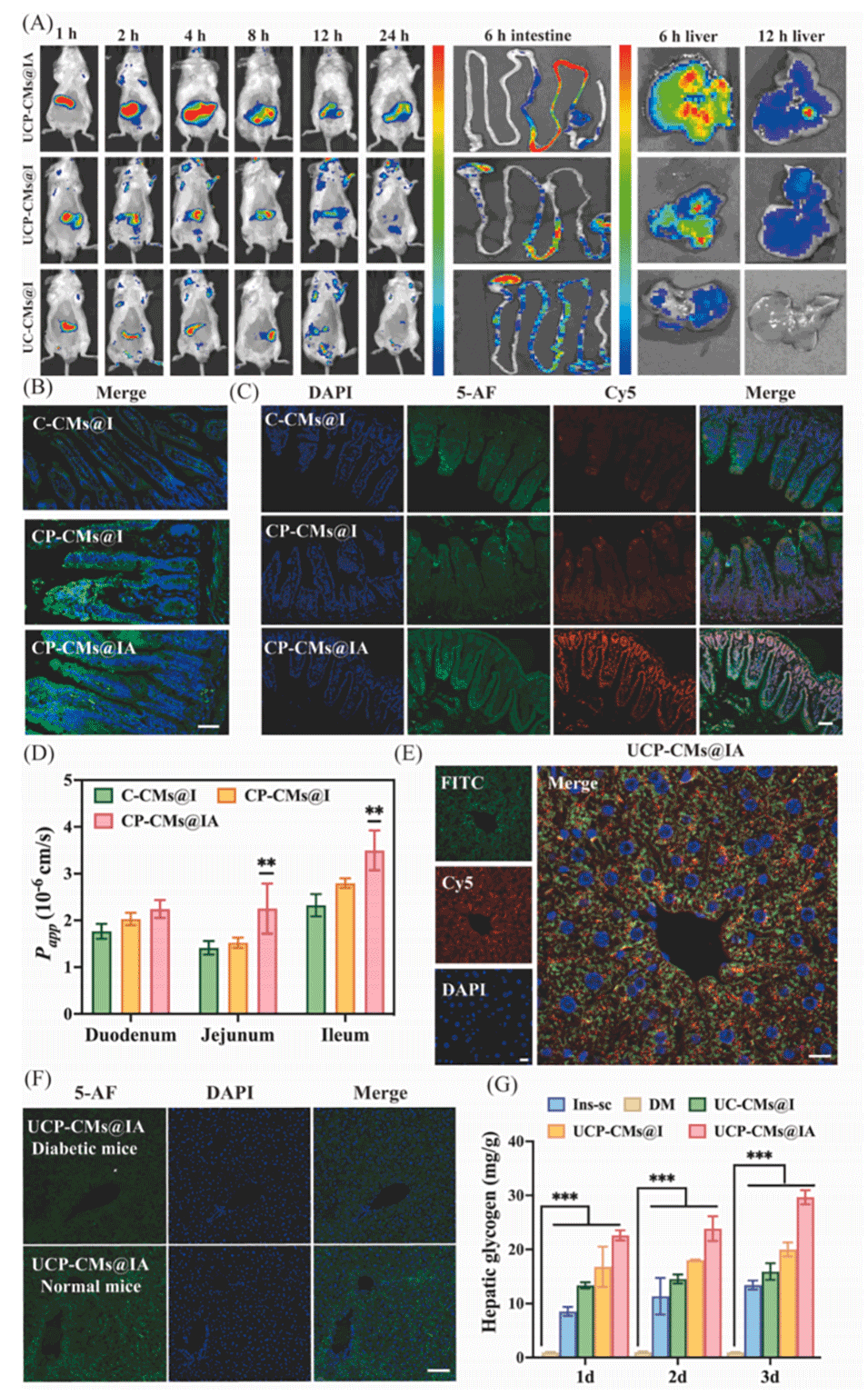
图4.(A)经UC-CMs@I、UCP-CMs@I和UCP-CMs@IA处理的糖尿病小鼠的活体成像观察和组织分布分析。(B)小肠绒毛切片与C-CMs@I、CP-CMs@I和CP-CMs@IA孵育后的CLSM图像,比例尺:10µm。(C)C-CMs@I、CP-CMs@I和CP-CMs@IA与肠道中PHT1的CLSM共定位图像,比例尺:10µm。(D)C-CMs@I、CP-CMs@I和CP-CMs@IA的胰岛素在肠环中的离体表观渗透系数(Papp)。(E)孵育6小时后纳米颗粒(绿色)与胰岛素(红色)的CLSM共定位图像,比例尺:20.0µm。(F)正常小鼠和糖尿病小鼠口服UCP-CMs@IA后的肝脏积累CLSM图像,比例尺:20.0µm。(G)糖尿病小鼠暴露于不同制剂3天后的肝糖原水平。所有统计值以平均值±标准差表示(n=3),统计学显著性用**P<0.01和***P<0.001表示。
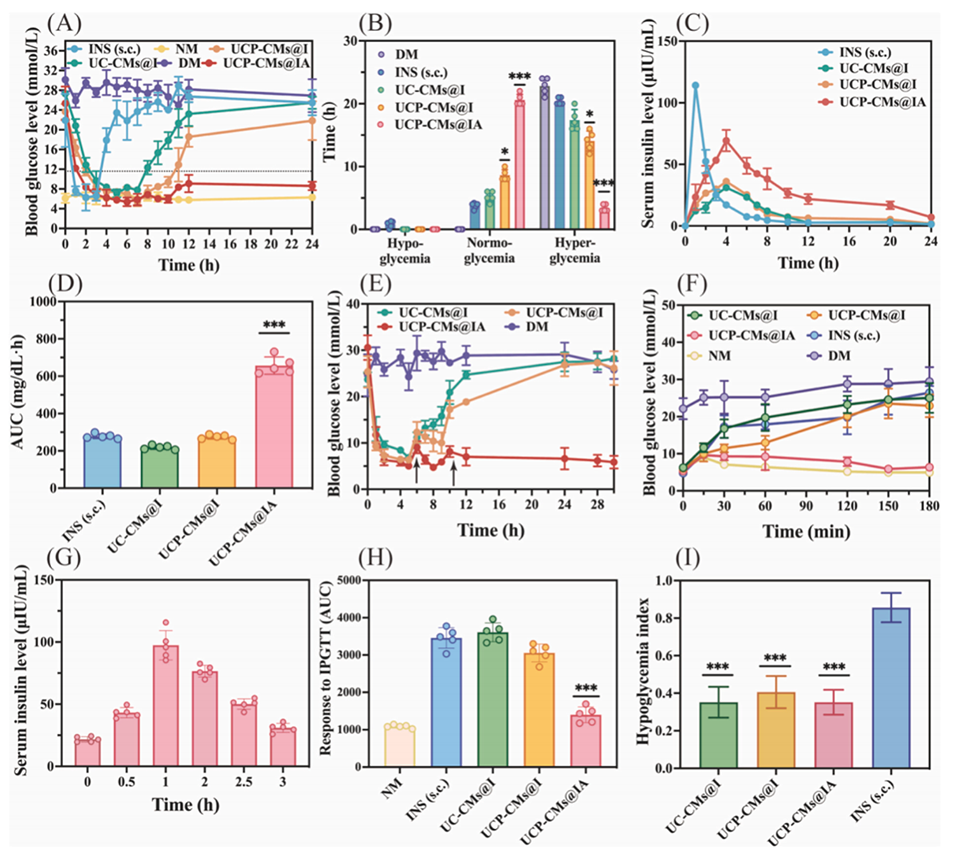
图5.(A)糖尿病小鼠接受各种胰岛素制剂后的血糖(GLs)曲线。(B)经UC-CMs@I、UCP-CMs@I和UCP-CMs@IA处理后低血糖、正常血糖和高血糖的持续时间。(C)糖尿病小鼠给予胰岛素皮下注射(INS(s.c.))、UC-CMs@I、UCP-CMs@I和UCP-CMs@IA后的时间依赖性血清胰岛素水平。(D)代表血糖随时间变化的曲线下面积(AUC)值。(E)每日两次进食模拟餐后血糖波动。(F)糖尿病小鼠在给予UC-CMs@I、UCP-CMs@I和UCP-CMs@IA 2小时后的腹腔内葡萄糖耐量试验(IPGTT)结果。(G)腹腔注射葡萄糖后的血清胰岛素水平。(H)180分钟内糖尿病小鼠给予不同胰岛素制剂后的血糖曲线下面积(AUC)值。(I)低血糖指数,计算方法为初始血糖与最低血糖读数之差除以达到最低血糖的时间。所有统计值以平均值±标准差表示(n=5),统计学显著性用*P<0.05和***P<0.001表示。
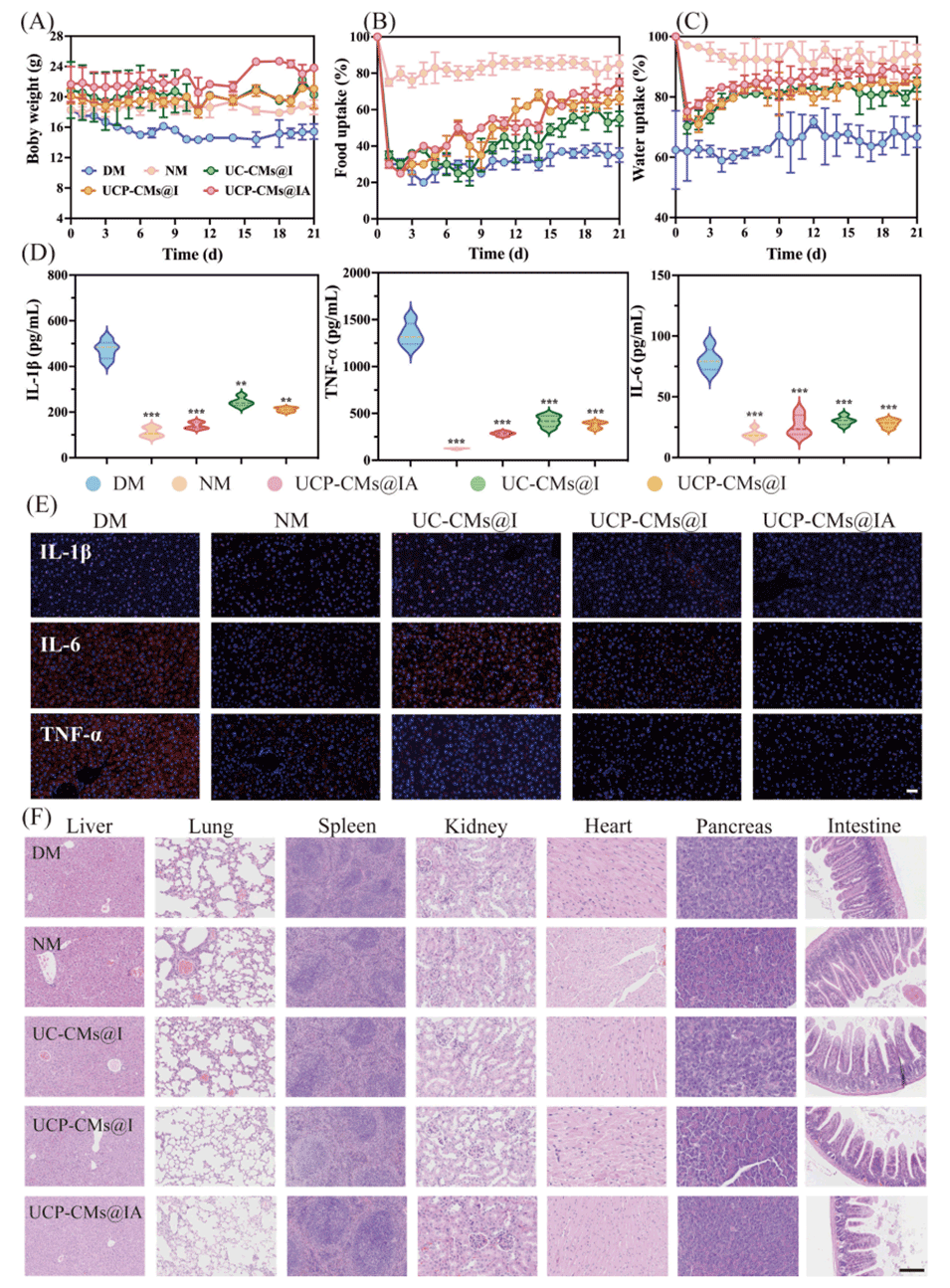
图6(A)体重、(B)食物摄入量和(C)饮水量的每日波动。(D)经各种制剂处理的糖尿病小鼠血液中IL-1β、IL-6和TNF-α的水平。(E)肝脏中IL-6、IL-1β和TNF-α的免疫荧光代表性照片(红色),通过CLSM观察,比例尺:30μm。(F)给予UC-CMs@I、UCP-CMs@I和UCP-CMs@IA 21天后肝脏、肺、脾脏、肾脏、心脏、胰腺和肠道的苏木精-伊红(H&E)染色,比例尺:40.0µm。所呈现的数据为平均值±标准差(n=3),统计学显著性用**P<0.01和***P<0.001表示。
论文链接:https://doi.org/10.1016/j.cej.2025.161732

马俞宏(本文第一作者),中国药科大学制药工程学专业博士生,指导老师为钱红亮教授。科研工作聚焦口服治疗糖尿病领域,致力于克服降糖药物的跨膜障碍及提高口服利用度,以第一作者在Chemical Engineering Journal, Advanced Healthcare Materials等期刊上发表论文7篇,并申请6项国家发明专利,其中授权4项。获研究生国家奖学金,并受CSC国家留学基金资助,赴澳大利亚墨尔本大学,在Christoph Hagemeyer教授和Rong Xu研究员的指导下,进行为期一年的联合培养。

钱红亮(本文通讯作者),博士、教授、博士生导师,省青蓝工程优秀青年骨干教师、省科技副总。师从南京工业大学陆小华教授和南京大学张志炳教授。聚焦制药分离热力学,通过热力学和机器学习方法指导中药材/药食同源品活性成分提取及应用于糖尿病治疗、药渣(生物质)高效利用,在Chemical Engineering Journal、Energy、Fuel和Journal of Controlled Release等期刊上发表文章 60 余篇,其中机器学习单篇文章被引用 92 次(2022 年发表)。与东南大学吉远辉教授合作,热力学模拟和系统优化研究成果受邀在张锁江院士任主编的 Green Chemical Engineering 期刊上撰写综述文章。近 5 年主持国家自然科学基金面上项目、国家重点研发课题(280万元)和校青年科技领军人才培育等纵向项目,与企业共建联合实验室(300万元)并任负责人,主持的项目经费 860 余万元。














