胃肠道作为人体与外界环境接触的主要界面,易受食源性病原体侵袭,引发感染和腹泻等疾病。世界卫生组织报告,每年约有5.5亿人因不安全食品患腹泻病。沙门氏菌是主要致病菌之一,会破坏肠道组织和菌群,导致腹痛、腹泻等严重胃肠道问题,其中鼠伤寒沙门氏菌(S. typhimurium)是急性胃肠炎的主要病因。

抗生素是治疗沙门氏菌病的主要方法,但存在非特异性抗炎、耐药性上升、靶向性差等问题。鉴于此,中国农业大学食品科学与营养工程学院许文涛教授团队开发了一种口服固液双相微胶囊(SL-BMs),该微胶囊通过创新的微流控T形芯片和气体剪切技术制备而成,能精准靶向治疗沙门氏菌诱导的肠炎,具备靶向抗菌、抗炎、调节肠道菌群等多重治疗优势。相关研究以“Oral solid-liquid biphasic microcapsules for precision targeted therapy of Salmonella-induced enteritis”为题目,发表在期刊《Chemical Engineering Journal》上。
本文要点:
1、本研究通过气体剪切微流控技术制备了一种新型口服固液双相微胶囊(SL-BMs),用于精准靶向治疗沙门氏菌诱导的肠炎。
2、其核心采用首次筛选的双功能适配体CAB-3T,可特异性靶向伤寒沙门氏菌并负载抗菌成分肉桂醛(CA),外壳由季铵化壳聚糖(QSC)和海藻酸钠(SA)经CaCl2固化形成,可抵抗胃酸降解。
3、体内外研究表明,SL-BMs具备多方面的治疗优势:能精准靶向沙门氏菌感染部位;在肠道内的保留时间显著延长,可达15小时;在肠道环境中实现pH响应性控释,释放出的CA对沙门氏菌展现出高达95.28%的杀菌率。
4、SL-BMs能够显著降低促炎细胞因子的分泌水平,同时促进M2型巨噬细胞的分化,进而有效调节肠道免疫炎症反应。
5、此外,SL-BMs还能够优化肠道菌群的组成,抑制沙门氏菌的生长增殖,维持肠道稳态,为肠道组织修复和功能恢复创造有利条件。
微流控T形芯片的结构及工作原理
微流控T形芯片核心为“T”形剪切通道设计,包含两个关键入口:
分散相入口:输送由适配体CAB-3T、肉桂醛(CA)、季铵化壳聚糖(QSC)和海藻酸钠(SA)组成的混合液。
连续相入口:通入氮气(N₂)作为气体剪切介质,与分散相通道在“T”形交叉处形成剪切界面。
基于气体剪切作用实现固液双相微胶囊(SL-BMs)的制备,具体过程如下:
混合液输送与剪切:分散相混合液经通道送至T形交叉区域,氮气以5m/s的流速从连续相入口进入,对混合液(流速0.1m/s)产生剪切应力,将其切割为均匀液滴。
固化成形:剪切形成的液滴通过通道进入含5%w/v氯化钙(CaCl₂)的固化溶液,QSC与SA在Ca²⁺作用下交联,形成固体外壳,包裹含CA和适配体的液态核心,最终形成SL-BMs。
该设计通过精准控制气液流速,可制备尺寸均一(平均586.86±11.10μm)的微胶囊,其固体外壳能抵御胃酸,液态核心实现活性成分的靶向释放,为肠道靶向治疗奠定基础。
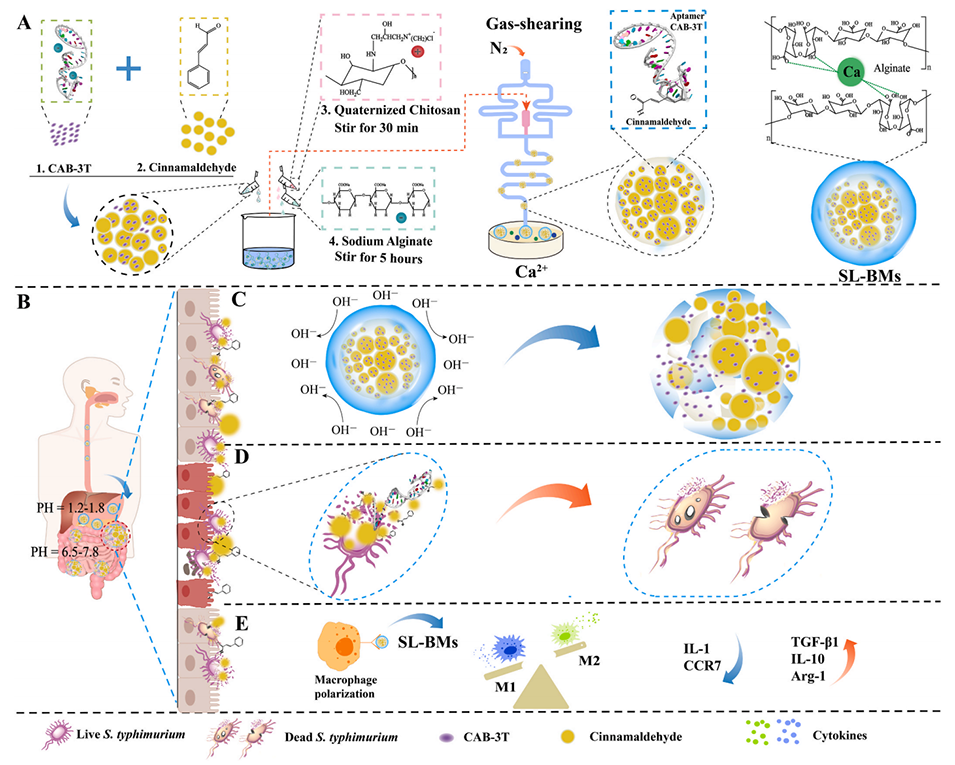
Scheme 1.固液双相微胶囊(SL-BMs)用于精准靶向治疗鼠伤寒沙门氏菌诱导的肠炎
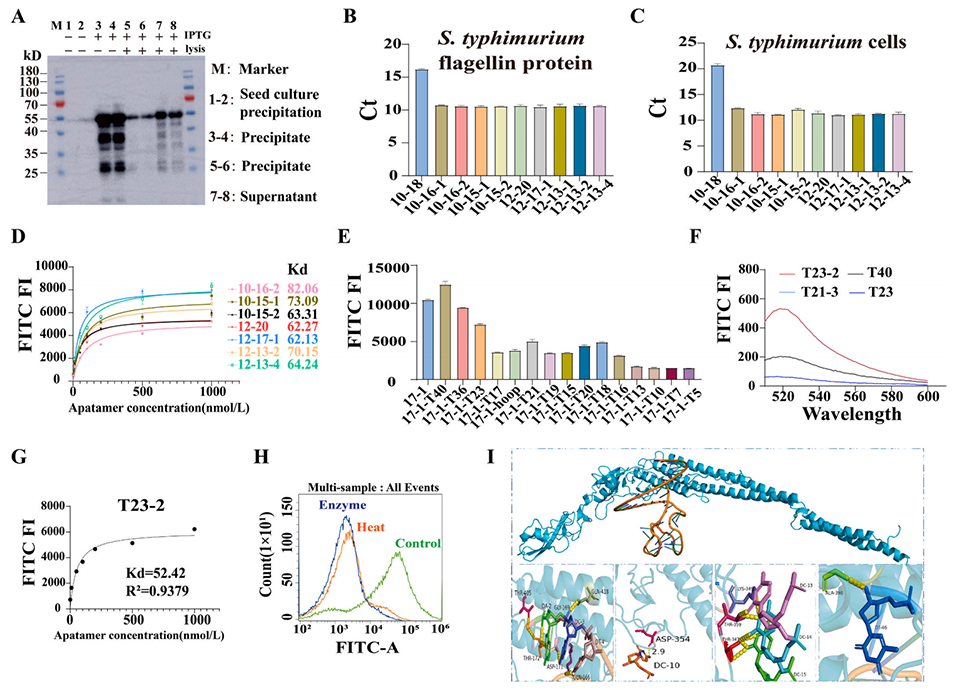
图1.鼠伤寒沙门氏菌鞭毛蛋白的表达与纯化,以及鼠伤寒沙门氏菌适配体的SELEX筛选与截短
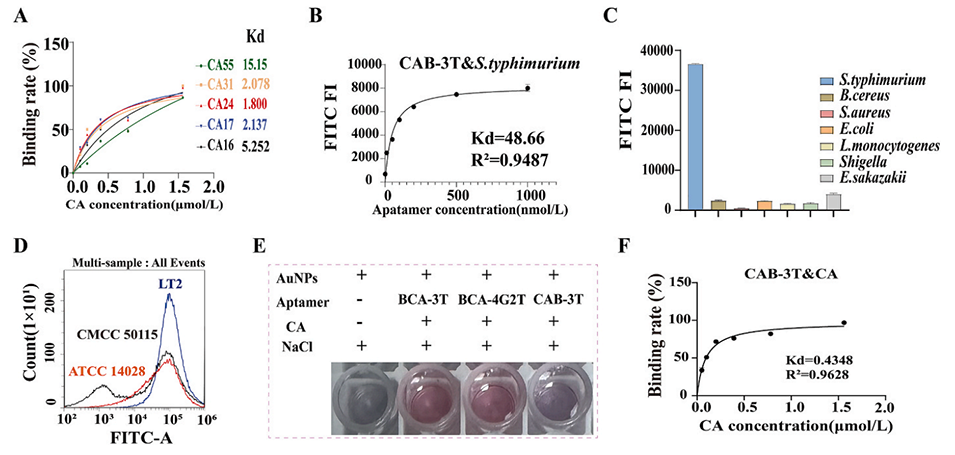
图2.肉桂醛(CA)适配体的截短及鼠伤寒沙门氏菌与CA的适配体偶联
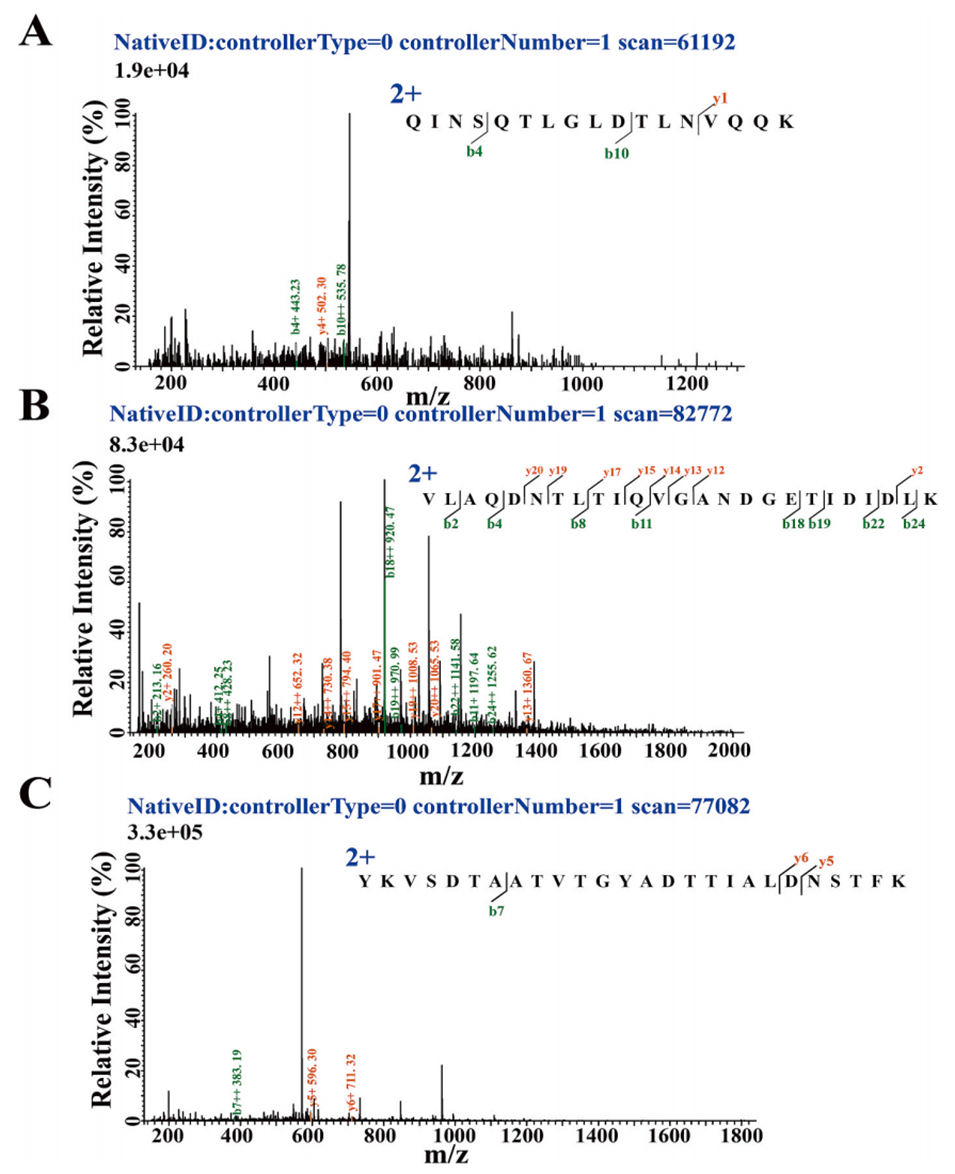
图3.鞭毛蛋白衍生肽段的代表性二级质谱图
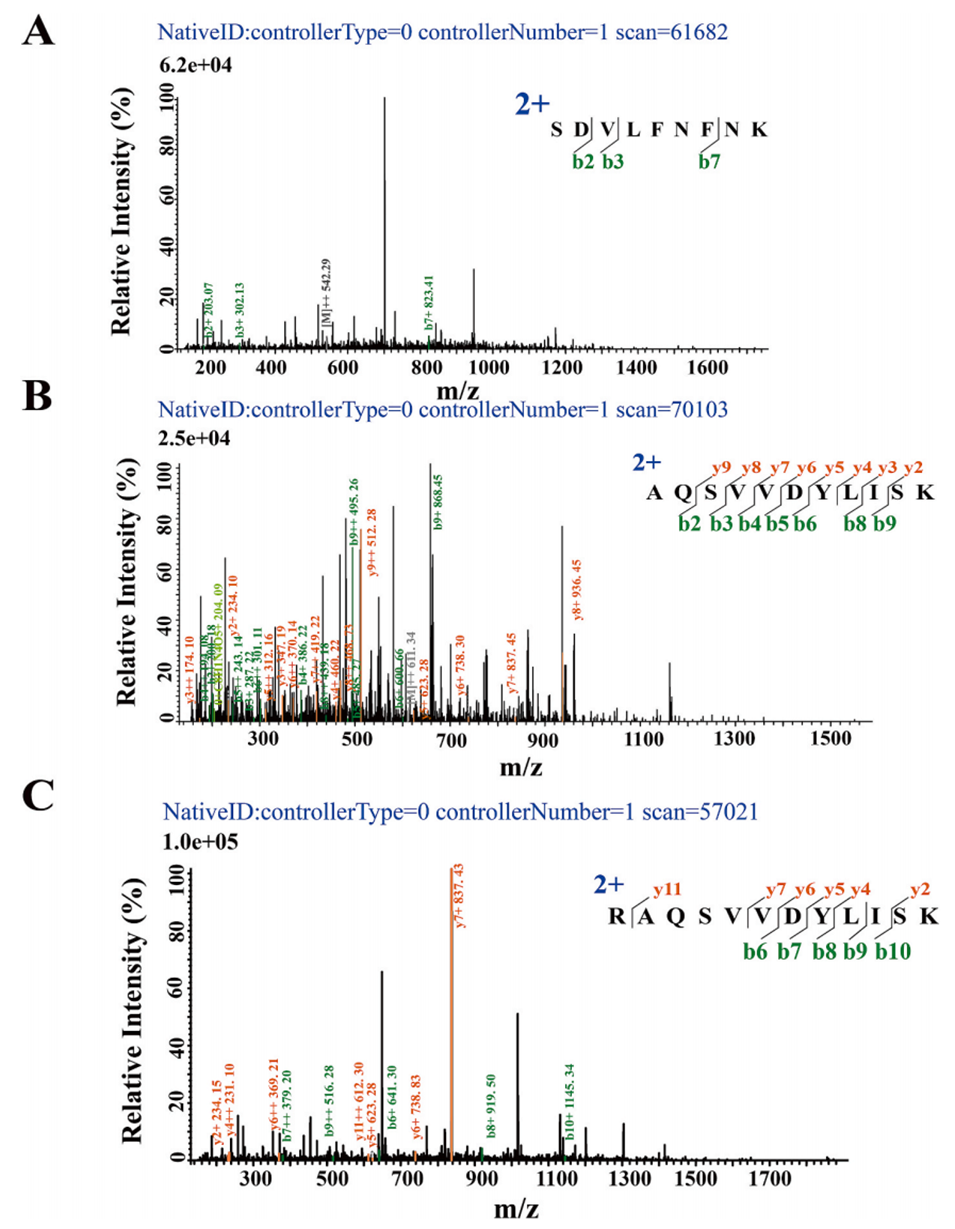
图4.外膜蛋白A(OmpA)衍生肽段的代表性二级质谱图
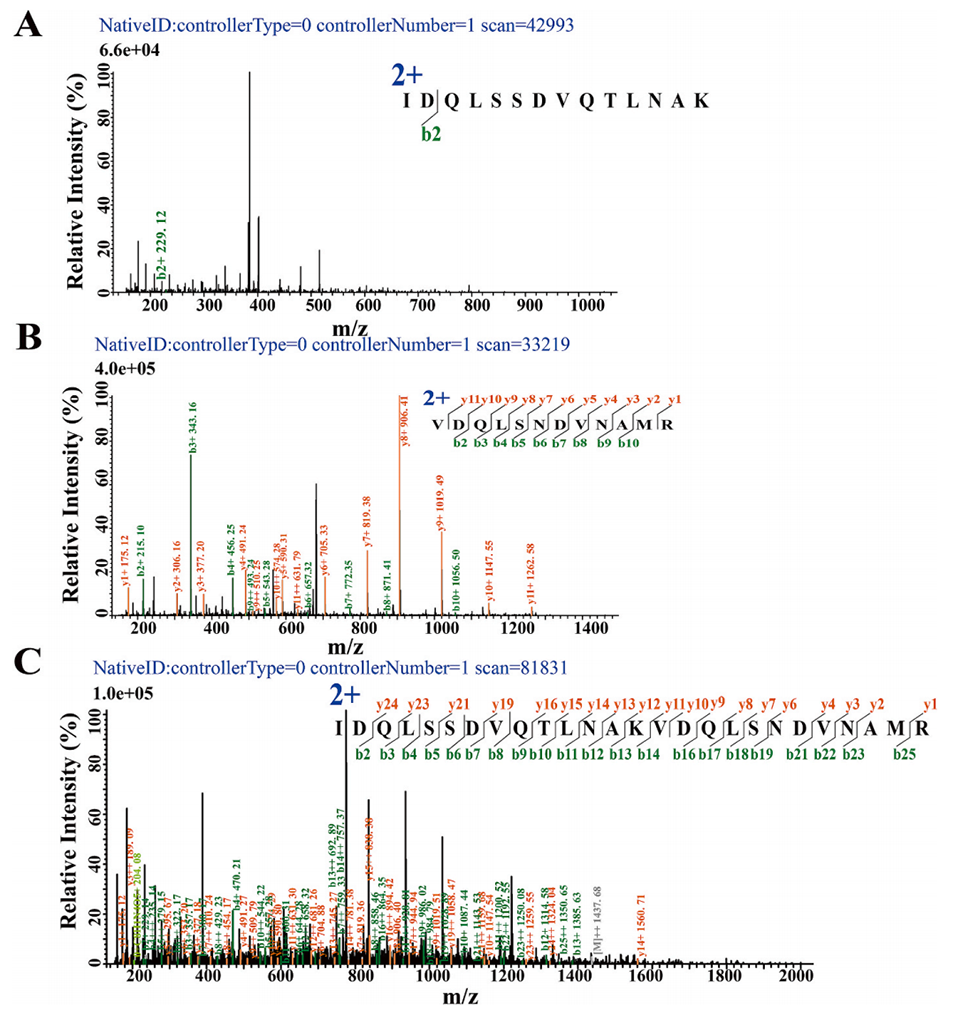
图5.主要外膜脂蛋白Lpp1衍生肽段的代表性二级质谱图
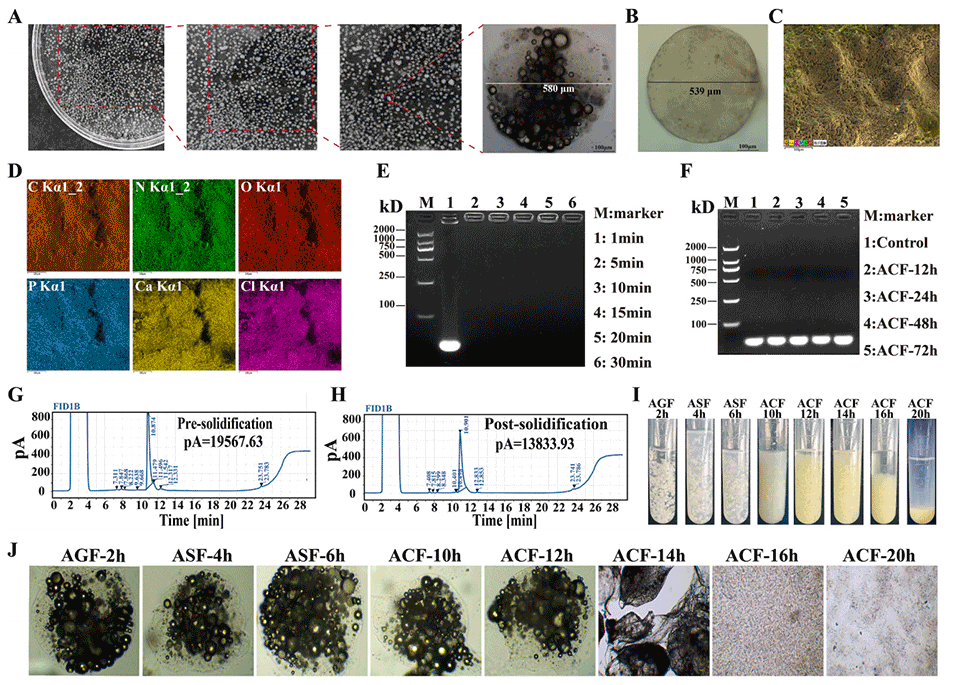
图6.固液双相微胶囊(SL-BMs)的制备与表征
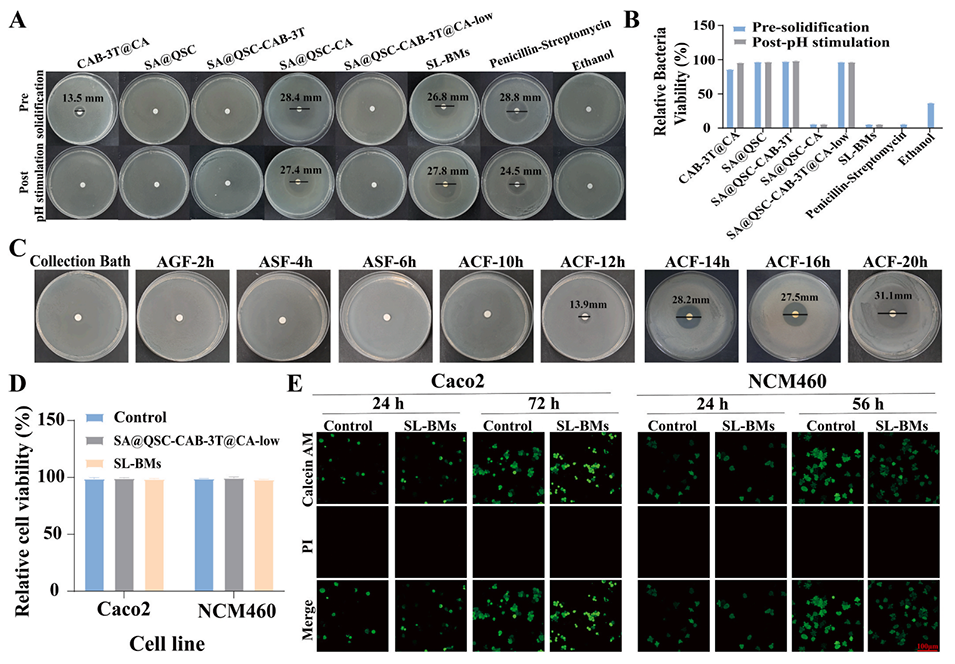
图7.固液双相微胶囊(SL-BMs)的抗菌效能与生物相容性
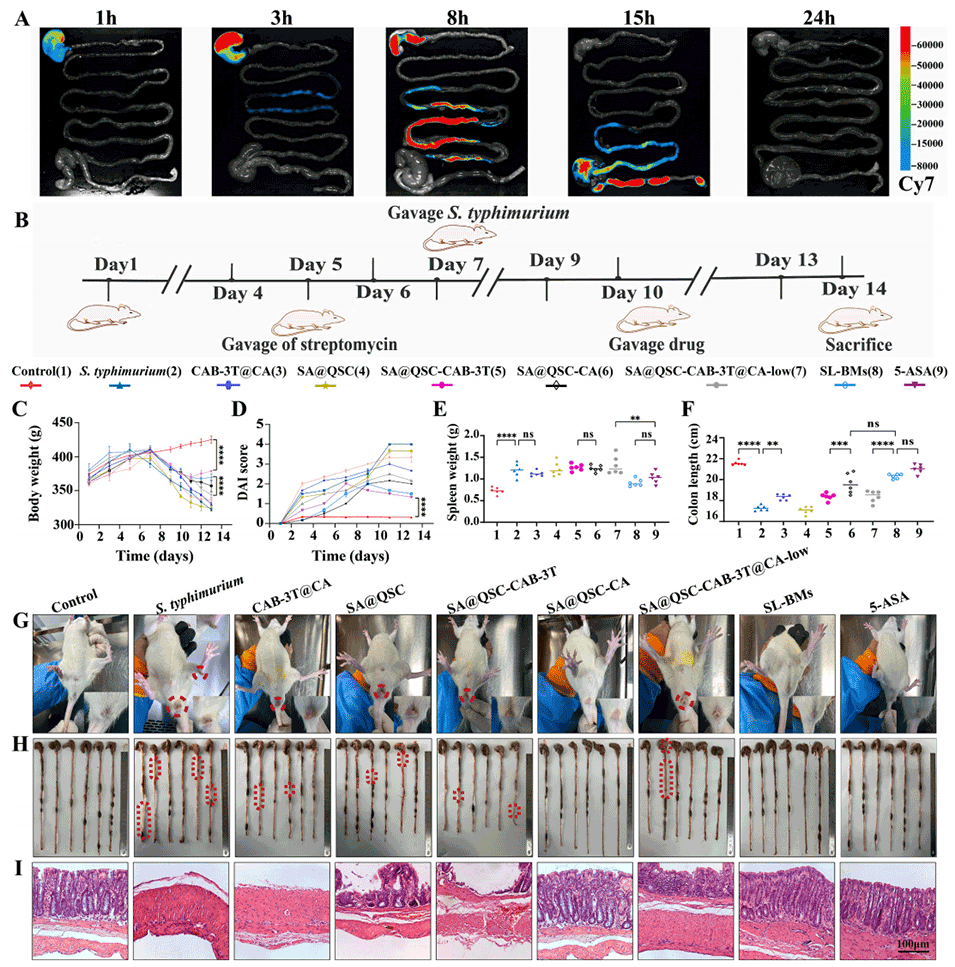
图8.口服固液双相微胶囊(SL-BMs)对鼠伤寒沙门氏菌诱导的大鼠结肠炎的治疗效果,显示出良好疗效
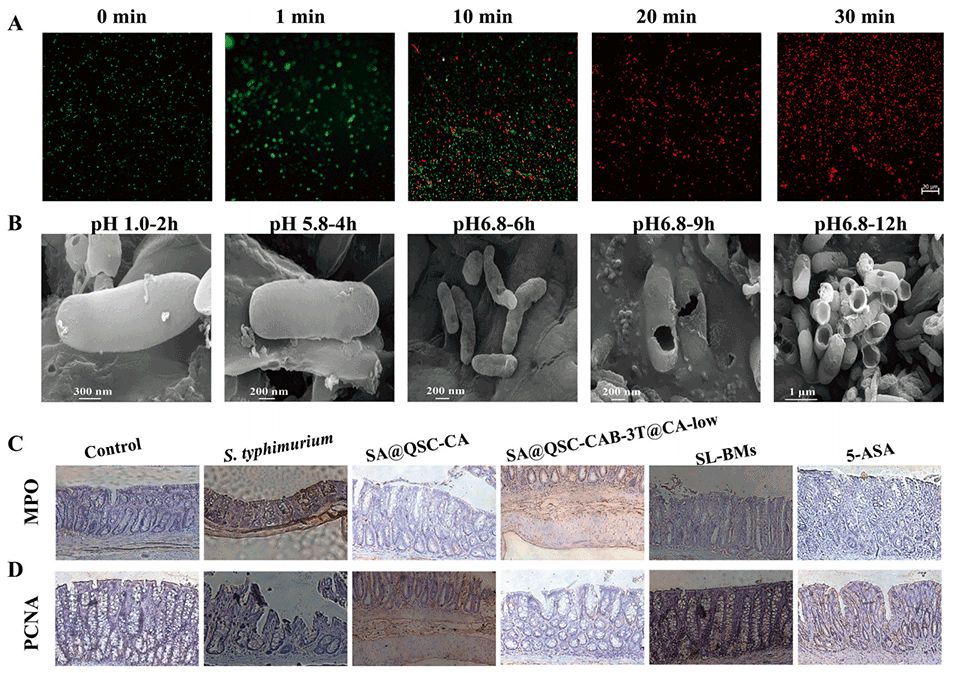
图9.固液双相微胶囊(SL-BMs)对肠道炎症的抑制作用
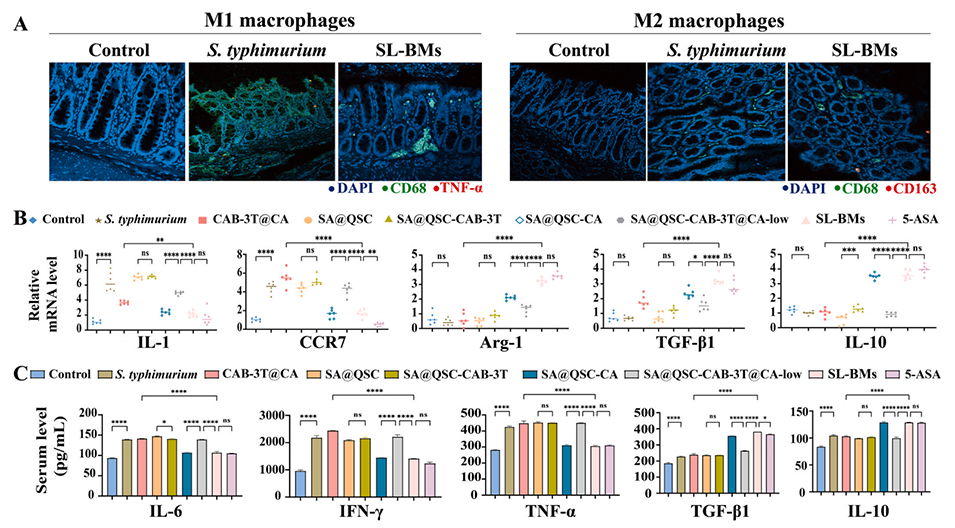
图10.固液双相微胶囊(SL-BMs)促进肠道组织的及时修复
论文链接:https://doi.org/10.1016/j.cej.2025.161497














