
导读:
益生菌在调节肠道免疫稳态和支持肠道健康方面发挥着至关重要的作用。然而,口服给药面临非特异性分布、疗效低等挑战。为了实现精确高效的递送,中国海洋大学食品科学与工程学院张兰威教授、林凯副教授等人通过微流控技术将透明质酸(HA)与半胱氨酸修饰的壳聚糖(CCH)共价连接,构建了靶向结肠炎症部位CD44受体的益生菌递送系统,将两株益生菌包封于修饰后的壳聚糖基质中形成微球,实现了益生菌在炎症部位的精准定位与高效递送,有效改善结肠炎症状。相关研究以“Microfluidic Fabrication of Hyaluronic Acid–Cysteine-Modified Chitosan Microspheres for CD44-Targeted Probiotic Delivery in Colitis Treatment”为题目,发表在期刊《ACS Applied Materials & Interfaces》上。
本文要点:
1、本研究构建了一种基于微流控技术的透明质酸-半胱氨酸修饰壳聚糖(CCH)微球靶向递送系统,用于将益生菌精准递送至结肠炎炎症部位的CD44受体,以提升益生菌在结肠炎治疗中的效果。
2、将两株益生菌(双歧杆菌FL-276.1和丁酸梭菌ATCC19398)包封于修饰后的壳聚糖基质中,形成平均直径约276μm的益生菌@CCH微球。
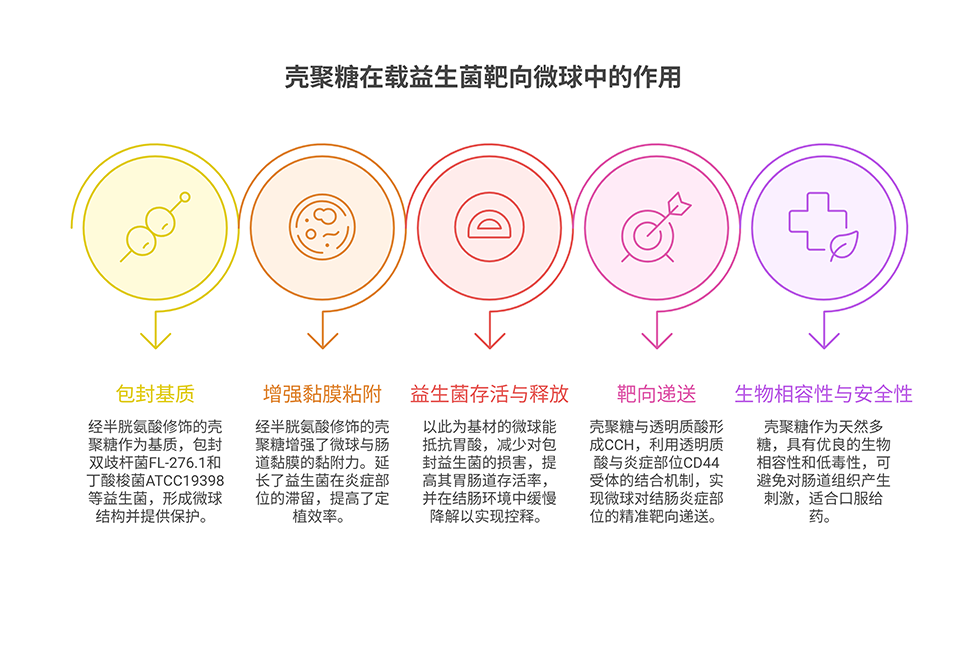
3、借助透明质酸(HA)与CD44的受体-配体结合机制,以及半胱氨酸修饰壳聚糖赋予的肠黏膜黏附特性,该微球对炎症性Caco-2细胞捕获率高,在DSS诱导的结肠炎小鼠模型中能延长滞留并靶向定位。
4、实验表明,益生菌@CCH微球可通过调节肠道菌群组成、增加短链脂肪酸产生、维护肠屏障完整性来维持肠道稳态,为增强益生菌在肠道健康管理中的应用提供了理论依据。
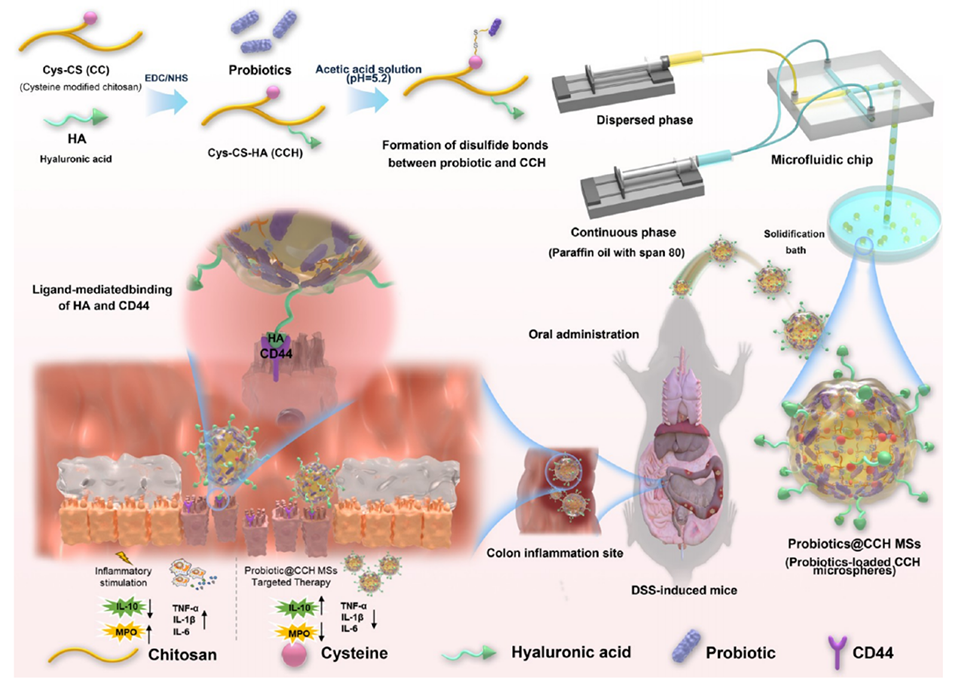
Scheme 1. 载益生菌靶向微球用于炎症性肠病治疗的示意图。
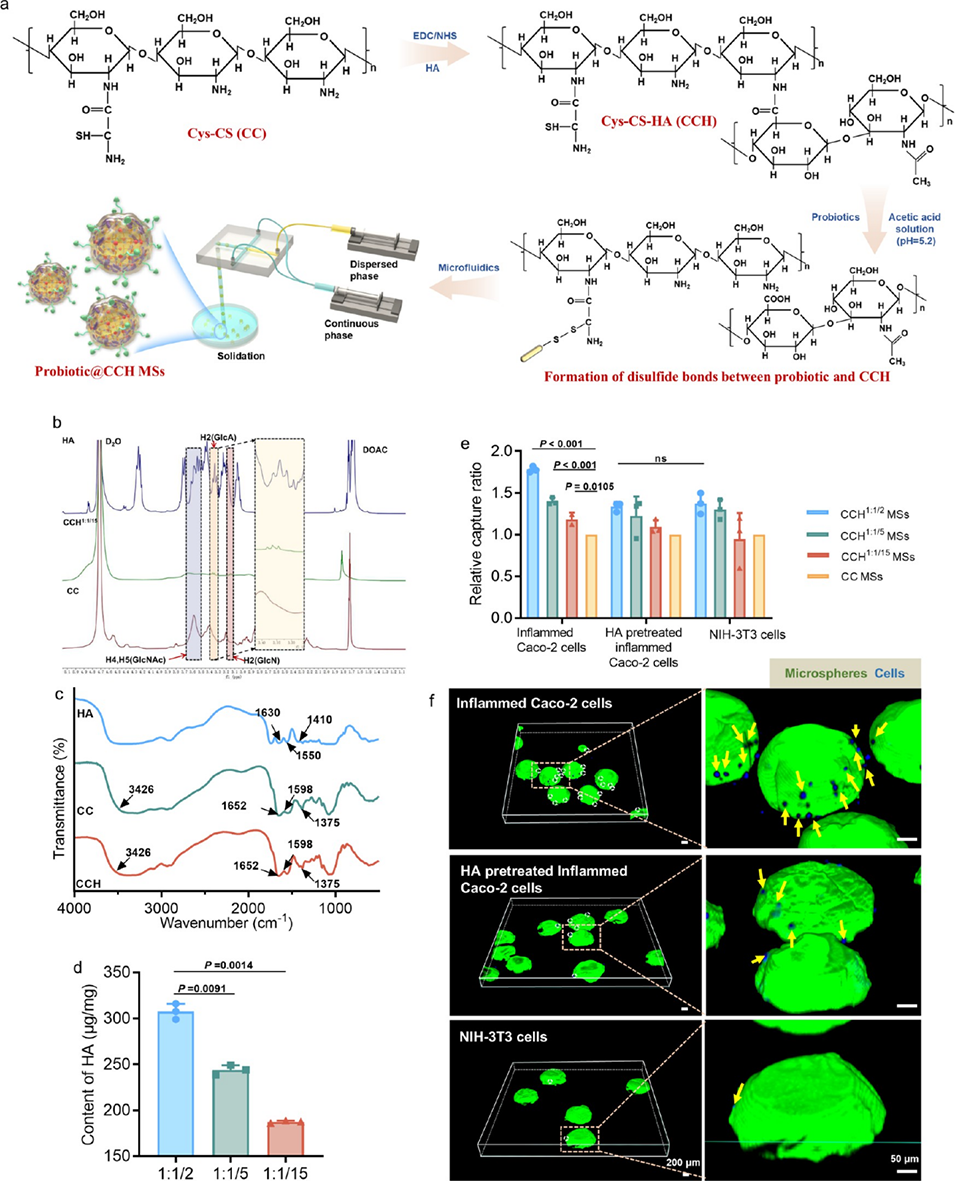
图 1. CCH 微球的合成与表征。(a)益生菌@CCH 微球的制备与合成流程示意图:透明质酸(HA)首先通过酰胺反应与巯基修饰的壳聚糖结合,随后益生菌通过二硫键与半胱氨酸残基连接,最终利用微流控技术获得益生菌@CCH 微球。(b)氢核磁共振(¹H NMR)谱图和(c)傅里叶变换红外(FTIR)光谱证实 HA 接枝到半胱氨酸修饰壳聚糖(CC)上形成了 CCH。(d)CCH1:1/2、CCH1:1/5和 CCH1:1/15 中接枝的 HA 含量。(e)不同 HA 含量的 CCH 微球对炎症性 Caco-2 细胞、HA 预处理的 Caco-2 细胞及 NIH-3T3 细胞的相对捕获效率。(f)通过共聚焦激光扫描显微镜(CLSM)观察 FL-276.1@CCH1:1/2 微球捕获的细胞数量。绿色荧光代表包埋在 CCH 微球中的 FL-276.1(经绿色 SYTO9 染色标记),蓝色荧光代表经 DAPI 染色的细胞核。
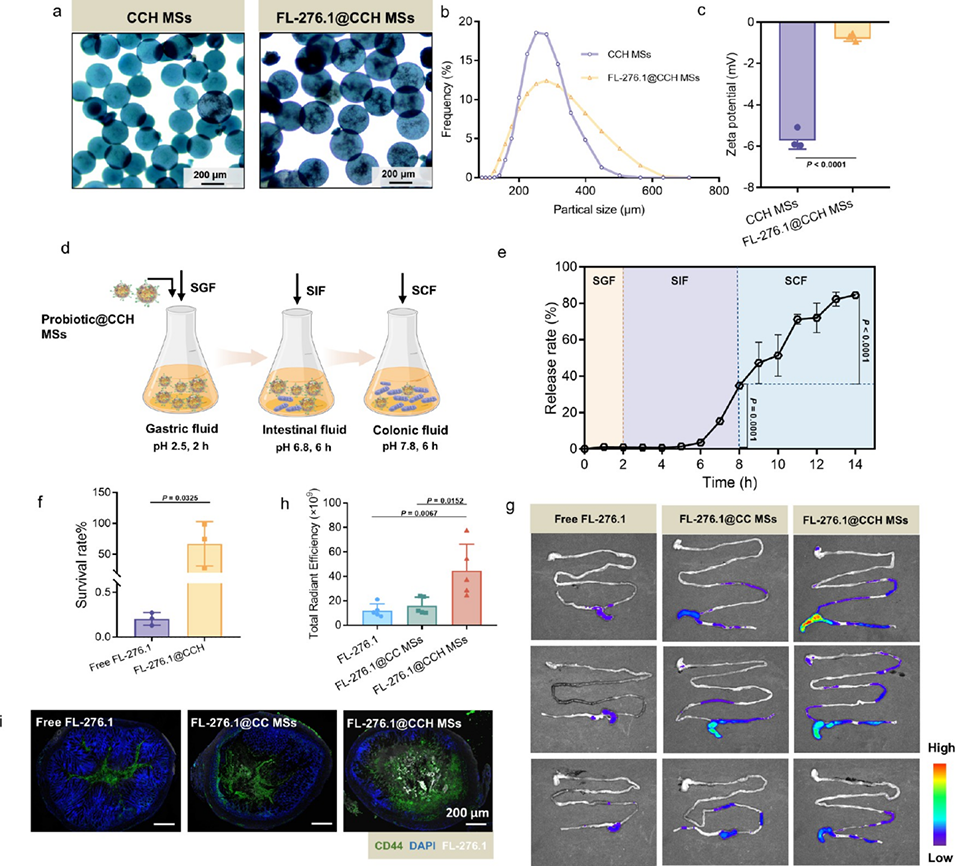
图 2. FL-276.1@CCH 微球的性能表征。(a)CCH 的光学显微镜图像、(b)粒径分布以及(c)zeta 电位值。(d)FL-276.1@CCH 微球的体外模拟消化过程示意图,具体为 5 mL 模拟胃液(SGF,pH=2.5,m/v=9:1)处理 2 小时、模拟肠液(SIF,pH=2.5,v/v=1:4)处理 6 小时、模拟结肠液(SCF,pH=7.8,v/v=1:2)再处理 6 小时。(e)随着消化时间延长,包封的 FL-276.1 的释放曲线。(f)游离 FL-276.1 和 FL-276.1@CCH 微球经模拟胃液处理 2 小时后的存活率。(g)利用 IVIS 成像系统观察 FL-276.1@CCH 微球在小鼠肠道中的荧光分布;(h)各组结肠荧光的总辐射效率。(i)免疫荧光共定位:绿色荧光信号代表与抗 CD44 染色结合的 CD44 受体,蓝色代表经 DAPI 染色的细胞核,白色代表 FL-276.1@CCH 微球。
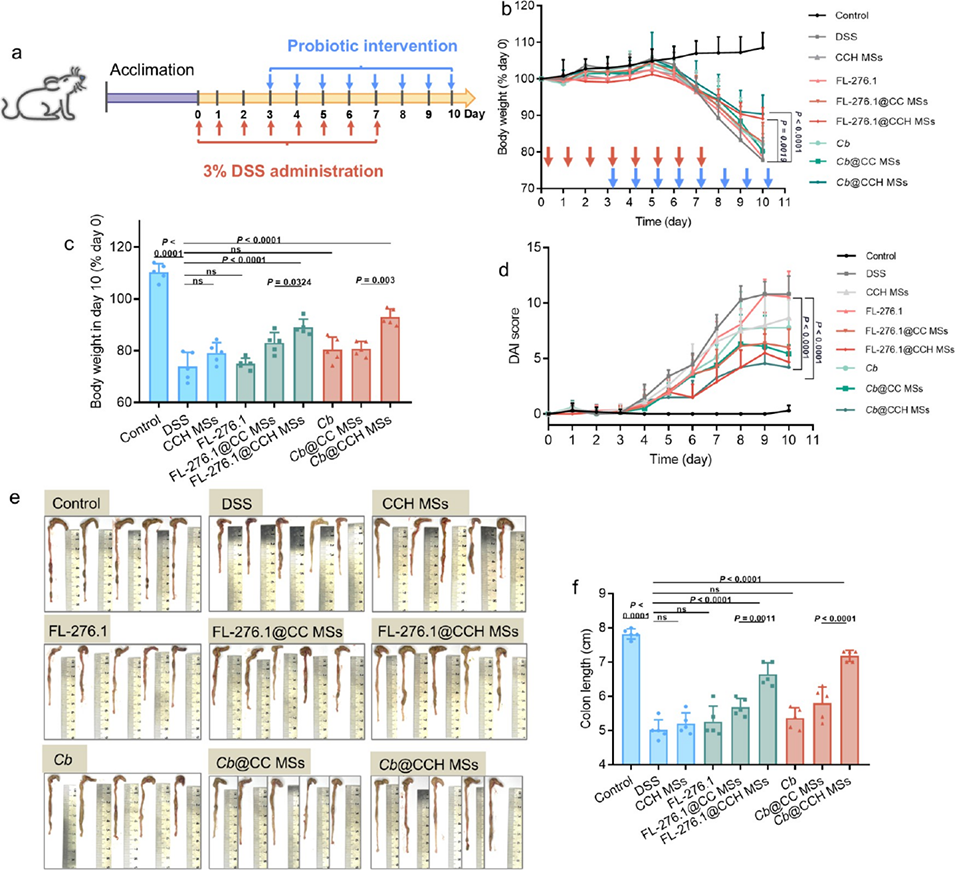
图 3. FL-276.1@CCH 微球和 Cb@CCH 微球益生菌递送系统对 DSS 诱导结肠炎的治疗效果。(a)DSS 诱导结肠炎模型干预实验方案示意图。(b)各组经灌胃给药后的每日体重变化(n=9),红色箭头表示 0-7 天给予 3% DSS,蓝色箭头表示 3-10 天进行益生菌干预。(c)第 10 天的体重;(d)疾病活动指数(DAI)评分(n=9);(e)结肠宏观照片;(f)治疗后的结肠长度变化(n=5)。
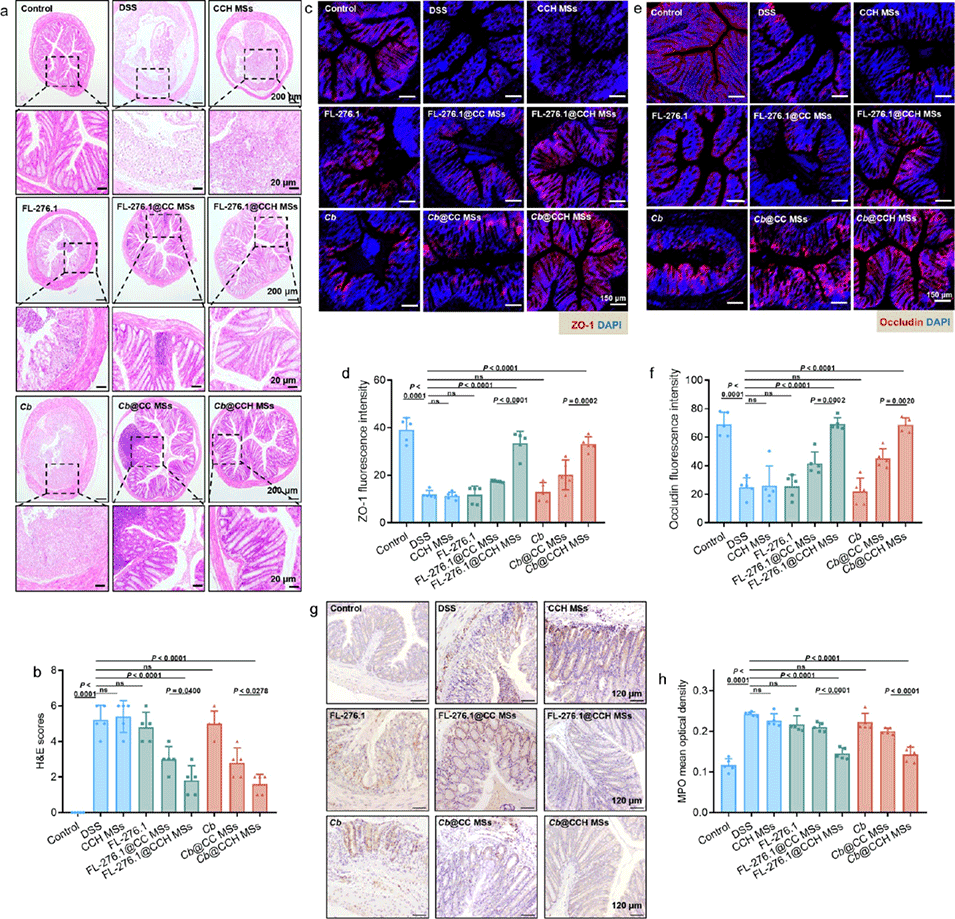
图 4. 肠道理化屏障的维持。(a)结肠组织的 H&E 染色图像及(b)H&E 评分,比例尺 = 200 μm 和 20 μm(放大图)。(c)ZO-1 和(e)闭合蛋白(occludin)在结肠中表达的免疫荧光染色典型图像,比例尺 = 150 μm。(d)ZO-1 和(f)闭合蛋白的荧光强度:红色荧光代表 ZO-1 和闭合蛋白的表达,蓝色代表经 DAPI 染色的细胞核。(g)近端结肠的髓过氧化物酶(MPO)染色代表性图像及(h)MPO 平均光密度,比例尺 = 120 μm。
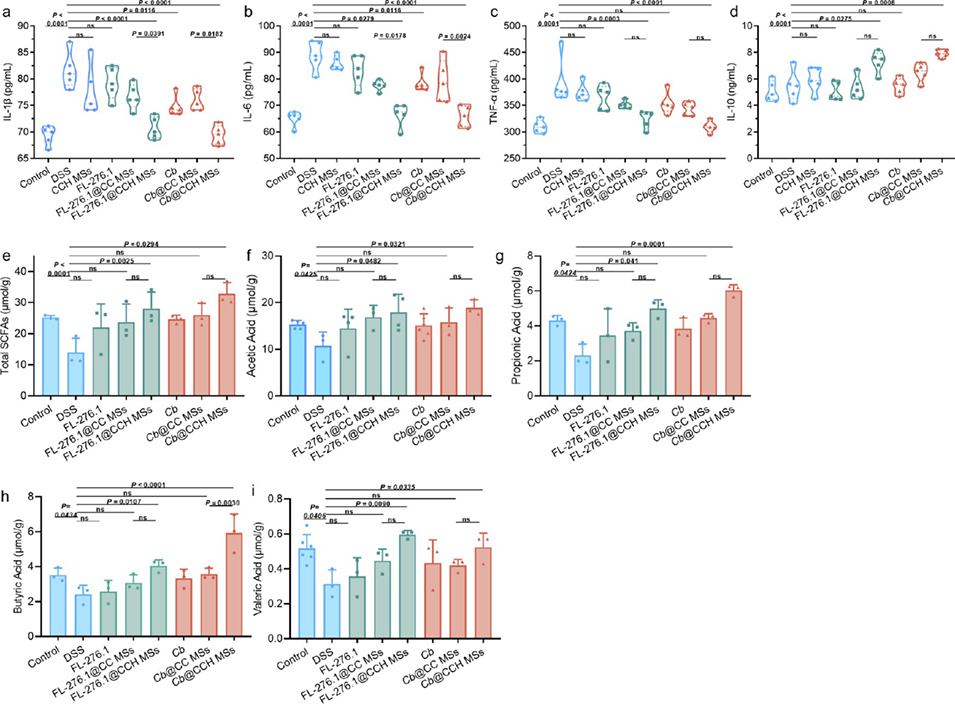
图 5. 减轻 DSS 诱导的结肠炎小鼠炎症及调节肠道代谢物短链脂肪酸(SCFAs)含量。小鼠血清中炎症因子水平:(a)IL-1β、(b)IL-6、(c)TNF-α 和(d)IL-10 的水平。小鼠肠道代谢产生的粪便中的 SCFAs 含量:(e)总 SCFAs;(f)乙酸;(g)丙酸;(h)丁酸;(i)戊酸。
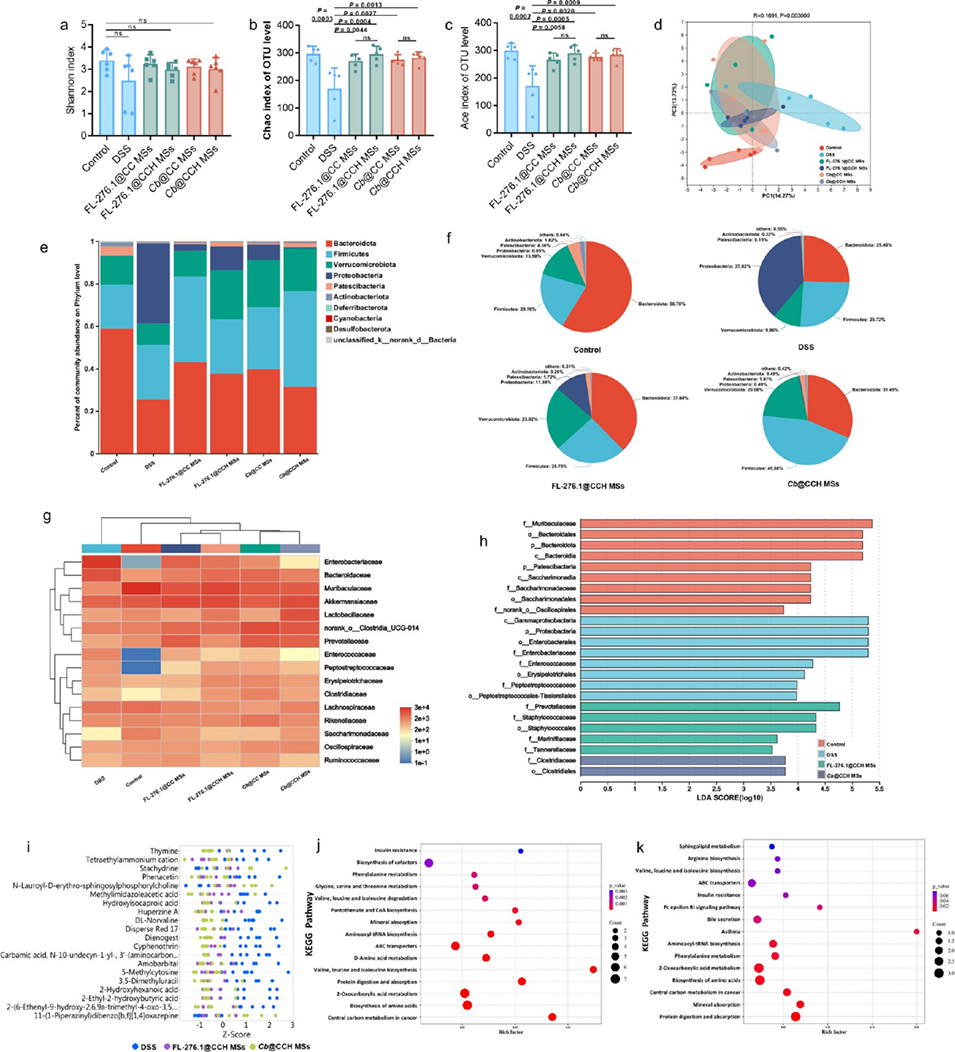
图 6. 调节肠道菌群相对丰度以治疗炎症性肠病。(a)操作分类单元(OTU)水平上的 Shannon 指数、(b)Chao 指数和(c)Ace 指数。(d)通过主成分分析(PCA)展示的肠道菌群 β 多样性。(e)门水平肠道菌群相对丰度直方图及(f)组成饼图。(g)科水平肠道菌群组成的热图分析。(h)线性判别分析。(i)基于不同代谢物相对含量的 Z 评分图。(j)DSS 组与 FL-276.1@CCH 微球组、(k)DSS 组与 Cb@CCH 微球组差异代谢物的京都基因与基因组百科全书(KEGG)富集图。
论文链接:https://doi.org/10.1021/acsami.5c10456
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














