
导读:
近期,有研究人员开发了一种基于液滴挤压的新型微流控平台(DASH),可规模化生成用于药物递送的细胞外囊泡-脂质纳米颗粒(EV-LNP)杂化物。该平台通过微流控技术实现EVs与LNPs的可控融合,在保留EV完整性的同时显著提升药物装载效率和靶向能力,尤其在黑色素瘤模型中展现出优异疗效,为精准纳米医学提供了新的技术手段。相关研究以“Droplet Squeeze Microfluidic Platform for Generating Extracellular Vesicle Hybrids for Drug Delivery”为题目,发表在期刊《Small》上。
本文要点:
1、本研究提出了一种基于液滴挤压的微流控平台(DASH),用于规模化生成载药细胞外囊泡-脂质纳米颗粒(EV-LNP)杂化物,以解决细胞外囊泡(EVs)在临床转化中面临的完整性和药物装载效率问题。
2、研究优化了脂质组成和微流控参数,通过液滴介导的挤压机制实现EVs与脂质纳米颗粒(LNPs)的可控融合,并对EV杂化物进行了理化和功能表征。
3、体外研究表明,EV杂化物靶向效率增强,能成功包封小分子治疗药物,在2D和3D黑色素瘤培养模型中,其细胞毒性显著优于单独的载药EVs或LNPs。
4、此外,还对EV杂化物的稳定性、融合机制、靶向结合亲和力及治疗潜力等进行了探究,由此构建的可扩展、低破坏性微流控平台,为EV杂化物的工程化设计提供了可靠工具,也为精准纳米医学的推进奠定了坚实的技术基础。
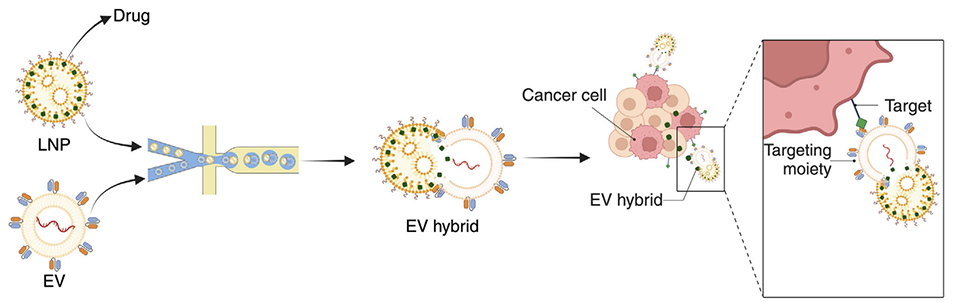
图1. 用于靶向药物递送的细胞外囊泡杂化物的生成示意图。
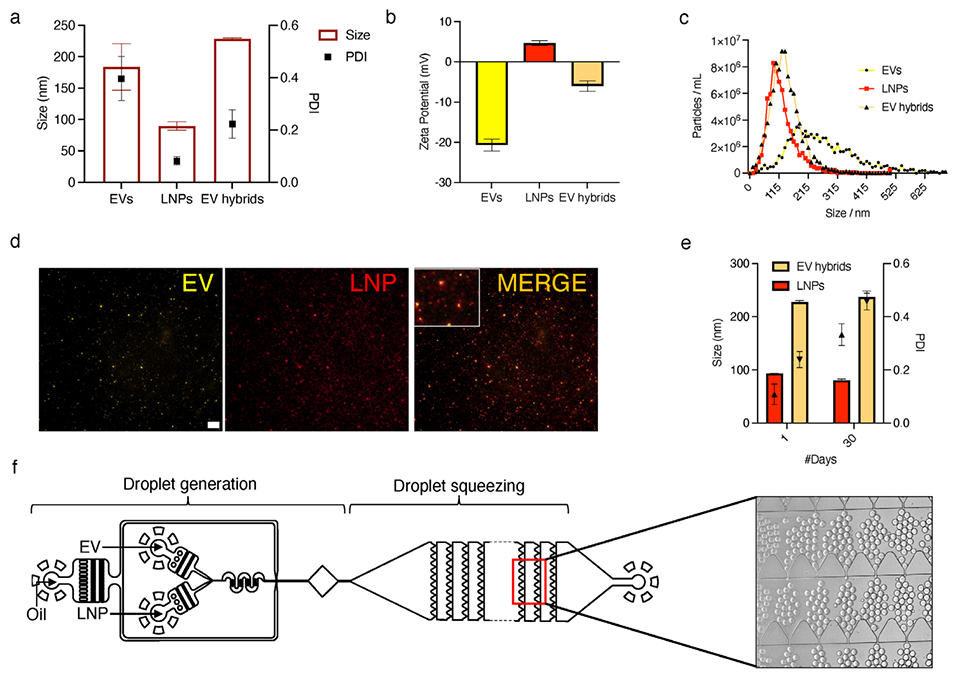
图2. 细胞外囊泡杂化物的合成与表征。
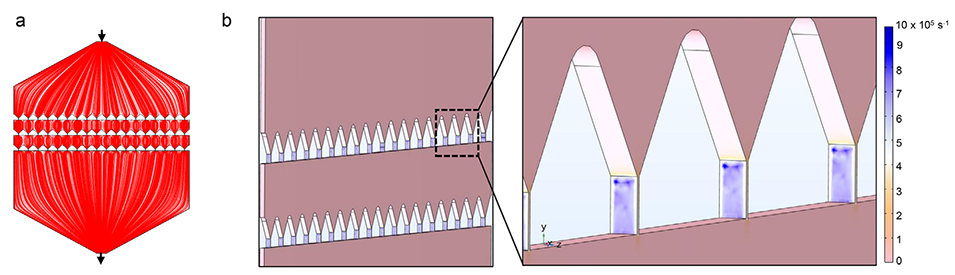
图3. 微流控装置中流动的COMSOL模拟。
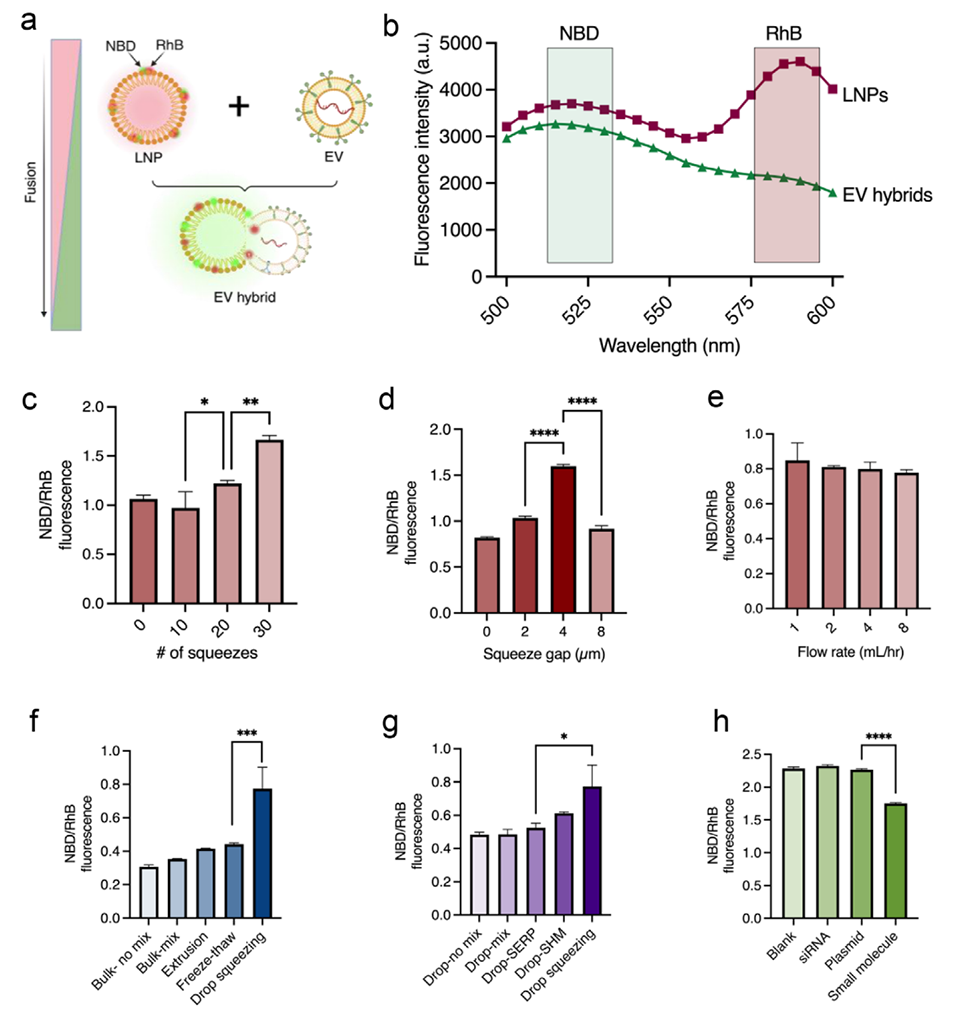
图4. 用于脂质纳米颗粒-细胞外囊泡融合的液滴挤压装置的优化与表征。
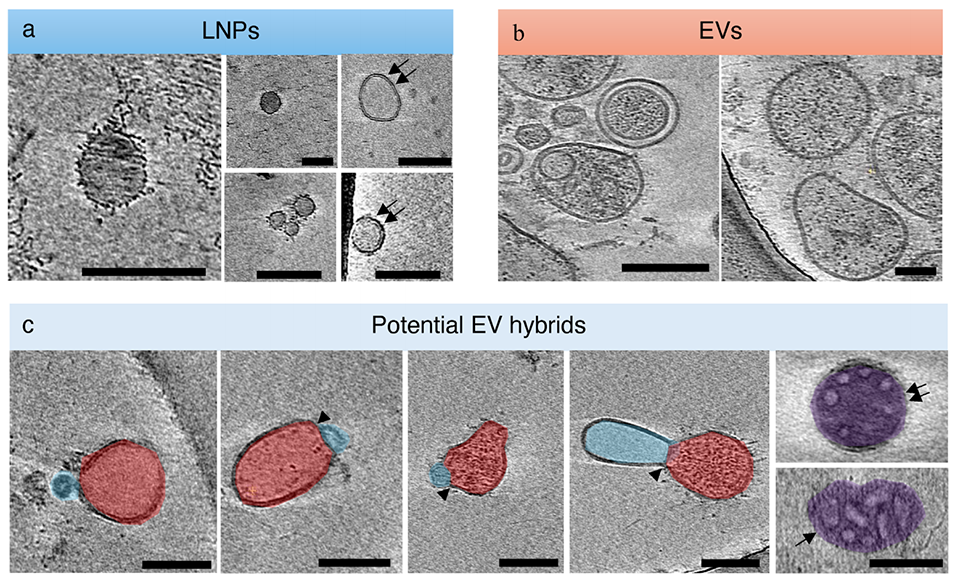
图5. 细胞外囊泡杂化物的冷冻电子断层扫描图。
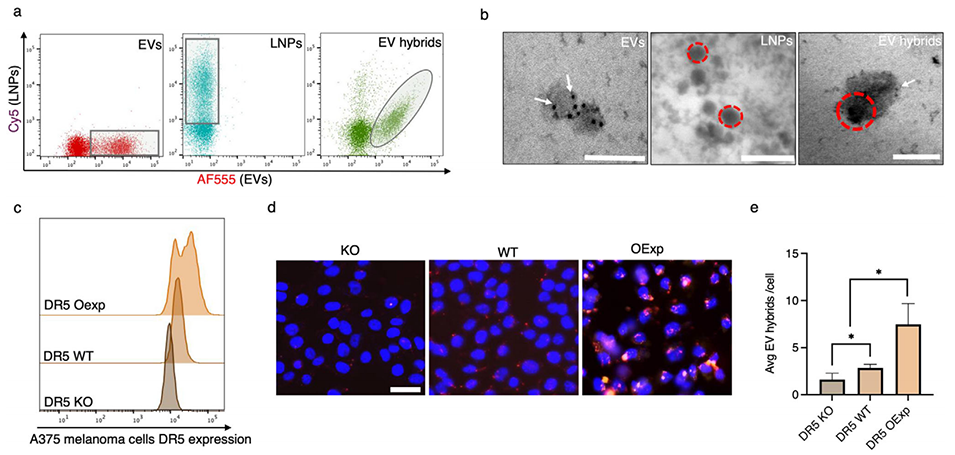
图6. 细胞外囊泡杂化物的表征。
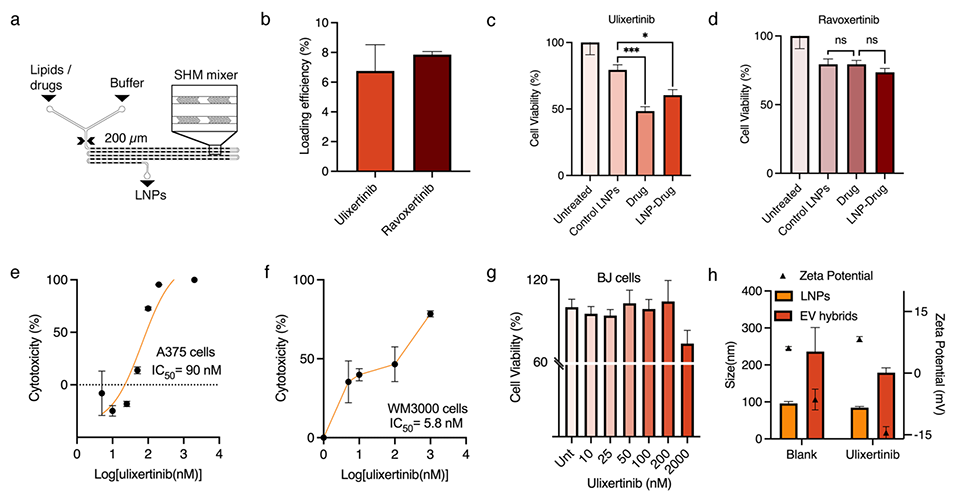
图7. 载药脂质纳米颗粒的表征。
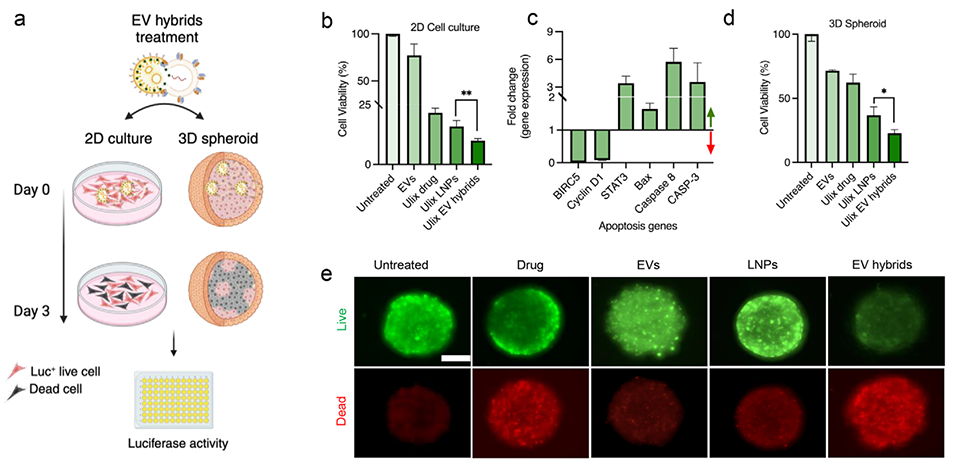
图8. 细胞外囊泡杂化物作为药物递送系统的治疗潜力。
论文链接:https://doi.org/10.1002/smll.202503807
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














