导语: 壳聚糖由甲壳素脱乙酰化制得,凭借其无毒、生物相容、可降解及低成本的显著优势,是生物医药领域常用的功能材料。从吸附分离、催化载体到药物控释,其纤维、膜、微球等形式展现出巨大潜力[1]。然而,传统方法制备壳聚糖微球,尤其是粒径小于60μm且高度均一的关键规格,常受困于操作繁琐、粒径分布宽、重复性差等瓶颈,难以满足规模化需求。
微流控技术的兴起带来了转机!本期,我们借鉴发表在《Advanced Healthcare Materials》上的“A Novel Microfluidic Approach for Monodispersed Chitosan Microspheres with Controllable Structures”文献,结合自主专利微流控芯片(ALFA, CN2023221630104),开发了一套简便高效、结构可控的单分散壳聚糖微球制备方案。核心亮点在于:
1、双重固化工艺: 融合溶剂萃取与化学交联。
2、低成本油相替代: 使用中链甘油三酯(MCT)体系替代昂贵的氟化油,显著降低生产成本。
3、结构按需定制: 仅需调控固化时间,即可轻松获得多孔型、核壳型或实心型三种典型结构微球,完美适配不同应用场景(如药物缓释需多孔,高强度载体需实心)。
一、方案亮点与机理
粒径控制: 微流控技术确保生成液滴单分散性优异,为微球奠定基础。
结构演变机理: 固化过程在含戊二醛的收集浴中进行,如图1所示。
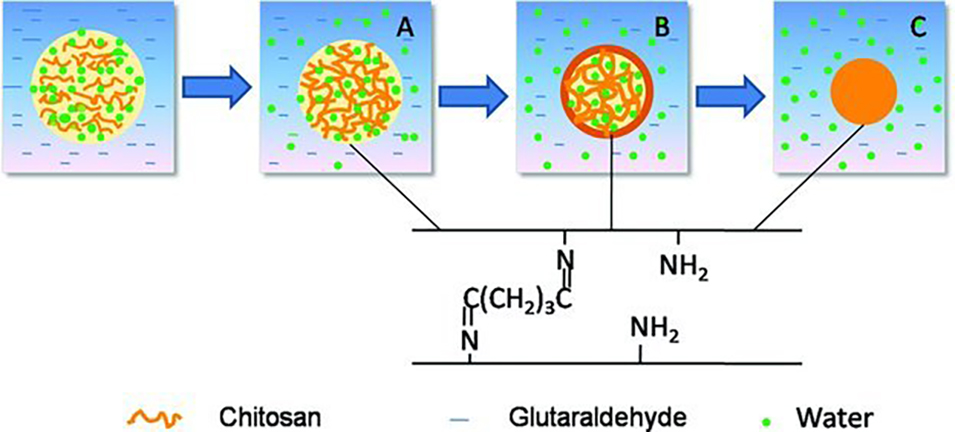
图1. 壳聚糖微液滴到微球形成过程示意图[1]
阶段A: 液滴中的水被萃取出来,形成表面及内部贯通的多孔结构。
阶段B:戊二醛醛基与壳聚糖氨基发生席夫碱反应,在微球表面优先交联形成致密壳层,内部保持多孔,构成核壳结构。
阶段C:随固化时间延长(本案例过夜),戊二醛向芯部扩散并深度交联,壳层增厚,最终形成整体实心结构。
颜色和尺寸指示: 微球交联后呈现深黄色,且颜色随固化加深。这源于席夫碱反应生成的亚胺键(-C=N-)发色团。交联越完全(时间>90分钟),亚胺键密度越高,颜色越深(深黄色),颜色直观反映了交联密度。水分完全去除及可能的副反应也有贡献,因此,随着固化时间的增加,微球的尺寸减小,由图2、图3对比可知。

图2. 壳聚糖微液滴的光学显微镜图,分散相、连续相流速分别为20 μL/min、120μL/min。
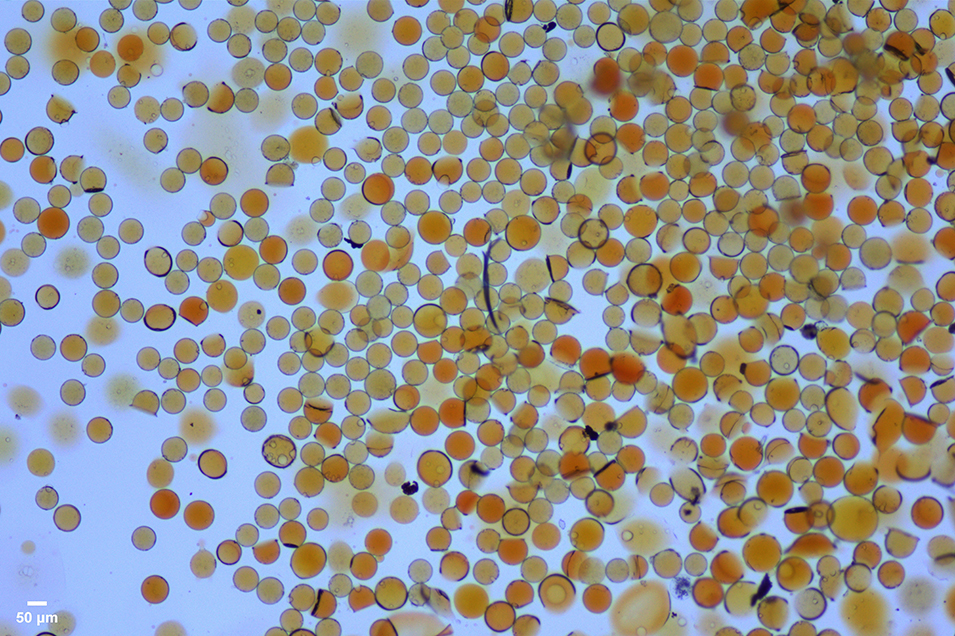
图3. 经戊二醛交联过夜后得到的壳聚糖微球光学显微镜图
二、完整制备流程
2.1 材料清单(易得、低成本)
分散相 (水相): 1 wt% 壳聚糖溶于 2 wt% 乙酸水溶液。
连续相 (油相 - 关键替代!): 含 5 wt% 乳化剂聚甘油蓖麻醇酸酯(PGPR)的 中链甘油三酯(MCT)溶液。
替代氟化油:采用MCT体系完全替代了目前市面上常用的高成本氟化油,显著降低原材料费用。
解决正辛醇气味与操作难题:与文献报道的Span80/正辛醇体系相比,我们选用MCT作为主体油相,有效避免了正辛醇的刺激性气味问题,大幅改善了实验操作环境。同时,PGPR作为一种高效的油包水(W/O)乳化剂,在MCT中能稳定形成单分散壳聚糖水相液滴,完美适配微流控过程。
生物相容性优势:MCT本身是常见的食品级和药用辅料,具有良好的生物相容性。
收集液 (固化浴): 连续相 + 1 wt% 戊二醛 (交联剂)。
2.2 设备核心
微流控芯片: 自主专利 ALFA 芯片 (共轴结构,专利号 CN2023221630104)
集成式微流控设备: MF-3G 微流控工作站
2.3 制备步骤详解
1、微液滴生成:
注射器分别抽取分散相、连续相。
安装至MF-3G工作站,连接ALFA芯片。
启动泵,以50μL/min流速排空管路气泡。
调节流速比: 分散相(内) 20 μL/min : 连续相(外) 120 μL/min (1:6)。
待液滴稳定生成后,显微镜观察确认单分散性。
将生成的W/O乳液收集至含戊二醛的收集液中。
2、原位交联固化:
收集浴中戊二醛的醛基和壳聚糖氨基之间发生的化学交联。
关键控制参数:固化时间。本案例采用过夜固化以确保充分交联,得到实心结构微球(如图3所示)。
2.4 微球清洗方案(去除油相MCT)
乙酸乙酯萃取清洗: 将微球转移至乙酸乙酯中,充分振荡混合。
离心分离: 离心后,MCT溶解于乙酸乙酯中形成上层清液。
抽取上清: 小心移除含油的上层清液。
重复清洗: 加入新鲜乙酸乙酯,重复 步骤1-3 至少3次,确保MCT完全去除。
溶剂去除: 清洗后的微球置于通风橱中,让残留的乙酸乙酯自然挥发干燥。
(可选)冷冻干燥: 如需彻底干燥,可进行冷冻干燥。
结语:本案例基于实验室特定条件及专利微流控芯片(ALFA)验证,重点展示工艺可行性。实际应用中,微球结构(多孔/核壳/实心)与性能(如药物释放、机械强度)的关联需结合您的具体场景进一步验证。欢迎交流探讨!
三、参考文献
[1] Xu J H , Zhao H , Lan W J ,et al. A Novel Microfluidic Approach for Monodispersed Chitosan Microspheres with Controllable Structures. Advanced Healthcare Materials, 2012, 1(1):106-111.














