
导读:
近期,广州医科大学陈文杰教授、You Zhou与云南省消化内镜临床医学中心Jialong Qi等人合作,成功开发了一种基于微流控技术与析因设计优化的脂质纳米颗粒(LNP)疫苗,该疫苗共装载HPV E7抗原肽与镁佐剂,解决了传统铝佐剂疗效有限、不良反应多等问题,在小鼠模型中显著抑制肿瘤生长并诱导强烈的抗原特异性T细胞免疫应答。相关研究以“A factorial design-optimized microfluidic LNP vaccine elicits potent magnesium-adjuvating cancer immunotherapy”为题目,发表在期刊《Materials Today Bio》上。
本文要点:
1、本研究针对HPV相关癌症,开发了一种基于微流控技术和析因设计优化的脂质纳米颗粒(LNP)疫苗,共载E7抗原肽与镁离子佐剂。
2、镁离子替代传统铝佐剂,展现出更强的T细胞活化和细胞免疫应答能力。
3、机制研究表明,镁离子通过胶原-CD36轴促进树突状细胞成熟与抗原呈递,发挥佐剂作用。
4、通过实验设计(DoE)优化,LNP配方在包封率和稳定性上得到提升,有望成为针对HPV相关癌症的靶向免疫激活系统。
5、该研究证实了镁离子作为LNP疫苗佐剂的有效性和安全性,为癌症治疗性疫苗研发提供了新思路。
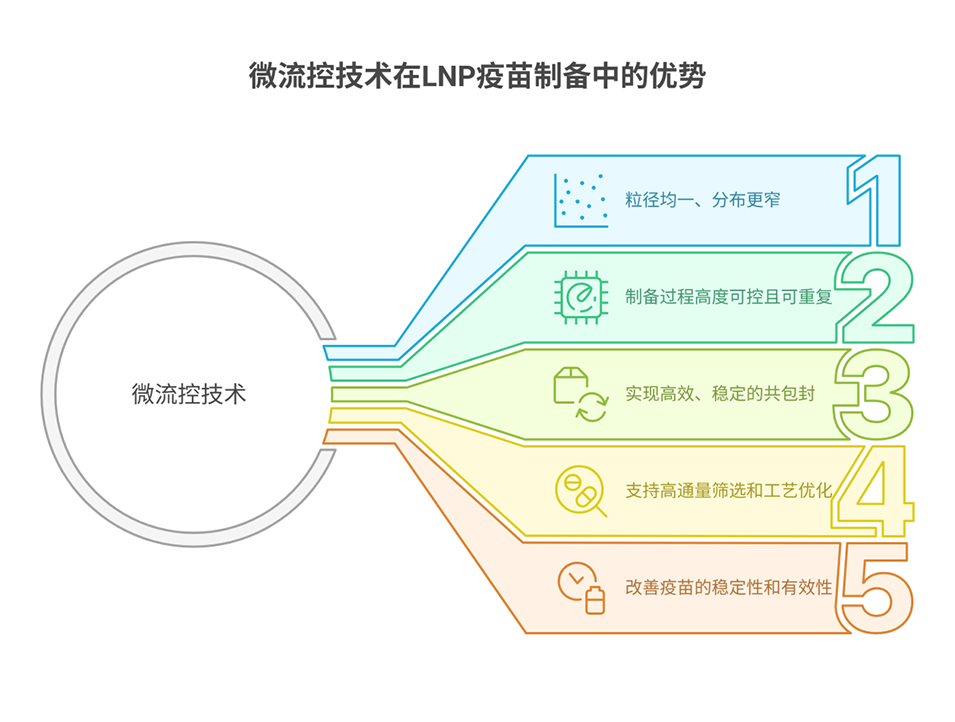
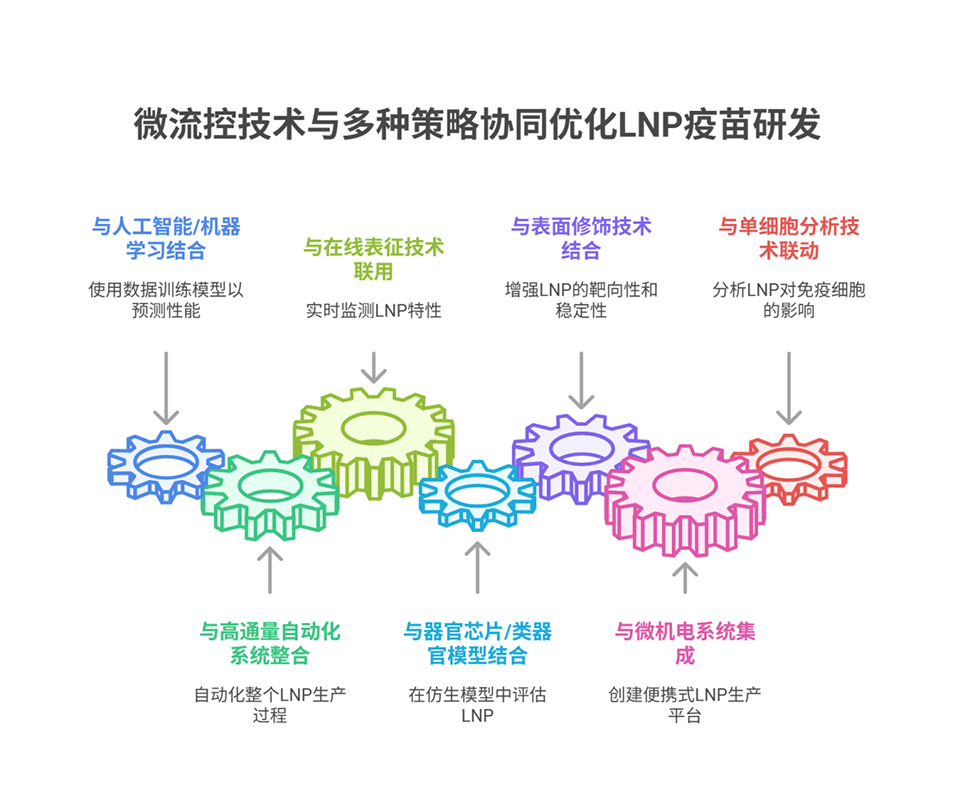
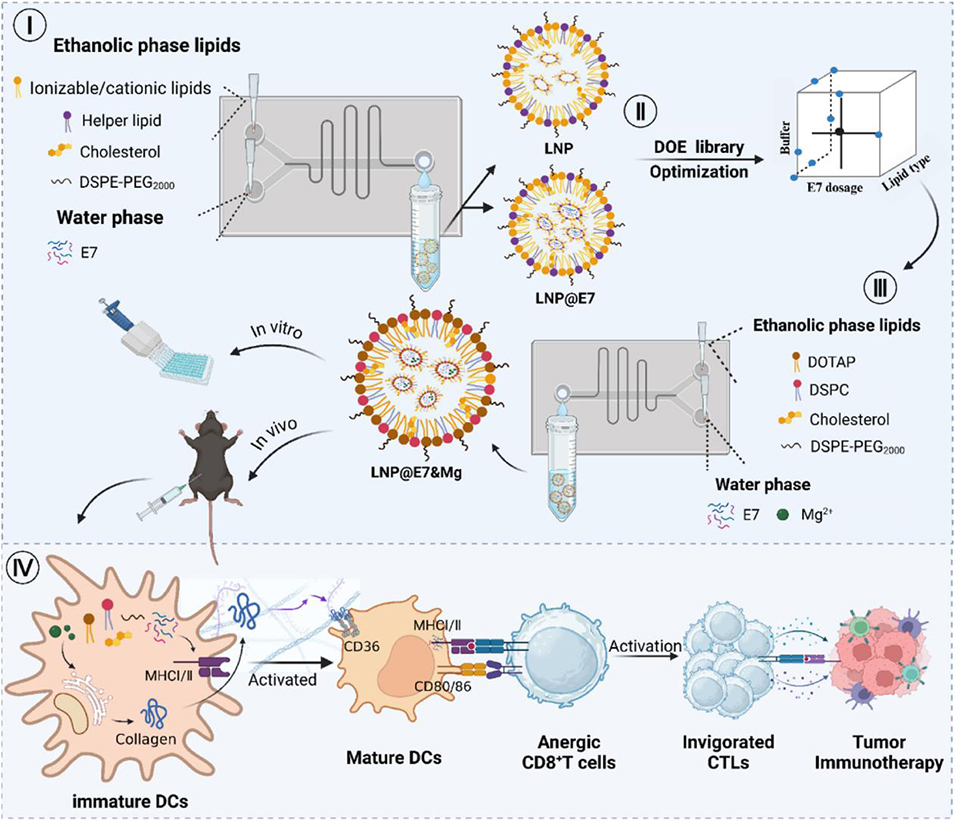
图 1 微流控优化镁佐剂 LNP 癌症疫苗的研究方案。(I)通过确定性筛选设计(DSD)确定 LNP 制备中的脂质浓度、流率比(FRR)与总流速(TFR);(II)对脂质类型、缓冲体系及 E7 剂量进行实验设计(DoE)优化;(III)加入 Mg²⁺制备 LNP@E7&Mg 纳米疫苗,用于后续实验;(IV)探究镁离子的佐剂作用机制及 LNP@E7&Mg 疫苗的抗肿瘤免疫治疗效果。
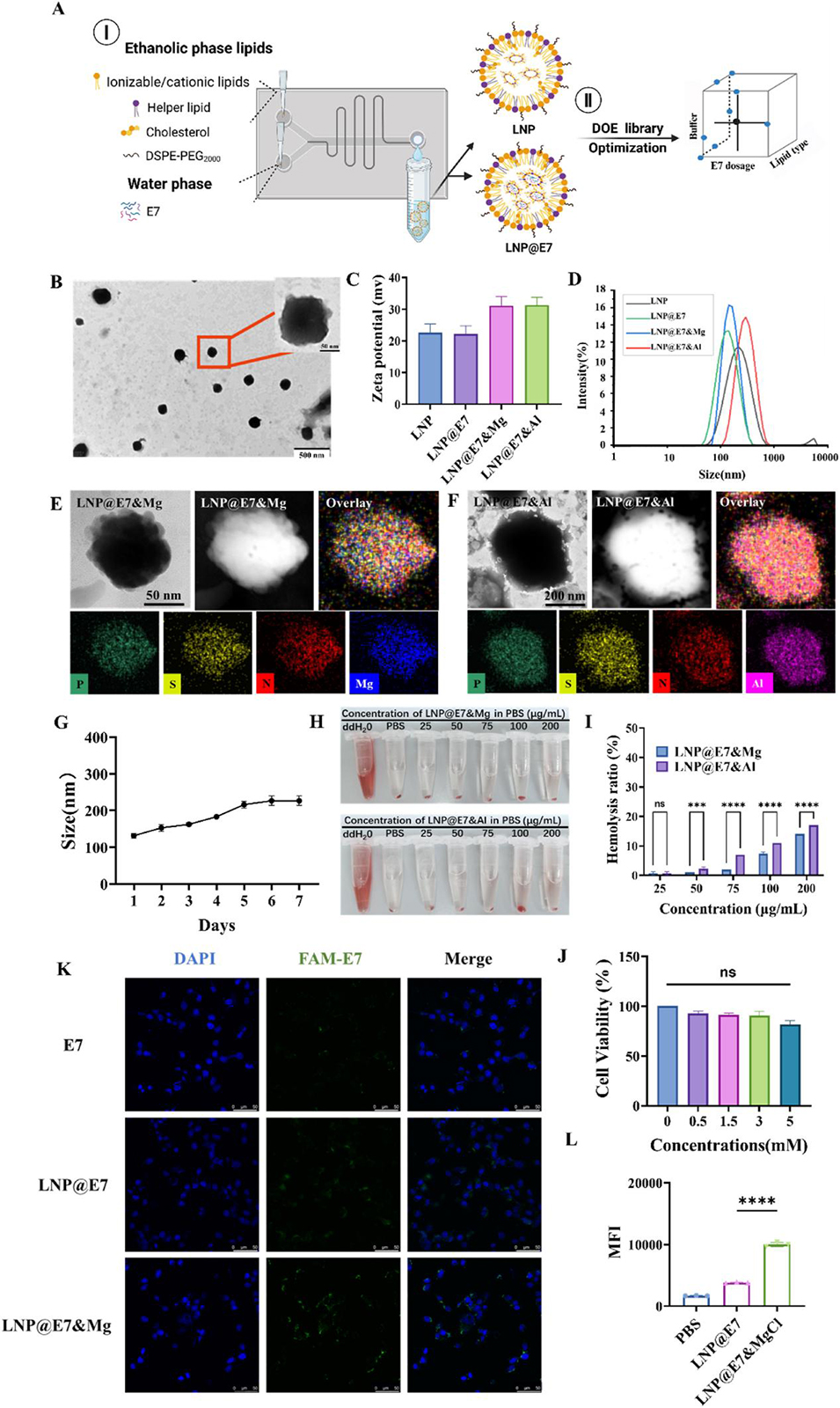
图 2 纳米疫苗的表征、细胞活性及细胞摄取实验。(A)基于微流控技术结合 DoE 优化制备 LNP 与 LNP@E7 的示意图;(B)LNP@E7&Mg 的透射电镜(TEM)代表性图像,插图中标尺为 500 nm;(C)LNP 疫苗颗粒的 zeta 电位分析;(D)LNP@E7&Mg 的动态光散射(DLS)图谱;(E, F)LNP@E7&Mg 与 LNP@E7&Al 的元素映射代表性图像;(G)LNP@E7&Mg 粒径随时间变化的曲线;(H)不同浓度纳米疫苗的溶血实验结果;(I)不同浓度纳米疫苗溶血率的统计分析;(J)不同浓度纳米疫苗安全性的细胞活性实验;(K)共聚焦显微镜观察 DC2.4 细胞孵育 6 h 后对 E7 肽的摄取情况,标尺为 50 μm;(L)流式细胞术检测不同处理组纳米疫苗孵育 DC2.4 细胞 6 h 后的平均荧光强度(MFI)。采用方差分析(ANOVA)检验,*p<0.05、**p<0.01、***p<0.001、****p<0.0001 表示组间差异具有统计学意义。
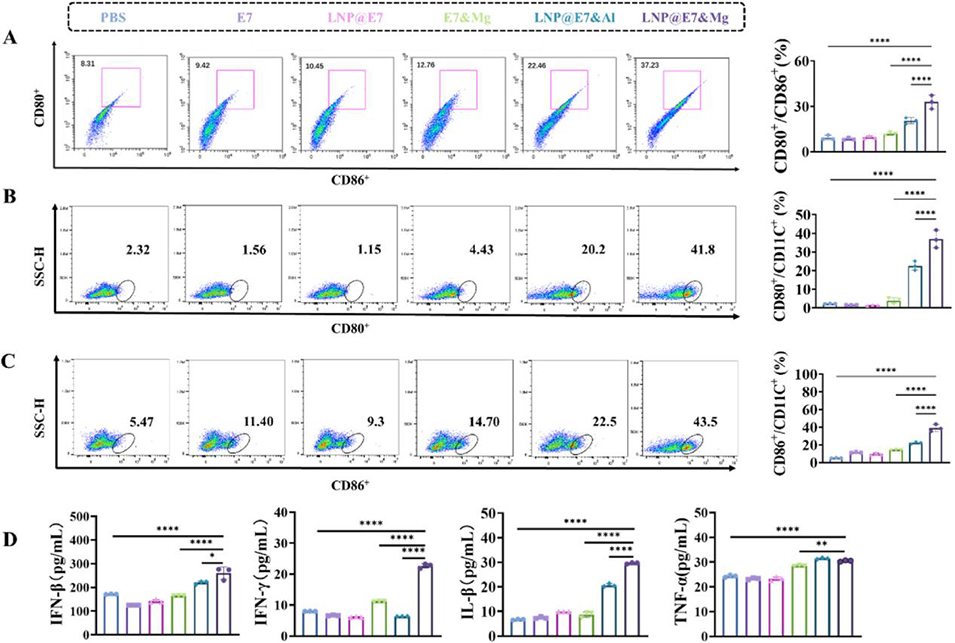
图 3 骨髓来源树突状细胞(BMDCs)的体外活化实验。(A)纳米疫苗处理后 BMDCs 表面 CD80 CD86 细胞群的表达分析及相应统计图;(B)纳米疫苗处理后 BMDCs 表面 CD80 表达的分析及相应统计图;(C)纳米疫苗处理后 BMDCs 表面 CD86 表达的分析及相应统计图;(D)纳米疫苗处理后 BMDCs 分泌干扰素 -β(IFN-β)、干扰素 -γ(IFN-γ)、白细胞介素 - 1β(IL-1β)与肿瘤坏死因子 -α(TNF-α)的水平。采用方差分析(ANOVA)检验,*p<0.05、**p<0.01、***p<0.001、****p<0.0001 表示组间差异具有统计学意义。
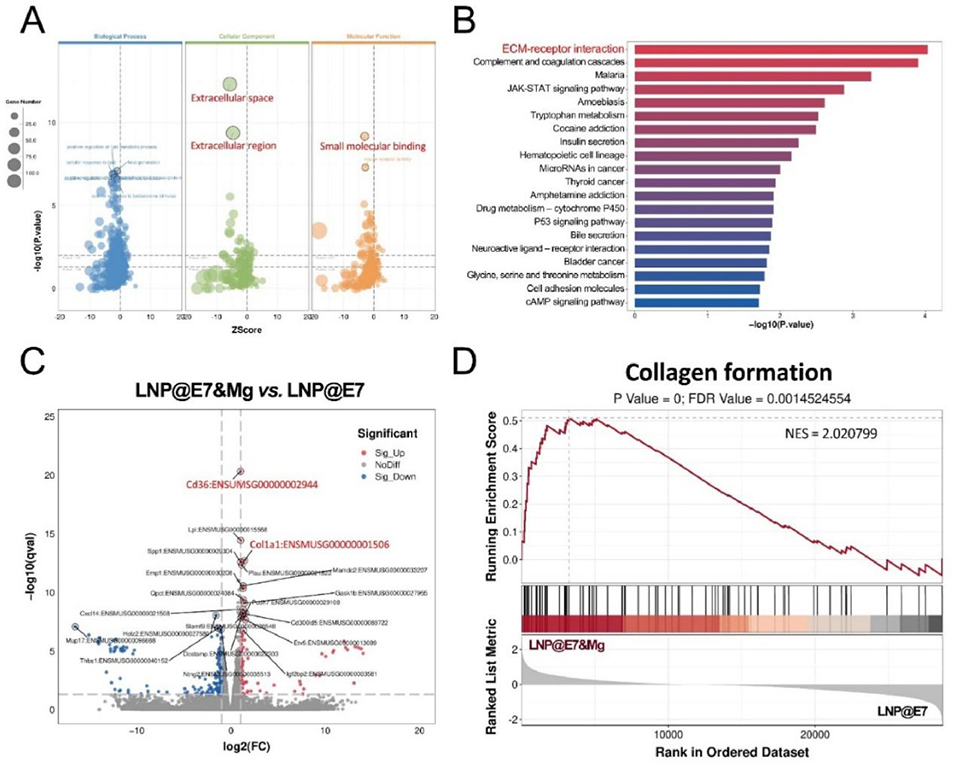
图 4 转录组测序(RNA-seq)分析 Mg²⁺的佐剂作用机制。(A)LNP@E7&Mg 与 LNP@E7 处理 BMDCs 后的 GO 富集分析气泡图;(B)LNP@E7&Mg 处理组相较于 LNP@E7 处理组 BMDCs 中差异表达基因的前 20 个富集通路;(C)基因调控谱的火山图,其中上调最显著的两个基因(Cd36、Col1a1)用红色标注;(D)基因集富集分析(GSEA)显示 LNP@E7&Mg 与 LNP@E7 处理 BMDCs 中胶原形成通路的富集情况。
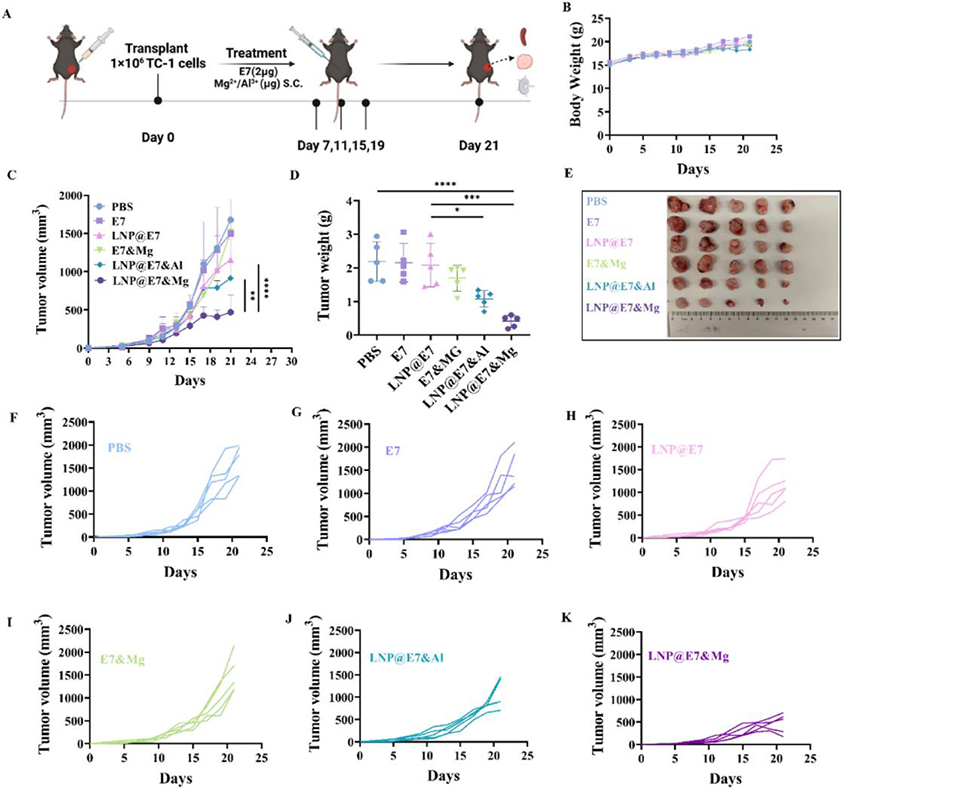
图 5 纳米疫苗的抗肿瘤活性实验。(A)小鼠免疫方案,每组 n=5;(B)各组小鼠的体重增长曲线;(C)各组小鼠 21 天内的肿瘤生长曲线;(D)各组小鼠的肿瘤重量;(E)肿瘤实物照片;(F–K)各组单只小鼠肿瘤生长的动态监测曲线。采用方差分析(ANOVA)检验,*p<0.05、**p<0.01、***p<0.001、****p<0.0001 表示组间差异具有统计学意义。
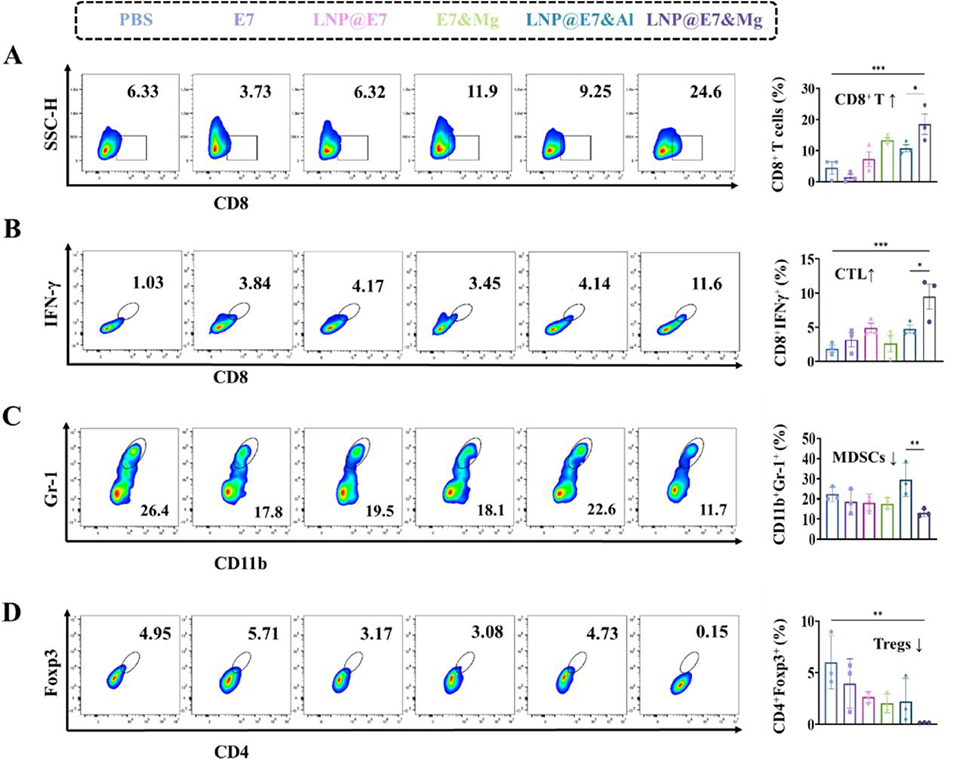
图 6 不同纳米疫苗处理后肿瘤组织中免疫细胞的流式细胞术分析。(A)肿瘤组织中 CD8⁺T 细胞含量的流式分析及统计数据;(B)肿瘤组织中细胞毒性 T 淋巴细胞(CTLs,CD8⁺IFNγ⁺)的代表性图像及统计数据;(C)肿瘤组织中髓系抑制细胞(MDSCs,CD11b⁺Gr-1⁺)的流式分析及统计数据;(D)肿瘤浸润调节性 T 细胞(Tregs,CD4⁺Foxp3⁺)的代表性流式图及统计数据。采用方差分析(ANOVA)检验,*p<0.05、**p<0.01、***p<0.001 表示组间差异具有统计学意义。
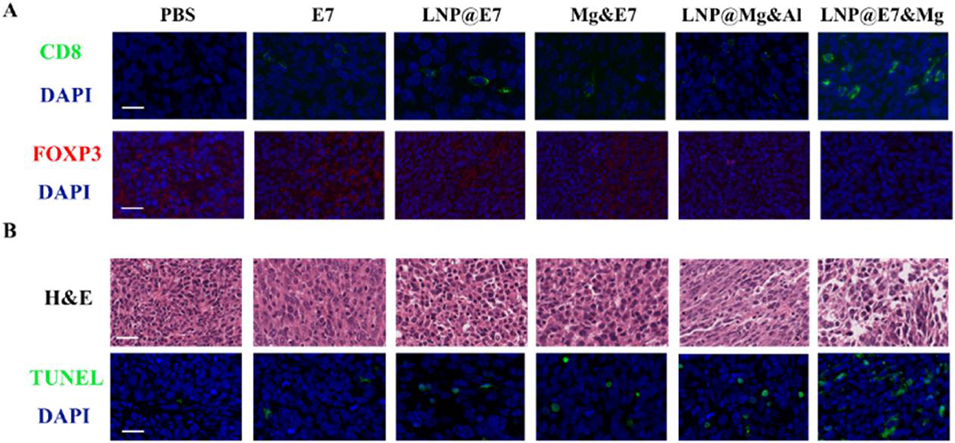
图 7 不同纳米疫苗处理后肿瘤组织中免疫细胞的免疫组化分析。(A)肿瘤组织中 CD8⁺浸润细胞与 Foxp3⁺细胞的代表性免疫组化图像。蓝色:细胞核;绿色:CD8⁺区域;红色:Foxp3⁺区域。标尺为 20 μm;(B)肿瘤组织的组织学评估及 TUNEL 凋亡检测。蓝色:细胞核;绿色:TUNEL 阳性(凋亡)区域。标尺为 20 μm。
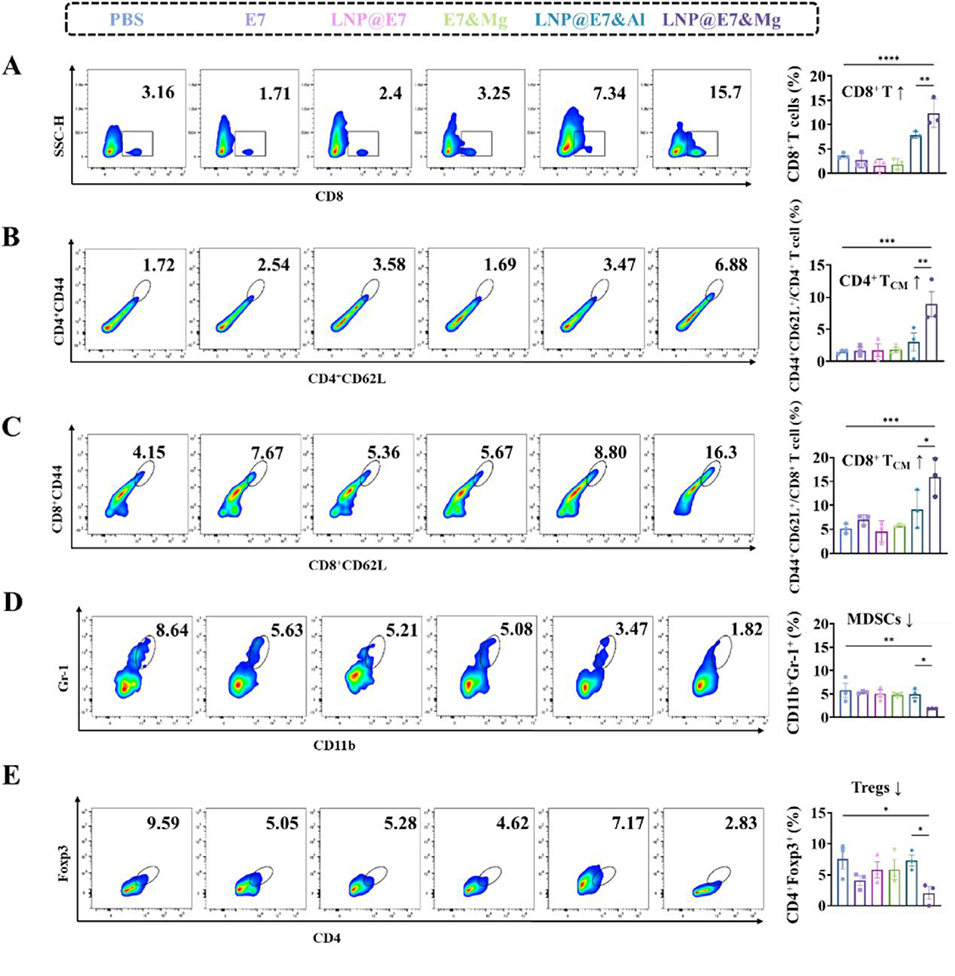
图 8 纳米疫苗诱导的脾脏免疫应答实验。(A)脾脏中 CD8⁺T 细胞的流式分析及统计数据;(B, C)脾脏中 CD4⁺与 CD8⁺中央记忆 T 细胞(TCM)的代表性流式图及统计数据;(D)脾脏中髓系抑制细胞(MDSCs,CD11b⁺Gr-1⁺)的代表性流式图及统计数据;(E)脾脏中调节性 T 细胞(Tregs,CD4⁺Foxp3⁺)的代表性流式图及统计数据。采用方差分析(ANOVA)检验,*p<0.05、**p<0.01、***p<0.001、****p<0.0001 表示组间差异具有统计学意义。
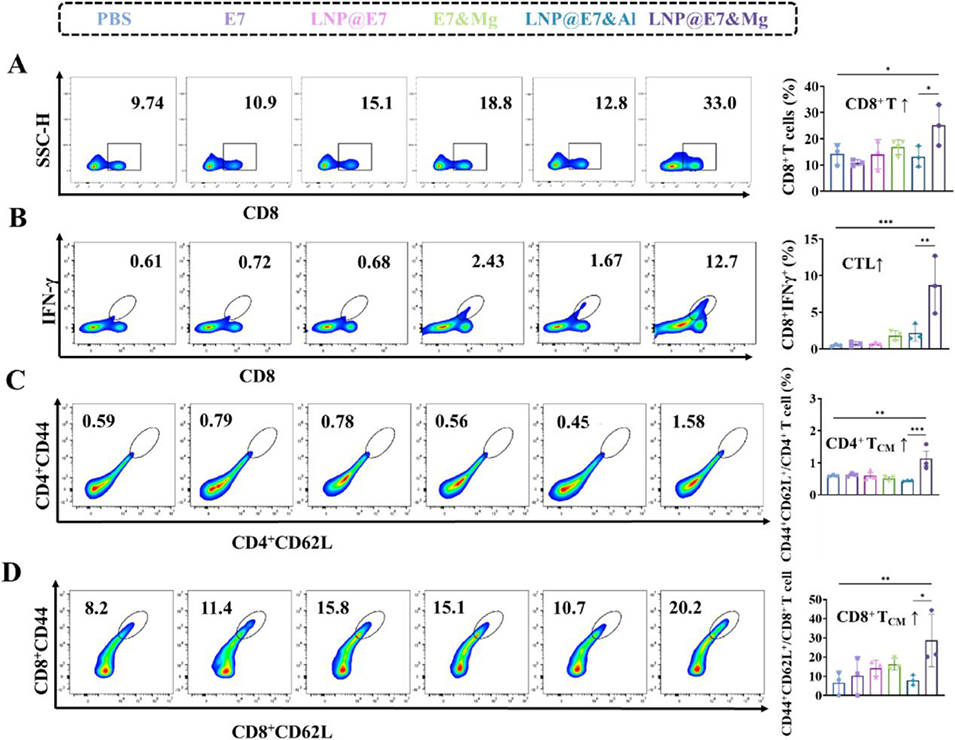
图 9 纳米疫苗诱导的淋巴结免疫应答实验。(A, B)小鼠淋巴结中 CD8⁺T 细胞与细胞毒性 T 淋巴细胞(CTLs)含量的流式分析及统计数据;(C、D)淋巴结中 CD8⁺与 CD4⁺中央记忆 T 细胞(TCM)的代表性流式图及统计数据。采用方差分析(ANOVA)检验,*p<0.05、**p<0.01、***p<0.001 表示组间差异具有统计学意义。
论文链接:https://doi.org/10.1016/j.mtbio.2025.101703
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














