
导读:
脓毒症是机体对感染反应失调引发的致命性疾病,目前缺乏有效治疗手段。研究表明,Gasdermin D(GSDMD)是脓毒症发生发展的关键执行者。基于此,复旦大学药学院王建新教授团队联合中国医药工业研究总院陆伟根副院长、何军研究员以及上海交通大学医学院附属瑞金医院瞿洪平教授团队,成功开发了一种基于环形非对称分割重组(CA/SAR)混合原理的新型微流控芯片(CA/SAR/C1),实现了靶向GSDMD的siRNA脂质纳米粒(siGSDMD-LNPs)的高效、连续化制备。通过肺部给药,该纳米制剂能高效沉默GSDMD蛋白表达,显著抑制细胞焦亡及全身炎症反应,在脓毒症模型小鼠中展现出良好的器官保护作用和生存率提升。相关研究以“Designed microchannel-based lipid nanoparticles encapsulated siRNA targeting gasdermin D for sepsis management via pulmonary delivery”为题目,发表在期刊《Nano Today》上。
本文要点:
1、本研究聚焦脓毒症治疗难题,设计出基于微流控技术的脂质纳米颗粒(LNPs),用于递送靶向Gasdermin D(GSDMD)的小干扰RNA(siGSDMD),为脓毒症治疗提供新策略。
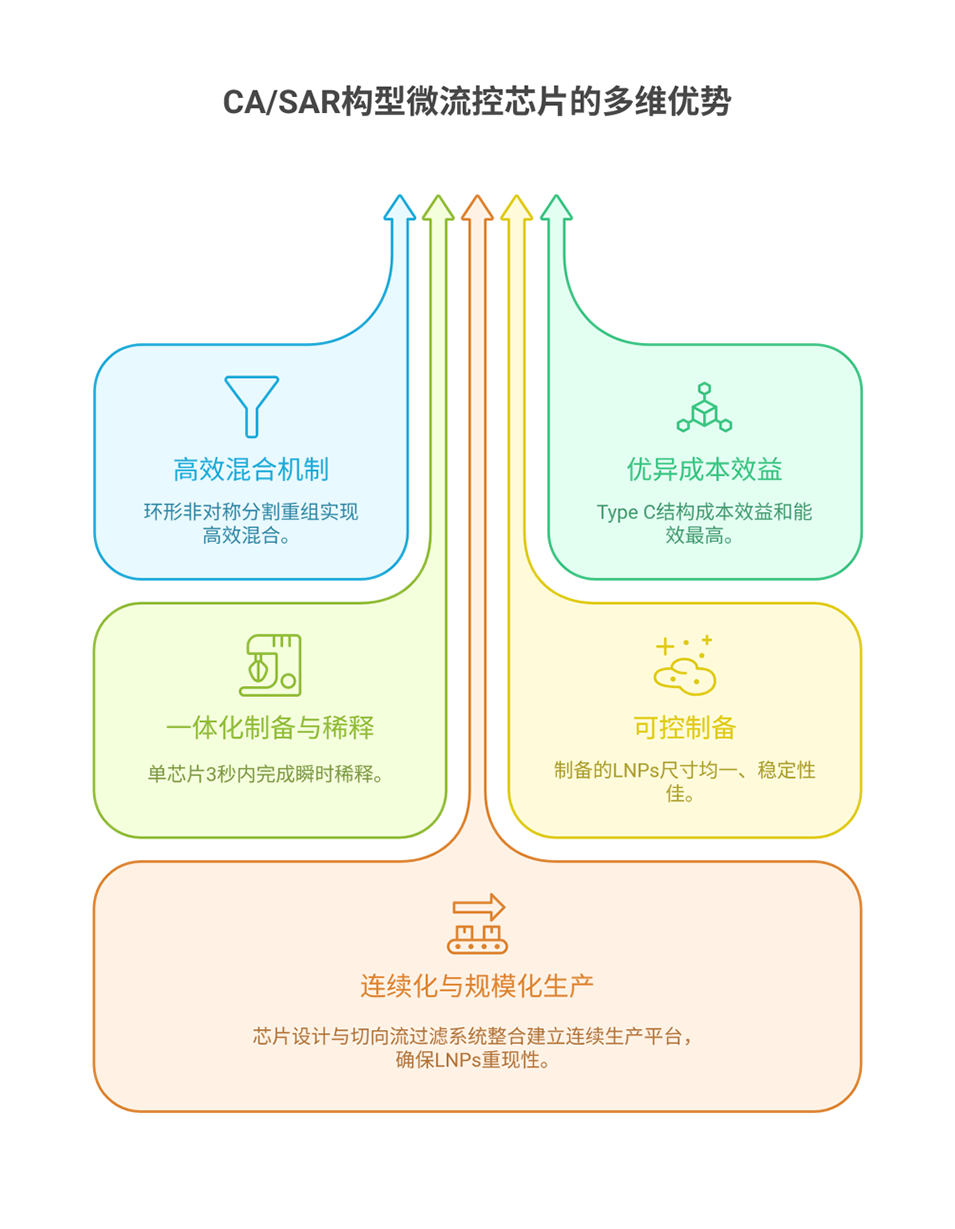
2、开发新型环形非对称分割重组(CA/SAR)微流控平台(CA/SAR/C1),经计算流体动力学(CFD)模拟筛选出主副通道宽度比3:1的Type C微通道,其混合效率、成本效益(Mec)优于传统交错人字形(SHM)和环形(TrM)装置,可实现LNPs的连续、可控制备。
3、筛选出沉默效率最高的siGSDMD序列(#3),以DLin-MC3-DMA、DSPC等为脂质材料,通过CA/SAR/C1芯片一步制备siGSDMD-LNPs。这些颗粒粒径约94nm、PDI≈0.1,在PBS、血清中稳定性良好,4℃储存9个月理化性质无显著变化,且能保护siRNA免受降解。
4、体外以骨髓来源巨噬细胞(BMDMs)为模型,证实siGSDMD-LNPs可被细胞高效摄取、实现溶酶体逃逸,显著沉默GSDMD表达,减少IL-1β、TNF-α等炎症因子分泌。
5、体内构建LPS诱导脓毒症小鼠模型,肺部给药后,该颗粒可富集于肺部,沉默GSDMD以阻断焦亡,缓解肺、肾、肝等器官损伤,提高小鼠生存率,效果与阳性对照药双硫仑相当,二者联用还具协同增效作用。
6、CA/SAR/C1芯片实现了siGSDMD-LNPs的高效、连续制备,该纳米系统通过肺部给药靶向沉默GSDMD,可有效缓解脓毒症相关炎症与器官损伤,为脓毒症治疗提供了新型递送技术与治疗策略。
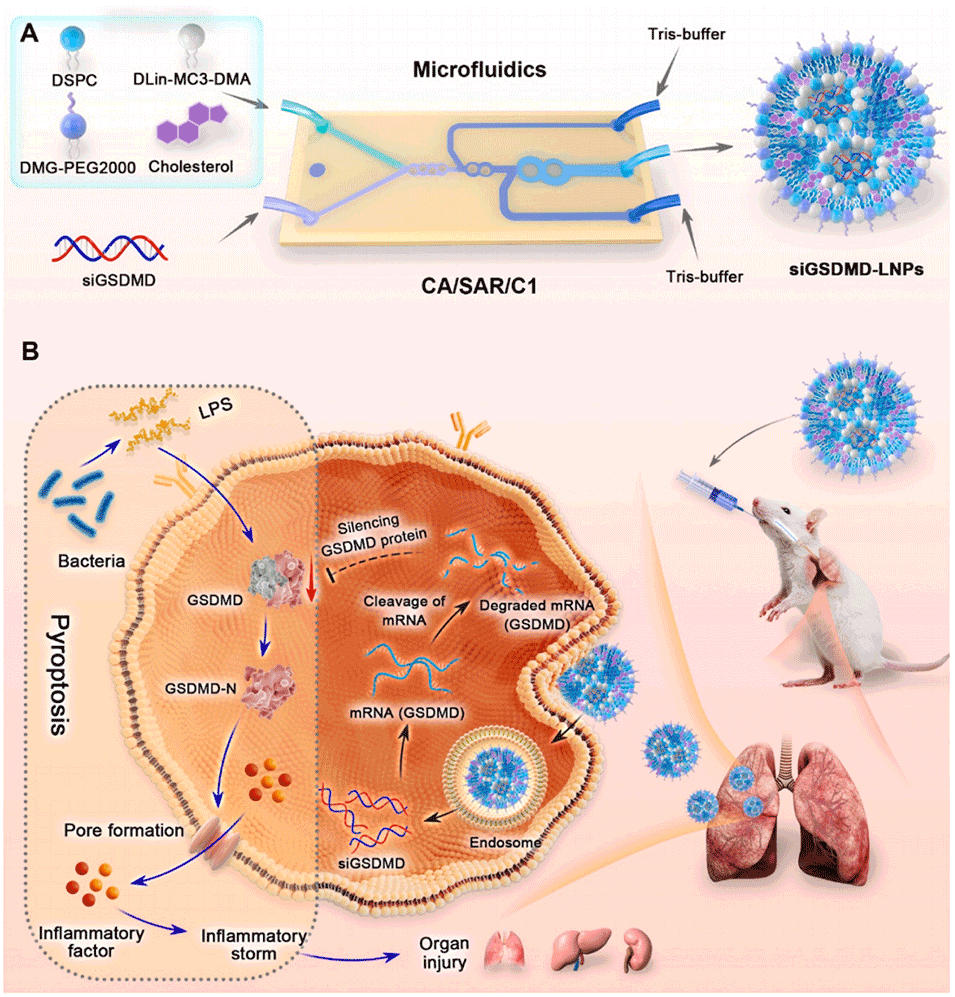
Scheme 1:siGSDMD-LNPs 的制备及其缓解脓毒症的作用机制示意图。(A)基于特定微通道的 siGSDMD-LNPs 制备过程;(B)siGSDMD-LNPs 缓解脓毒症的机制:通过 siRNA 沉默 GSDMD,进而减轻焦亡介导的炎症反应与器官损伤。
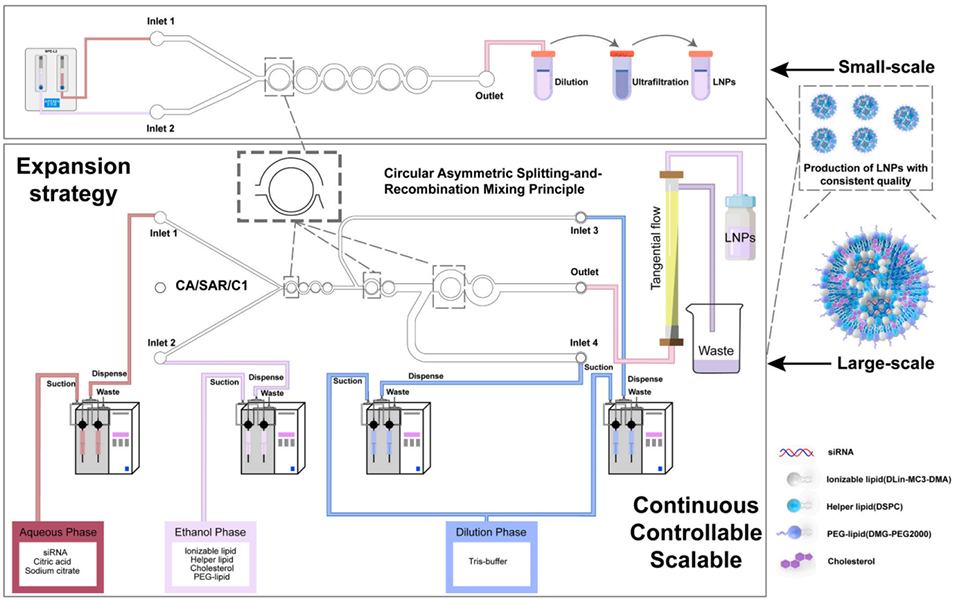
图 1:基于环形非对称分割重组(CA/SAR)混合原理,利用设计的 CA/SAR 微通道与 CA/SAR/C1 芯片实现高质量一致性脂质纳米颗粒(LNPs)制备的扩展策略图。
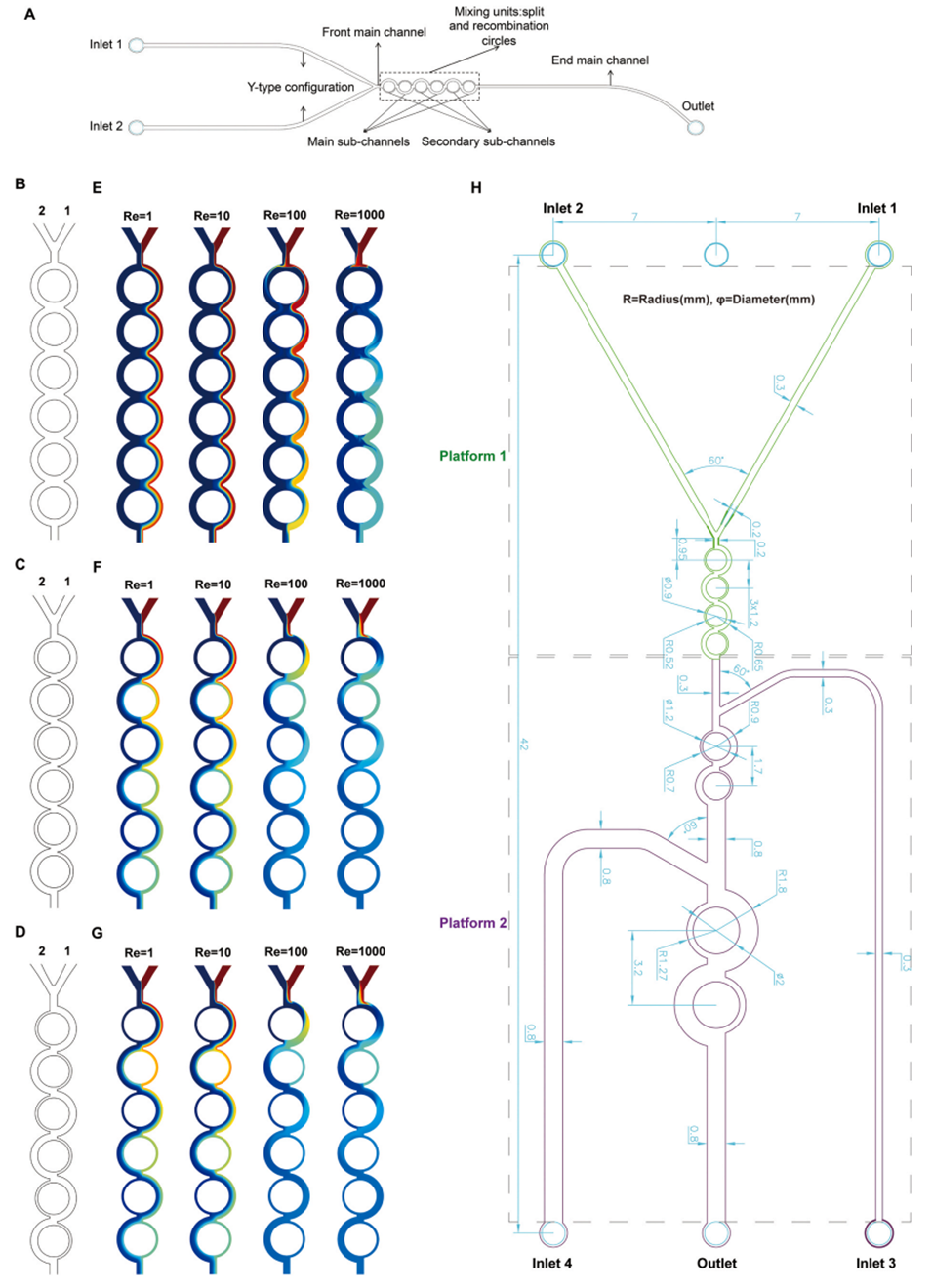
图 2:(A)候选环形分割重组(SAR)微通道示意图;(B-D)三种候选微通道(分别命名为 A 型、B 型、C 型)的结构,其主通道宽度(W1)与副通道宽度(W2)的比例分别为 1:1、2:1 和 3:1;(E-G)A 型、B 型、C 型微通道在不同雷诺数(Re)下的单独混合行为;(H)CA/SAR/C1 芯片的内部通道结构。

图 3:(A-F)不同网格条件下,7 号横截面中心线处的浓度分布(A-C)与速度分布(D-F)。对于 A 型、B 型、C 型微通道,8 号网格与 9 号网格对应的速度和浓度分布最为接近;综合计算效率考虑,选择 8 号网格进行后续分析;(G-I)A 型、B 型、C 型微通道在不同雷诺数(Re)下,不同循环次数对应的混合指数(MI);(J-L)A 型、B 型、C 型微通道在雷诺数 1-1000 范围内的混合指数(MI)、压力差(△Pa)及混合效率成本(Mec),结果显示 C 型微通道的 Mec 最低(即成本效益最高)。

图 4:A 型(A-D)、B 型(E-H)、C 型(I-L)微通道在 0 号、2 号、4 号、6 号横截面(分别对应 0、2、4、6 次循环)处的混合性能对比图。结果表明,采用环形非对称分割重组(CA/SAR)设计的 B 型和 C 型微通道混合性能显著更优:当雷诺数(Re)超过 100 时,B 型微通道仅需 4 次循环、C 型微通道仅需 3 次循环即可实现完全混合(混合指数 MI>90%);且具有更高不对称比例(W1/W2=3:1)的 C 型微通道,其性能优于 B 型微通道(W1/W2=2:1)。
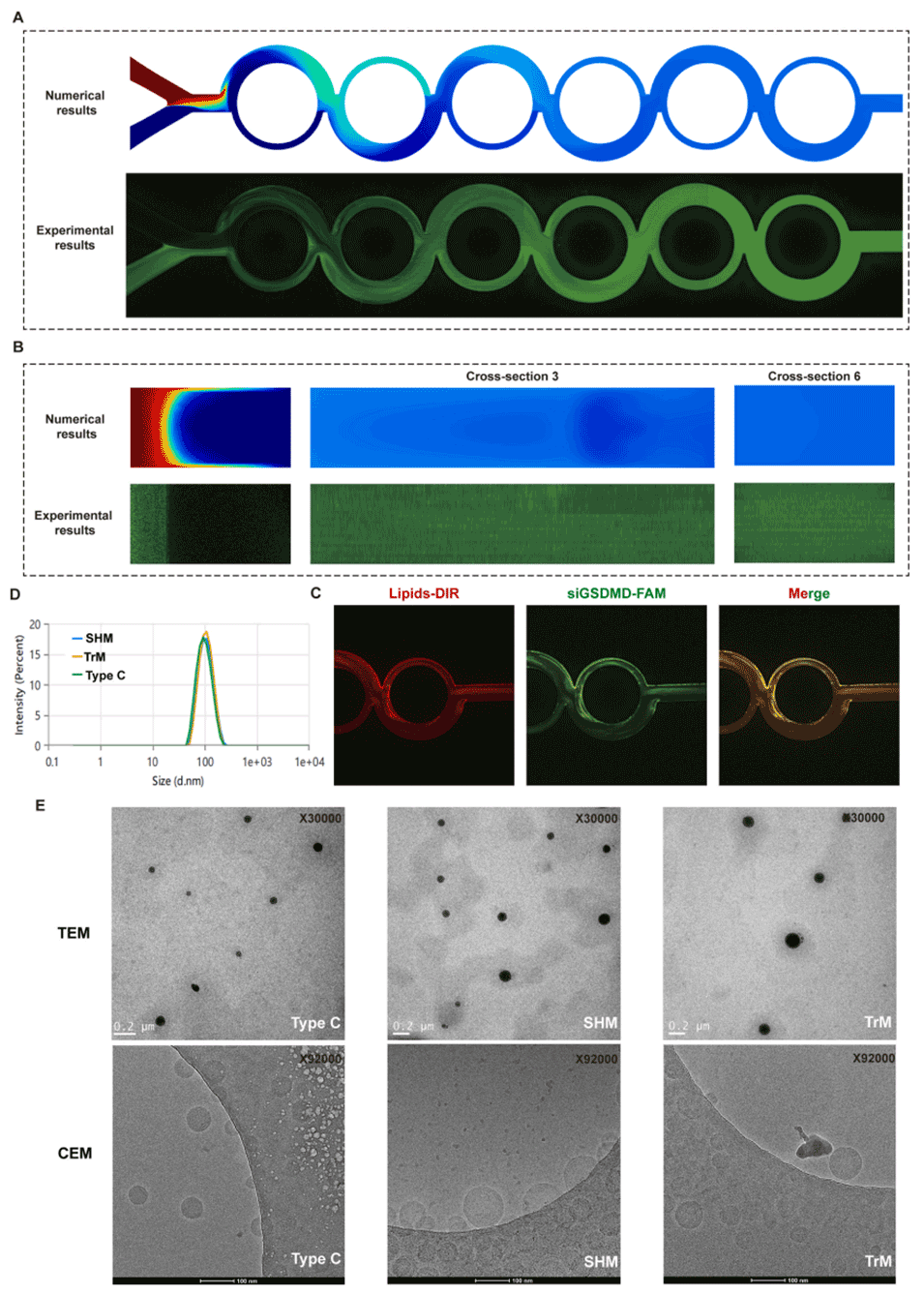
图 5:雷诺数 Re=660 时,C 型微通道内流体行为的数值模拟与实验验证对比。(A)基于乙醇-水两相体系(比例 1:3)的模拟流体行为与实际流体行为对比;(B)0 号、3 号、6 号横截面处界面混合性能的数值模拟结果与实验结果对比;(C)通过激光共聚焦显微镜(CLSM)观察 siGSDMD-LNPs 制备过程中第 6 次循环时的流体混合情况(脂质用 DIR 标记,siGSDMD 用 FAM 标记),表明在 LNPs 制备条件下,C 型微通道可实现两相流体的充分均匀混合(总流速 TFR 设为 6 mL/min,流率比 FRR 设为 3);(D)采用 C 型、交错人字形(SHM)、环形(TrM)微通道制备的最终 LNPs 的粒径对比;(E)采用 C 型、SHM、TrM 微通道制备的最终 LNPs 的形态对比。
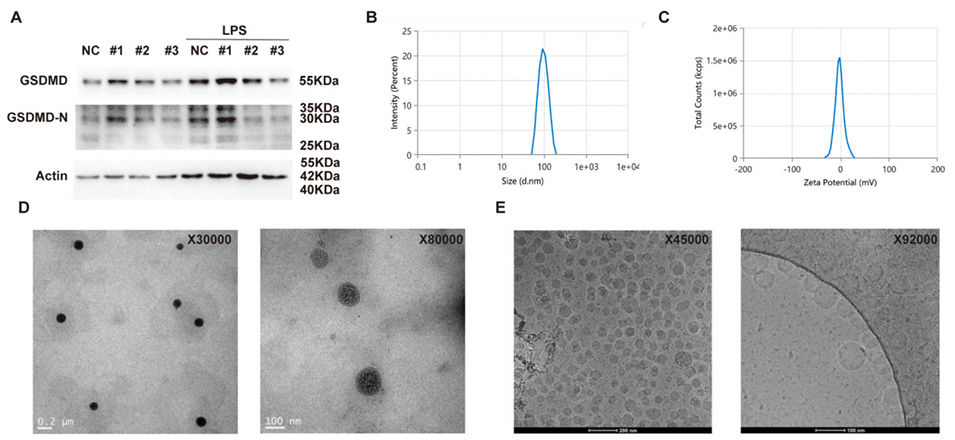
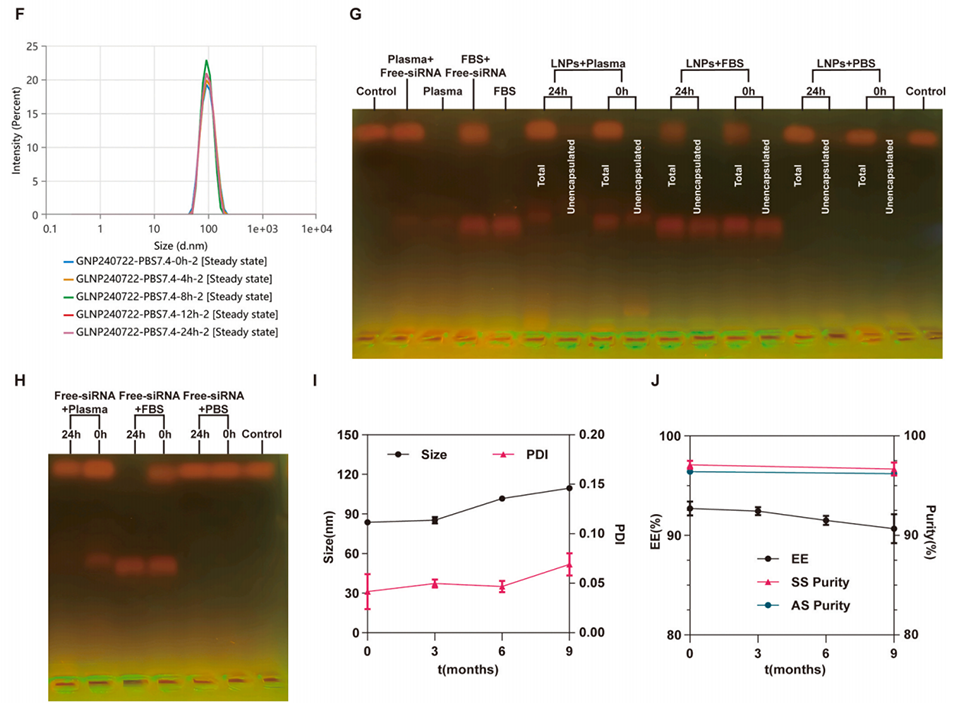
图 6:(A)siRNA 序列筛选结果:骨髓来源巨噬细胞(BMDMs)与候选 siRNA 序列或阴性对照 siRNA(siNC)共孵育 48 小时后,再用 1 μg/mL 脂多糖(LPS)刺激 4 小时,通过蛋白质印迹法(Western blotting)检测 GSDMD 与 GSDMD-N(GSDMD 活性片段)的蛋白水平,以 β- 肌动蛋白(β-actin)作为内参;(B-E)siGSDMD-LNPs 的理化性质表征:(B)粒径与多分散指数(PDI);(C)zeta 电位;(D)透射电子显微镜(TEM)图像;(E)冷冻电子显微镜(CEM)图像;(F)siGSDMD-LNPs 在 pH 7.4 的磷酸盐缓冲液(PBS)中稀释后 24 小时内的粒径变化;(G-H)通过凝胶电泳检测 siGSDMD-LNPs 与游离 siGSDMD 在 pH 7.4 的 PBS、胎牛血清(FBS)或血浆中 24 小时内的稀释稳定性(以负载效率 LE 衡量)。结果显示,二者在 PBS 中的稳定性相当;但在 FBS 和血浆中,siGSDMD-LNPs 的负载效率显著高于游离 siGSDMD,表明 LNPs 可保护 siGSDMD 免受上述环境中的降解;(I-J)siGSDMD-LNPs 在 4±2℃条件下储存 9 个月后的长期稳定性。
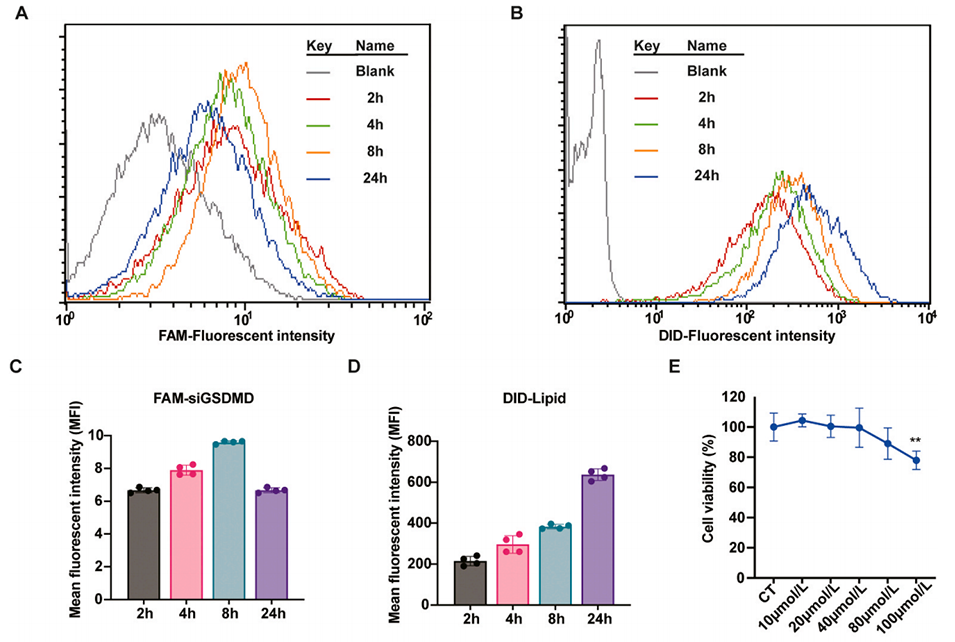
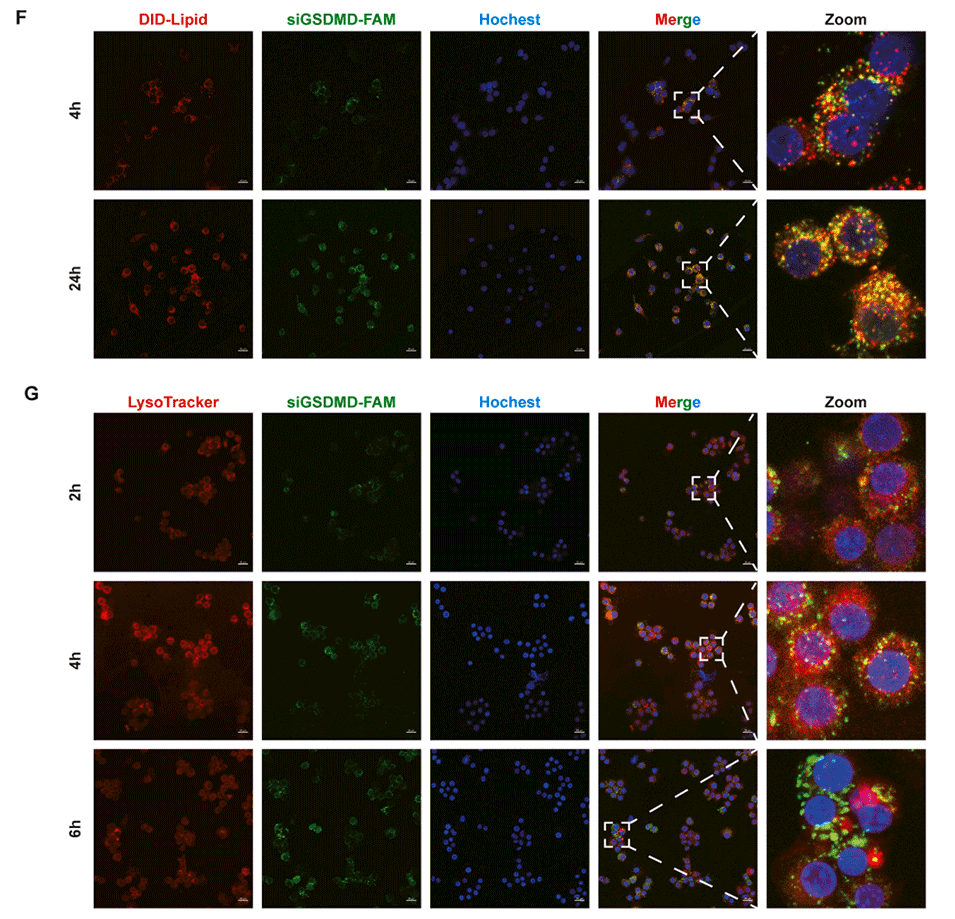
图 7:siGSDMD-LNPs 在骨髓来源巨噬细胞(BMDMs)中的细胞内转运过程。(A-D)BMDMs 与 siGSDMD-LNPs(脂质用 DID 标记,siGSDMD 用 FAM 标记)共孵育,分别在 2、4、8、24 小时通过流式细胞术检测 DID 标记脂质与 FAM 标记 siGSDMD 的荧光强度(n=4);(E)通过 CCK8 法检测 BMDMs 与不同浓度 siGSDMD-LNPs 共孵育后的细胞活力;(F)激光共聚焦显微镜(CLSM)图像显示 BMDMs 对 siGSDMD-LNPs 的摄取情况(siGSDMD 用 FAM 标记,呈绿色;LNPs 中的脂质成分用 DID 标记,呈红色;细胞核用 Hoechst 33342 染色,呈蓝色);(G)CLSM 图像显示 siGSDMD-LNPs(FAM 标记 siGSDMD)在 BMDMs 中 2、4、6 小时的细胞内转运情况(siGSDMD 用 FAM 标记,呈绿色;溶酶体用溶酶体示踪剂 LysoTracker Red 染色,呈红色;细胞核用 Hoechst 33342 染色,呈蓝色)。
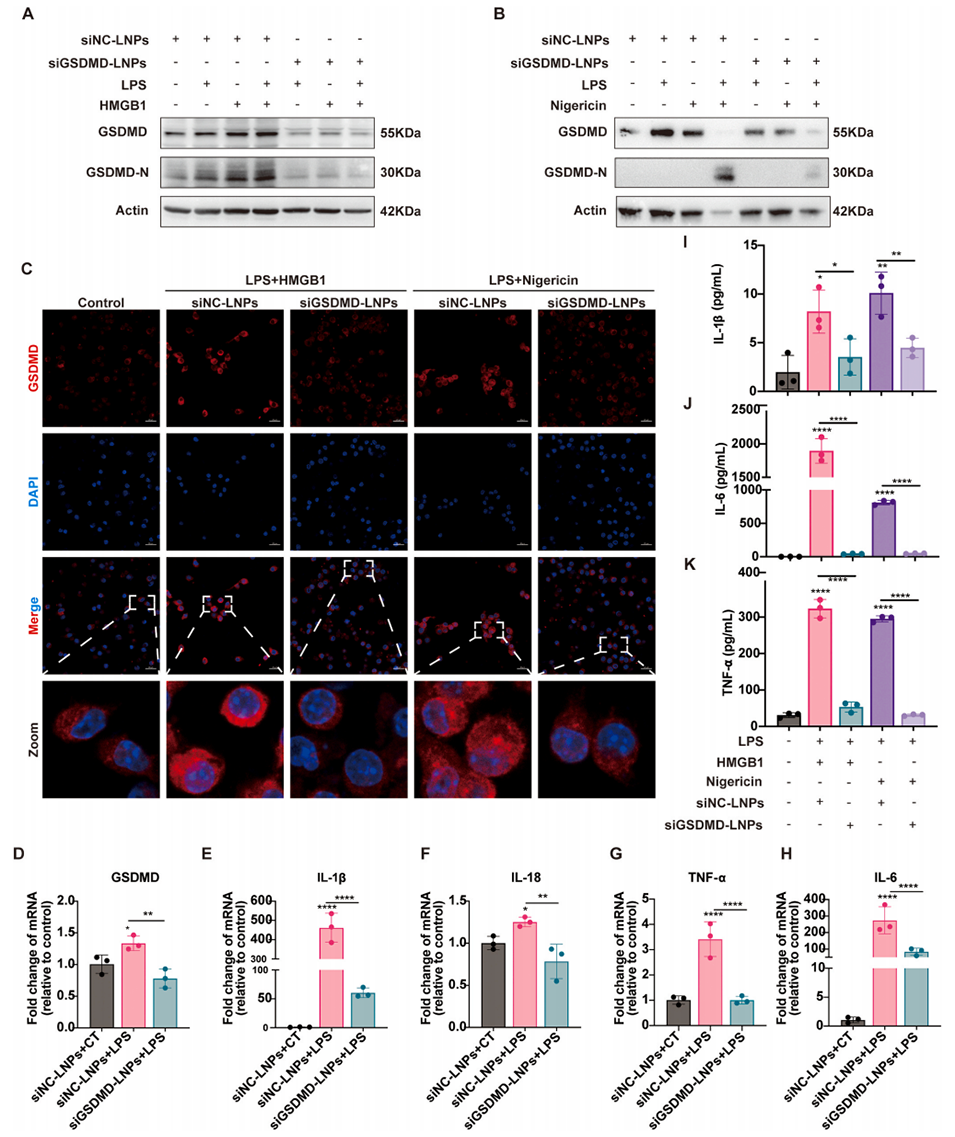
图 8:siGSDMD-LNPs 在骨髓来源巨噬细胞(BMDMs)中的体外药效学评价。(A、B)BMDMs 与 siGSDMD-LNPs 或阴性对照 LNPs(siNC-LNPs)共孵育 48 小时后诱导焦亡,通过蛋白质印迹法检测 GSDMD 与 GSDMD-N 的蛋白水平;(C)CLSM 图像显示 BMDMs 中 GSDMD 的表达与定位;(D-H)通过实时荧光定量聚合酶链反应(RT-qPCR)检测 GSDMD 及炎症因子的 mRNA 水平(n=3);(I-K)通过酶联免疫吸附试验(ELISA)检测经 siNC-LNPs 或 siGSDMD-LNPs 处理的 BMDMs 释放的促炎细胞因子水平(n=3)。
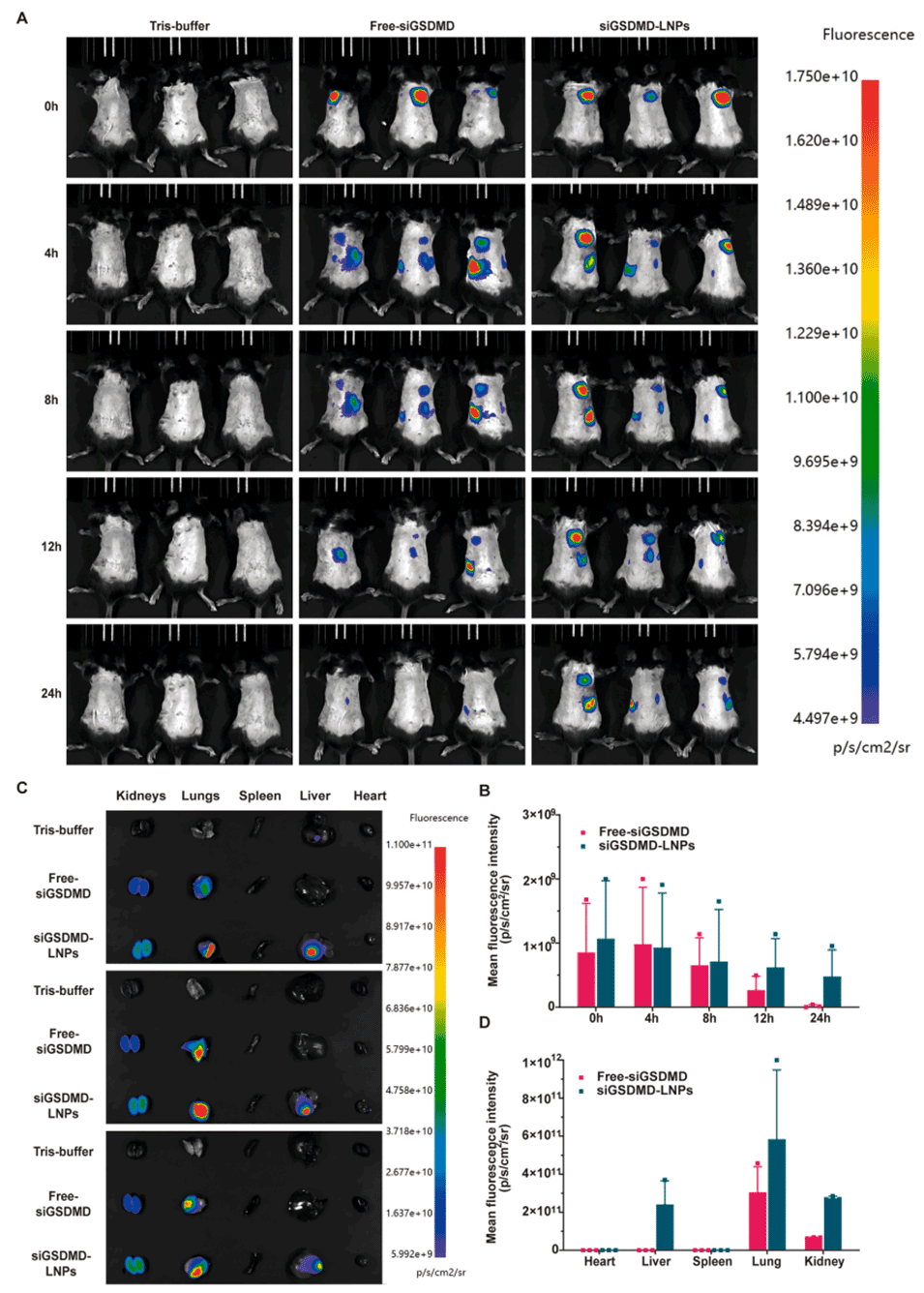
图 9:利用 AniView 100 活体成像系统观察 siGSDMD-LNPs 在小鼠体内的肺部靶向分布情况。(A, B)经肺内给药后,不同时间点 siGSDMD-LNPs(siGSDMD 用 CY5 标记)在小鼠体内的组织分布活体成像图(n=3);(C, D)肺内给药 24 小时后,小鼠离体器官(心、肝、脾、肺、肾)的成像图及荧光强度分析(n=3)。
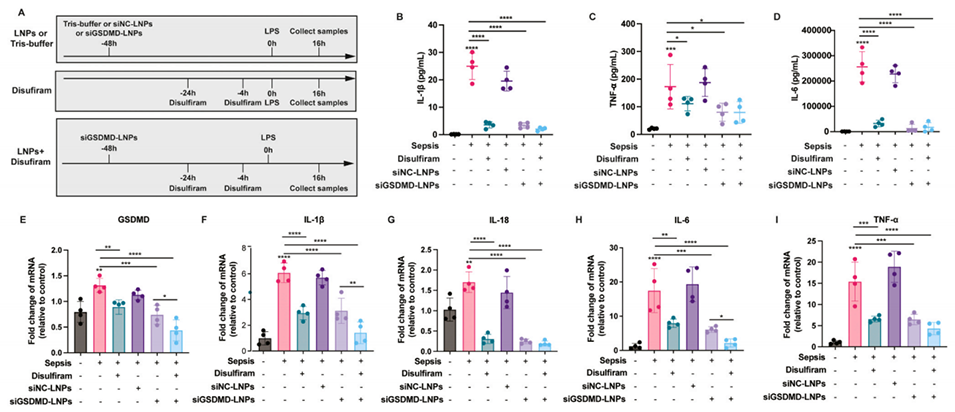
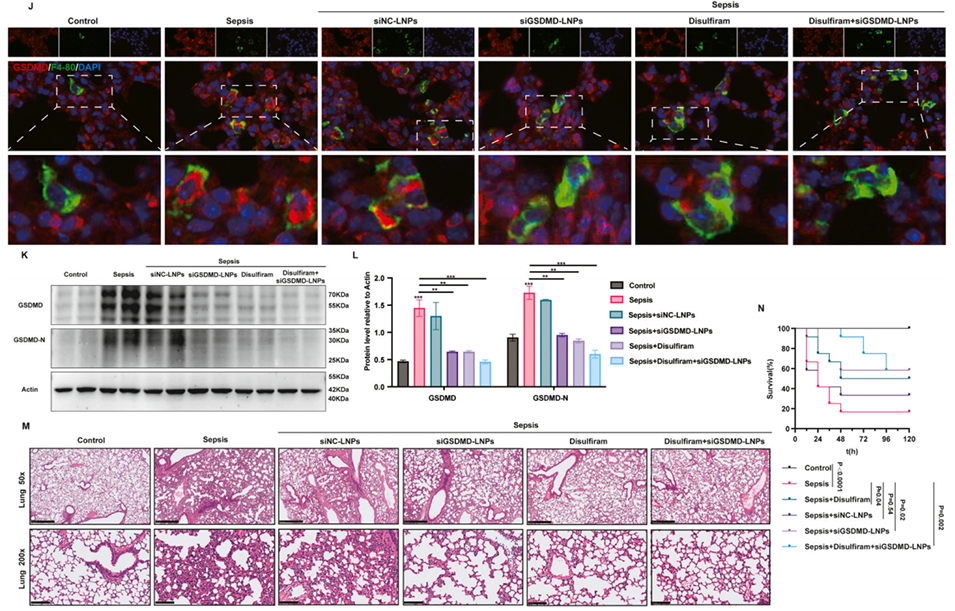
图 10:肺内给药 siGSDMD-LNPs 可减轻脓毒症小鼠的炎症反应与肺损伤。(A)体内药效学研究的给药方案;(B-D)通过 ELISA 检测经 siGSDMD-LNPs 或双硫仑(disulfiram)处理的脓毒症小鼠血浆中炎症因子水平(n=4);(E-I)通过 RT-qPCR 检测脓毒症小鼠肺组织中 GSDMD 及炎症因子的 mRNA 表达水平(n=4);(J)肺组织中 GSDMD 与巨噬细胞标志物 F4/80 的免疫荧光染色图;(K-L)通过蛋白质印迹法检测肺组织中 GSDMD 与 GSDMD-N 的蛋白表达水平;(M)经 siGSDMD-LNPs 或双硫仑处理的脓毒症小鼠肺组织苏木精-伊红(H&E)染色图;(N)经致死剂量脂多糖(LPS,50 mg/kg)诱导的脓毒症小鼠,在接受 siGSDMD-LNPs 或双硫仑治疗后的生存率曲线。
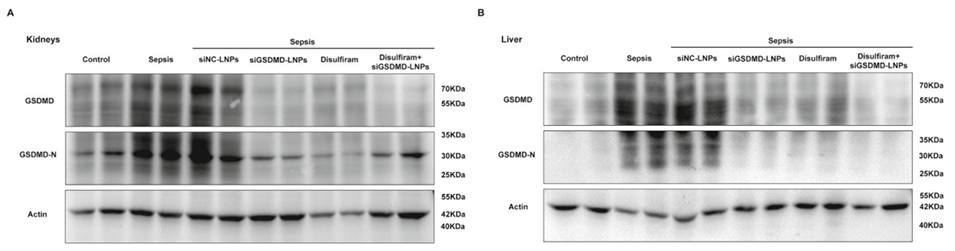
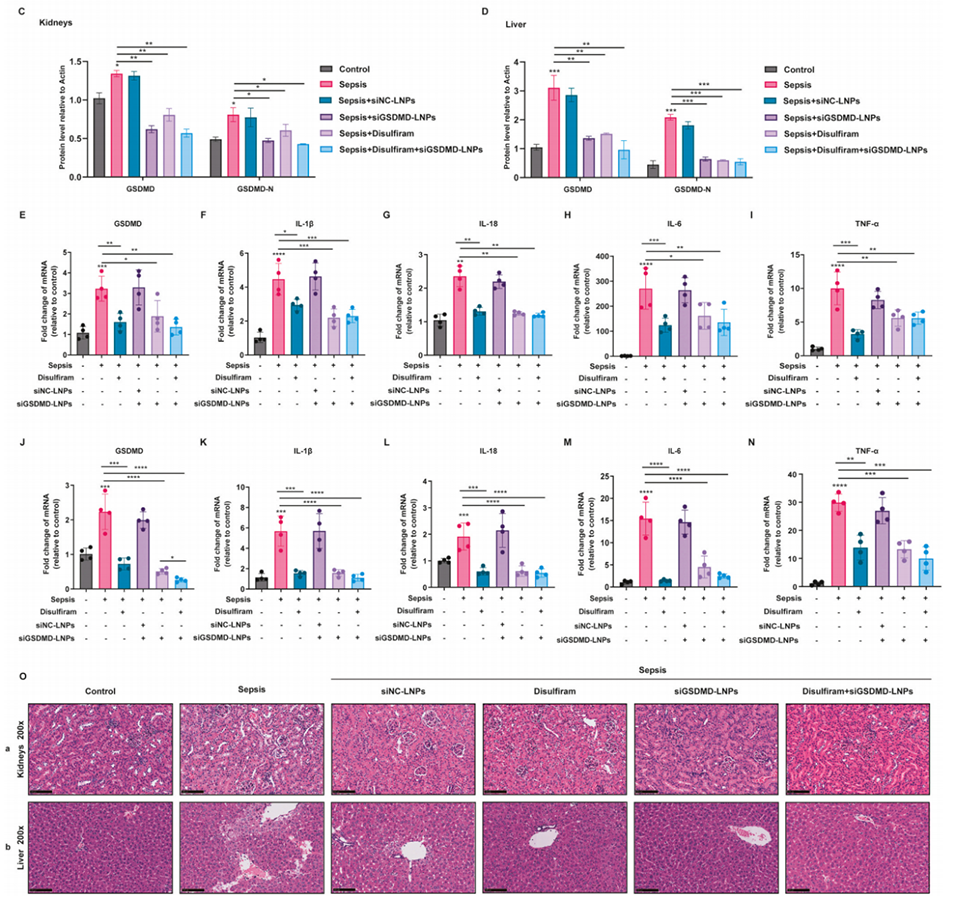
图 11:肺内给药 siGSDMD-LNPs 通过下调 GSDMD 表达抑制脓毒症相关的肾损伤与肝损伤。(A-D)通过蛋白质印迹法分析肾组织与肝组织中 GSDMD 与 GSDMD-N 的蛋白水平;(E-N)通过 RT-qPCR 检测肾组织(E-I)与肝组织(J-N)中 GSDMD 及炎症因子的 mRNA 表达水平(n=4);(O)经 siGSDMD-LNPs 或双硫仑处理的脓毒症小鼠肾组织与肝组织的 H&E 染色图。
论文链接:https://doi.org/10.1016/j.nantod.2025.102653
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














