生物聚合物核壳微球在药物递送、组织工程和诊断等各类生物医学应用中发挥着关键作用。这些应用要求微球具备尺寸稳定可控、形状精度高的特性,然而,实现尺寸与形状可控的核壳型生物聚合物微凝胶的高通量合成仍是一大难题。

近期,有研究人员开发了一种基于脉冲离心微流控的新策略,成功实现了单分散、尺寸均一核壳微球的一步法高效制备,有效解决了颗粒合并的难题。该技术还将荧光纳米材料与细胞封装相结合,在长达15天的实验中保持了优异的细胞活性和结构完整性。相关研究以“One-step generation of luminescent core-shell microspheres for cell encapsulation via pulsed operation in centrifugal microfluidics”为题目,发表在期刊《Microsystems & Nanoengineering》上。
本文要点:
1、本研究开发了一种基于离心微流控脉冲操作的一步法工艺,以高通量制备单分散且发光的壳聚糖-海藻酸盐核壳微球。
2、通过调控转速脉冲模式,有效避免了微球合并问题,实现了单分散、尺寸均一的核壳结构制备。
3、引入氮掺杂石墨烯量子点(NGQDs)作为荧光标记,赋予微球实时成像功能;添加鱼明胶(FG)进一步提高了生物相容性。
4、所得微球结构完整性优异,15天后仍能保持核壳结构;生物相容性方面,C2C12细胞15天后存活率超88%,细菌2天后存活率达到同等水平。
5、该系统具备良好的可扩展性,可在不影响功能的前提下稳定制备大量微球,且这种高效精简的方法简化了制备流程,为靶向治疗、组织再生和诊断等应用提供了新的可能性。
本研究的核心创新“脉冲操作”,其本质是巧妙地利用物理动力学手段,解决了一个由化学过程速率限制所引发的工程问题。
微球的形成依赖于海藻酸钠与钙离子的离子交联化学反应。这个反应并非瞬时完成,需要一定的扩散和时间。在连续操作模式下,新生成的液滴由于缺乏物理分离,在化学交联完成前就因空间过于接近而彼此融合。
脉冲操作(转速的周期性变化)并没有尝试改变化学交联的速度(例如,更换交联离子或改变浓度),而是引入了欧拉力(Euler force)这一物理机制。通过突然的减速/加速,产生足够的流体扰动,将新生成的液滴从喷射点“推开”,人为地为其化学交联过程创造了所需的时间和空间上的隔离。
对未来微流控设计的启示:
1、跨学科思维:优秀的微流控设计往往是流体力学、材料化学和控制工程的交叉产物。未来在设计类似系统时,不应局限于单一学科的传统思路(如只优化化学配方),而应思考如何通过物理场(如力、声、光、电)的动态控制来主动管理化学和生物过程。
2、主动控制范式:这项技术代表了一种从“静态优化”到“动态控制”的范式转变。它表明,通过对外场参数(如转速、电压、温度)进行时序化的智能控制,可以解决许多在静态条件下无法克服的难题(如堵塞、合并、不均匀性),这为开发更智能、更可靠的微流控系统提供了新方向。
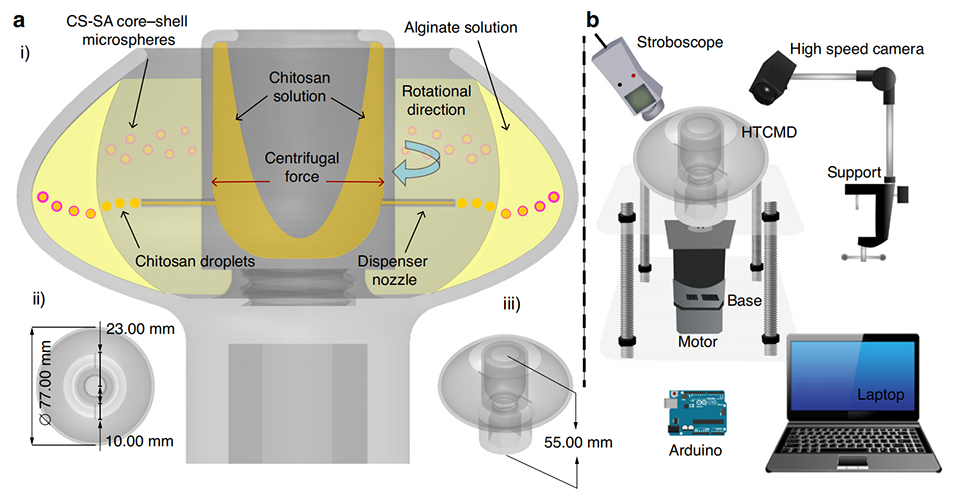
图 1 高通量离心微流控装置(HTCMD)的设计与工作原理
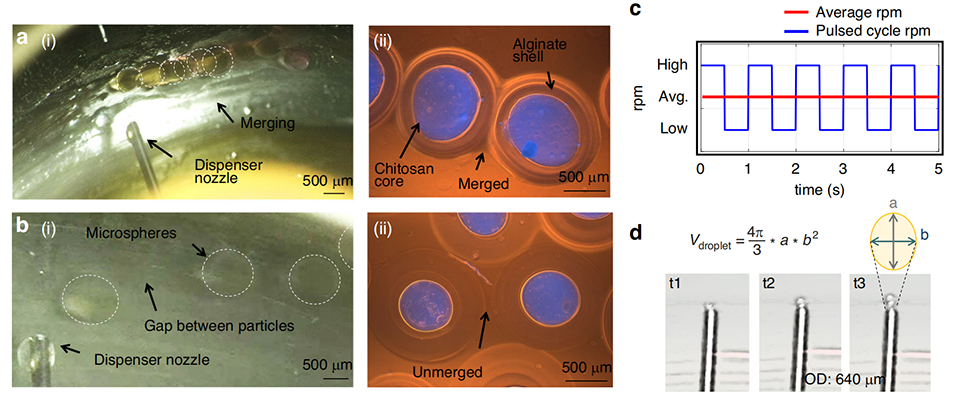
图 2 高通量离心微流控装置(HTCMD)连续操作与脉冲操作的对比
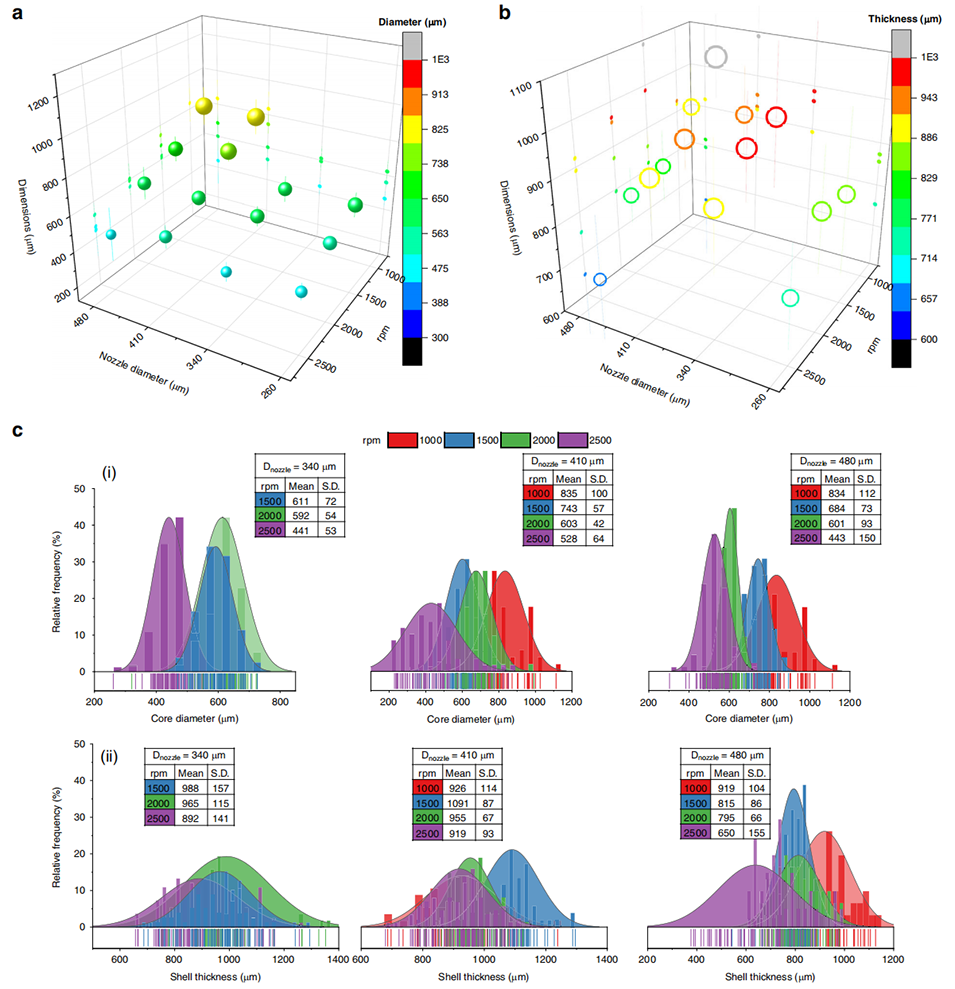
图 3 不同喷嘴直径和旋转速度下核直径与壳厚度的尺寸分布分析
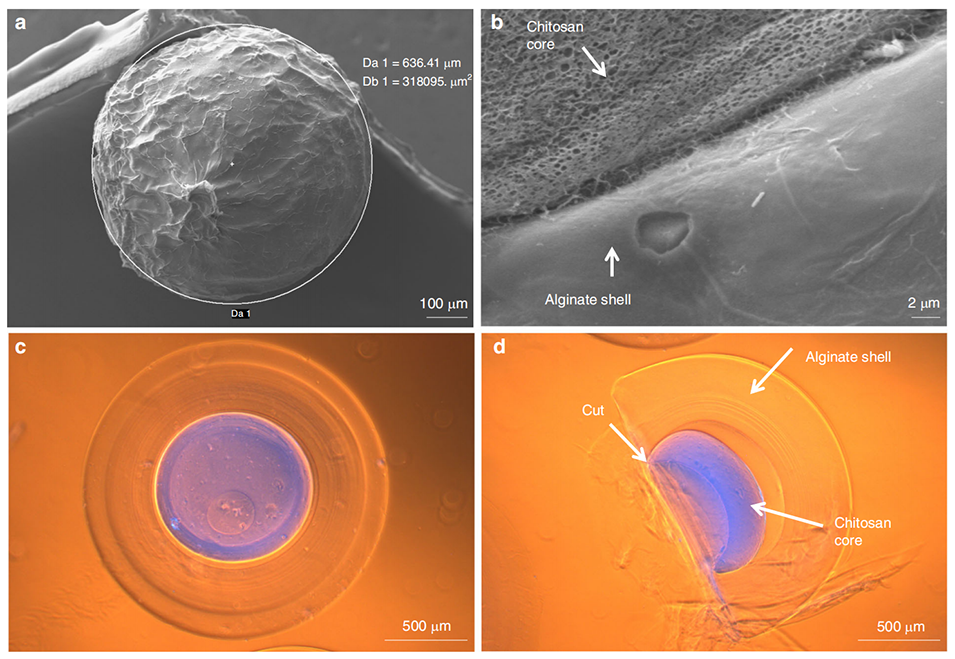
图 4 壳聚糖-海藻酸盐核壳微球的微观表征
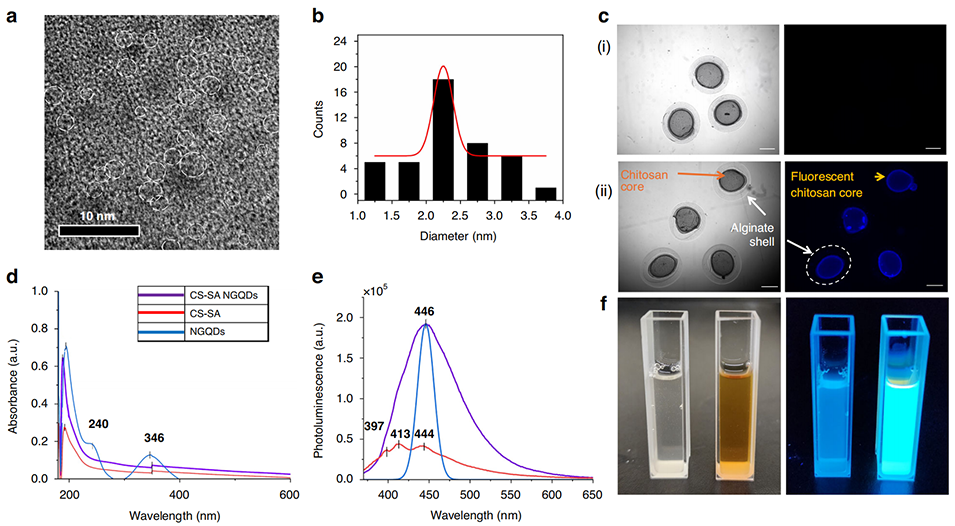
图 5 氮功能化石墨烯量子点(NGQDs)及其使核壳微球具备发光特性的作用
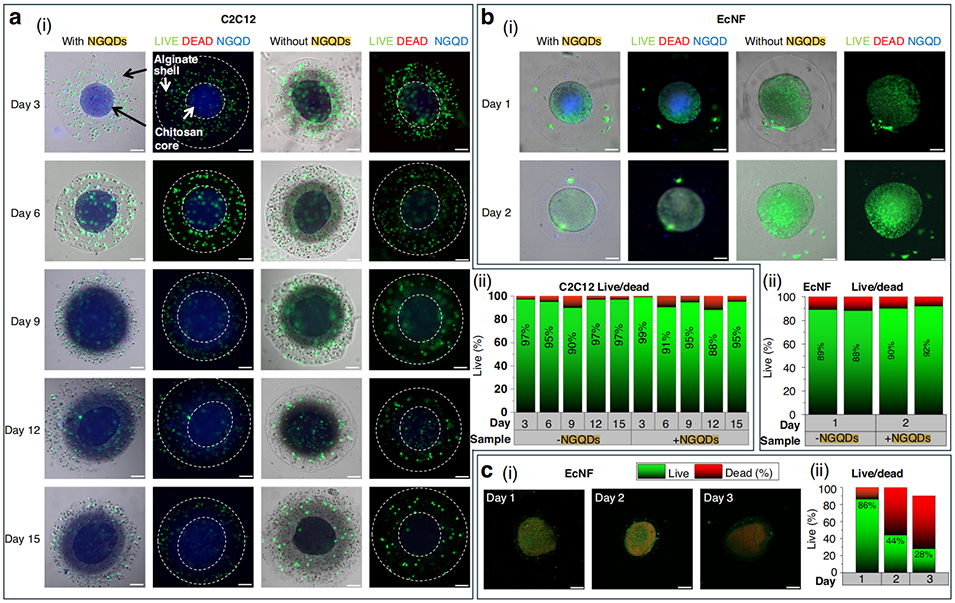
图 6 负载氮功能化石墨烯量子点(NGQDs)的核壳微球的细胞与细菌存活率分析
论文链接:https://doi.org/10.1038/s41378-025-01009-y
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














