
导读:
近期,苏州大学骨科研究所徐勇教授、施勤教授、钮俊杰等人开发了一种具有免疫调节功能的仿生轴承启发润滑微球(LFDCS),该微球通过微流控技术制备,以硫酸软骨素和甲基丙烯酰化丝胶蛋白为骨架,结合叶酸靶向脂质体,实现了对骨关节炎的“润滑-抗炎-修复”三位一体治疗。相关研究以“Bionic bearing-inspired lubricating microspheres with Immunomodulatory effects for osteoarthritis therapy”为题目,发表在期刊《Journal of Nanobiotechnology》上。
本文要点:
1、本研究通过薄膜水化和微流控方法,制备以硫酸软骨素(Chs)/甲基丙烯酰化丝胶蛋白(SerMA)为核心,接枝叶酸(FA)和78c修饰脂质体(78c@Lipo-FA)的可注射水凝胶微球(LFDCS)。
2、LFDCS兼具仿生轴承的软骨润滑与粘附能力,降解时释放硫酸软骨素促进软骨细胞功能;在基质金属蛋白酶9作用下,释放的78c@Lipo-FA通过叶酸靶向M1型巨噬细胞并抑制其功能。
3、RNA测序显示,LFDCS通过下调PI3K/AKT信号传导和炎症反应来改善软骨细胞功能障碍。
4、动物实验证实,LFDCS可降低关节摩擦、抑制炎症并减轻软骨细胞功能障碍,为巨噬细胞介导疾病的治疗提供新策略。
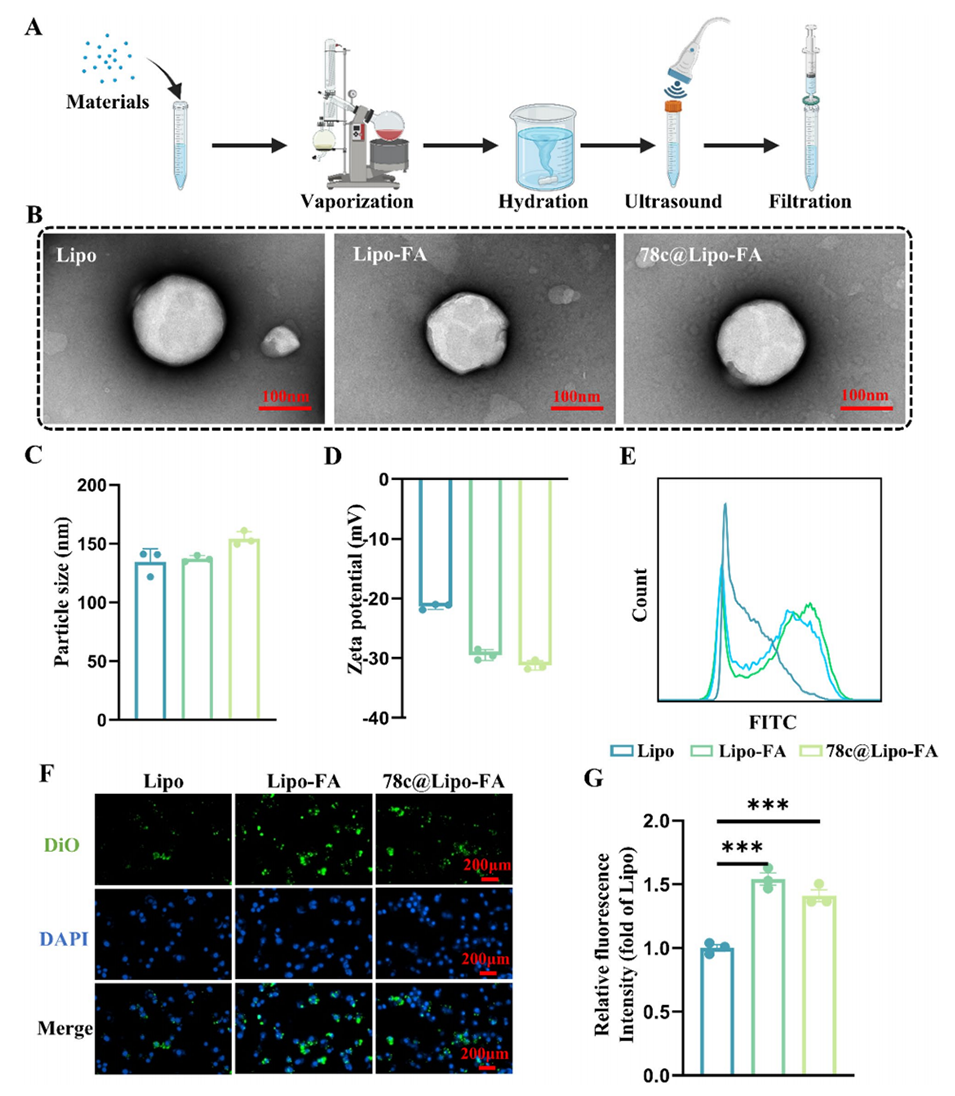
图1. 78c@Lipo-FA的表征。(A) Lipo-FA的制备流程示意图,材料包括78c、氢化大豆磷脂(HPSC)、胆固醇、十八胺和DSPE-PEG2k-FA。(B)脂质体的透射电镜(TEM)图像。(C)脂质体的粒径分布(n=3)。(D)脂质体的zeta电位(n=3)。(E)流式细胞术检测骨髓来源巨噬细胞(BMMs)摄取脂质体的代表性图。(F)荧光显微镜下BMMs摄取脂质体的代表性图像(BMMs孵育4小时后)。(G) BMMs摄取脂质体的相对荧光强度(n=3)。***p<0.001
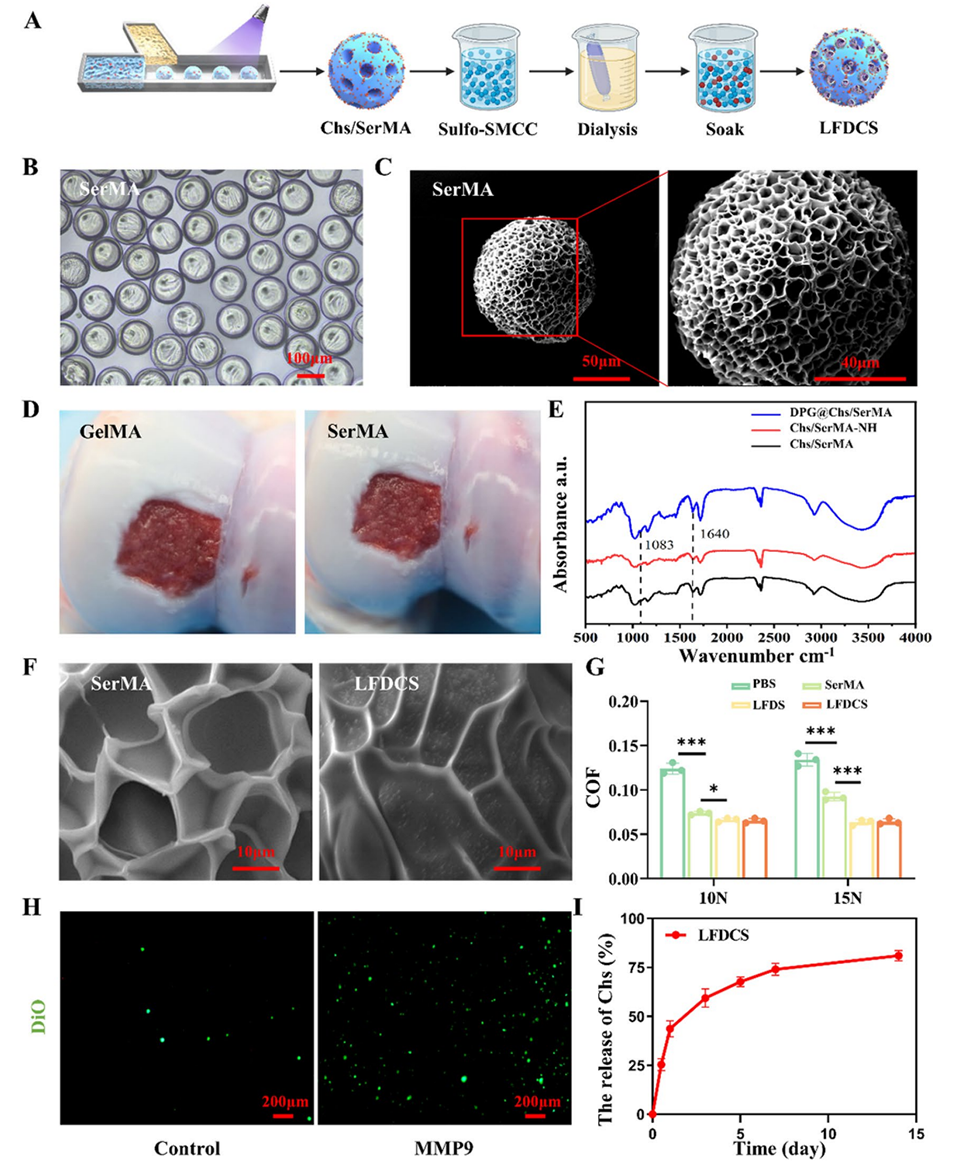
图2. LFDCS的表征。(A) LFDCS的制备流程示意图。(B)光学显微镜下观察到的SerMA水凝胶微球形态。(C) SerMA水凝胶微球的代表性扫描电镜(SEM)图像。(D) GelMA和SerMA水凝胶微球在猪软骨上的黏附情况大体观察。(E) DPG@Chs/SerMA、Chs/SerMA-NH和Chs/SerMA的傅里叶变换红外光谱(FTIR)。(F) SerMA和LFDCS的代表性SEM图像。(G) PBS、SerMA、LFDS和LFDCS的摩擦系数(COF)直方图(n=3)。(H)荧光显微镜下观察LFDCS中脂质体的响应性释放。(I) LFDCS中硫酸软骨素(Chs)的释放曲线(n=3)。*p<0.05,***p<0.001
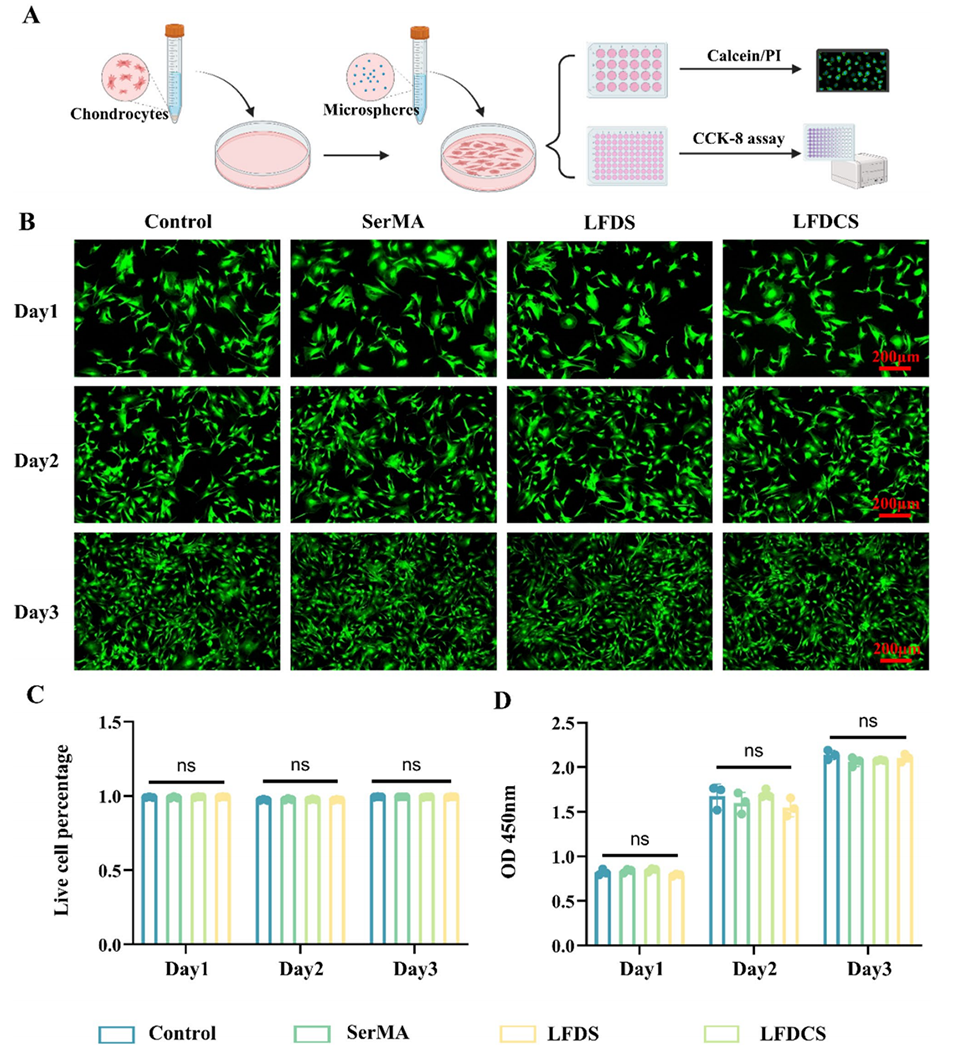
图3. LFDCS的生物相容性。(A)材料生物相容性检测流程示意图。(B,C)第1、2、3天软骨细胞的Calcein/PI染色及定量分析(n=3)。(D)第1、2、3天软骨细胞活力的CCK8检测(n=3)。ns表示无显著差异
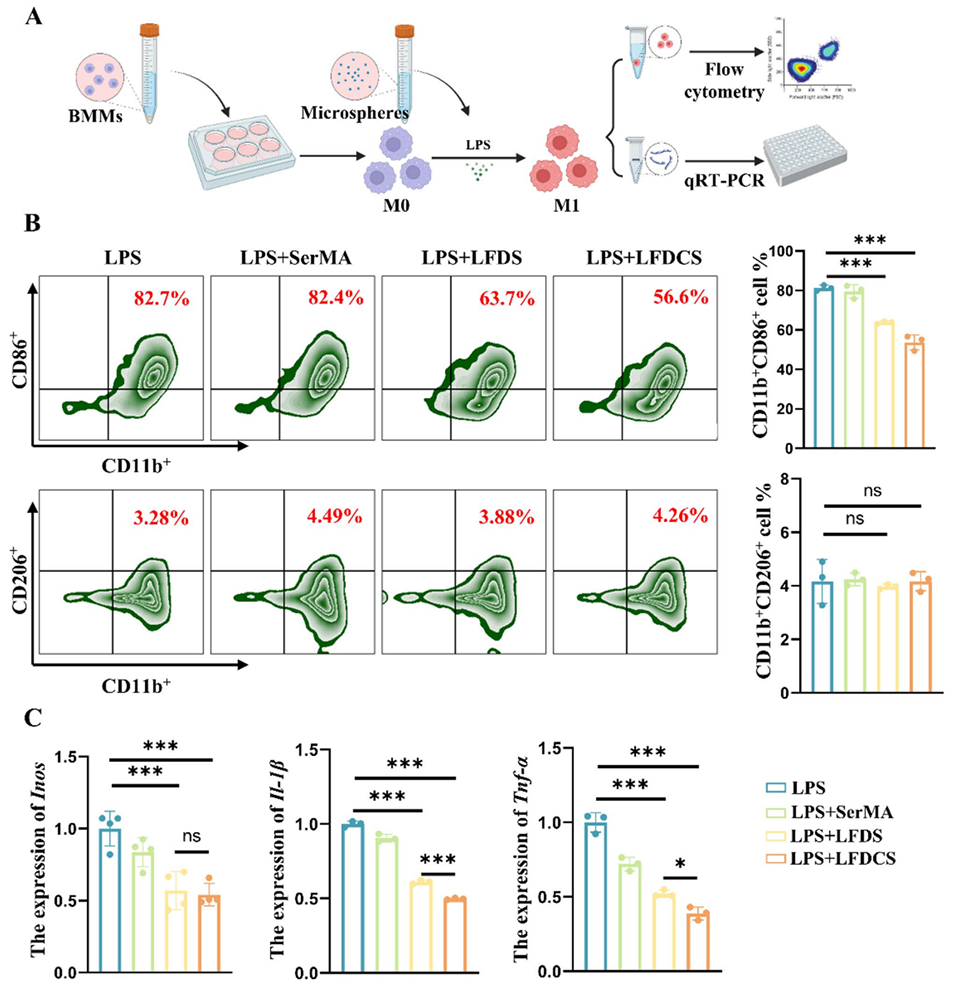
图4. LFDCS抑制巨噬细胞向M1表型极化。(A)微球干预巨噬细胞极化的流程示意图。(B)流式细胞术检测24h时CD11b+CD86+(M1表型)和CD11b+CD206+(M2表型)的比例(n=3)。(C) qRT-PCR检测24h时M1极化相关基因(Inos、Il-1β和Tnf-α)的表达(n=3)。*p<0.05,***p<0.001,ns表示无显著差异
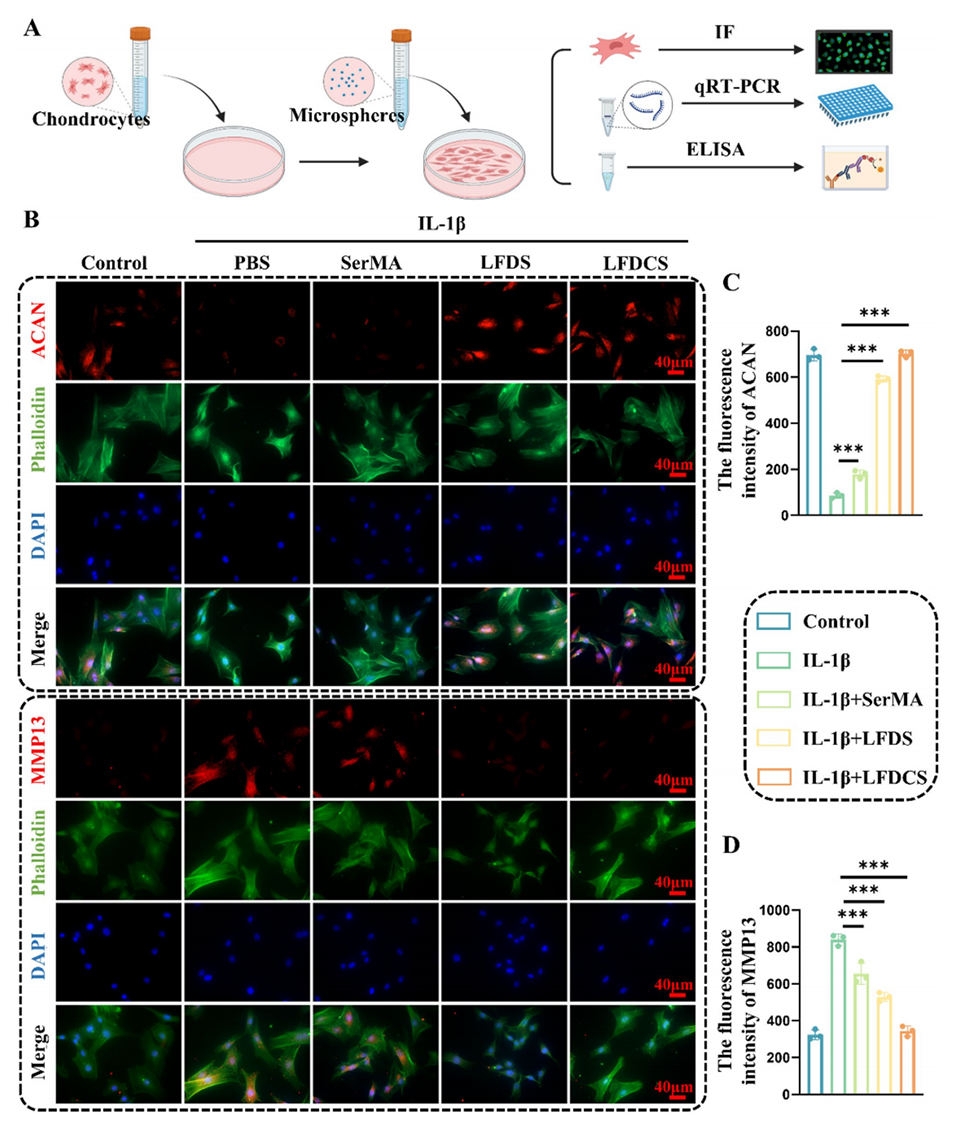
图5. LFDCS上调软骨细胞中ACAN表达并下调MMP13表达。(A) LFDCS干预IL-1β诱导软骨细胞的示意图。(B)免疫荧光(IF)检测软骨细胞中ACAN和MMP13的表达。(C, D)软骨细胞中ACAN和MMP13表达的定量分析(n=3)。***p<0.001
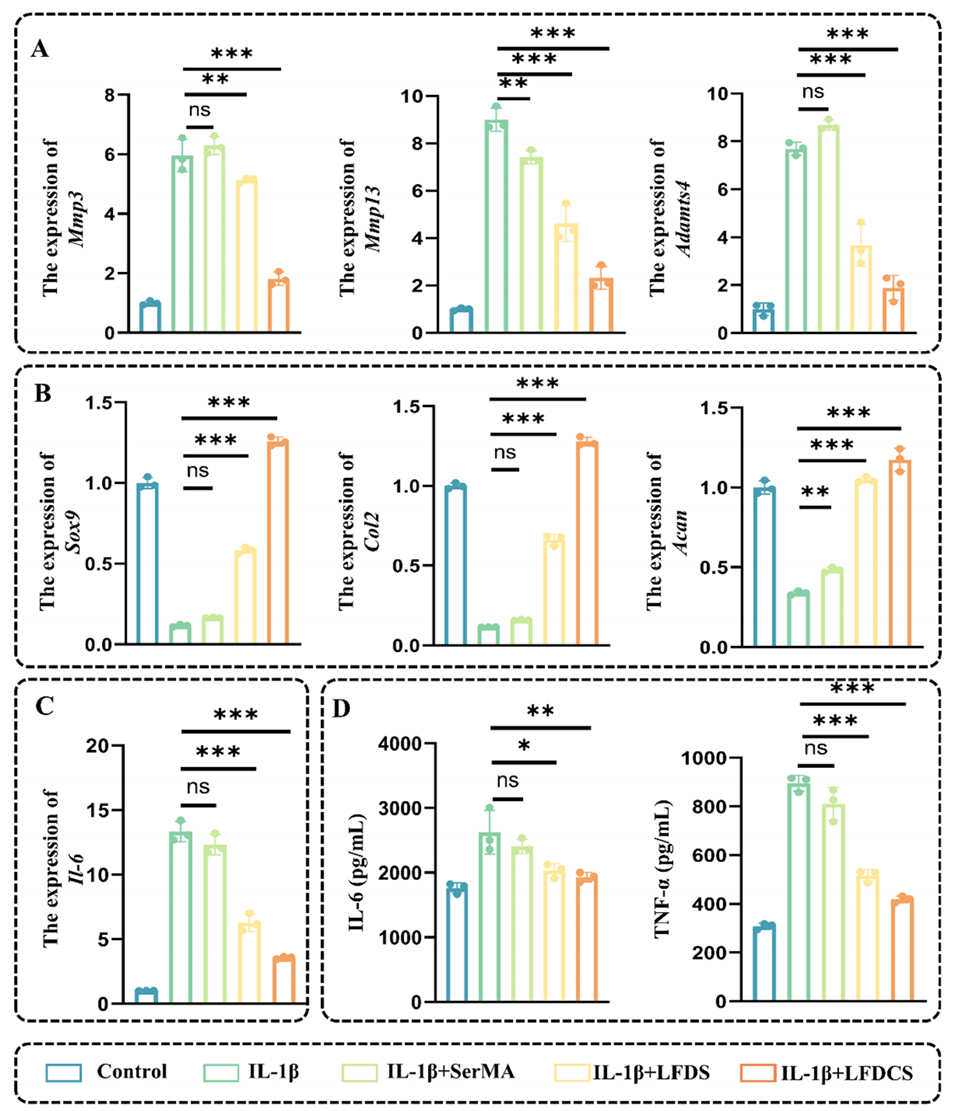
图6. LFDCS改善IL-1β诱导的软骨细胞功能障碍。(A) qRT-PCR检测软骨细胞分解代谢相关基因(Mmp3、Mmp13和Adamts4)的表达。(B) qRT-PCR检测软骨细胞合成代谢相关基因(Sox9、Col2和Acan)的表达。(C) qRT-PCR检测软骨细胞炎症基因Il-6的表达。(D) ELISA检测IL-6和TNF-α的浓度。*p<0.05,**p<0.01,***p<0.001,ns表示无显著差异
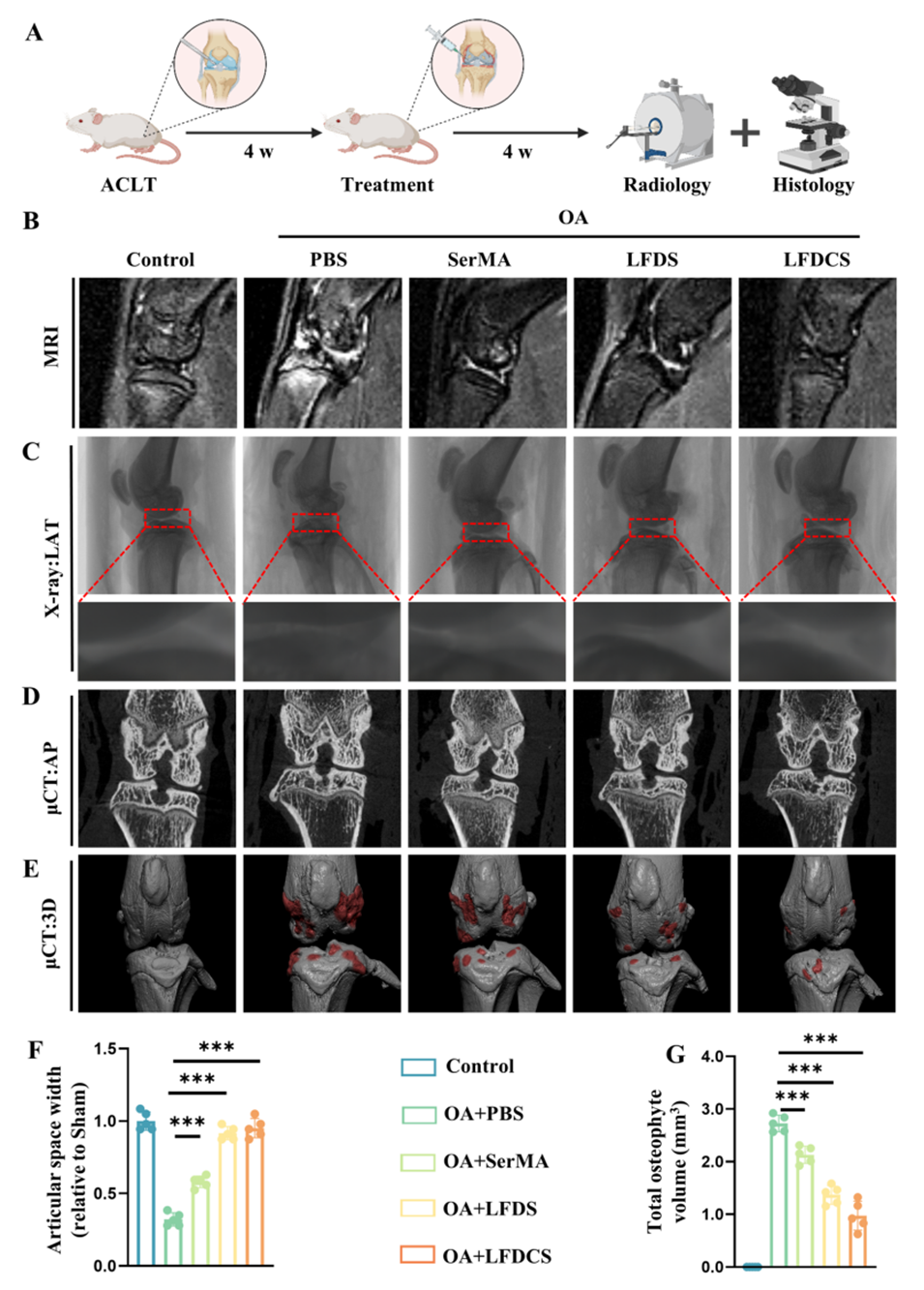
图7. LFDCS减少OA大鼠关节内液相信号和骨赘形成。(A) LFDCS治疗流程示意图。(B) MRI扫描检测关节腔水肿情况。(C) X射线扫描检测关节表面,LAT表示侧位。(D)显微CT(µCT)扫描检测关节表面,AP表示前后位。(E) µCT扫描的膝关节三维重建图像。(F)大鼠内侧软骨间隙宽度的X射线定量分析(n=5)。(G)大鼠膝关节总骨赘的定量分析(n=5)。***p<0.001
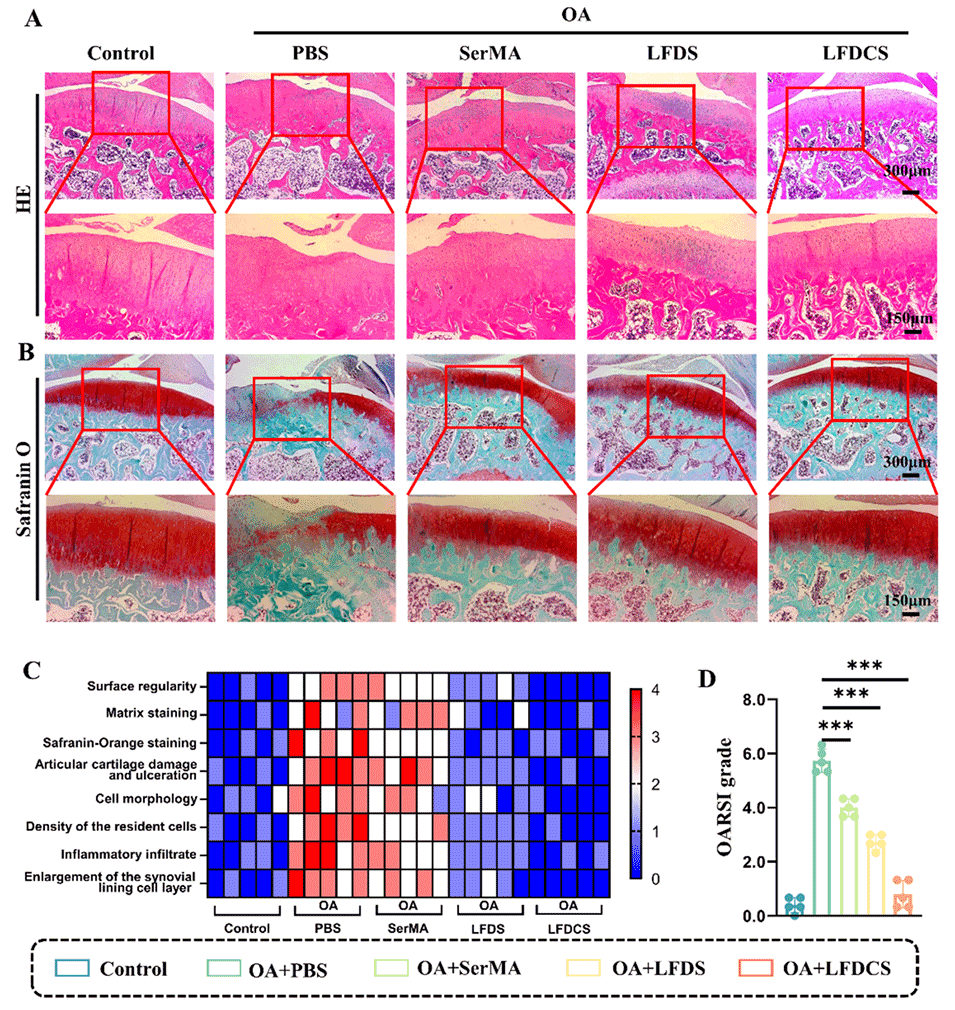
图8. LFDCS减轻OA大鼠的软骨磨损。(A) OA大鼠关节表面磨损的H&E染色。(B) OA大鼠软骨表面的番红O(SafraninO)染色。(C)组织学评分变量的热图(n=5)。(D)大鼠关节的OARSI分级(n=5)。***p<0.001
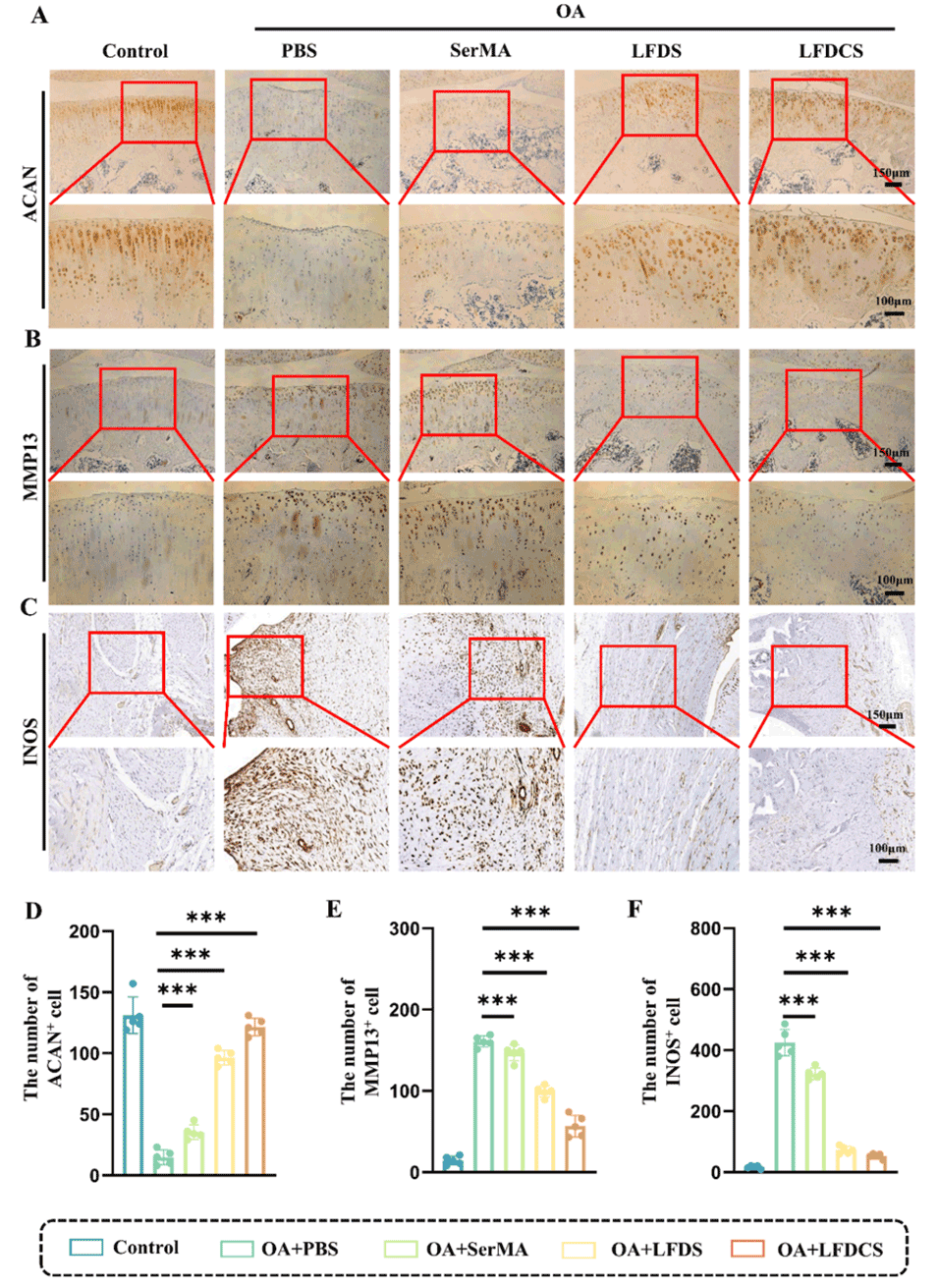
图9. LFDCS改善软骨功能并减轻OA大鼠的滑膜炎症。(A-C)免疫组化(IHC)检测大鼠关节中ACAN、MMP13和INOS的表达。(D-E) IHC检测ACAN、MMP13和INOS数量的定量分析(n=5)。***p<0.001
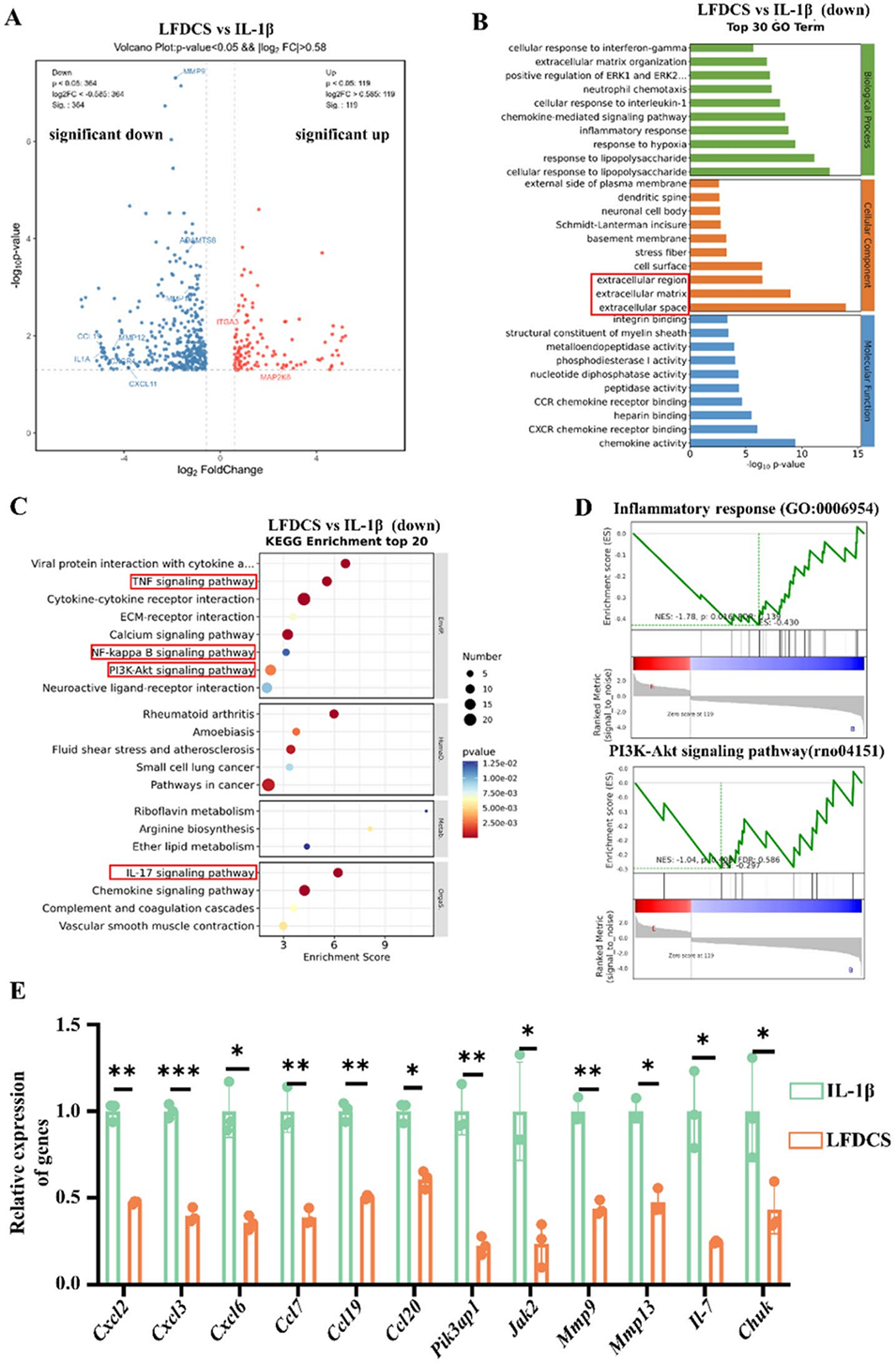
图10.有无LFDCS处理的IL-1β诱导软骨细胞的RNA测序分析。(A)火山图分析IL-1β组和LFDCS组之间的差异表达基因(DEGs)。(B) GO富集分析IL-1β组和LFDCS组之间DEGs的细胞组分。(C) KEGG富集分析IL-1β组和LFDCS组之间DEGs的信号通路。(D) IL-1β组和LFDCS组之间DEGs中炎症反应和PI3K-Akt信号通路的基因集富集分析(GSEA)。(E) qRT-PCR检测Cxcl2、Cxcl3、Cxcl6、Ccl7、Ccl19、Ccl20、Pik3ap1、Jak2、Mmp9、Mmp13、Il7、Chuk的表达(n=3)。*p<0.05,**p<0.01,***p<0.001。IL-1β表示用IL-1β处理的软骨细胞;LFDCS表示用IL-1β和LFDCS浸出液处理的软骨细胞
论文链接:https://doi.org/10.1186/s12951-025-03544-2














