皮肤作为人体最大器官,其损伤修复面临氧化应激和细菌感染两大主要障碍。过量活性氧(ROS)会引发炎症、阻碍血管生成,而细菌感染则会加剧ROS释放、破坏组织,导致伤口愈合延迟。传统水凝胶在药物控释和灵活性方面存在不足,因此亟需开发兼具ROS清除和抗菌性能的新型水凝胶贴片作为药物载体。

近期,大连市皮肤病医院朱英华团队与安徽医科大学第一附属医院丁晓亚研究员等人合作,开发出一种基于微流控电喷雾技术的核壳结构微胶囊递送系统。该系统通过负载白藜芦醇与壳聚糖,实现抗菌与清除活性氧的双重功能,在感染性伤口模型中可加速愈合、抑制炎症并促进胶原沉积与血管生成。相关研究以“Resveratrol-loaded engineered microcapsules with dual antimicrobial and ROS-scavenging for programmed wound healing”为题目,发表在期刊《Materials Today Bio》上。
本文要点:
1、本研究采用微流控电喷雾技术,先制备负载白藜芦醇(RSV)的海藻酸钠(ALG)微球,再通过壳聚糖(CS)溶液包覆并经戊二醛交联,形成RSV@ALG-CS核壳微胶囊。
2、CS水凝胶涂层可提高微胶囊稳定性,防止RSV过早泄漏。
3、在酸性环境下,CS水凝胶逐渐降解,促使RSV持续释放,增强微胶囊的抗菌性能。
4、此外,释放的RSV表现出优异的抗氧化能力,可保护细胞免受氧化应激。
5、动物实验表明,该微胶囊可加速伤口愈合、减轻氧化应激、消除细菌感染、下调炎症反应并促进胶原沉积和血管生成,在细菌感染伤口治疗中具有重要应用价值。
负载白藜芦醇工程微胶囊的材料组成
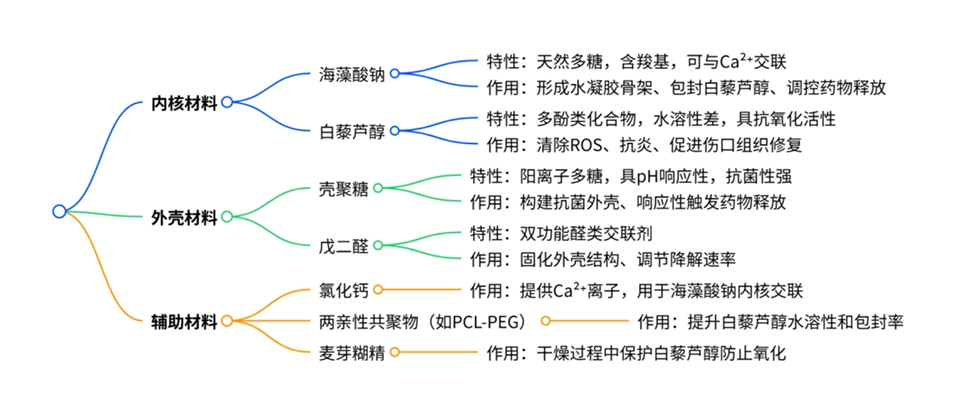
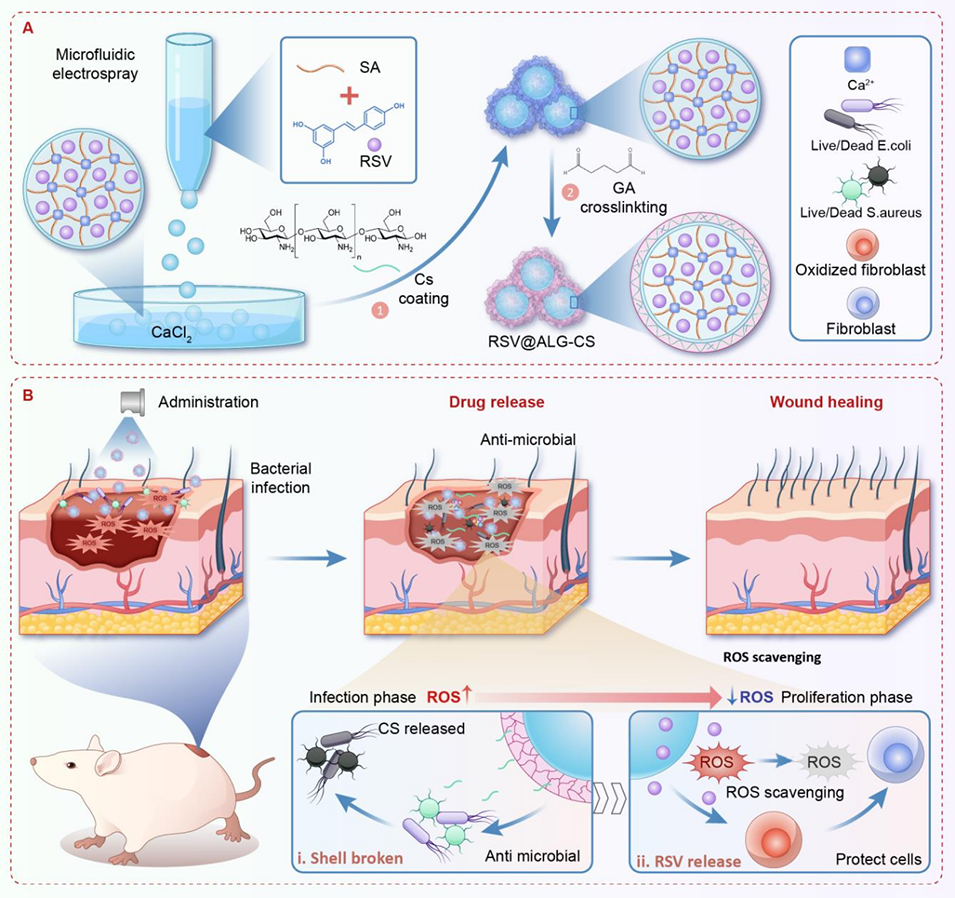
图1. RSV@ALG-CS微胶囊的制备及应用示意图。a) RSV@ALG-CS微胶囊的制备流程:首先通过微流控电喷雾技术制备ALG微粒子,随后进行CS包覆并形成CS水凝胶壳层。b)所制备的RSV@ALG-CS微胶囊通过CS层的抗感染作用及释放RSV的ROS清除功能,直接应用于大鼠全层皮肤伤口的治疗。
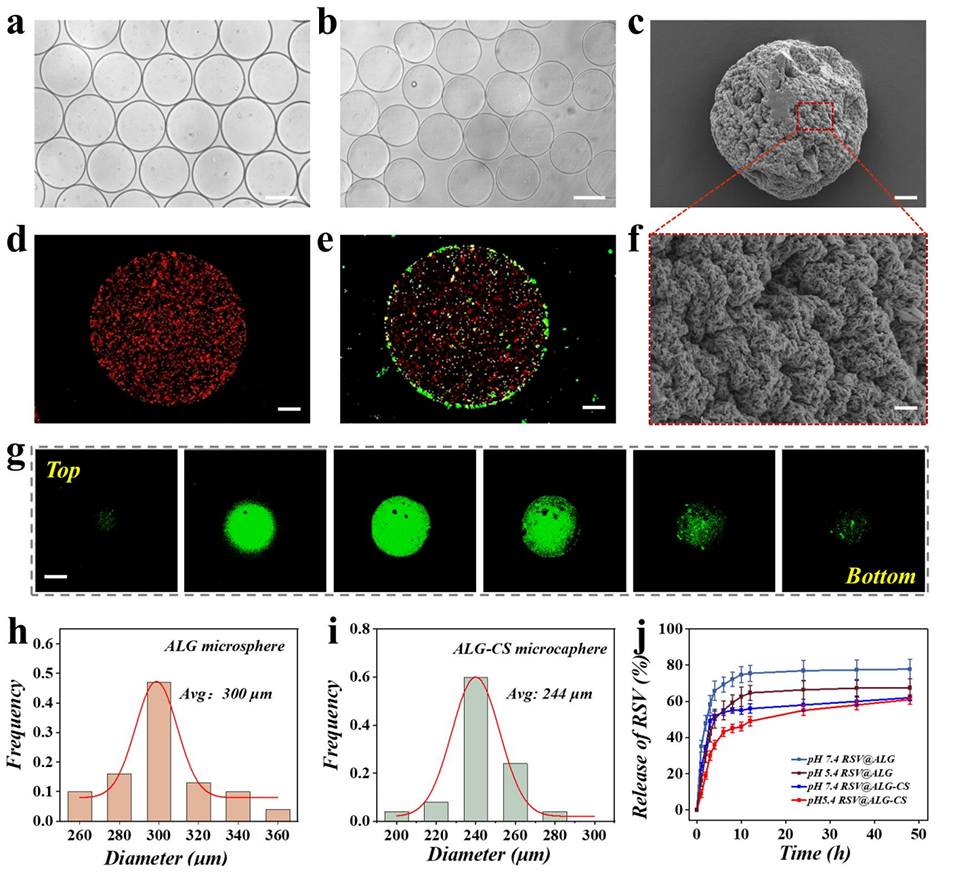
图2.a) ALG微球的光学显微镜照片。b) ALG-CS微胶囊的光学显微镜照片。c) ALG-CS微胶囊的扫描电镜(SEM)照片。d, e) ALG和ALG-CS微球的荧光照片。f)冻干ALG-CS微胶囊的放大视图。g)单个ALG-CS微胶囊从顶部到底部的荧光图像。h, i) ALG和ALG-CS微胶囊的粒径分布。j) RSV@ALG和RSV@ALG-CS微胶囊在不同pH条件下的体外RSV释放曲线。比例尺:a)和b)为200μm,c)、d)和e)为40μm,f)为5μm,g)为100μm。
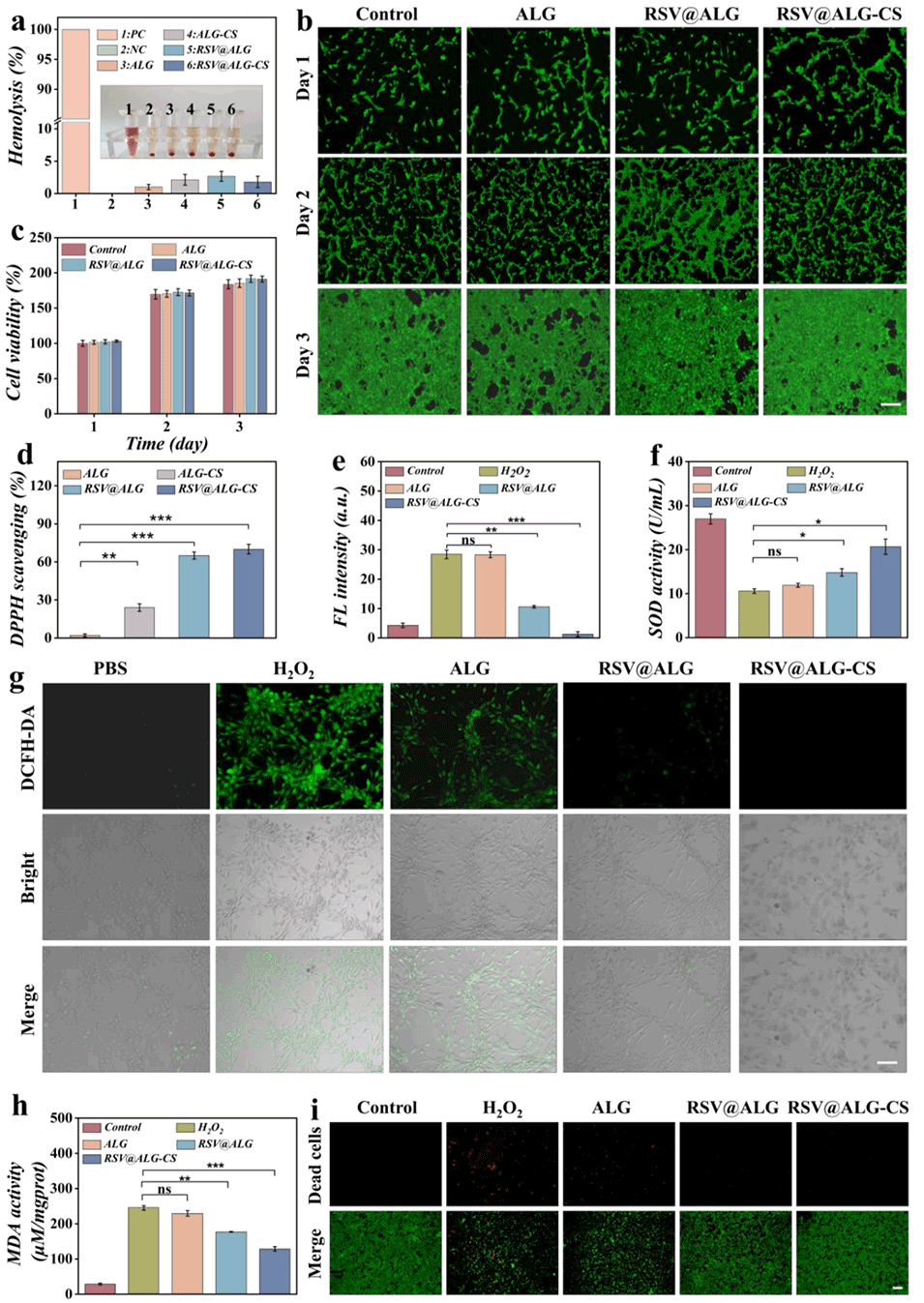
图3.a)不同微胶囊的溶血活性。b)不同微胶囊处理NIH3T3细胞1、2、3天后的荧光图像。c)不同微胶囊处理NIH3T3细胞1、2、3天后的CCK-8检测结果。d)不同微胶囊的DPPH自由基清除率结果。e) NIH3T3细胞内H2O2消耗的定量分析。f)不同微胶囊处理后细胞中的超氧化物歧化酶(SOD)活性。g)不同微胶囊处理NIH3T3细胞后的荧光图像。h)不同微胶囊处理后细胞中的丙二醛(MDA)活性。i) RSV@ALG-CS微胶囊在ROS环境下对NIH3T3细胞的保护作用。比例尺:b)、g)和i)为100μm。
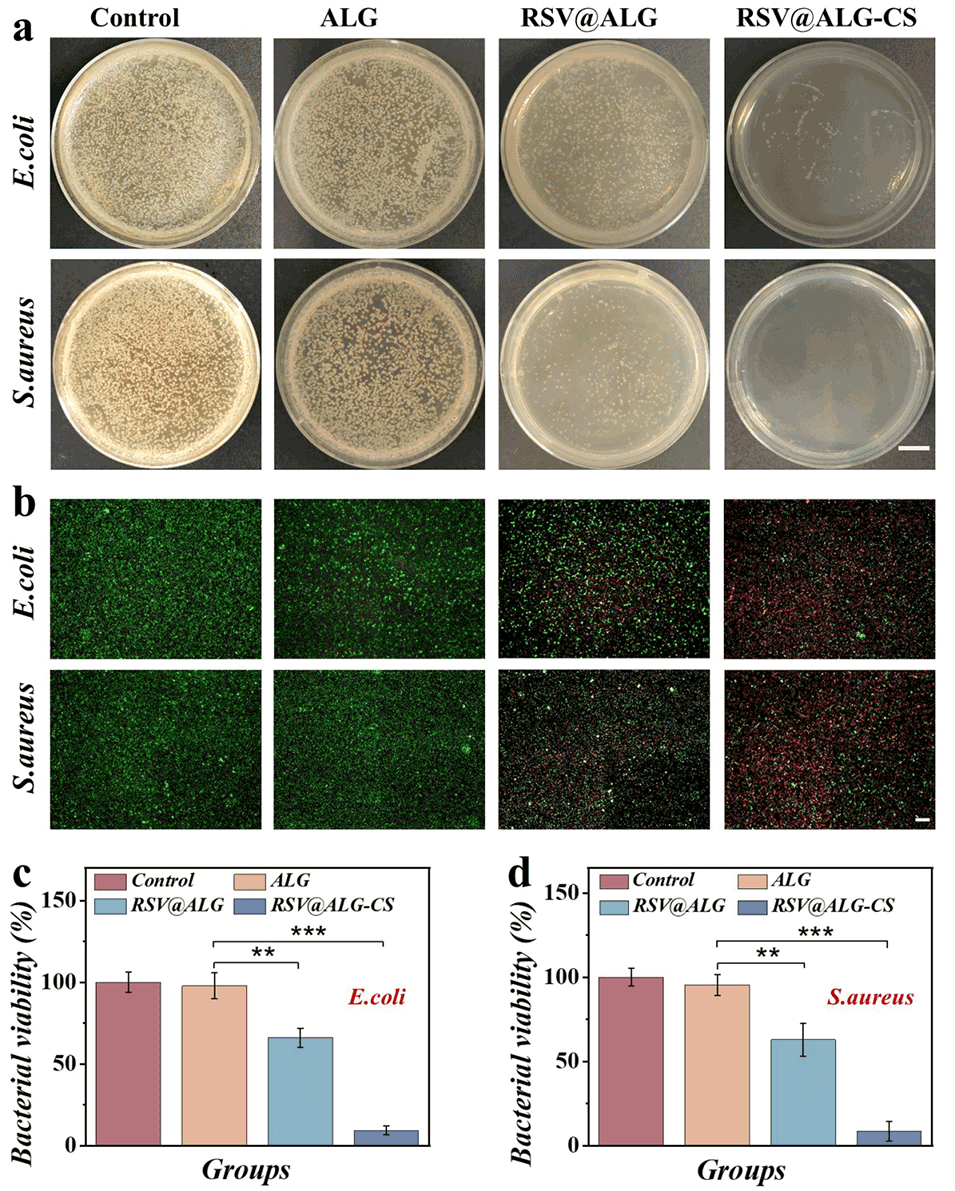
图4. RSV@ALG-CS微胶囊的抗菌功效。a) ALG、RSV@ALG和RSV@ALG-CS微胶囊与金黄色葡萄球菌和大肠杆菌共培养后,琼脂平板上的菌落图像。b)与ALG、RSV@ALG和RSV@ALG-CS微胶囊共培养的细菌活/死染色结果。c, d)与ALG、RSV@ALG和RSV@ALG-CS微胶囊共培养的大肠杆菌和金黄色葡萄球菌的相对存活率分析。比例尺:a)为1cm,b)为50μm。
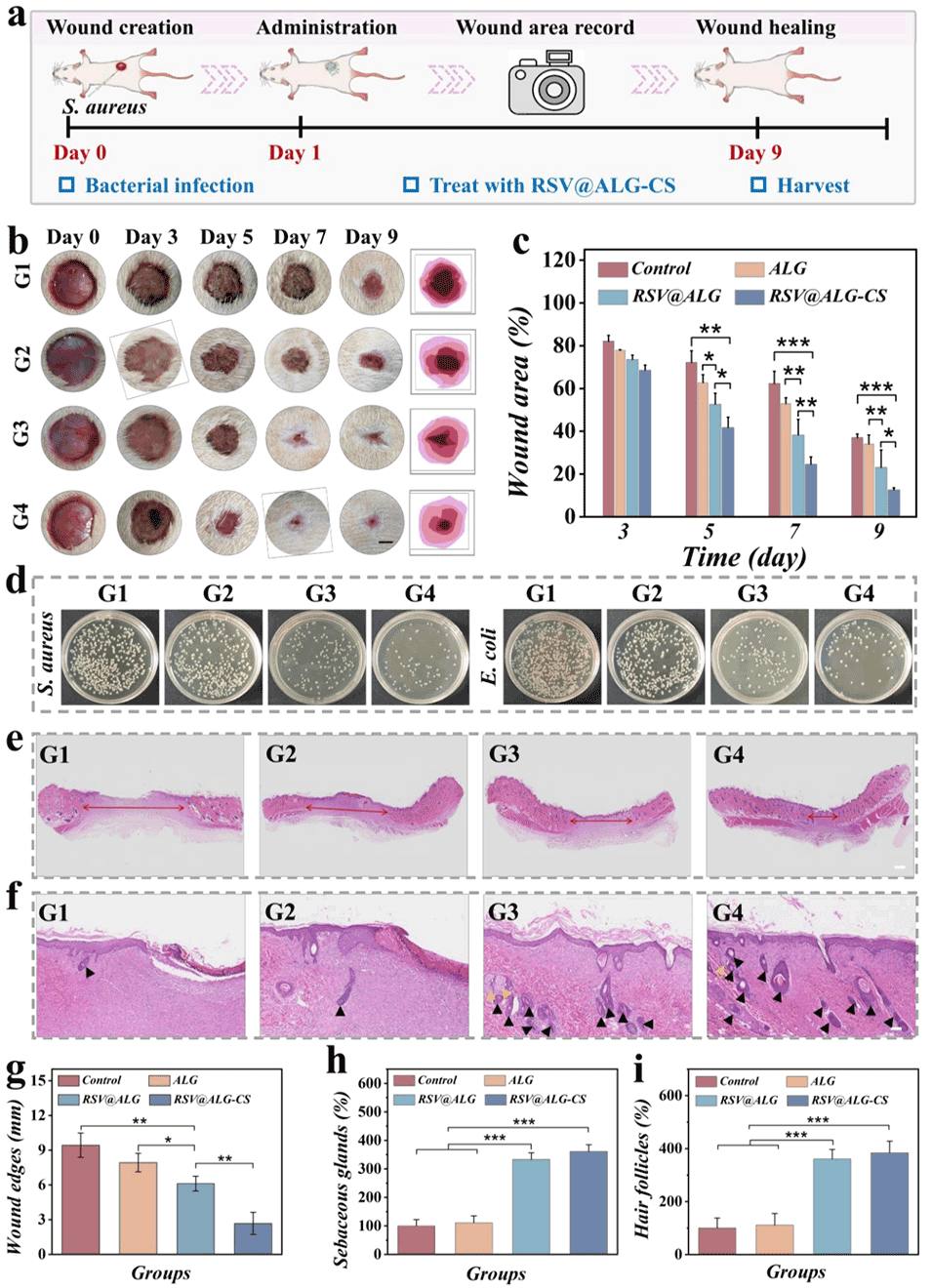
图5.a)伤口处理流程示意图。b)各组在第3、5、7、9天的代表性伤口数码图像及轮廓。比例尺:500μm。c)各组伤口面积的定量分析。d) ALG、RSV@ALG和RSV@ALG-CS微胶囊处理后,金黄色葡萄球菌和大肠杆菌在琼脂平板上的菌落图像。e)第9天不同处理组伤口的苏木精-伊红(H&E)染色。比例尺:1mm。f)第9天放大的H&E图像,显示生成的皮脂腺和毛囊。比例尺:100μm。黑色和黄色三角形分别表示毛囊和皮脂腺。g)第9天不同处理组伤口边缘的定量分析。h, i)第9天不同处理组皮脂腺和毛囊的定量分析。
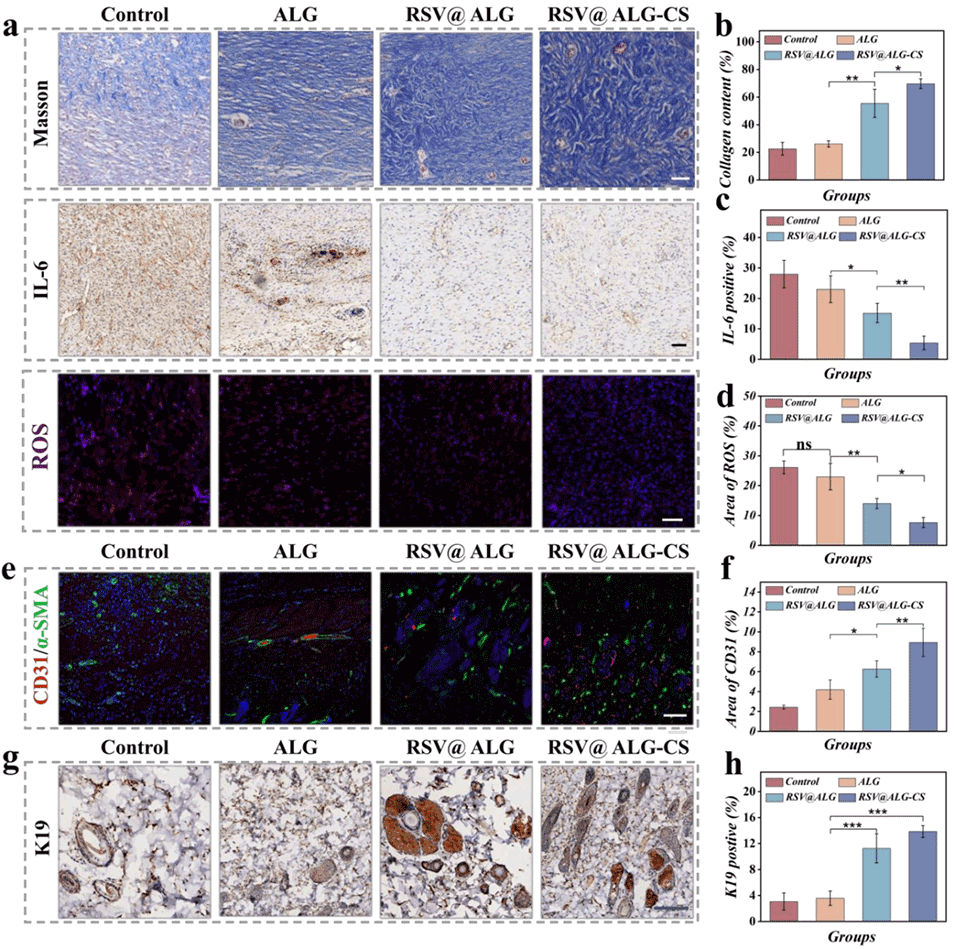
图6. a)第9天不同处理伤口的Masson三色染色、IL-6免疫组织化学染色和ROS免疫荧光染色。b)第9天不同处理伤口的胶原含量(%)。c, d)第9天不同处理后IL-6和ROS含量的定量分析。e)第9天不同处理伤口的CD31(红色)/α-SMA(绿色)双重免疫荧光染色。f)第9天不同处理后CD31含量的定量分析。g,h)第9天不同处理伤口的K19免疫组织化学染色及定量分析。比例尺:a)为50μm,e)和g)为100μm。
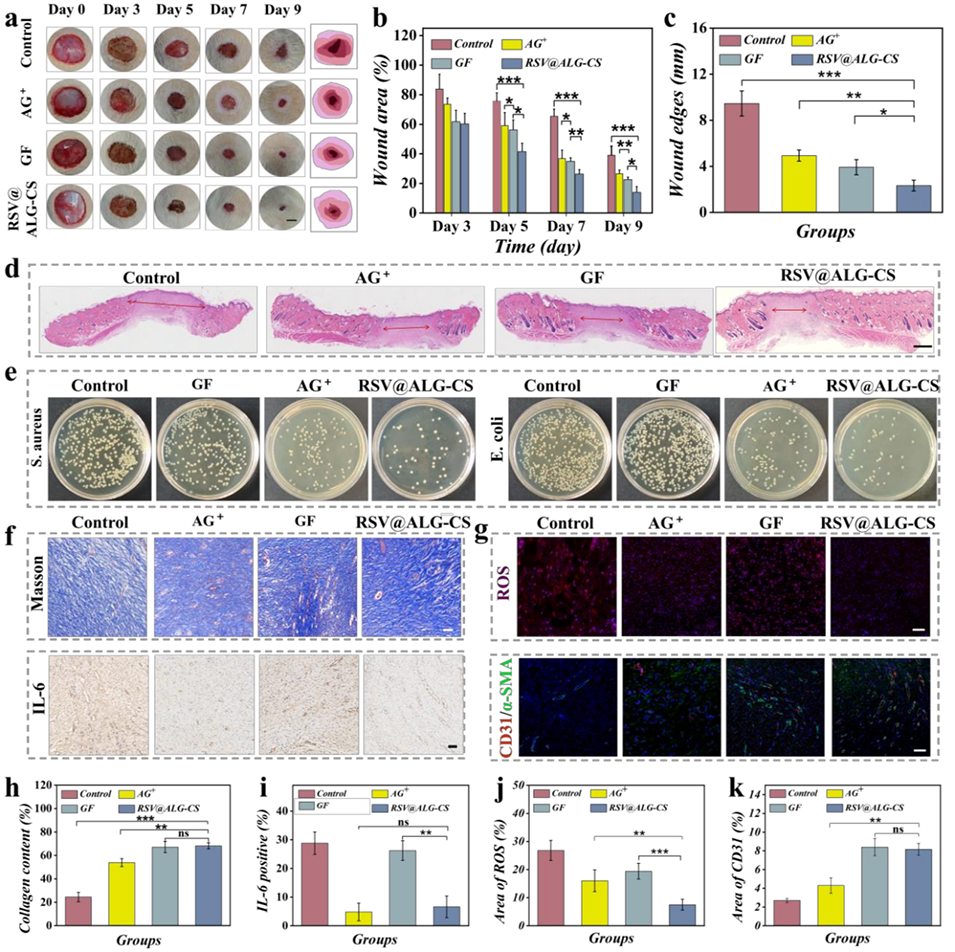
图7. a)各组在第3、5、7、9天的代表性伤口数码图像及轮廓。比例尺:500μm。b)各组伤口面积的定量分析。c)第9天不同处理组伤口边缘的定量分析。d)第9天不同处理伤口的H&E染色。比例尺:1mm。e)与生长因子(GF)、AG+和RSV@ALG-CS微胶囊共培养的金黄色葡萄球菌和大肠杆菌在琼脂平板上的菌落图像。f)第9天不同处理伤口的Masson三色染色和IL-6免疫组织化学染色。比例尺:50μm。g)第9天不同处理伤口的ROS和CD31(红色)/α-SMA(绿色)免疫荧光染色。比例尺:50μm。h)第9天不同处理伤口的胶原含量(%)。i, j, k)第9天不同处理后IL-6、ROS和CD31含量的定量分析。
论文链接:https://doi.org/10.1016/j.mtbio.2025.102007














