脂质体作为经典的囊泡状药物递送系统,因与人体细胞膜结构相似,具备良好的生物相容性和屏障穿透能力,但传统脂质体存在理化稳定性差、药物易渗漏、循环半衰期短及靶向特异性不足等临床局限。
细胞膜仿生纳米粒(CM-BNPs)凭借源细胞天然的生物相容性、免疫逃逸能力及靶向归巢效应,成为靶向递送平台的理想选择,有效弥补了传统脂质体的缺陷。然而,单细胞膜纳米囊泡功能单一,挤出法、超声法等传统制备方法存在效率低、产物均一性差、膜蛋白易失活等问题,限制了其应用。
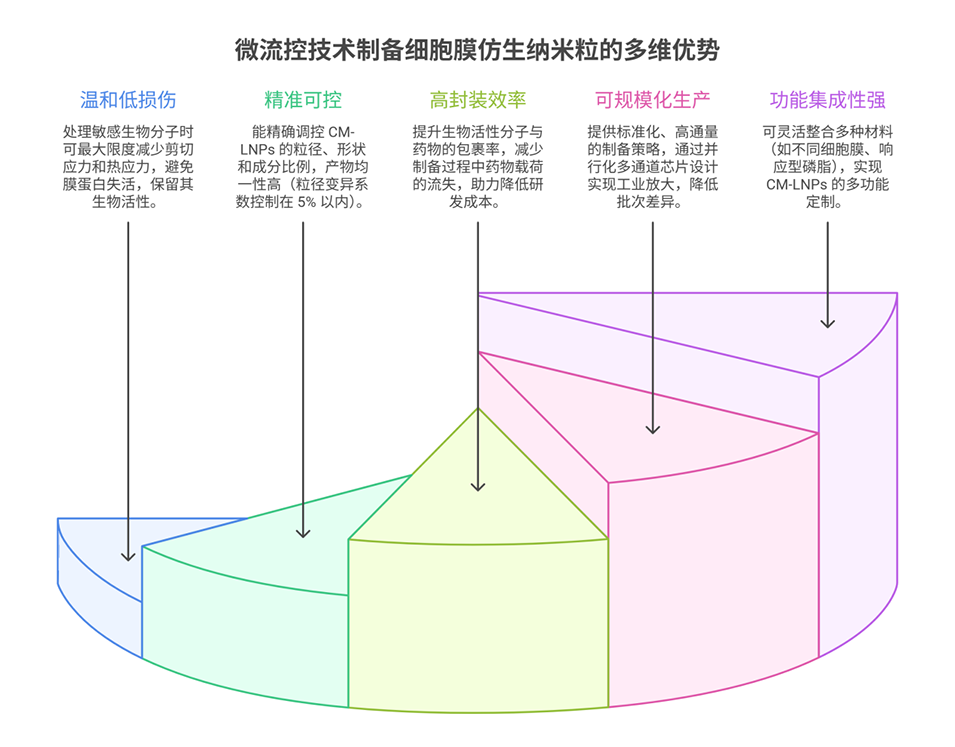
为进一步提升载体的多功能性与制备精准性,细胞膜杂化脂质纳米粒(CM-LNPs)应运而生,其融合天然细胞膜的生物特性与合成磷脂的工程可调性,而微流控技术的发展为CM-LNPs的高效、规模化精准制备提供了新路径,推动该领域向临床转化迈进。

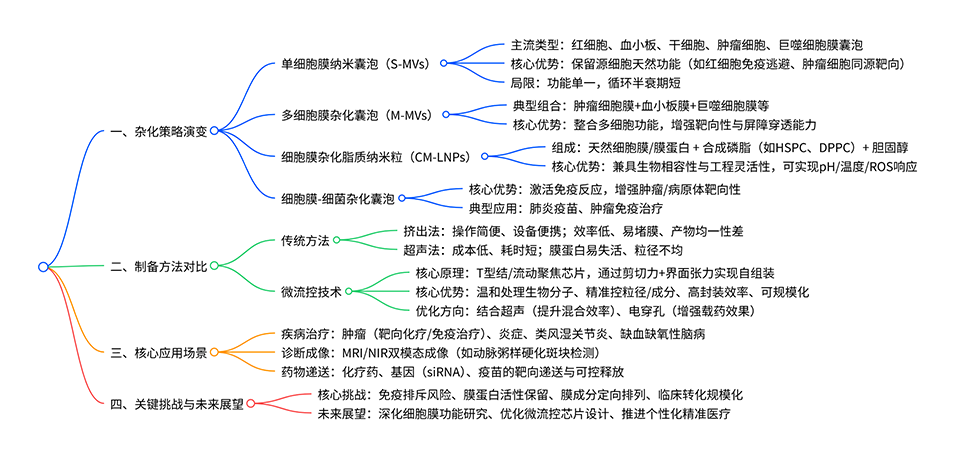
近期,东南大学生物科学与医学工程学院黄宁平教授发表综述,系统回顾了细胞膜仿生纳米颗粒的发展历程,从单细胞膜纳米囊泡、多种细胞膜杂化纳米囊泡逐步演进至细胞膜杂化脂质纳米颗粒(CM-LNPs),这种技术革新实现了天然细胞生物功能与合成材料优良特性的协同融合。文章还对比了传统挤出法和超声法的优缺点,强调了微流控技术在精准制备、低损伤、规模化等方面的显著优势,同时探讨了CM-LNPs在生物医学领域的应用前景与技术挑战。相关研究成果以“Engineering revolution of cell membrane-biomimetic nanoparticles: from hybridization strategy innovation to microfluidics-enabled precision fabrication”为题目,发表在期刊《Science China Materials》上。
本文要点:
1、随着生物纳米材料技术的不断发展,仿生纳米载体的设计和制造策略也经历着重大的转型和创新。本文系统回顾了从单细胞膜纳米囊泡到多种细胞膜杂化纳米囊泡,再到天然细胞膜或膜蛋白与工程化合成磷脂组成的细胞膜杂化脂质纳米粒的演变过程。
2、这一技术的进步使多种细胞的生物功能得以保留,同时又融入了合成材料的一些优良特性,增强了工程化改造的灵活性和表面可修饰性。
3、最后,对比了传统挤出法和超声法在细胞膜纳米囊泡制备中的优缺点,强调了新型微流控技术在细胞膜杂化脂质纳米粒制备中的优势和发展前景,并探讨了这类脂质纳米粒在生物医学领域未来的应用前景和挑战。
一张图读懂全文:
如何实现细胞膜杂化纳米粒中膜蛋白功能的精准保留与调控,以增强其靶向性与生物安全性?
膜蛋白是细胞膜功能的主要执行者,其在CM-LNPs中的保留与定向排列直接影响靶向性、免疫逃逸和生物安全性。目前可采取以下策略:
1、膜蛋白提取与修饰技术优化:
采用温和的膜蛋白提取方法(如去垢剂辅助提取),避免蛋白变性。
通过基因工程手段在膜蛋白上引入定向标签(如His标签、荧光蛋白),便于在组装过程中控制其朝向。
2、组装过程的定向控制:
利用微流控技术中的界面自组装原理,通过调节两相流体的界面张力,引导膜蛋白在磷脂双层中定向排列。
结合仿生膜重构技术,在膜蛋白周围构建局部磷脂环境,模拟其天然构象。
3、功能验证与安全性评估:
通过蛋白质组学、荧光共定位等技术确认膜蛋白的保留情况与取向。
在体内外模型中系统评估其靶向效率、免疫原性和毒性,确保其生物安全性。
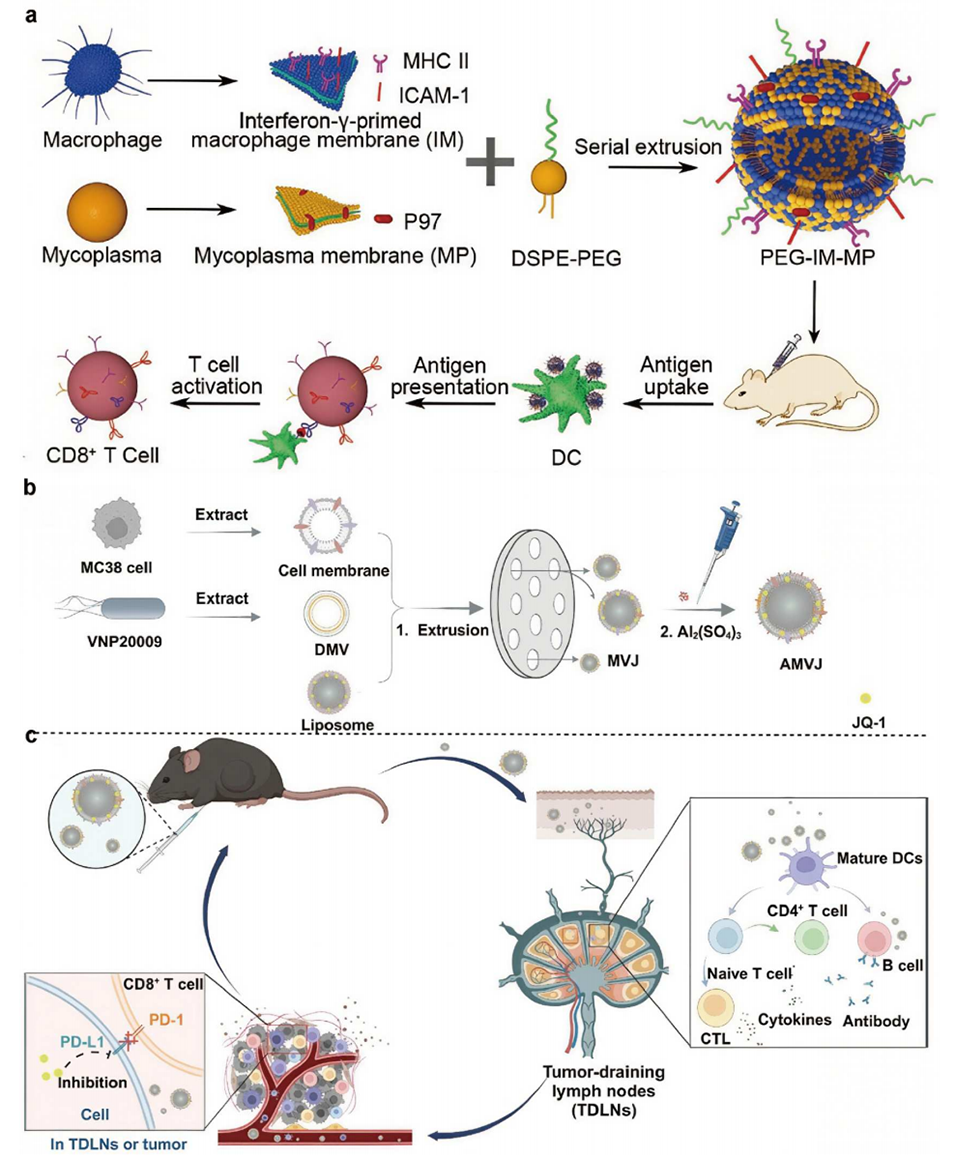
图1 细胞膜-细菌纳米囊泡的制备及其在肿瘤治疗中的应用

图2 膜蛋白与磷脂构建的弹性蛋白酶修饰仿生脂质体用于增强肿瘤化学免疫治疗的示意图
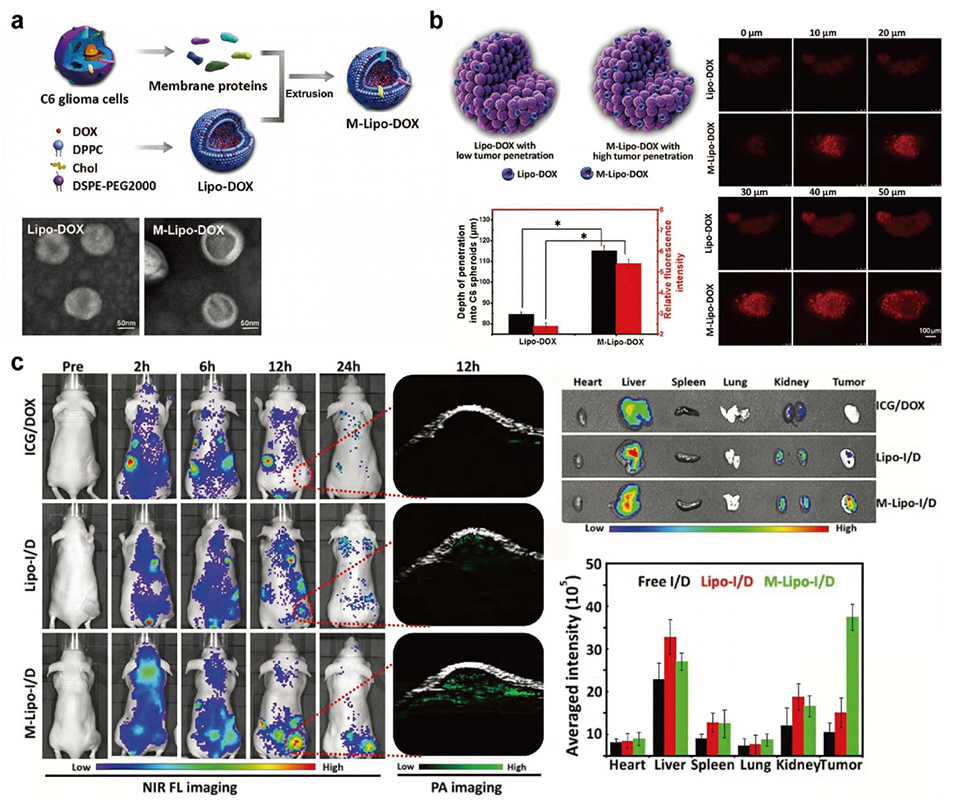
图3 C6 细胞膜杂化脂质纳米粒的制备及其在肿瘤治疗中的应用
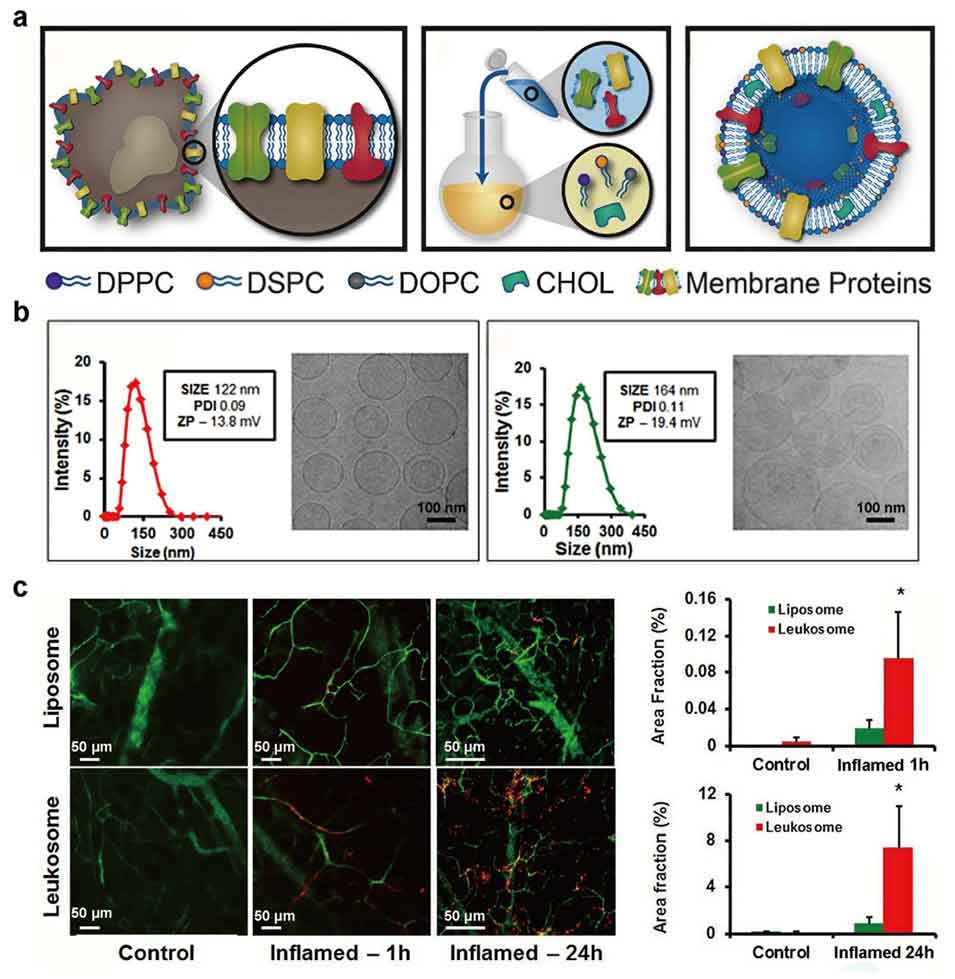
图4 白细胞质膜杂化脂质纳米粒的研发及其在靶向炎症治疗中的应用
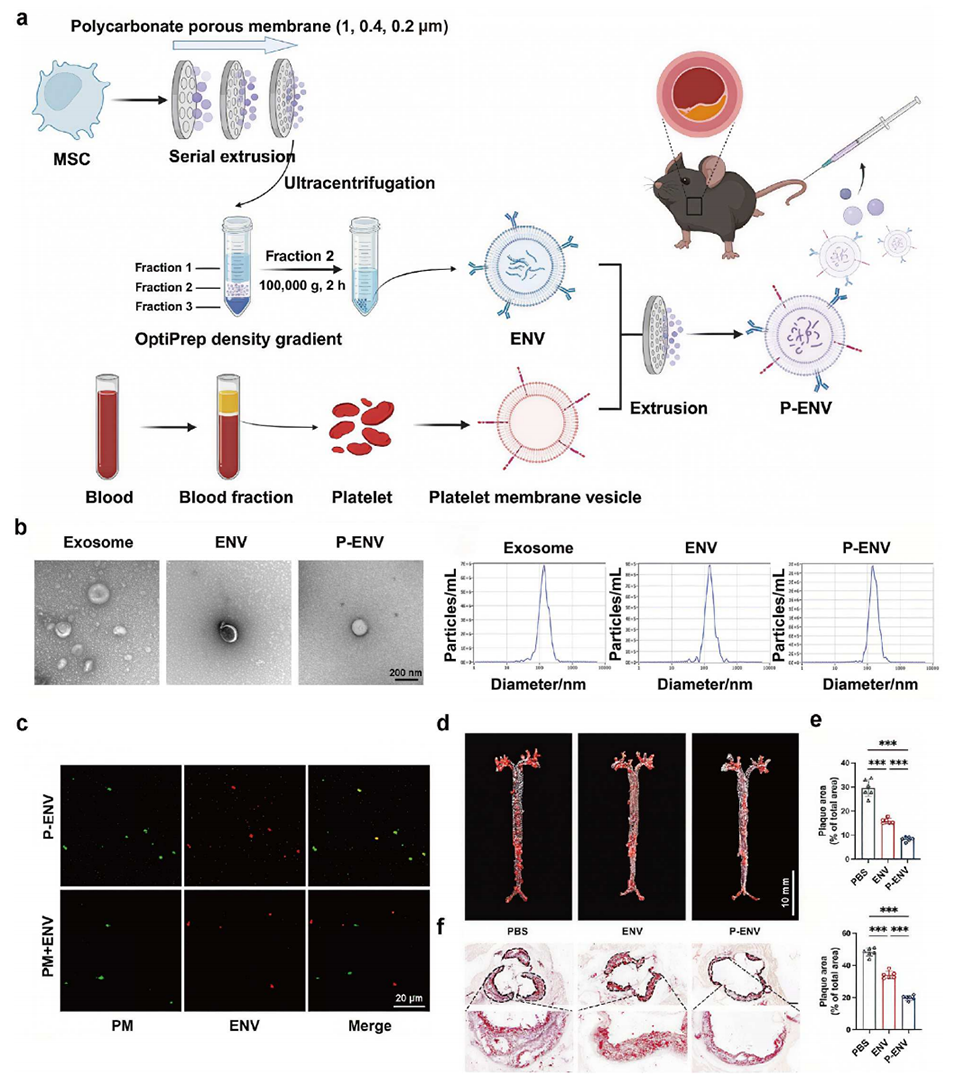
图5 挤出法制备 P-ENVs(血小板膜包被外泌体模拟纳米囊泡)及其在动脉粥样硬化治疗中的靶向递药作用
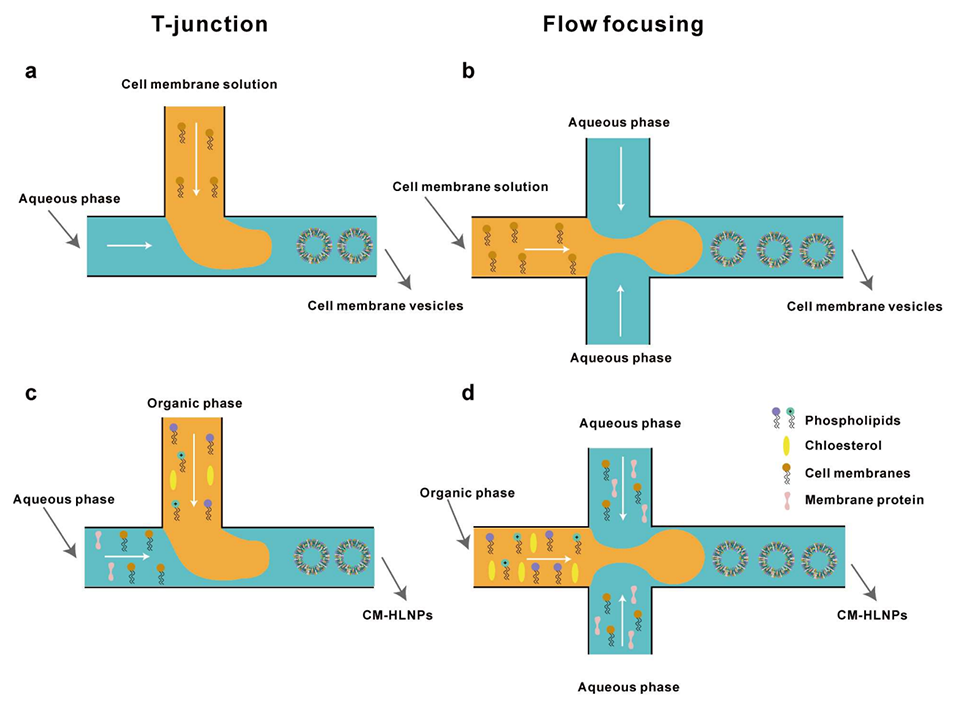
图6 基于微流控技术制备细胞膜囊泡与细胞膜杂化脂质纳米粒(CM-HLNPs)的通用策略
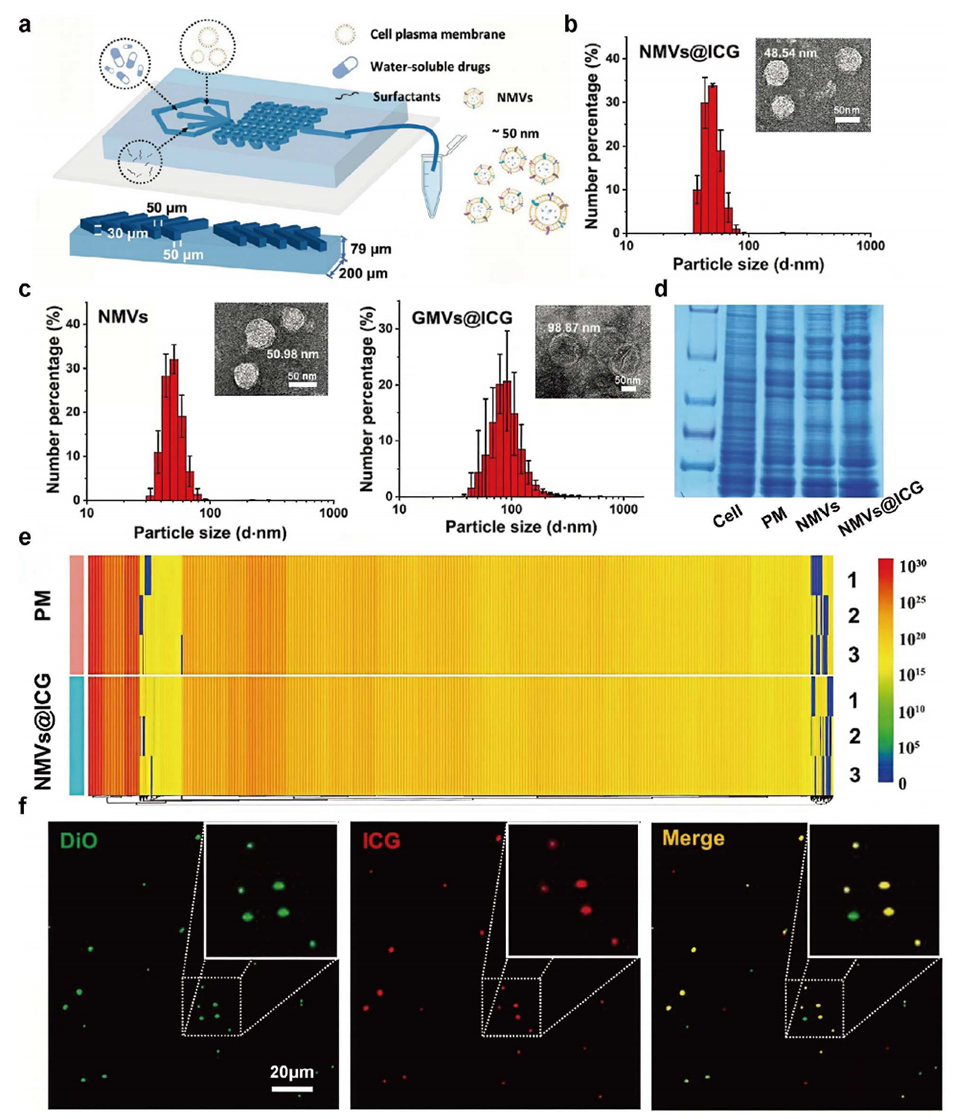
图7 基于微流控技术制备纳米级巨噬细胞囊泡的工艺
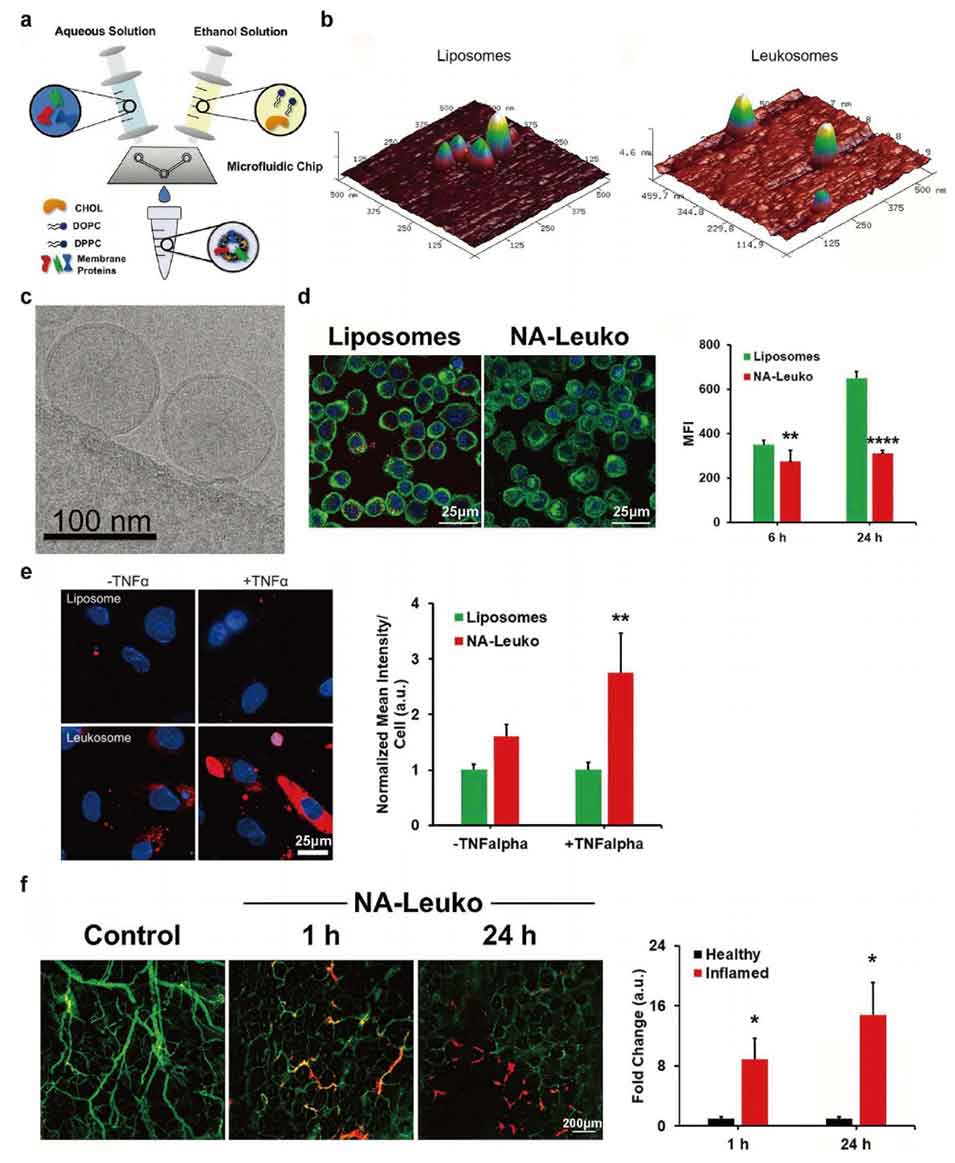
图8 基于微流控技术制备白细胞膜蛋白杂化脂质纳米粒的方法
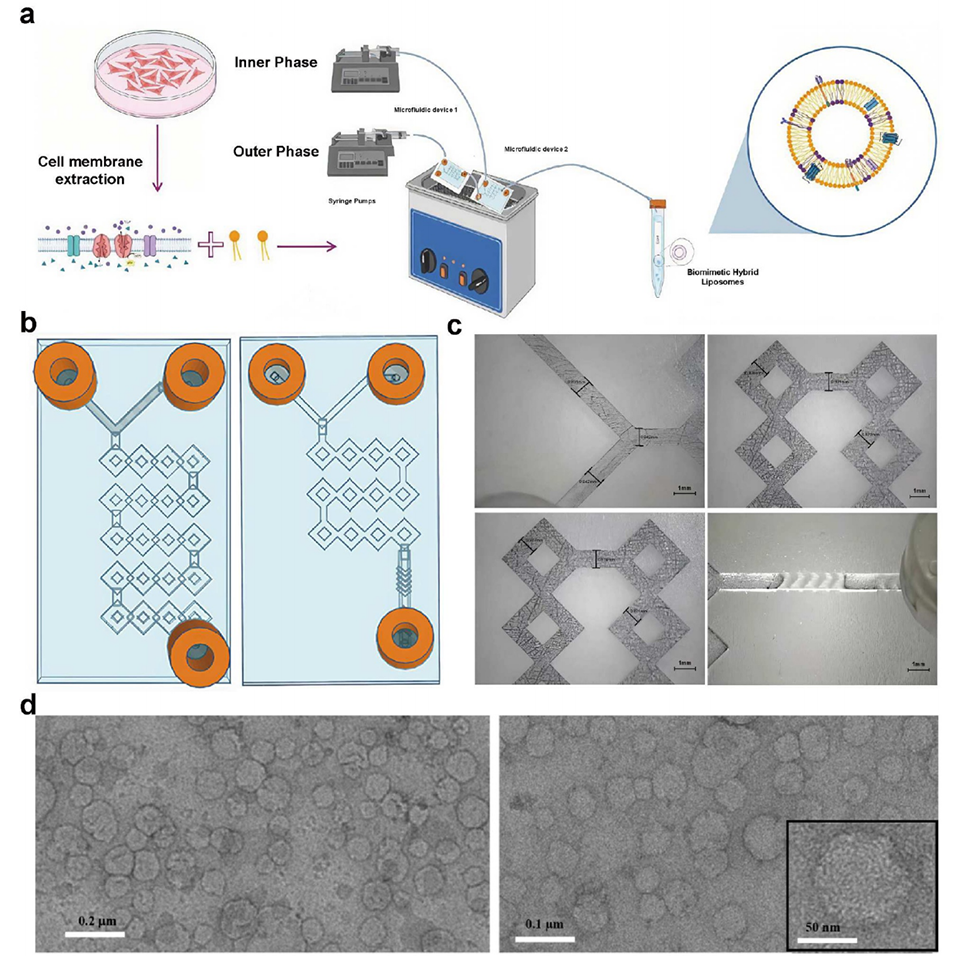
图9 微流控-超声联用制备 U-87 MG 细胞膜仿生脂质体的流程
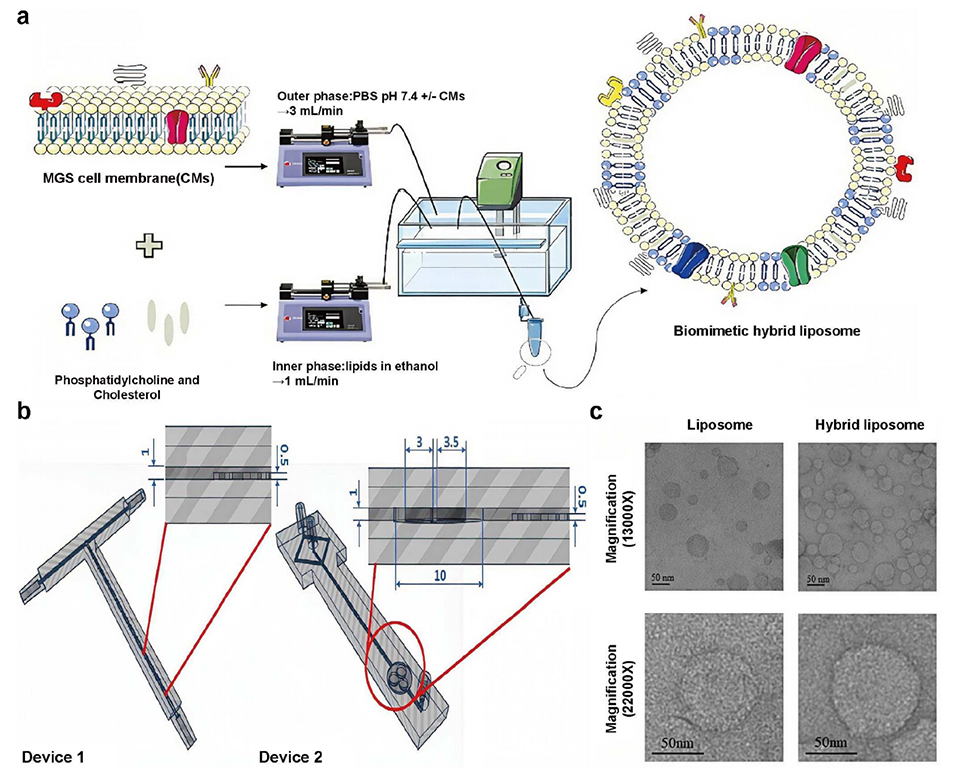
图10 微流控-超声联用制备黑色素瘤细胞膜杂化脂质纳米粒的方案
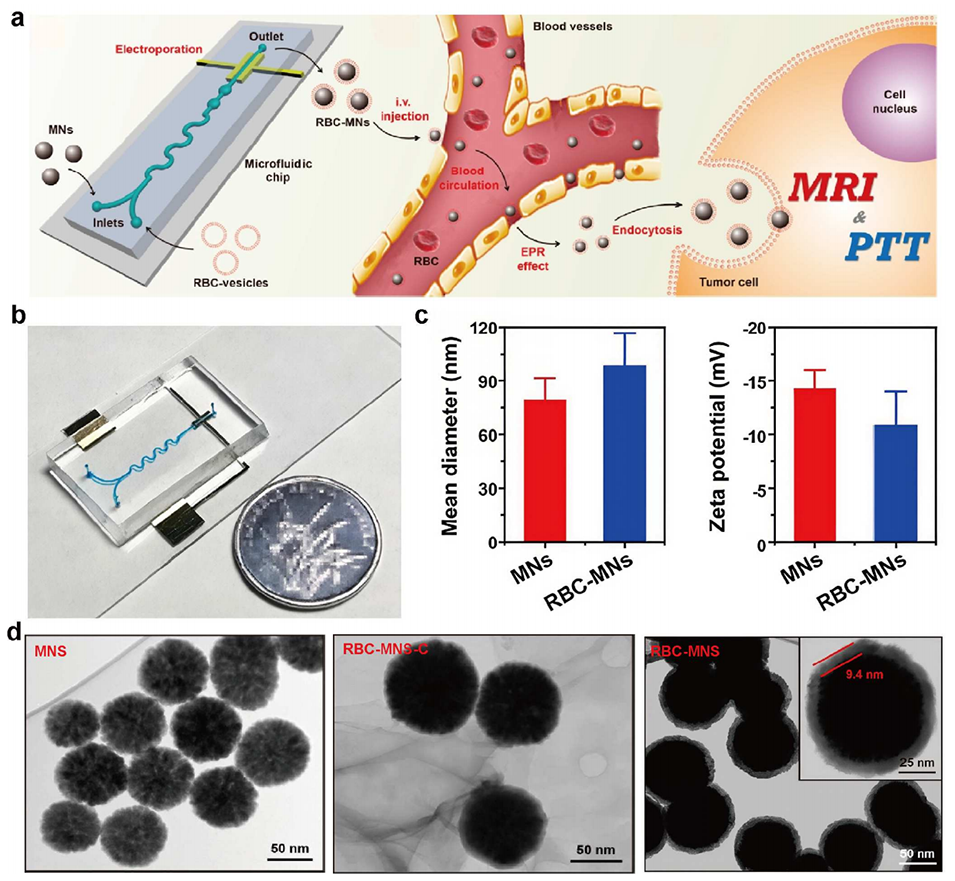
图11 微流控-电穿孔联用制备红细胞膜纳米粒的技术
论文链接:https://doi.org/10.1007/s40843-025-3740-y
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














