核壳颗粒因其能够在空间上将药物核心与保护壳分离,从而提升封装效率、保护敏感治疗药物以及精确控制释放动力学,成为一种很有前途的药物递送平台。

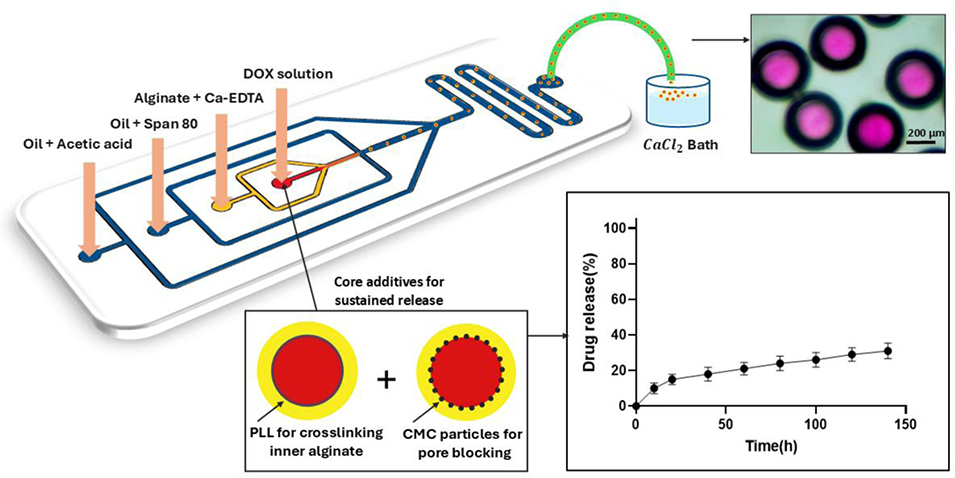
为解决传统化疗药物阿霉素临床应用中副作用显著、释放不可控的问题,近期,谢里夫理工大学研究人员基于微流控技术制备了一种可调水核-海藻酸盐壳微粒,用于实现抗癌药阿霉素的持续封装与释放。该研究通过优化各相流速、装置交汇口宽度、壳层组成,并引入羧甲基纤维素颗粒与ε-聚L-赖氨酸协同增强药物滞留,使包封率提升至92%以上,释放时间延长至超过120小时。相关研究以“Tunable Core Water–Shell Alginate Microparticles Produced by Microfluidics for Sustained Doxorubicin Encapsulation and Release”为题目,发表在期刊《Carbohydrate Polymer Technologies and Applications》上。
本文要点:
1、该研究旨在开发一种基于微流控技术的核壳结构海藻酸盐微颗粒,用于阿霉素(DOX)的缓释递送。
2、通过优化微流控装置参数(如通道宽度、各相流速)、壳层溶液组成(海藻酸盐与Ca-EDTA浓度),成功制备出单分散性良好的水核-海藻酸盐壳微颗粒(直径350±21μm,壳厚43±3μm)。
3、为提升药物包封效率和延长释放时间,研究在核相加入羧甲基纤维素(CMC)颗粒和ε-聚L-赖氨酸(ε-PLL),构建互穿网络与静电复合物,使包封效率从约67%提升至92%以上,释放时长延长至120小时以上。
4、体外细胞实验表明,该载体对乳腺癌细胞(MCF7)具有可预测的持续细胞毒性,且能降低药物副作用。
5、动力学分析显示,无添加剂时药物释放为非菲克扩散(扩散与基质侵蚀共同作用),加入添加剂后转为菲克扩散主导。该系统可精准调控结构与释放特性,为个性化化疗递送提供了可行平台。
本研究设计的流动聚焦微流控装置通过多单元协同作用实现核壳微颗粒的精准制备,核心功能区域的作用如下:
交叉通道接口(3个):第一个用于核相(水相)与壳相(海藻酸盐+Ca-EDTA溶液)形成平行流动的核壳型流体流;第二个用于连续相(矿物油+Span80)剪切核壳流,生成核壳液滴;第三个用于注入交联剂相(矿物油+Span80+乙酸),触发Ca²⁺释放并实现壳层原位凝胶化。
蛇形通道:为酸渗透提供充足时间,确保壳层凝胶化均匀,避免因酸扩散不充分导致的凝胶结构缺陷,保障核壳颗粒形态稳定性。
为解决海藻酸盐壳层孔隙较大(5-200nm)导致的药物保留率低、释放过快问题,本研究通过在核相添加羧甲基纤维素(CMC)颗粒和ε-聚-L-赖氨酸(ε-PLL)构建双重调控体系,其具体作用如下:
CMC颗粒的作用:通过乙二醇二缩水甘油醚(EGDE)交联后,干燥态直径435±20nm,水合后膨胀至1143±31nm,可物理封堵海藻酸盐壳层的5-200nm孔隙,减少药物分子渗透;同时与海藻酸盐相互作用,降低孔隙连通性,强化水凝胶基质结构。
ε-PLL的作用:作为聚阳离子聚合物,通过胺-羧基相互作用与海藻酸盐的古洛糖醛酸(G-block)形成静电复合物,缩小壳层孔隙尺寸、增强机械稳定性;同时促进壳层内层凝胶化,解决外层凝胶化后Ca²⁺难以渗透至内层导致的交联不充分问题,减少药物泄漏。
两者共同作用使药物包封效率从2±1%提升至92.3±1.5%,并将释放时长从6小时延长至120小时以上,释放机制从非菲克扩散转变为更可控的菲克扩散。
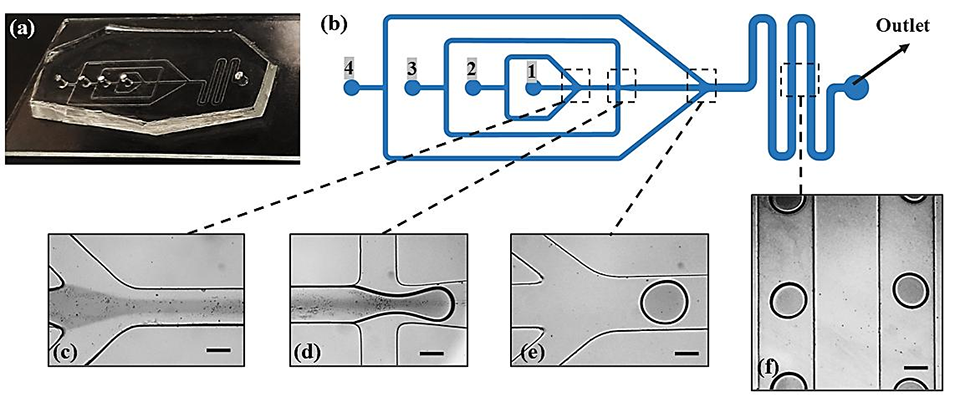
图1.(a)用于制备核壳型微胶囊的微流控装置示意图。(b)流动聚焦装置的结构示意图:入口 1 注入含液体食用色素的去离子水,入口 2 注入不同浓度海藻酸钠与 Ca-EDTA 组成的壳溶液,入口 3 注入含 3 wt% 司盘 80 的矿物油,入口 4 注入含 3 wt% 司盘 80 与 1%(v/v)乙酸的矿物油。(c)第一个交汇口,用于形成核壳型流体。(d)液滴生成单元。(e)第三个交汇口,用于原位交联。(f)酸渗透稳定段。比例尺为 200 µm。
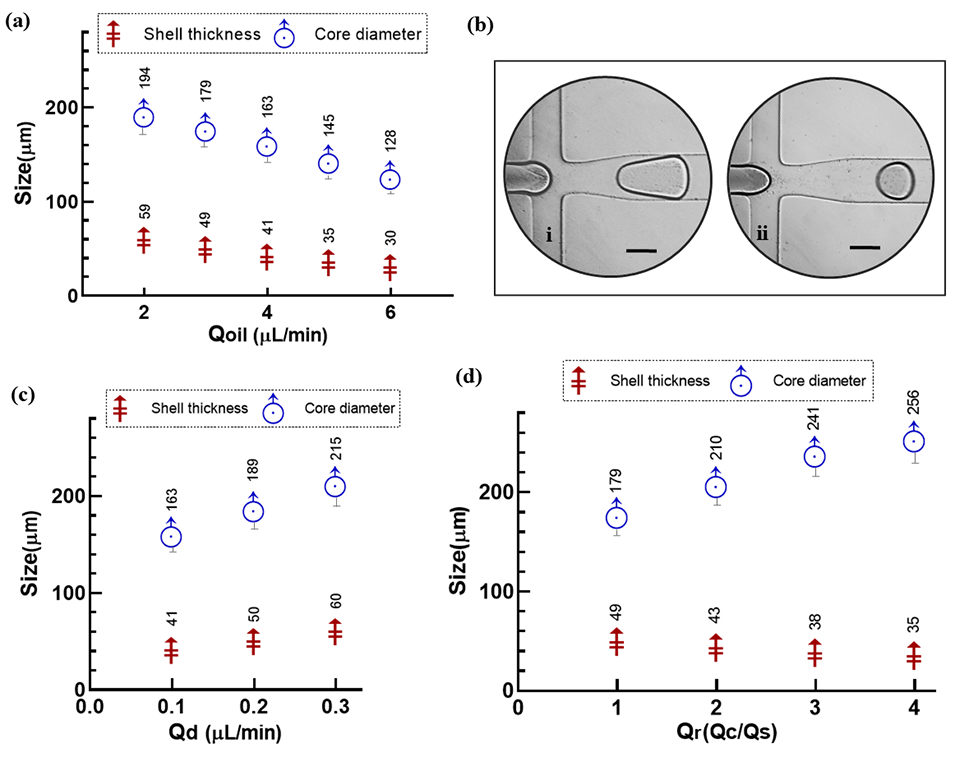
图2.(a)在壳相和核相流速均为 0.1 μL/min 时,油相流速对壳厚度和核直径的影响。(b)壳相和核相流速均为 0.3 μL/min 时的核壳颗粒形成情况:(i)油相流速 = 3 μL/min;(ii)油相流速 = 4 μL/min。比例尺为 150 µm。(c)油相流速 = 4 μL/min 时,分散相流速对壳厚度和核直径的影响。(d)壳相流速 = 0.1 μL/min、油相流速 = 3 μL/min 时,核相流速对核尺寸和壳尺寸的影响。误差线代表测量值的标准差;壳厚度的标准差过小,在图中无法直观区分。
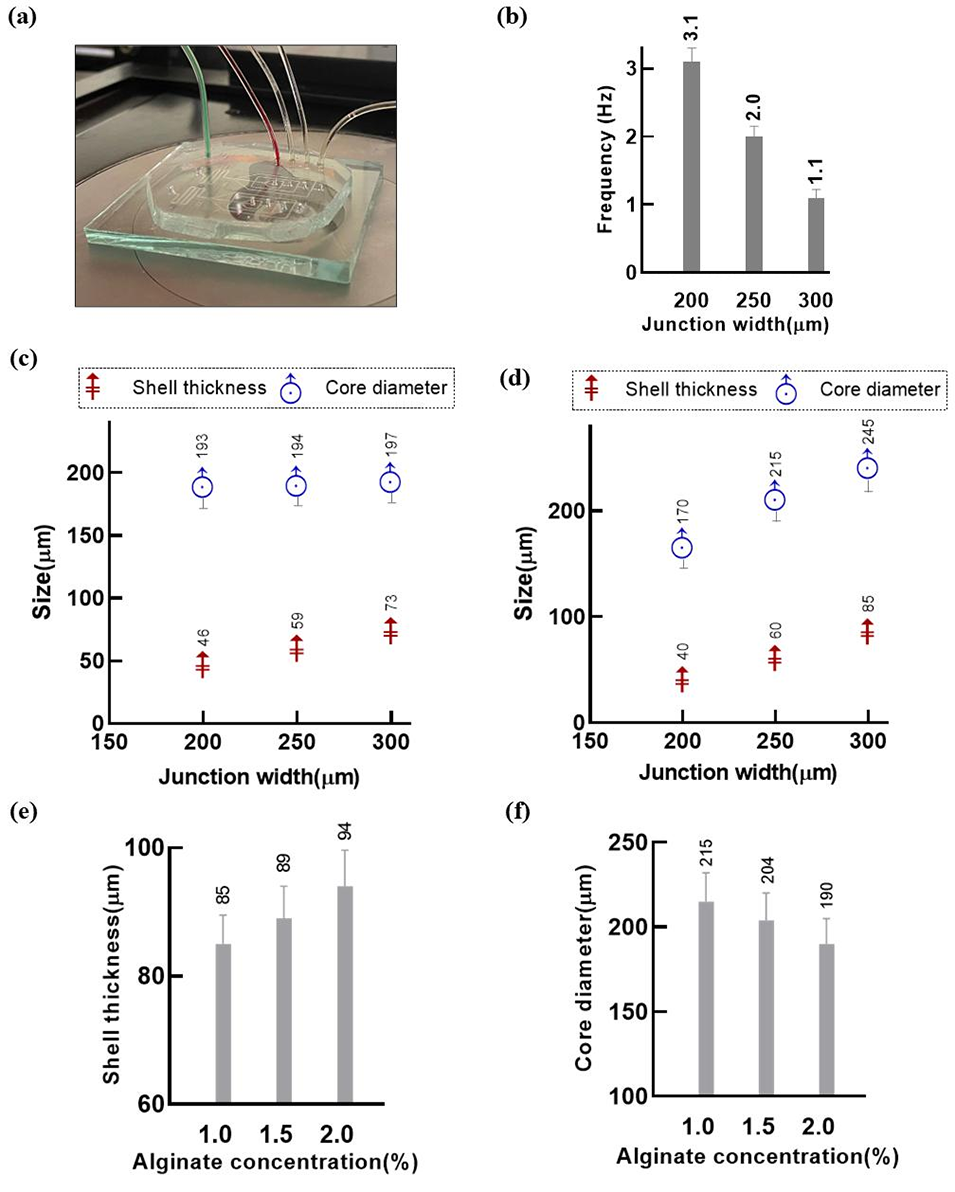
图3.(a)不同交汇口宽度的流动聚焦装置。(b)壳相流速 = 0.1 μL/min、核相流速 = 0.4 μL/min、油相流速 = 3 μL/min 时,核壳颗粒的生成频率。(c)壳相和核相流速均为 0.1 μL/min、油相流速 = 2 μL/min 时,不同装置的壳厚度和核直径对比。(d)壳相和核相流速均为 0.3 μL/min、油相流速 = 4 μL/min 时,不同装置的壳厚度和核直径对比。误差线代表标准差;壳厚度的标准差过小,在图中无法直观区分。(e)(f)在交汇口宽度为 300 µm、壳相和核相流速均为 0.3 μL/min、油相流速 = 4 μL/min 时,海藻酸盐浓度对壳厚度(e)和核直径(f)的影响。误差线代表标准差。
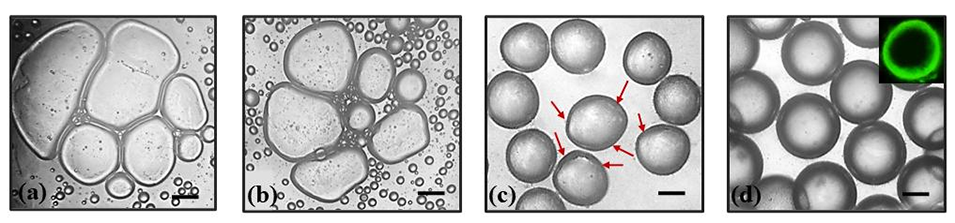
图4. 不同壳溶液组成制备的核壳微凝胶形态:(a)1%(w/v)海藻酸钠 + 1%(w/v)Ca-EDTA;(b)2%(w/v)海藻酸钠 + 1%(w/v)Ca-EDTA,两者均出现微凝胶融合或坍塌现象。(c)1%(w/v)海藻酸钠 + 2%(w/v)Ca-EDTA,部分微凝胶发生变形(红色箭头标注变形区域)。(d)2%(w/v)海藻酸钠 + 2%(w/v)Ca-EDTA,形成高度单分散且球形度优良的液滴,激光共聚焦显微镜下可清晰观察到经荧光素染色的壳层。比例尺为 150 µm。所有条件下的流速保持一致:壳相和核相流速均为 0.3 μL/min,油相流速 = 4 μL/min,油/酸混合相流速 = 3 μL/min。
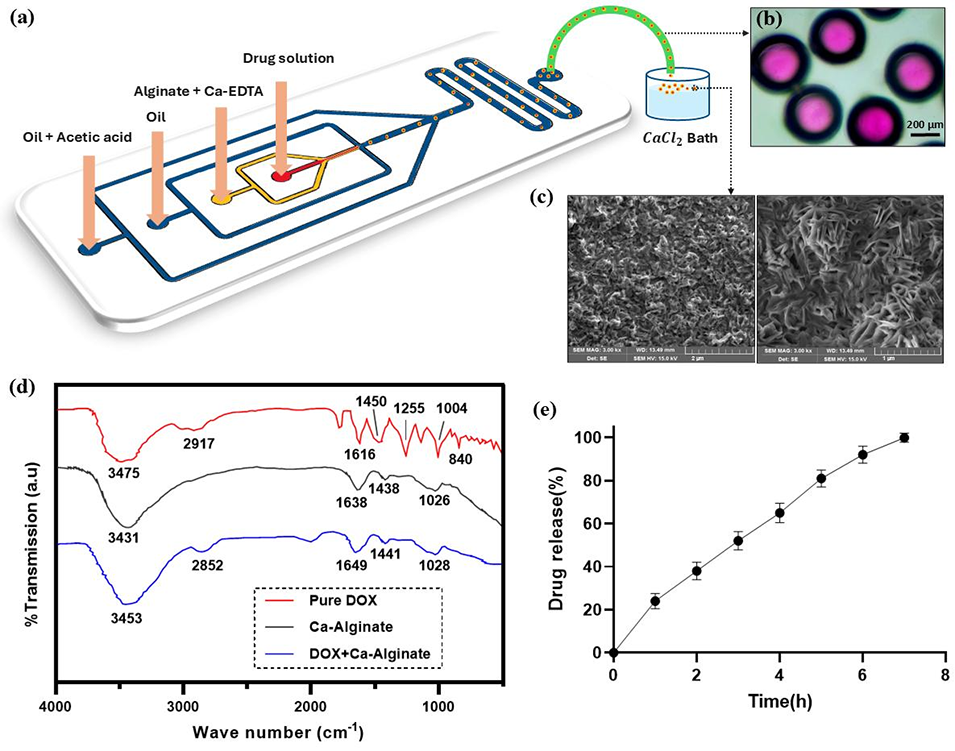
图5.(a)核壳型药物载体的制备流程示意图:入口 1 注入含 100μg/mL 阿霉素(DOX)的去离子水(核相流速 = 0.3 μL/min),入口 2 注入含 2%(w/v)海藻酸钠与 2%(w/v)Ca-EDTA 的溶液(壳相流速 = 0.3 μL/min),入口 3 注入含 3 wt% 司盘 80 的矿物油(油相流速 = 4 μL/min),入口 4 注入含 3 wt% 司盘 80 与 1%(v/v)乙酸的矿物油(油/酸混合相流速 = 3 μL/min)。(b)从装置中提取的药物载体(部分凝胶化),直径为 370±22 µm。(c)经氯化钙凝胶化后载体表面的场发射扫描电子显微镜(FE-SEM)图像,显示多孔表面形貌。(d)纯 DOX(红色)、氯化钙交联海藻酸盐(Ca-Alginate,黑色)及核含 DOX 溶液、壳为氯化钙交联海藻酸盐的微载体(DOX+Ca-Alginate,蓝色)的傅里叶变换红外(FTIR)光谱,表明药物与聚合物存在相互作用。(e)7 小时内核壳型药物载体的 DOX 释放曲线,显示壳层凝胶化可增强扩散阻力。误差线代表标准差。
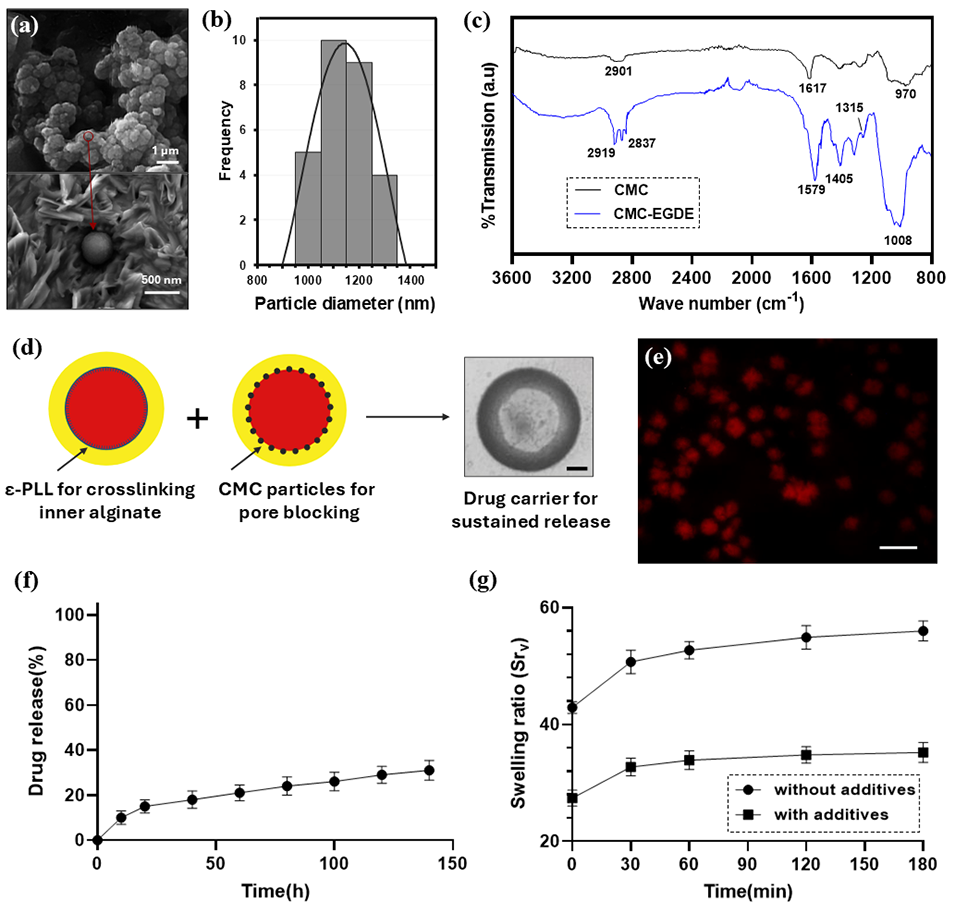
图6.(a)经乙二醇二缩水甘油醚(EGDE)交联的干燥羧甲基纤维素(CMC)颗粒的 FE-SEM 图像(上图),平均直径为 435±20 nm;交联海藻酸盐表面的 CMC 颗粒 FE-SEM 图像(下图),显示其孔隙封堵潜力。(b)CMC 颗粒在蒸馏水中溶胀后的动态光散射(DLS)粒径分布直方图,平均直径为 1143±31 nm。(c)纯 CMC(黑色)与 EGDE 交联 CMC 颗粒(CMC-EGDE,蓝色)的 FTIR 光谱,证实交联成功。(d)核相中添加 0.15%(w/v)CMC 颗粒(封堵海藻酸盐孔隙)和 0.07%(w/v)ε- 聚 - L - 赖氨酸(ε-PLL,促进壳内层凝胶化)以实现缓释的策略示意图。(e)核相添加添加剂后制备的载药微凝胶荧光强度图,表明药物保留率高。(f)添加 CMC 颗粒和 ε-PLL 后,核壳型药物载体在 140 小时内的 DOX 缓释曲线,显示界面修饰效果显著。(g)添加添加剂前后微载体的体积溶胀特性,含添加剂的药物载体溶胀程度更低。误差线代表标准差。
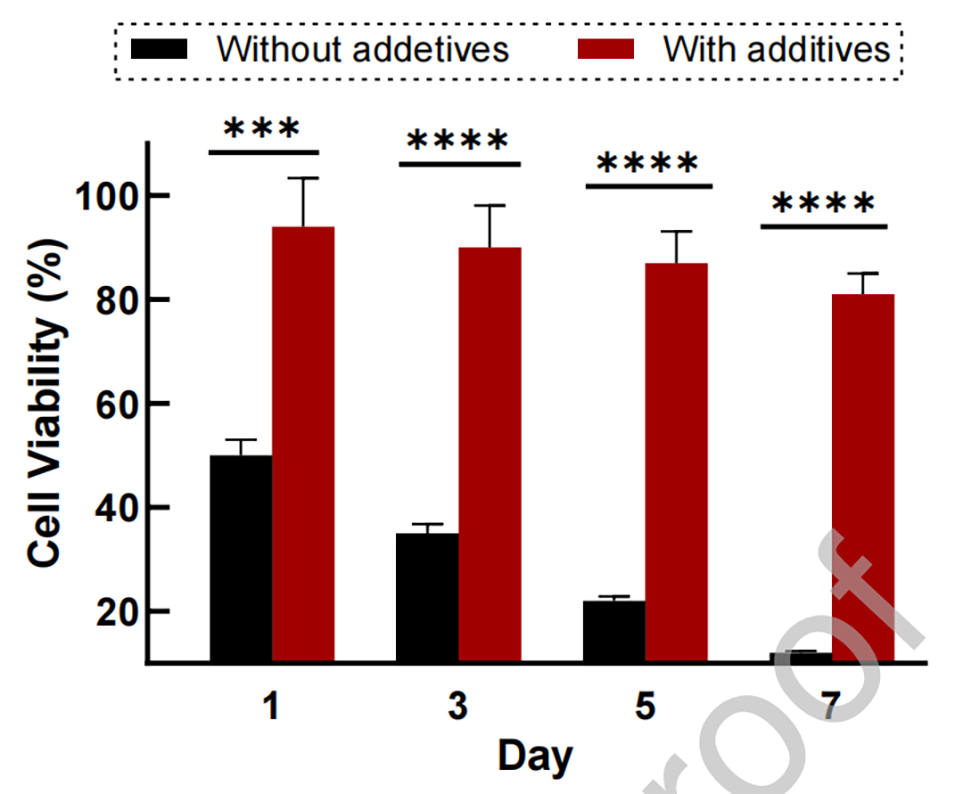
图7. 7 天内,经含添加剂(CMC 颗粒和 ε-PLL)与不含添加剂的核壳型药物载体处理后的细胞存活率对比。误差线代表数据的标准差。
论文链接:https://doi.org/10.1016/j.carpta.2026.101086
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














