在骨质疏松性骨缺损中,骨髓间充质干细胞(BMSCs)通过分化作用和旁分泌信号调控局部微环境,在组织再生中发挥关键作用。然而,氧化应激等持续的病理刺激会显著损害其功能,且干细胞在缺损部位的存活能力与归巢效率有限,这些均是影响治疗效果的主要障碍。

为解决上述问题,上海交通大学医学院附属同仁医院叶晓健教授、蒋帅教授、李晓晓副研究员等人基于微流控技术成功构建了一种pH响应型多功能微球系统(GB-RLip),通过整合白藜芦醇负载脂质体、GelMA水凝胶和醛基化透明质酸(HA-CHO)外壳,实现了结构支撑、干细胞递送和微环境调控的协同作用。该系统利用骨缺损部位的弱酸性环境触发药物靶向释放,有效缓解氧化应激,且能维持BMSCs的成骨潜能和旁分泌功能,显著促进骨质疏松性骨缺损的新骨形成和血管重建,为干细胞疗法和智能生物材料在骨再生领域的应用提供了新策略。相关研究以“A pH-triggered antioxidative stem cell spheroid platform restores paracrine signaling to enhance osteoporotic bone regeneration”为题目,发表于期刊《Materials Today Advances》。
本文要点:
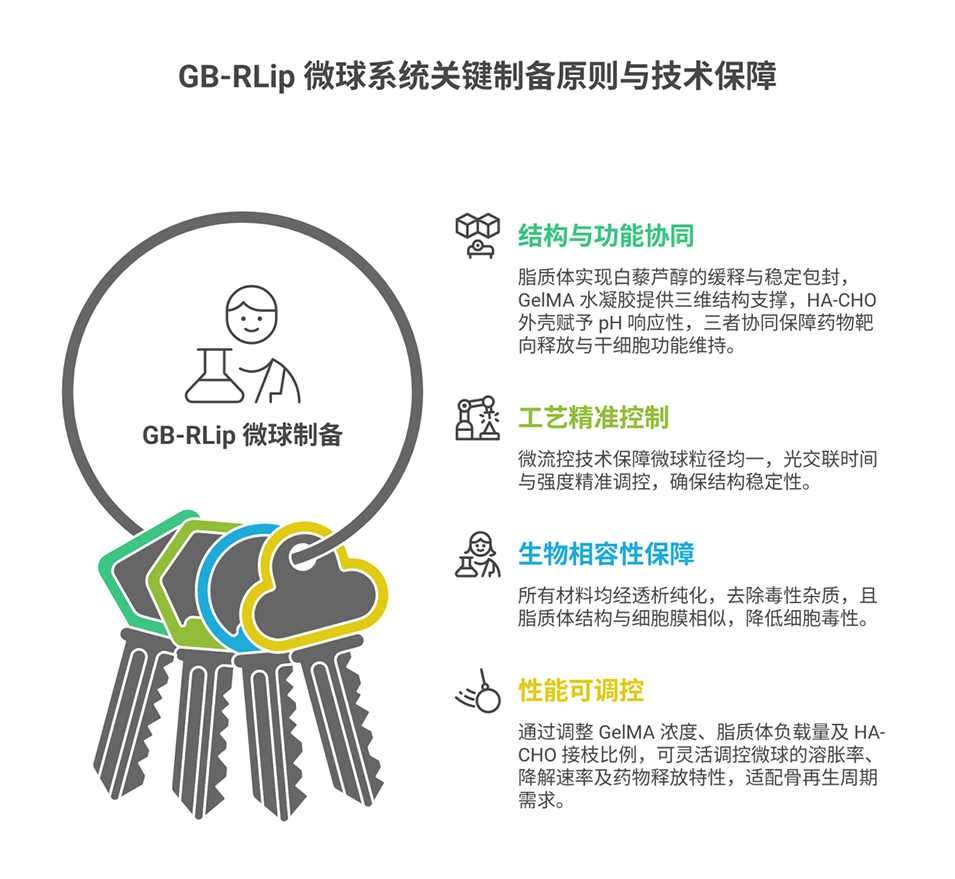
1、本研究构建了一种pH响应型、可注射的多功能微球系统(GB-RLip),该系统整合了白藜芦醇负载脂质体、GelMA水凝胶支架和醛基化透明质酸(HA-CHO)外壳,实现了结构支撑、干细胞递送与微环境调控的一体化功能。
2、骨缺损部位的弱酸性微环境会触发外壳解体,进而实现白藜芦醇的靶向释放,该过程可有效缓解氧化应激,同时维持骨髓间充质干细胞(BMSCs)的成骨潜能与旁分泌功能。
3、体外实验证实,该系统具有优异的生物相容性,且展现出强大的成骨活性与血管生成能力。体内实验进一步验证,GB-RLip能显著加速骨再生进程与血管重建。转录组分析结果表明,GB-RLip可激活多个与成骨和血管生成相关的信号通路,凸显其对骨组织再生的协同调控作用。
4、GB-RLip在响应型材料设计与生物功能整合方面均具备显著优势。该策略为干细胞疗法及智能生物材料的研发提供了极具潜力的平台,尤其适用于骨质疏松性骨再生领域。
GB-RLip微球系统的pH响应特性是通过外壳修饰实现的,醛基化透明质酸(HA-CHO)与GelMA水凝胶微球表面的氨基通过席夫碱反应形成交联外壳,在骨缺损部位的弱酸性微环境(pH<6.5)下,席夫碱键发生酸性水解,外壳解体并靶向释放白藜芦醇。
该设计的核心优势在于:①实现药物的局部靶向释放,避免全身代谢导致的药效损失;②外壳在生理pH下稳定,保证微球结构完整性和干细胞存活,在病理酸性环境下精准响应,提升治疗针对性。
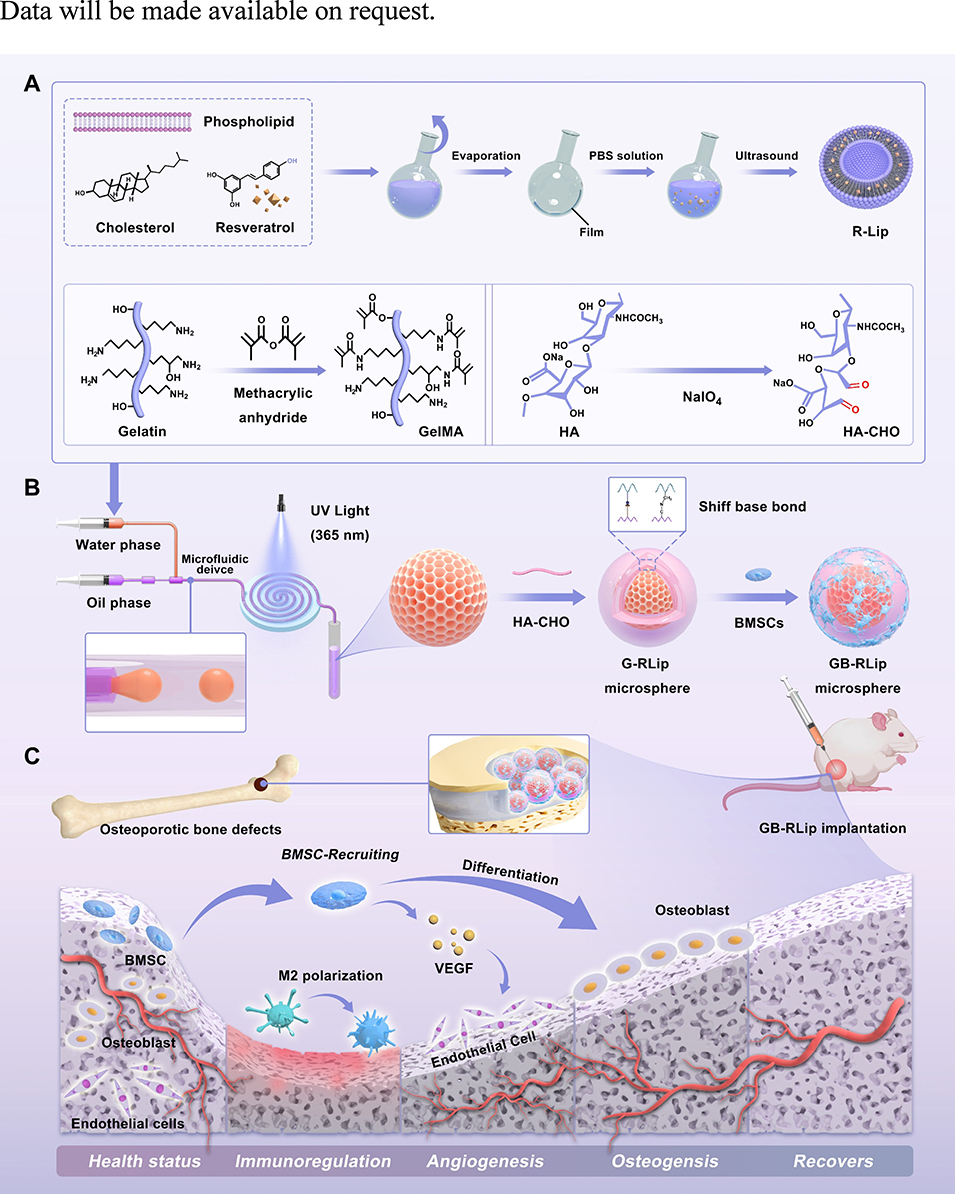
Scheme 1:pH 响应型抗氧化干细胞球状平台用于骨质疏松性骨修复的设计及治疗机制。(A)脂质体载体及微球前驱体的合成过程。(B)通过微流控技术与三维共培养组装 pH 响应型抗氧化干细胞球平台的流程。(C)通过微环境调控及旁分泌信号恢复介导的原位骨再生机制。
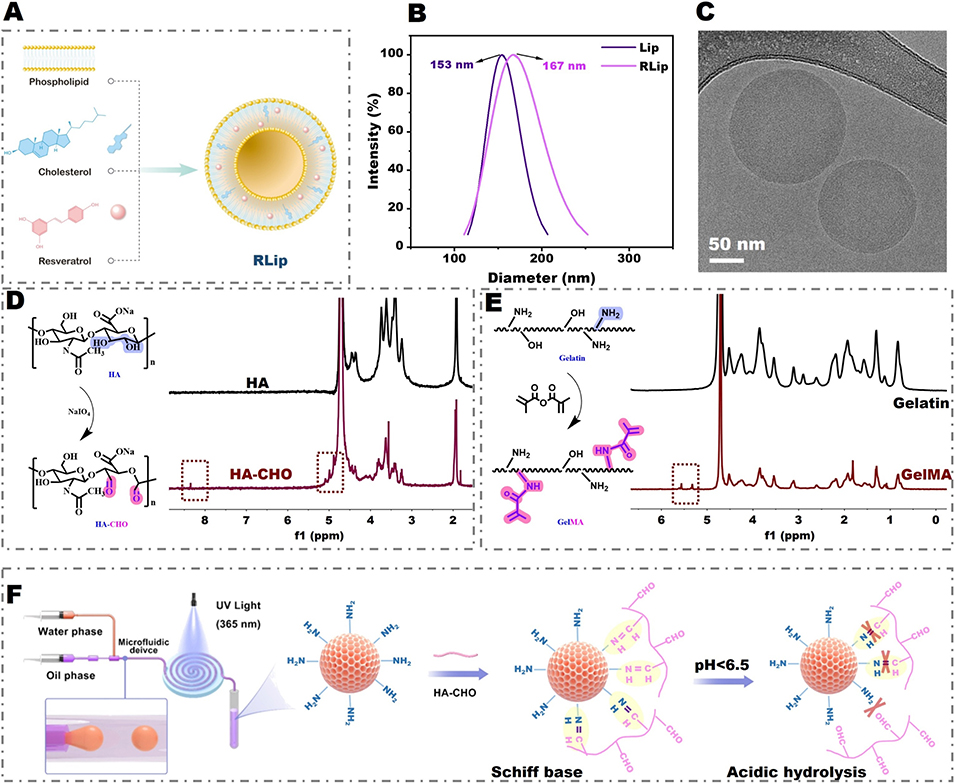
图1 (A)白藜芦醇负载脂质体的制备流程示意图。(B)脂质体的粒径分布曲线。(C)白藜芦醇负载脂质体的冷冻透射电子显微镜图像。(D–E)GelMA和醛基化透明质酸(HA-CHO)单体的合成路线及其核磁共振氢谱表征结果。(F)液滴微流控法制备水凝胶微球的流程示意图,以及通过 HA-CHO 表面修饰构建 pH 响应型外壳的过程。
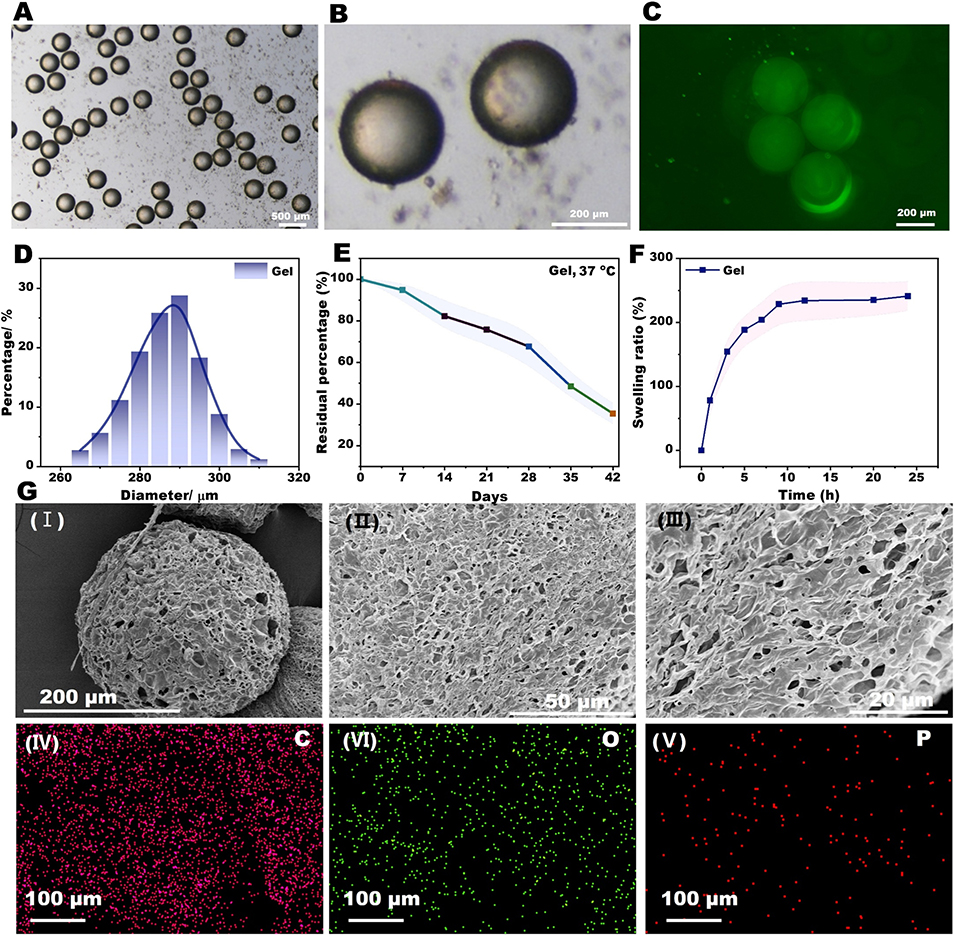
图2 (A–B)GelMA@脂质体水凝胶微球的光学显微镜图像。(C)荧光显微镜图像显示,荧光素异硫氰酸酯(FITC)标记的脂质体均匀包埋于水凝胶微球内部。(D)G-RLip 微球的粒径分布曲线。(E)微球在 0.1 U/mL 胶原酶 II 中的降解曲线。(F)G-RLip 微球在 PBS 中的溶胀曲线。(G)G-RLip 微球的 SEM 图像及 EDS 分析结果。
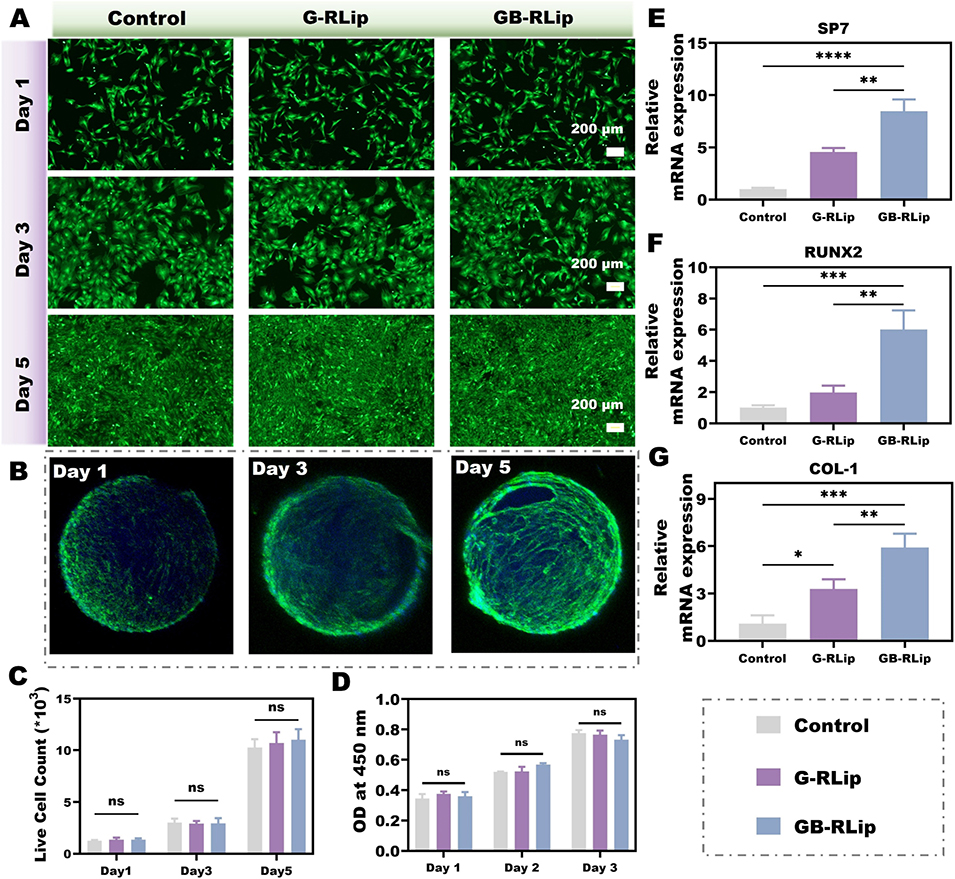
图3 (A–B)BMSCs 与水凝胶微球共培养 1 天、3 天、5 天后的活/死染色结果。(C)活细胞数量的定量分析数据。(D)通过 CCK-8 法检测的细胞活力评估结果。(E–G)体外成骨诱导 7 天后,成骨相关基因 RUNX2、COL-1、SP7 的相对表达水平(采用实时荧光定量聚合酶链反应 qRT-PCR 检测)。显著性水平:*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001;ns 表示无显著差异(n = 3)。
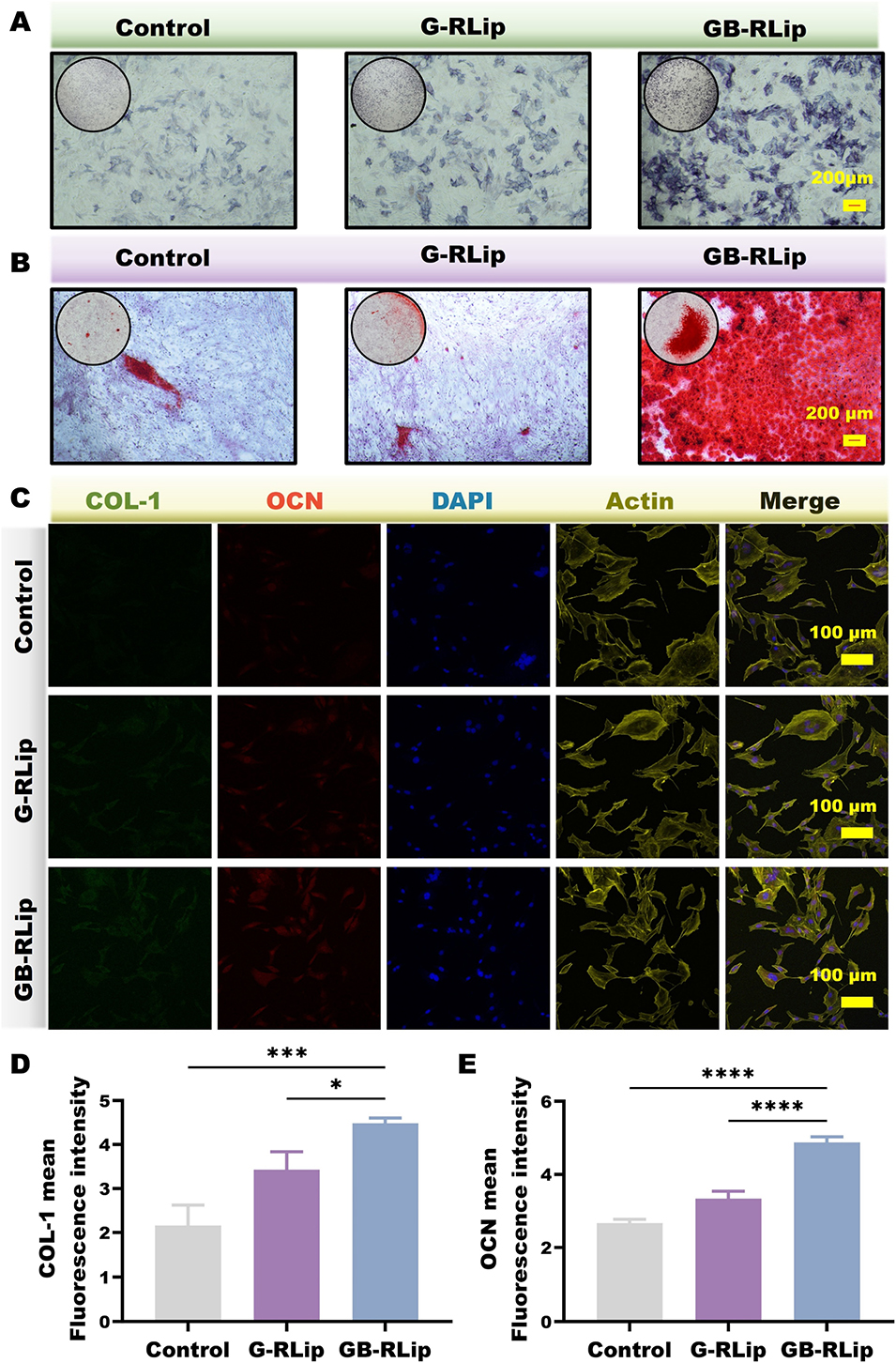
图4 (A)成骨诱导 7 天后,BMSCs 中碱性磷酸酶(ALP)活性的染色结果。(B)成骨诱导 21 天后,钙结节形成的茜素红 S(ARS)染色结果。(C)成骨标志物的免疫荧光染色图像:COL-1(绿色)和骨钙素(OCN,红色);4',6 - 二脒基 - 2 - 苯基吲哚(DAPI,蓝色)标记细胞核,肌动蛋白追踪剂(Actin,黄色)显示细胞骨架结构。(D–E)COL-1 和 OCN 的荧光强度定量分析结果。
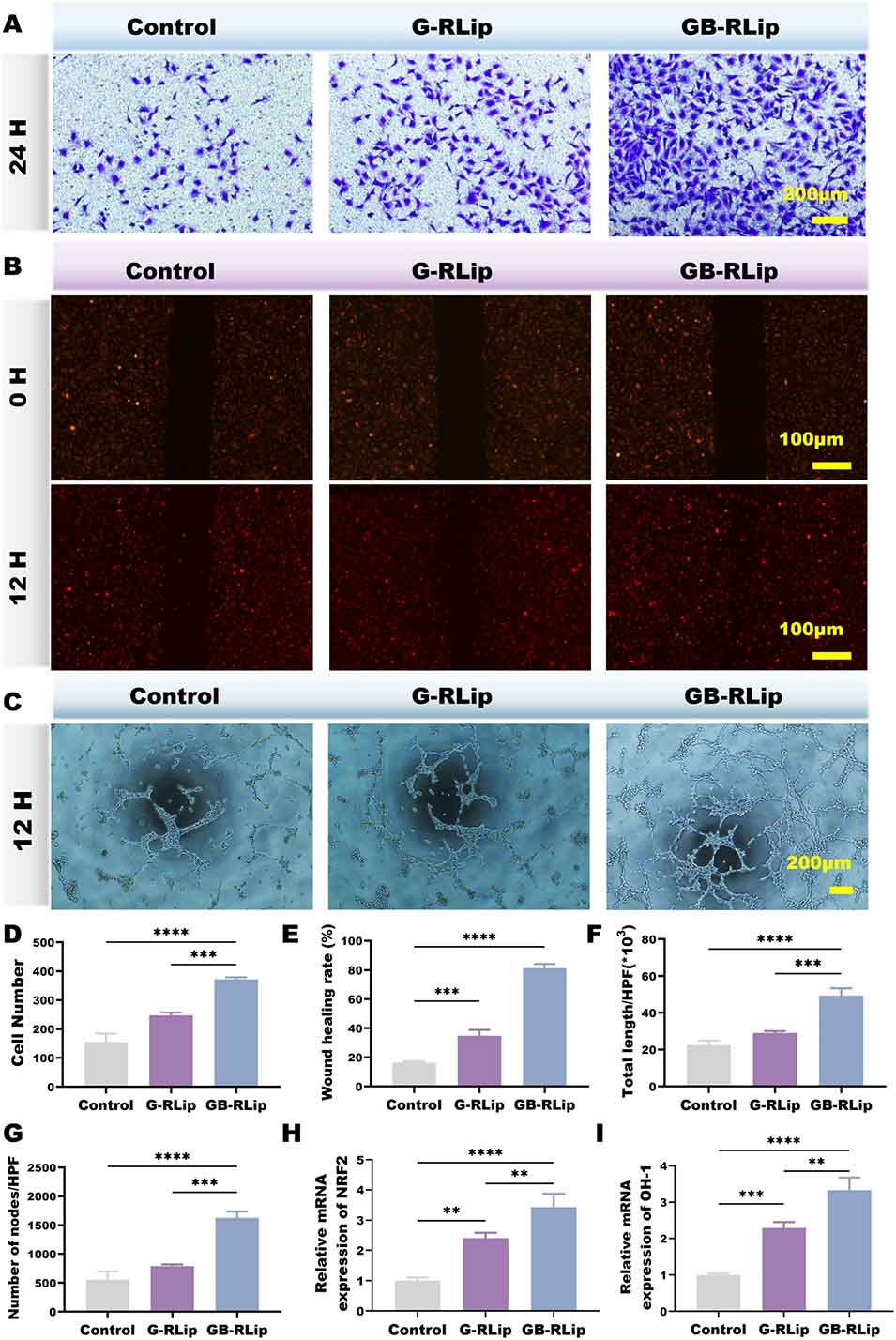
图5 (A)通过结晶紫染色评估 HUVECs 迁移能力的结果。(B–C)划痕愈合实验和管形成实验图像,展示各组细胞迁移及血管样结构形成情况。(D–G)Transwell 迁移细胞数、划痕愈合率、总血管长度及分支节点数的定量分析数据。(H–I)氧化应激相关基因的表达分析结果。

图6 (A)术后 4 周和 8 周的 Micro-CT 三维重建图像及二维横截面图像,显示不同处理组的骨再生情况。(B)H&E 染色和 Masson 三色染色结果,反映新骨形成及胶原沉积情况。

图7(A–B)术后 4 周和 8 周骨组织中,成骨标志物 OCN(绿色)和血管生成标志物血管内皮生长因子 A(VEGFA,红色)的免疫荧光染色图像。(C)主成分分析(PCA)散点图。(D)差异表达基因(DEGs)的火山图,红色标注上调基因,蓝色标注下调基因。(E)差异表达基因的基因本体(GO)富集分析结果。(F)京都基因与基因组百科全书(KEGG)通路富集分析结果,显示 GB-RLip 处理后显著激活的信号通路。
论文链接:https://doi.org/10.1016/j.mtadv.2025.100637
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














