骨关节炎(OA)是由关节软骨渐进降解与慢性炎症微环境引发的慢性关节病,会导致疼痛、活动受限及全身并发症。因软骨无血管神经且软骨细胞增殖能力低,其自我修复能力极弱。
现有临床治疗存在明显局限:微骨折术常生成机械强度与耐久性差的纤维软骨;自体软骨细胞移植在获取软骨时可能加重关节损伤,且体外2D培养易致软骨细胞去分化,降低软骨特异性基因表达;传统水凝胶微球虽能递送药物或生长因子,但组织黏附能力不足,注射后易在滑液中分散,无法与关节软骨有效接触,导致生物活性成分递送效率和治疗效果受损。

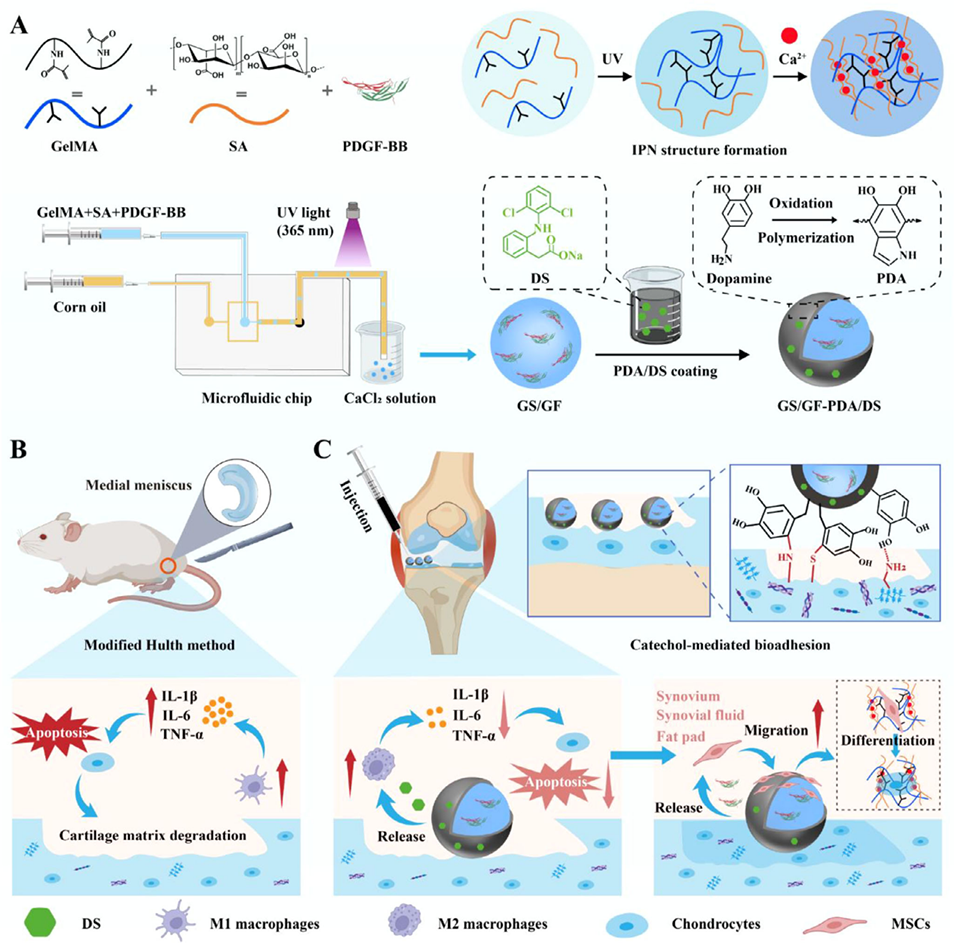
近期,福建中医药大学中西医结合研究院李西海教授、Lili Wang团队联合福州大学生物科学与工程学院杨建民教授团队,成功研发出一种具有互穿聚合物网络(IPN)结构与原位软骨锚定能力的可注射核壳水凝胶微球(GS/GF-PDA/DS),该微球可通过聚多巴胺(PDA)介导靶向黏附软骨缺损处,协同释放双氯芬酸钠(DS)与血小板衍生生长因子-BB(PDGF-BB),实现抗炎调控、内源性间充质干细胞(MSC)归巢及软骨分化引导的多功能治疗。相关研究以“Injectable Hydrogel Microspheres for Osteoarthritis Therapy via Endogenous Mesenchymal Stem Cells Homing and Chondrogenic Differentiation Enhancement”为题目,发表在期刊《Advanced Healthcare Materials》上。
本文要点:
1、本研究开发了一种用于骨关节炎(OA)治疗的可注射水凝胶微球(GS/GF-PDA/DS)。该微球采用微流控技术制备,具有互穿聚合物网络结构,并通过聚多巴胺涂层实现软骨缺损处的原位锚定。
2、微球早期释放的双氯芬酸钠与PDA共同缓解炎症、清除活性氧并调节巨噬细胞极化;持续释放的PDGF-BB则促进内源性间充质干细胞归巢。IPN结构增强了微球的力学性能,并为MSCs成软骨分化提供了适宜的微环境。
3、体外实验证明其具有良好的注射性、软骨锚定能力、抗炎及促成软骨分化作用;体内实验显示其能显著减轻大鼠滑膜炎症并促进软骨再生。本研究提出了一种集免疫调节、干细胞招募与软骨修复于一体的综合性OA治疗策略。
GS/GF-PDA/DS 微球各组分及核心功能
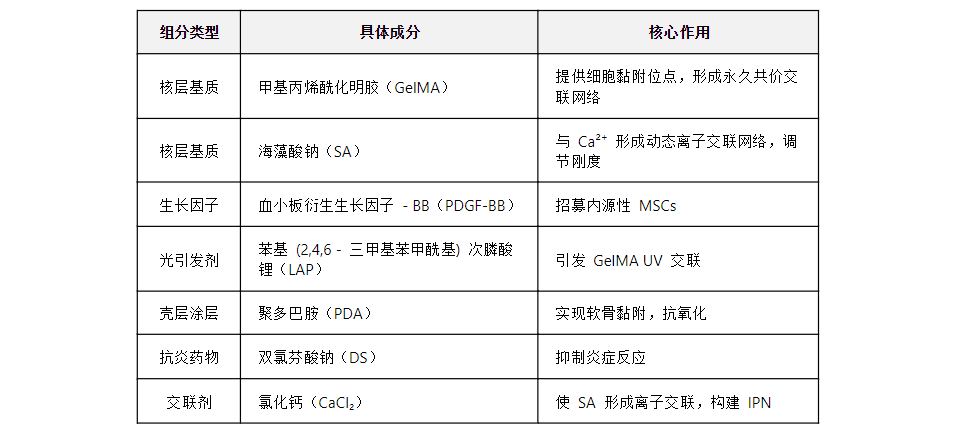
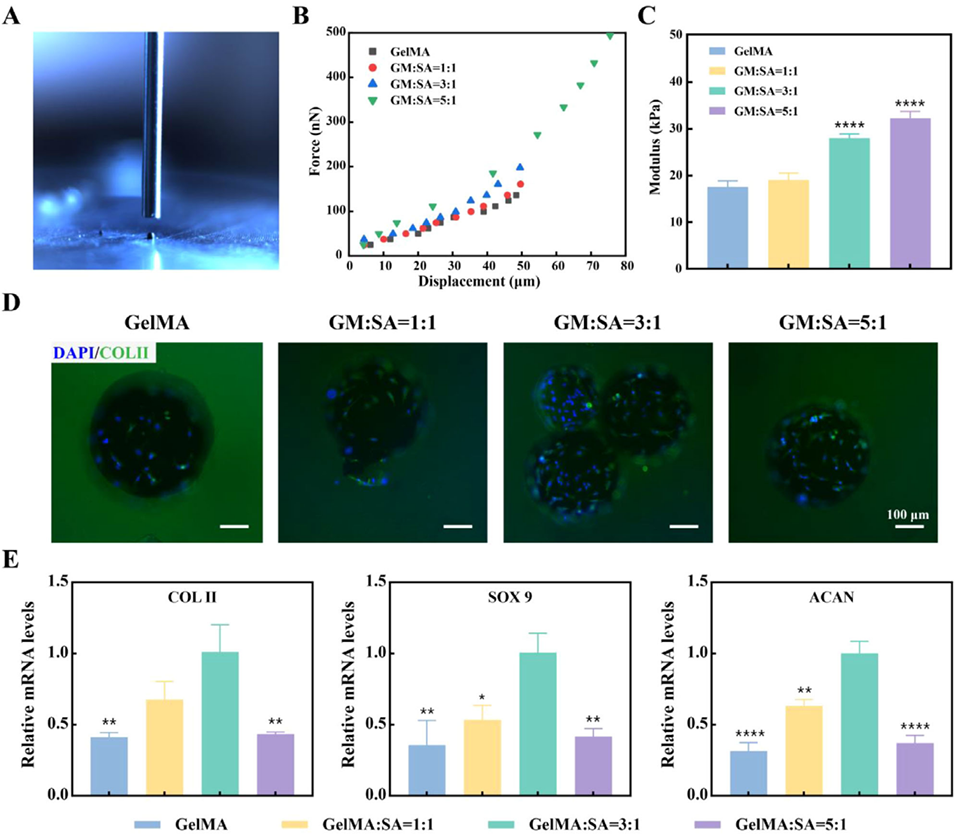
图1. 力学性能与软骨分化性能。(A)水凝胶微球力学性能测试照片;(B)力-位移曲线;(C)不同材料比例水凝胶微球的模量定量结果;(D)骨髓间充质干细胞(BMSCs)的Ⅱ型胶原(COLⅡ)免疫荧光染色图;(E)骨髓间充质干细胞软骨分化相关基因表达的实时荧光定量聚合酶链反应(RT-qPCR)结果。数据以平均值±标准偏差表示,采用单因素方差分析进行显著性检验;样本量n=3;*p<0.05,**p<0.01,****p<0.0001。
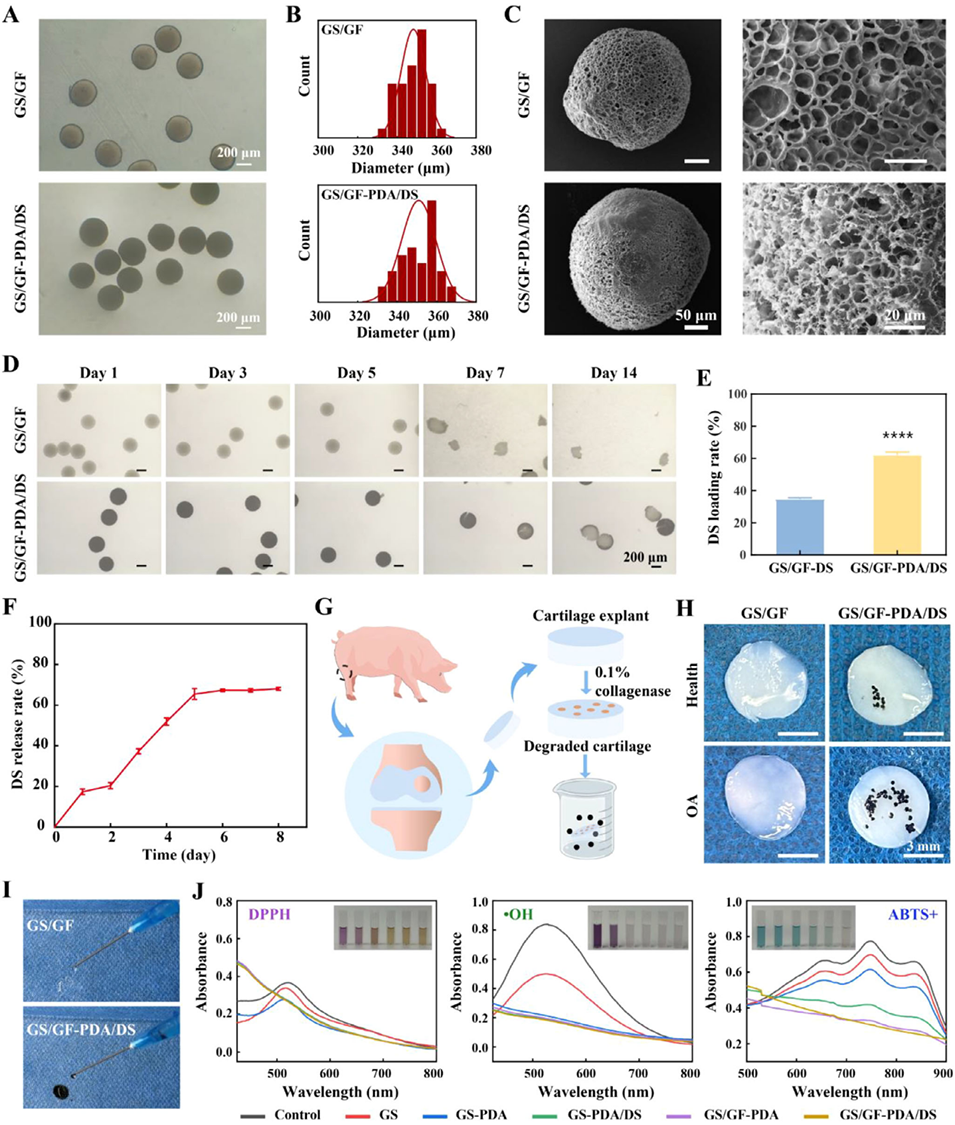
图2. 水凝胶微球的制备与表征。(A)显微镜图像;(B)粒径分布;(C)水凝胶微球的SEM图像;(D)水凝胶微球在胶原酶中的降解显微镜图像;(E)双氯芬酸钠(DS)载药率;(F)双氯芬酸钠释放曲线;(G)猪软骨外植体黏附降解实验示意图;(H)微球在健康软骨和骨关节炎(OA)软骨外植体表面的黏附照片;(I)注射性能;(J)自由基清除效果(包括1,1-二苯基-2-三硝基苯肼自由基DPPH、羟基自由基・OH和2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸自由基ABTS+)。数据以平均值±标准偏差表示,采用学生t检验进行显著性检验;样本量n=3;****p<0.0001。
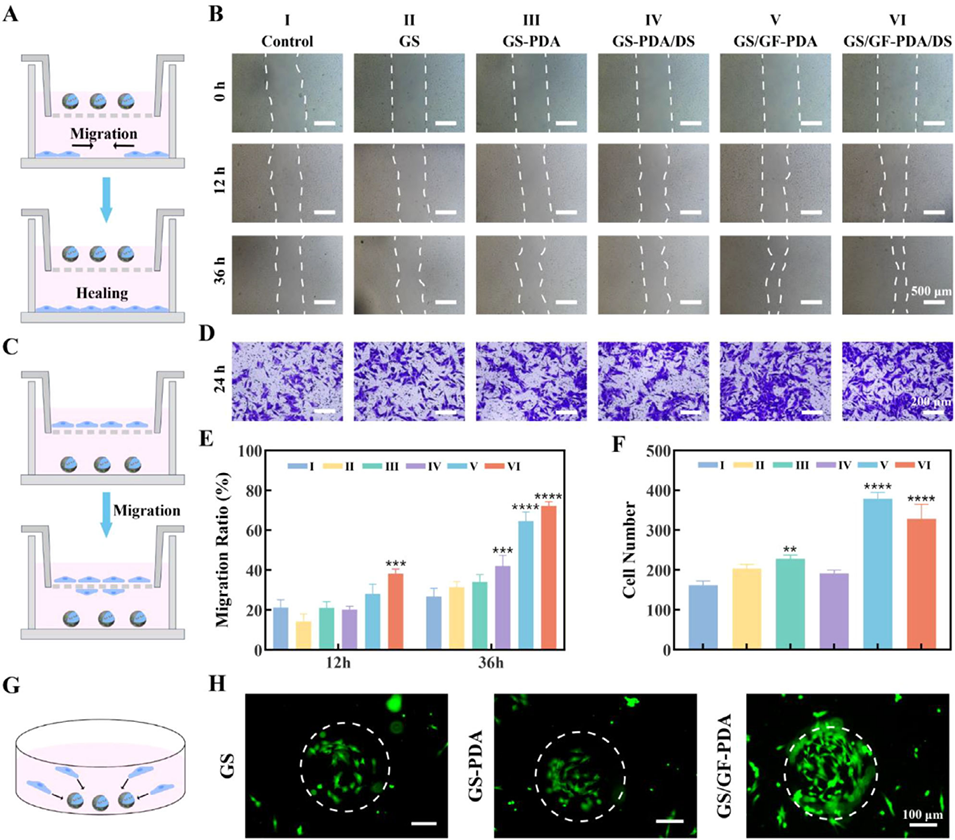
图3. 水凝胶微球的干细胞募集能力。(A)划痕愈合实验示意图;(B)骨髓间充质干细胞在0、12、36小时的划痕愈合实验代表性显微镜图像;(C)细胞趋化实验示意图;(D)骨髓间充质干细胞趋化实验的结晶紫染色代表性图像;(E)划痕愈合率;(F)迁移细胞数量定量结果;(G)微球与骨髓间充质干细胞共培养示意图;(H)微球与骨髓间充质干细胞共培养的活/死染色图像。数据以平均值±标准偏差表示,采用单因素方差分析进行显著性检验;样本量n=3;**p<0.01,***p<0.001,****p<0.0001。
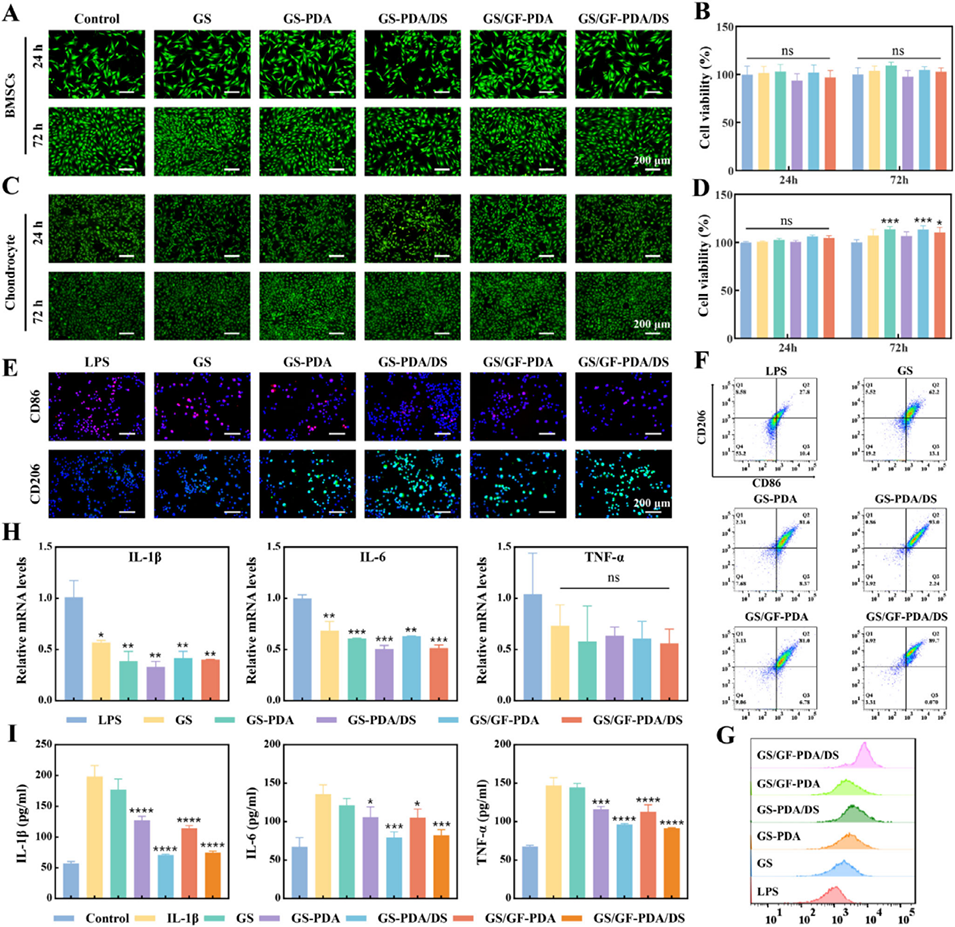
图4. 细胞相容性与炎症调控效果。(A)骨髓间充质干细胞的活/死染色图像;(B)骨髓间充质干细胞的CCK-8定量结果;(C)软骨细胞的活/死染色图像;(D)软骨细胞的CCK-8定量结果;(E)巨噬细胞极化的免疫荧光染色图;(F)巨噬细胞极化的流式细胞术结果;(G)CD206流式细胞术峰图;(H)巨噬细胞中炎症因子基因表达的实时荧光定量聚合酶链反应(RT-qPCR)结果;(I)白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)的酶联免疫吸附测定(ELISA)定量结果。数据以平均值±标准偏差表示,采用单因素方差分析进行显著性检验;样本量n=3;*p<0.05,**p<0.01,***p<0.001,****p<0.0001,ns表示无显著性差异。
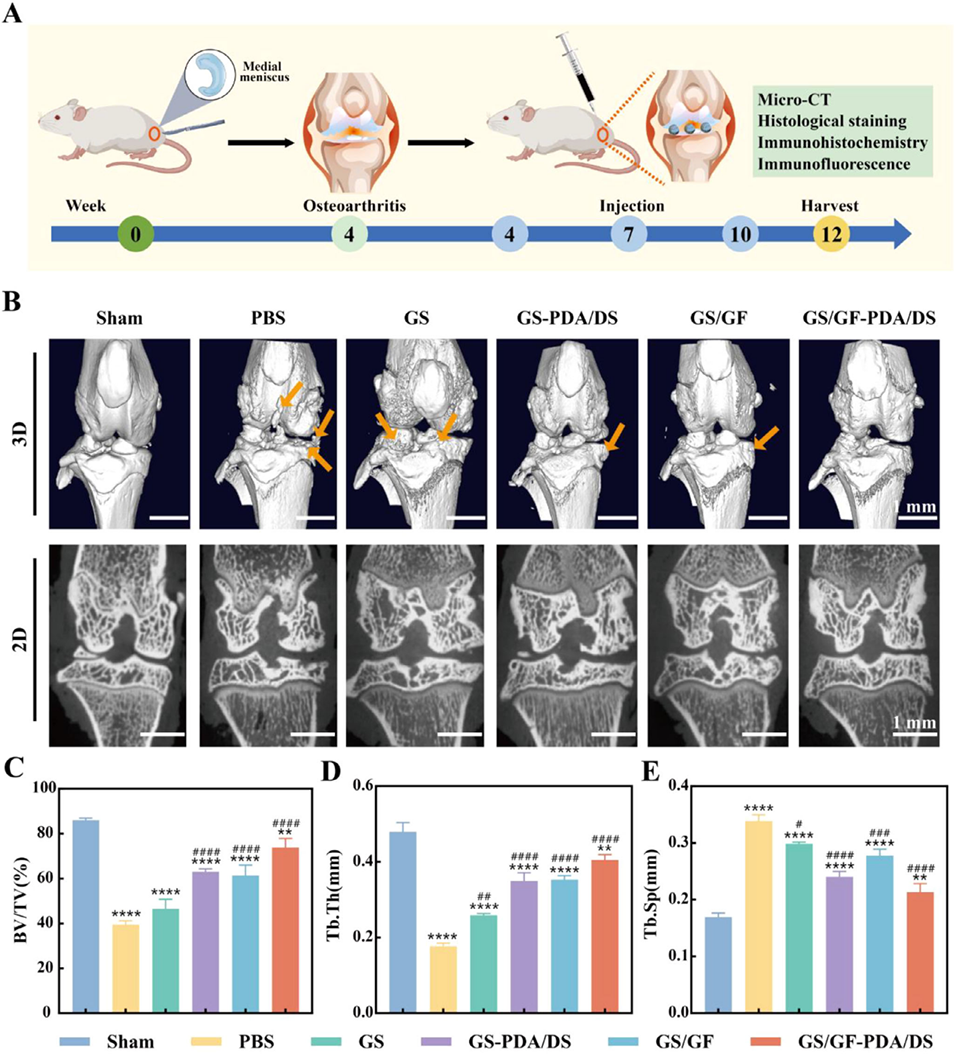
图5. 体内治疗效果。(A)动物建模与实验流程示意图;(B)显微计算机断层扫描的三维和二维图像(箭头指示骨赘);(C)骨体积分数(BV/TV)、(D)骨小梁厚度(Tb.Th)、(E)骨小梁分离度(Tb.Sp)的定量结果。数据以平均值±标准偏差表示,采用单因素方差分析进行显著性检验;样本量n=4;*表示与假手术(Sham)组比较,#表示与磷酸盐缓冲液(PBS)组比较;*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
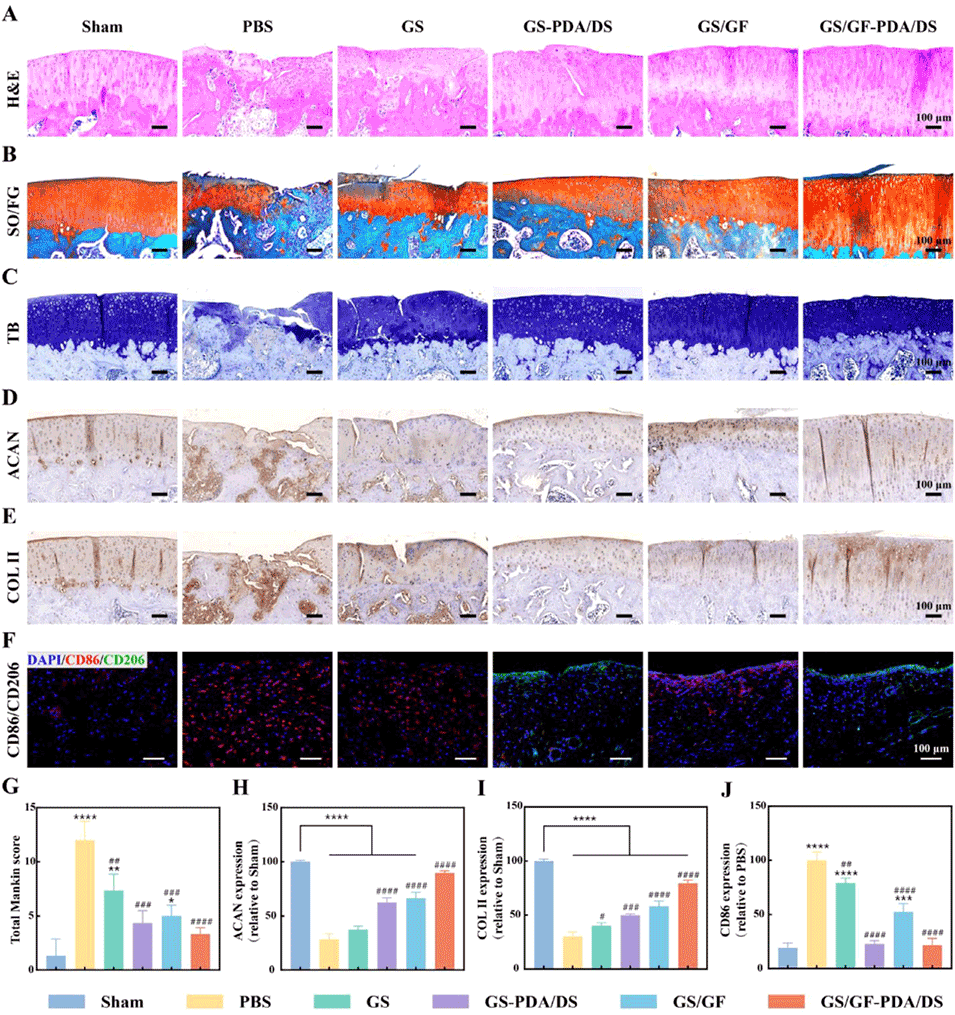
图6. 组织学染色分析。(A)治疗8周后关节软骨的苏木精-伊红(H&E)染色图;(B)番红O-固绿染色图;(C)甲苯胺蓝染色图;(D)治疗8周后关节软骨的蛋白聚糖免疫组织化学染色图;(E)Ⅱ型胶原免疫组织化学染色图;(F)治疗8周后滑膜组织的CD86/CD206免疫荧光染色图;(G)曼金(Mankin)总评分;(H)蛋白聚糖、(I)Ⅱ型胶原、(J)CD86的定量结果。数据以平均值±标准偏差表示,采用单因素方差分析进行显著性检验;样本量n=4;*表示与假手术(Sham)组比较,#表示与磷酸盐缓冲液(PBS)组比较;*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
论文链接:https://doi.org/10.1002/adhm.202504727
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














