
导读:
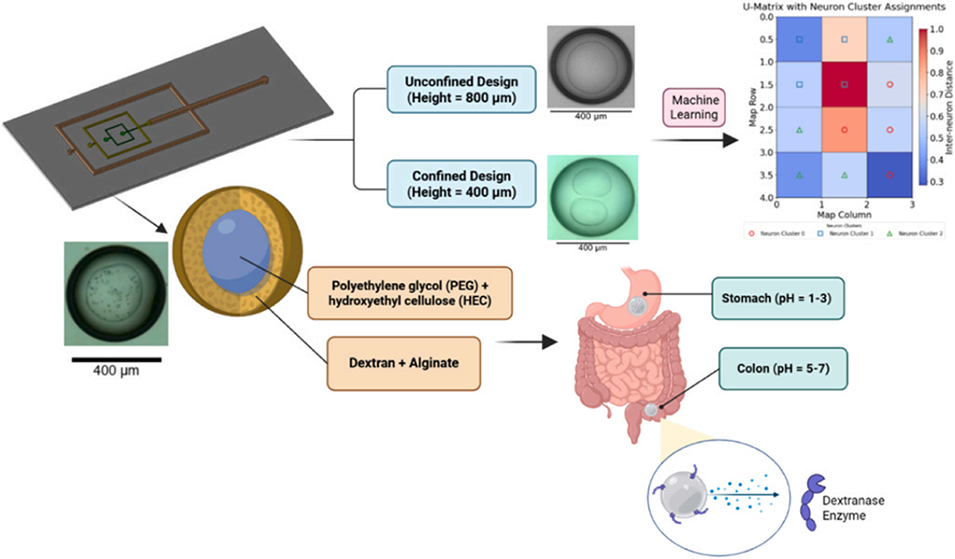
近期,加拿大维多利亚大学机械工程系团队开发了一种生物相容性微流控平台,通过设计具有不同垂直限域的3D打印流动聚焦芯片,实现了对双乳液内部单核或双核结构的灵活调控,该双乳液可通过离子交联形成海藻酸盐/葡聚糖胶囊,适用于结肠靶向递送。相关研究以“Microfluidic generation of single‑ and double‑core double emulsions for colon delivery”为题目,发表在期刊《Colloids and Surfaces A: Physicochemical and Engineering Aspects》上。
本文要点:
1、本研究开发了一种生物相容性微流控平台,用于制备油包水包水(W/W/O)双乳液,以实现结肠靶向给药。
2、该平台基于聚乙二醇(PEG)-葡聚糖双水相体系,在3D打印的流动聚焦芯片中,通过调节垂直限制来控制液滴形态:受限通道(0.4 mm)可产生双核结构,而非受限通道(0.8 mm)则生成单核液滴。
3、通过添加羟乙基纤维素(HEC)提高PEG核相粘度,确保在高粘度葡聚糖壳相中稳定成型。
4、随机森林回归与SHAP分析表明,油相和PEG流速是影响液滴及内核尺寸的关键因素。
5、交联后的葡聚糖-海藻酸盐胶囊机械强度显著增强,FTIR、SEM和流变学表征验证了其结构稳定性。
6、6μm微塑料封装效率在非受限设计中达96%,受限设计中为88%,显示出该平台在结肠靶向颗粒封装方面的潜力。
该研究开发的微流控平台通过3D打印流动聚焦芯片的垂直限制差异实现乳液结构调控,其核心设计参数为通道高度,具体如下:
双芯乳液:采用4mm高的受限通道,垂直限制强导致通道内形成陡峭的速度梯度,产生~1.1kPa的高剪切应力,在液滴内部激发两个反向旋转的环形涡旋,将PEG核心沿水平中面分割为两个独立芯;
单芯乳液:采用8mm高的非受限通道,垂直限制弱使速度梯度平缓,剪切应力降至~0.15kPa,涡旋强度不足以分割核心,同时需配合PEG浓度≤3.75%w/v、葡聚糖-PEG流速比≤1,避免Marangoni应力导致核心偏移,最终形成稳定单芯。
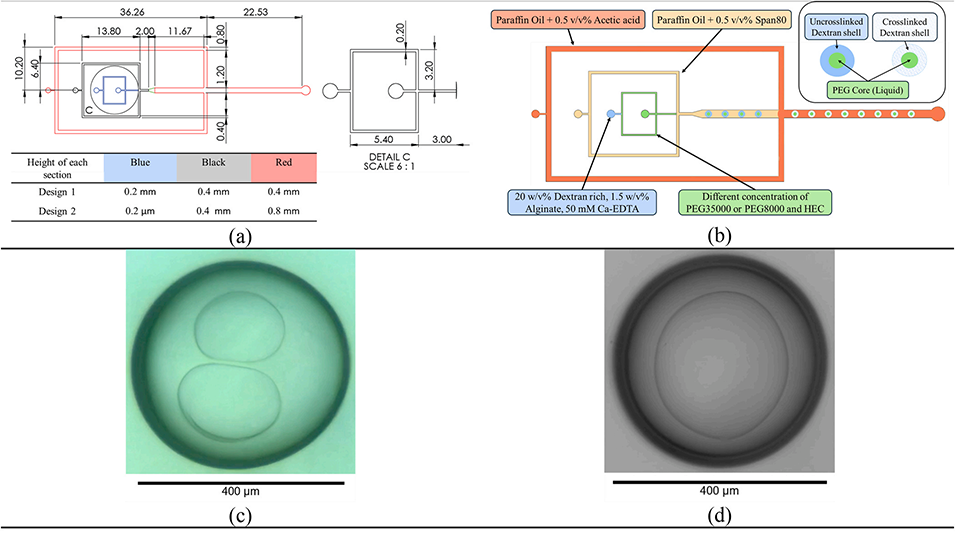
图1:微流控器件示意图:(a)微通道详细尺寸,彩色标注区域表示高度差异;(b)用于形成和交联核壳胶囊的微流控器件整体结构;(c)设计1(受限通道)生成的双芯双乳液;(d)设计2(非受限通道)生成的单芯双乳液。
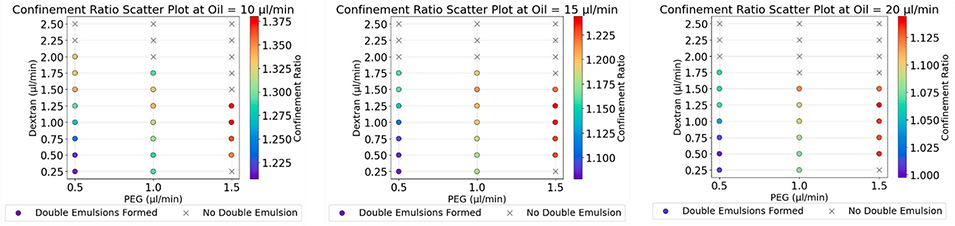
图2:设计1(高度400μm)在不同PEG、葡聚糖和油相流速条件下的垂直限制比。
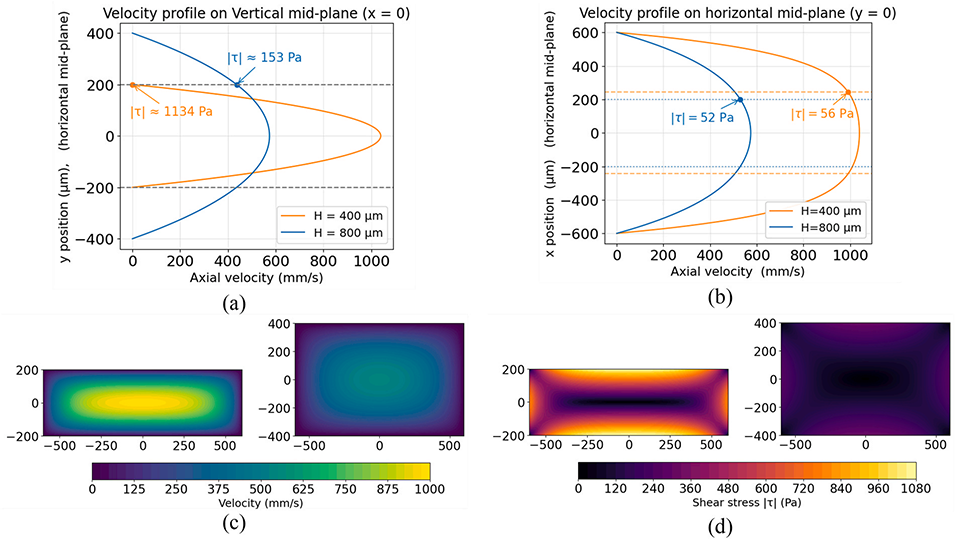
图3:通道设计的流动与剪切应力分析:(a)垂直中平面上的轴向速度分布;(b)水平中平面上的轴向速度分布;(c)轴向速度等高线;(d)剪切应力等高线。

图4:不同流动条件下,PEG8000浓度对核心形貌的影响。

图5:当PEG流速为0.5μL/min时,羟乙基纤维素(HEC)浓度对不同葡聚糖流速下双乳液形成的影响。
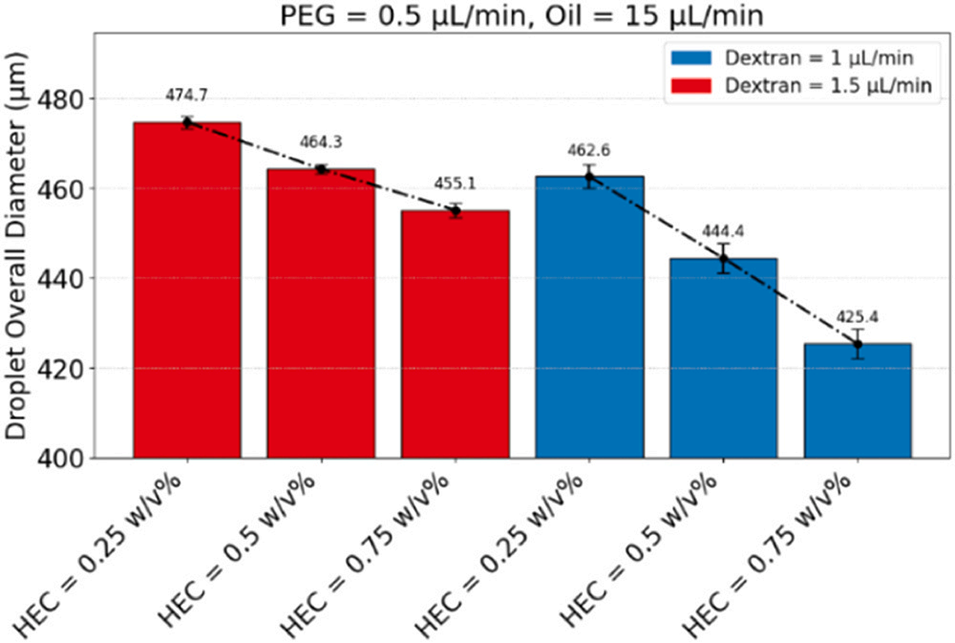
图6:当PEG流速为0.5μL/min时,HEC浓度和葡聚糖流速对双乳液总直径的影响。
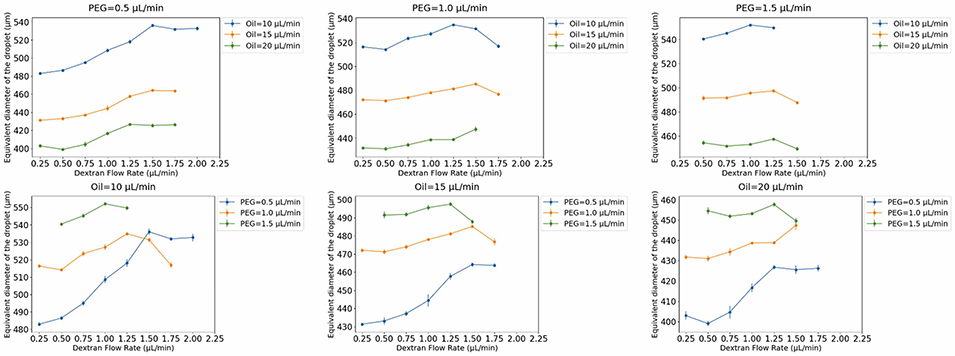
图7:双乳液液滴直径随PEG、葡聚糖和油相流速的变化,标注了滴状(dripping)与挤压状(squeezing)流型的转变点。
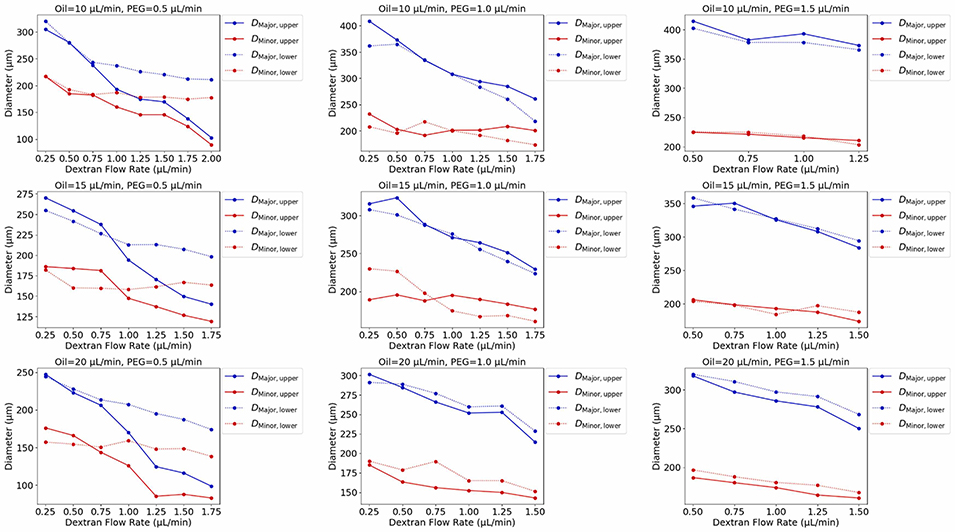
图8:内部核心的形貌分析,详细展示核心长径与短径如何随葡聚糖、PEG和油相流速变化。
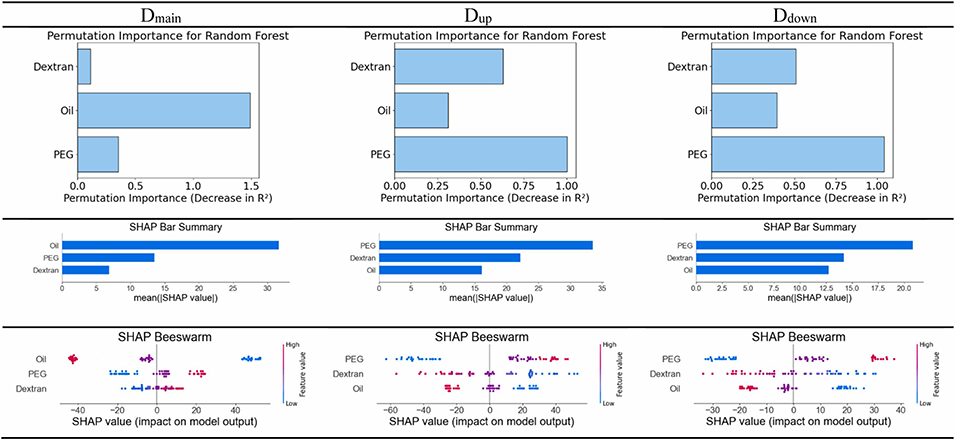
图9:基于随机森林回归、置换重要性和SHAP值的敏感性分析,体现油相、PEG和葡聚糖流速对乳液总直径及核心尺寸的影响。
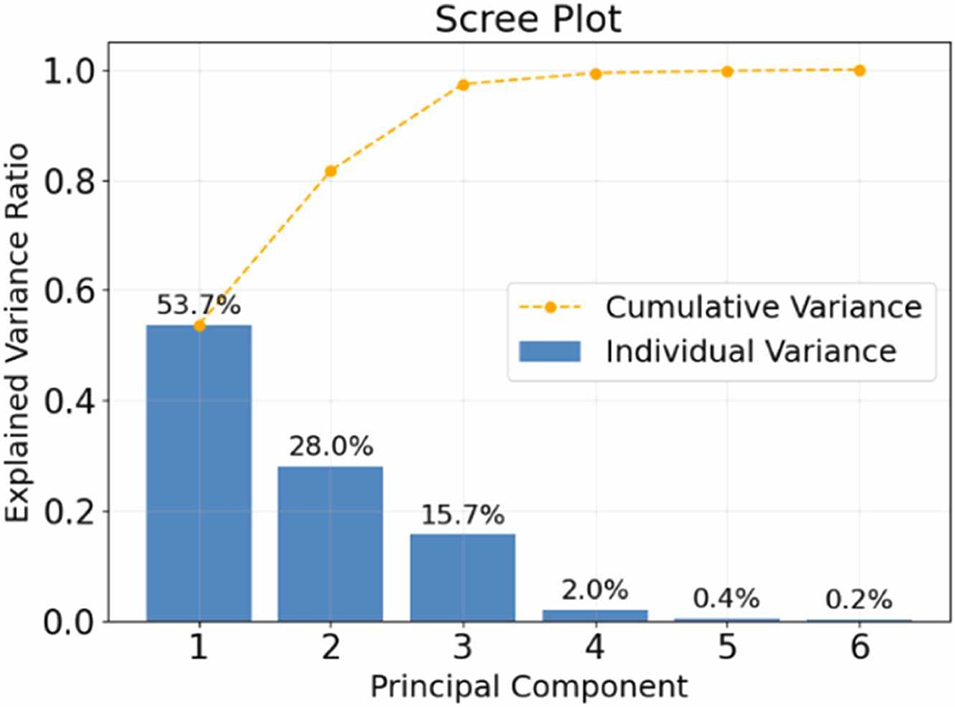
图10:基于主成分分析(PCA)的双乳液数据集降维结果,图中所示为各主成分的方差贡献率。
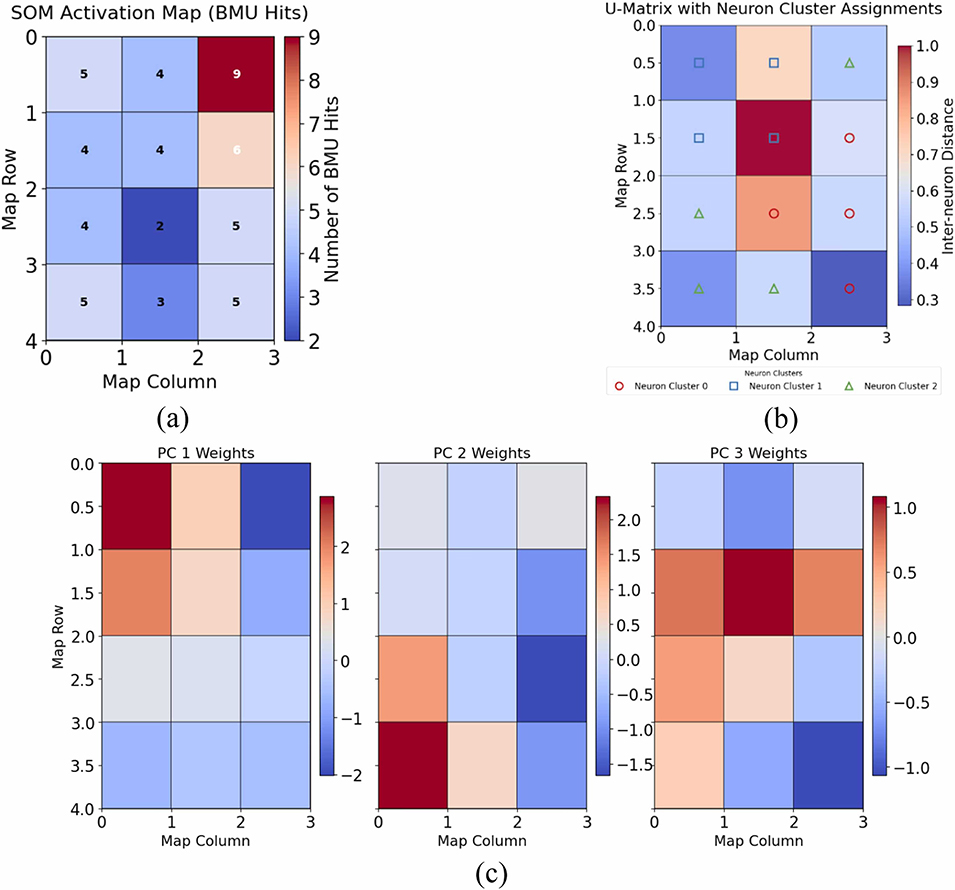
图11:自组织映射(SOM)聚类结果:(a)最佳匹配单元(BMU)命中次数的激活图;(b)指示聚类边界的神经元间距离图(U-矩阵);(c)阐明聚类结构的主成分权重平面。
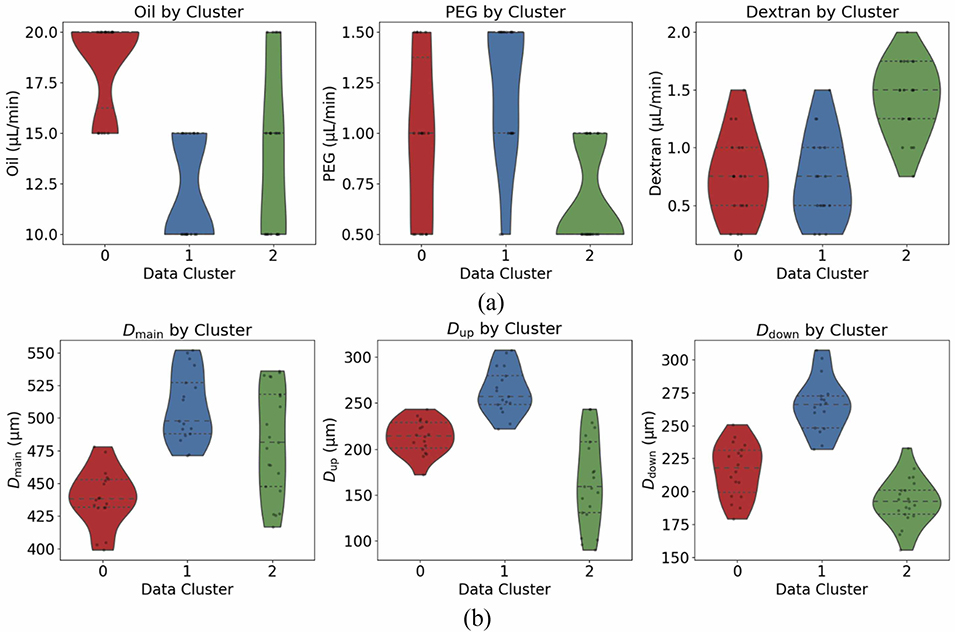
图12:通过小提琴图对各聚类的(a)流速和(b)液滴直径进行分布分析。
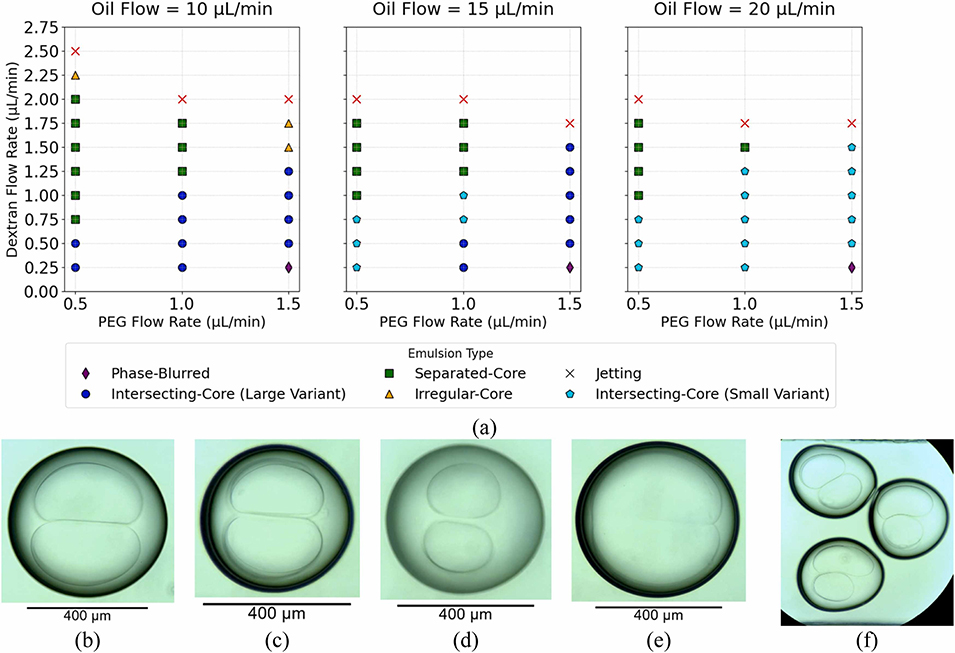
图13:(a)不同流速条件下双乳液结构的可视化分类;(b)交叉芯(大尺寸型);(c)交叉芯(小尺寸型);(d)分离芯;(e)相模糊结构;(f)不规则芯。
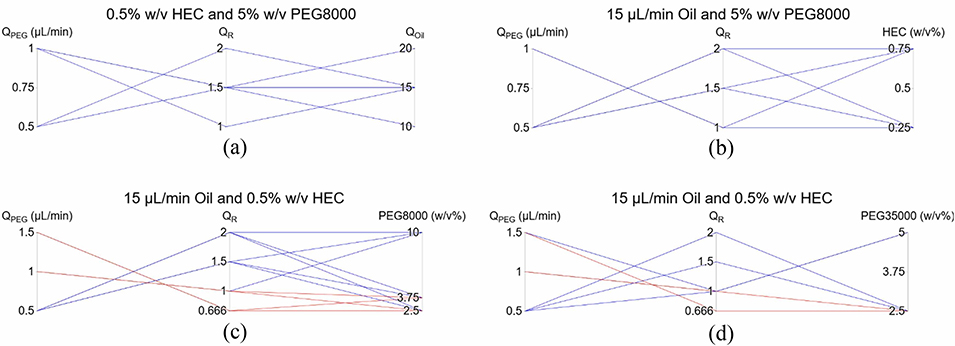
图14:不同聚合物浓度和流速下单芯乳液形成的成功图谱:(a)油相、PEG和葡聚糖流速的影响;(b)HEC浓度的影响;(c)PEG8000浓度的影响;(d)PEG35000浓度的影响。红线表示成功案例,蓝线表示失败案例。

图15:在固定油相流速为15μL/min、HEC浓度为0.5%(质量体积比)的条件下,不同参数组合的双乳液形成情况:(a)PEG流速=0.5μL/min、葡聚糖流速=1.5μL/min、PEG8000浓度=10%(质量体积比);(b)PEG流速=1μL/min、葡聚糖流速=1.0μL/min、PEG8000浓度=10%(质量体积比);(c)PEG流速=1μL/min、葡聚糖流速=1.0μL/min、PEG8000浓度=5%(质量体积比);(d)PEG流速=1μL/min、葡聚糖流速=1.0μL/min、PEG8000浓度=3.75%(质量体积比);(e)PEG流速=1μL/min、葡聚糖流速=1.0μL/min、PEG8000浓度=2.5%(质量体积比);(f)PEG流速=1μL/min、葡聚糖流速=1.0μL/min、PEG35000浓度=2.5%(质量体积比)。
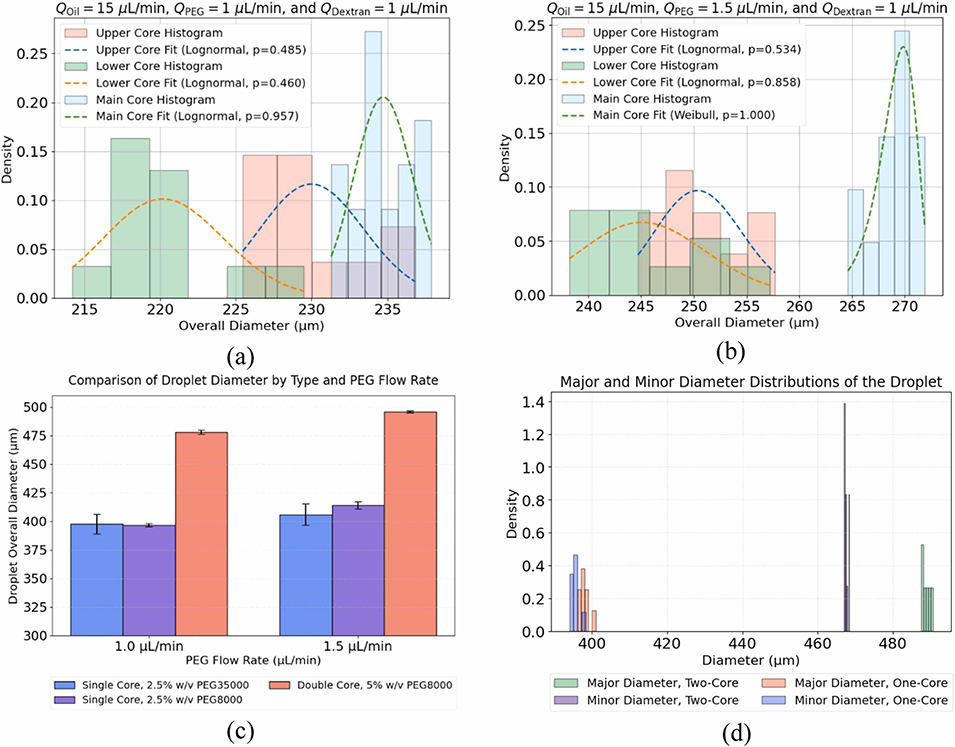
图16:单芯与双芯双乳液的几何特性对比:(a-b)核心直径分布及概率密度函数拟合;(c)乳液总直径对比;(d)长径与短径对比,突出乳液对称性差异。
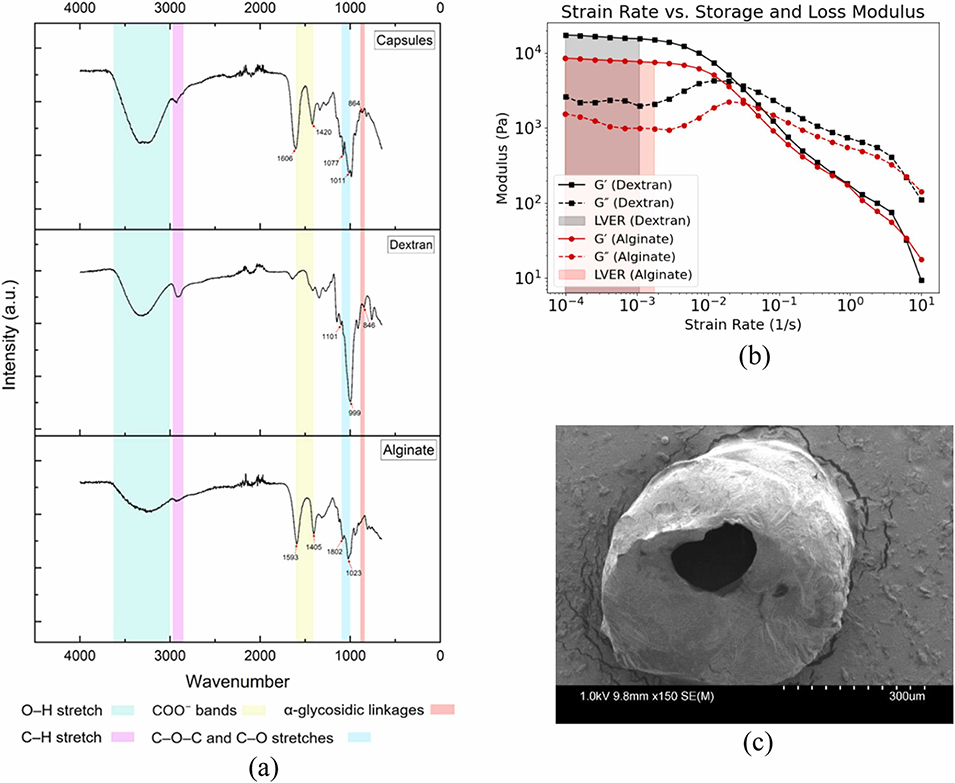
图17:交联胶囊的表征:(a)傅里叶变换红外(FTIR)光谱,验证海藻酸盐-葡聚糖的交联作用;(b)纯海藻酸盐水凝胶与葡聚糖增强型海藻酸盐水凝胶的粘弹性(储能模量G'与损耗模量G'')对比;(c)冻干胶囊的扫描电子显微镜(SEM)图像。

图18:(a)微通道内交联胶囊的可视化图像;(b)清洗后的交联胶囊;(c)交联胶囊的荧光图像。
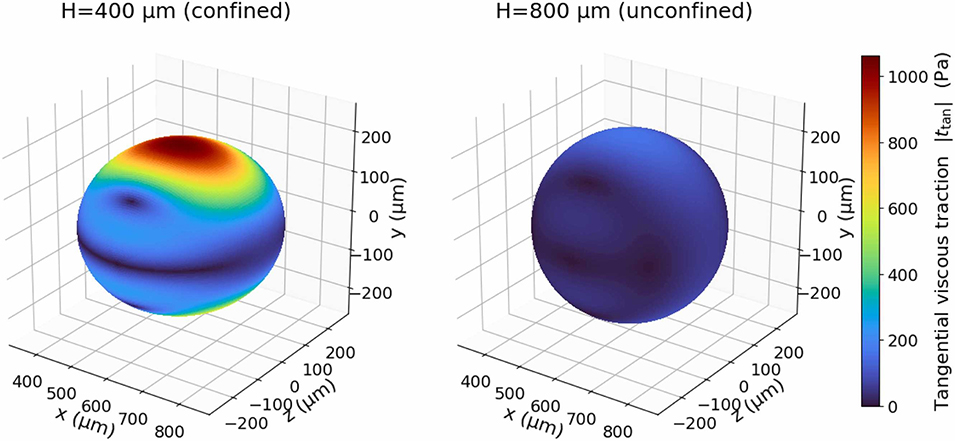
图19:受限(400μm高)与非受限(800μm高)两种设计中,双乳液表面的绝对切向剪切应力等高线。
论文链接:https://doi.org/10.1016/j.colsurfa.2025.138315
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














