
导读:
近期,斯坦福大学Joseph M. DeSimone教授团队开发了一种基于注射连续液体界面生产(iCLIP)技术的新型微流控微针贴片(MAP)。该贴片实现了复杂微流道与空心微针的一体化成型,支持多种载荷形式的透皮递送,包括液体药物共递送、原位混合及冻干制剂复溶,显著提升了给药能力和应用灵活性。相关研究以“Free-Form Microfluidic Microneedle Array Patches”为题发表于期刊《Advanced Functional Materials》。
本文要点:
1、本研究聚焦于开发一种集成微流体通道的微针阵列贴片(MAPs),旨在解决传统微针在载药量、递送多样性和规模化制造方面的局限,为透皮给药提供更高效、灵活的解决方案。
2、采用注射连续液体界面生产(iCLIP)这一增材制造技术,成功制备出高精度、可重复几何结构的复合微流体MAPs。其微针设计有侧开口孔,能降低插入时堵塞风险,保障透皮流体稳定递送,且可通过调整微针高度(600-900μm)实现不同深度的靶向给药,经猪皮和有限元分析验证,微针具备良好的皮肤穿透性与机械完整性,插入时不易断裂。
3、在功能验证方面,该微流体MAPs展现出出色的递送多样性:在小鼠体内实验中,能快速、精准递送液体载荷(如荧光素酶mRNA脂质纳米颗粒),24小时内表达水平可与皮内、肌内注射媲美,且呈剂量依赖性;可通过双独立微流体网络同时递送两种不同载荷(如mRNA和荧光标记卵清蛋白),效果与皮内注射相当;借助微流体反应器,能在给药点实时混合两种试剂并发生化学反应(如产生荧光产物)后递送;还可在储库中冻干固体载荷(如卵清蛋白),使用时用缓冲液复溶后快速递送,初期荧光信号与皮内注射相近。
4、不过,该技术要实现临床转化仍面临挑战,如需提升递送体积以匹配现有商用产品,还要将制造流程适配良好生产规范(GMP)标准。未来研究将围绕免疫原性、长期储存稳定性、大动物模型中的大体积递送及工业化生产可行性展开,以推动其在广泛治疗领域的应用。
传统基于数字光处理(DLP)的3D打印技术在制造内嵌微流道等负空间结构时,紫外光会在已固化的树脂层内散射和积累,导致通道内壁被意外固化而堵塞,这就是“overcuring”问题。
iCLIP技术的革命性在于将被动的液槽式打印变为主动的树脂注射过程。其关键物理机制如下:
1、机械冲洗与氧抑制协同作用:在打印过程中,通过构建平台上的微流道入口,主动将新鲜的、含有溶解氧的树脂注入到正在形成的微流道网络中。
2、维持“死区”未固化状态:溶解氧作为天然的自由基抑制剂,能有效抑制打印区域附近树脂的过早聚合。持续的树脂流动不仅带走了可能被过度曝光的热点区域的热量,还不断补充抑制剂(氧气),从而在微观尺度上精确控制固化边界,确保高深宽比的微流道在打印过程中始终保持畅通。
3、实现真正的三维自由制造:这一机制允许打印机在制造实心微针结构等需要高曝光量的区域和制造中空流道等需要避免曝光的区域之间无缝切换,从而能够一次性、一体化地制造出此前无法实现的复杂三维微流控结构。
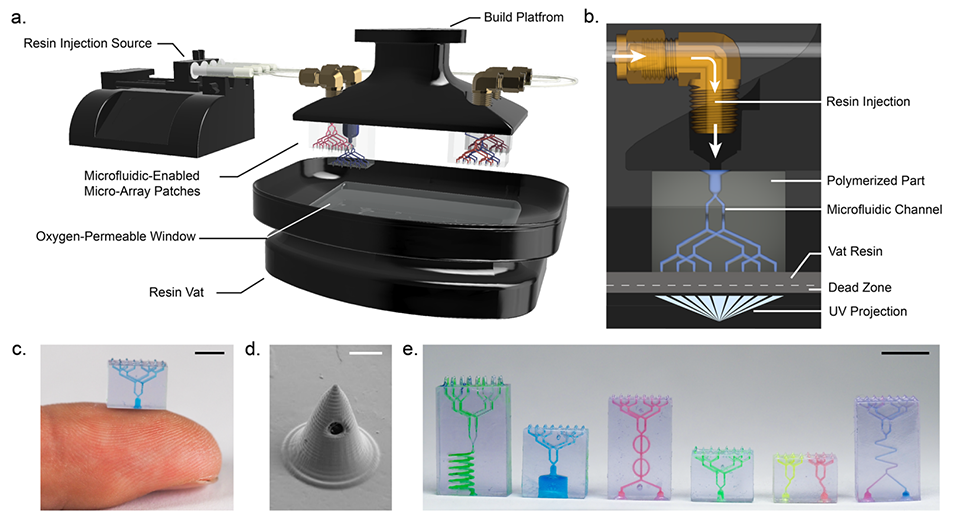
图1. 中空微流控MAP的设计。

图2. 中空微针的设计与性能。
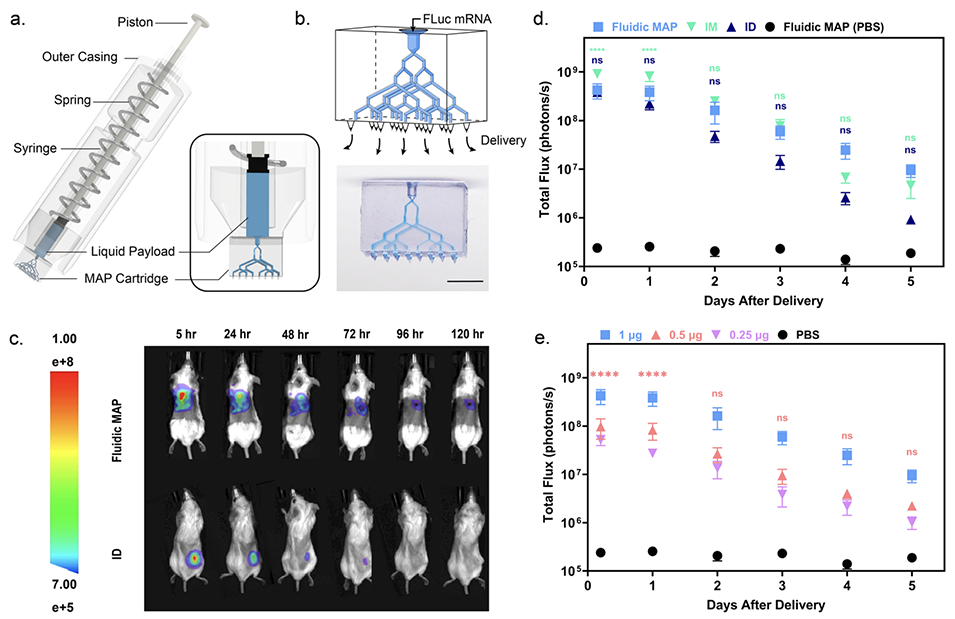
图3. 微流体MAP在小鼠体内递送萤火虫荧光素酶(FLuc)mRNA LNPs。
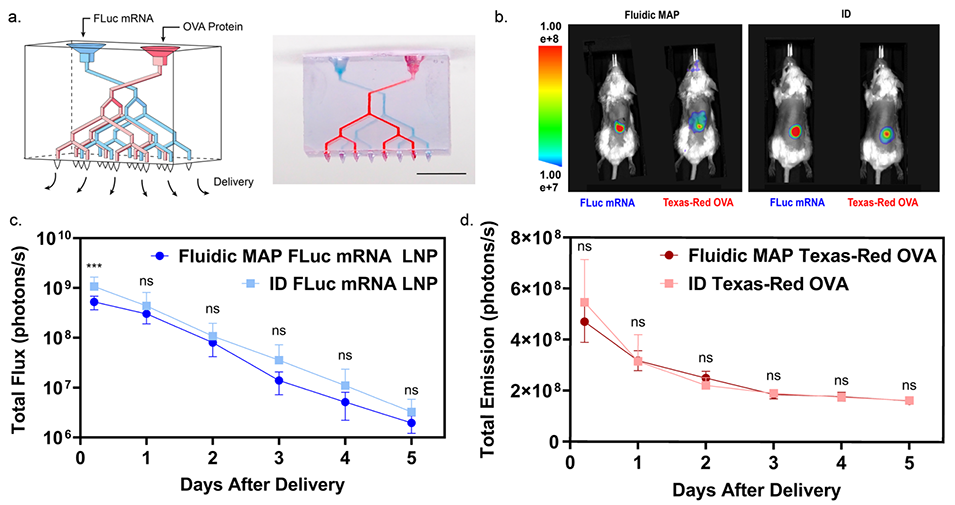
图4. 使用微流控MAP经皮递送多种载荷。
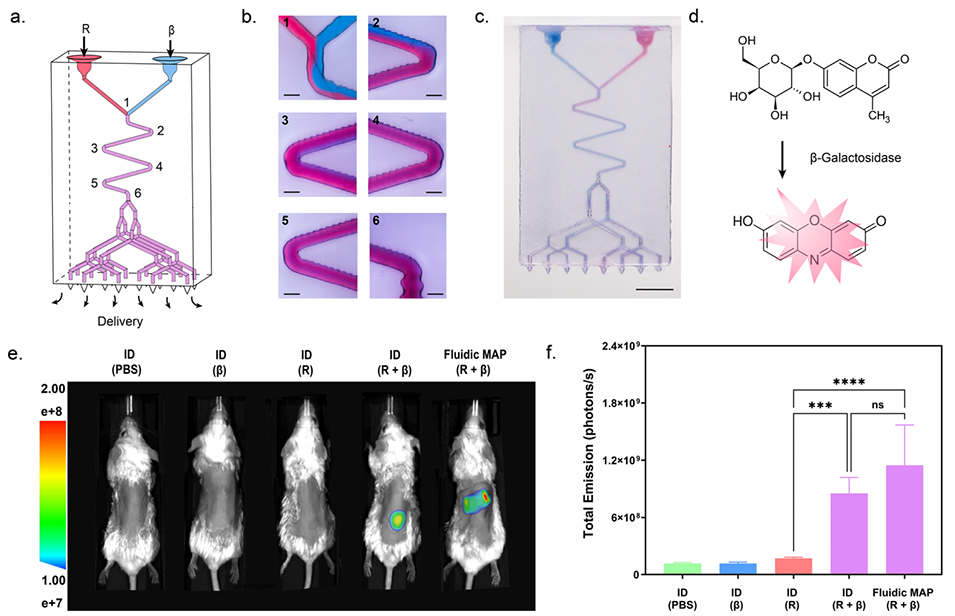
图5. 采用混合微流体MAP进行复合载荷的在体经皮递送
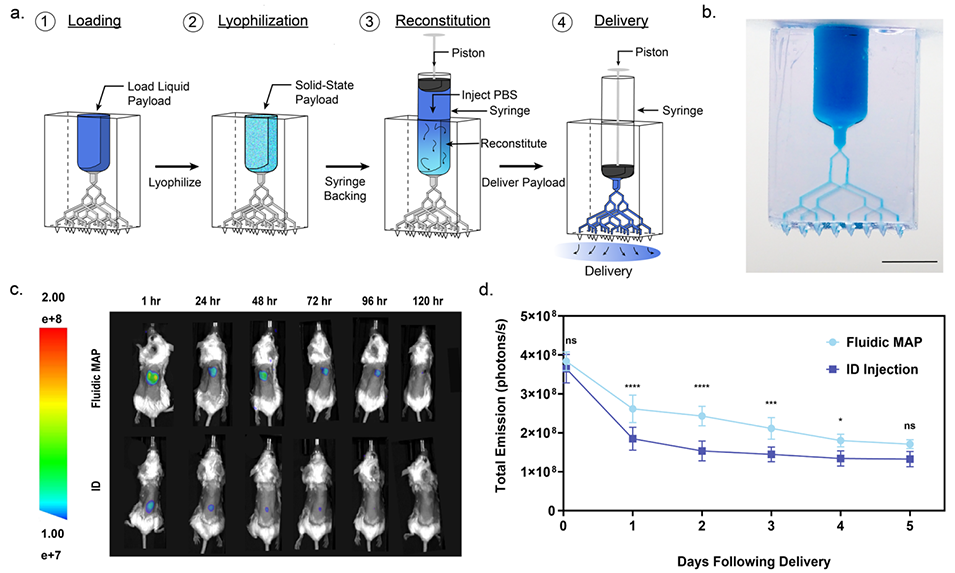
图6. 使用微流控MAP经皮递送固态冻干有效载荷。
论文链接:https://doi.org/10.1002/adfm.202514879
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














