外泌体是纳米级脂质双层囊泡,通过递送核酸和蛋白质等生物活性分子来介导细胞间通讯。其中,来源于唾液腺上皮干细胞(sgESC-Exos)的外泌体通过递送抗纤维化microRNA,如miR-1290和miR-3162,在唾液腺模型中表现出抗纤维化作用。然而,它们的临床转化受到低产量和颗粒异质性的阻碍。

为了应对这些挑战,有研究人员开发了一种基于反向Tesla结构微流控芯片的仿生策略,通过模拟天然外泌体的脂质组成并高效包封治疗性miRNA,成功制备出理化性质均一、可规模化生产的类外泌体纳米颗粒(ENPs)。该ENPs不仅产量显著提升,更在细胞摄取效率和抗纤维化治疗中展现出优越性能。相关研究以“Microfluidic Generation of Exosome‐Mimetic Nanoparticles for Scalable Production and Enhanced Therapeutic Efficacy”为题目,发表在期刊《Small》上。
本文要点:
1、本研究针对唾液腺上皮干细胞来源外泌体(sgESC-Exos)在抗纤维化治疗中应用受限的问题——产量低、颗粒异质性强,开发了一种基于微流控芯片的外泌体模拟纳米颗粒(ENPs)。
2、使用与反特斯拉结构微混合器集成的微流体芯片,高效混合脂质与水相,自组装形成粒径均匀、可高效封装核酸的ENPs。
3、所得外泌体模拟纳米颗粒在理化性质上与天然外泌体相似,且具备更均一的特性及更高的核糖核酸负载效率。
4、实验表明,其细胞摄取效率提高约21倍,伤口愈合速率提升两倍。该研究为外泌体仿生纳米药物提供了一个可规模化生产、具有临床转化潜力的强大平台。
微流控芯片是本研究的核心技术平台,其作用远不止于简单的混合,而是实现了对纳米颗粒合成过程的精确控制,从而解决了传统方法的关键局限。具体作用如下:
1、实现高效、均匀混合与自组装:在低雷诺数(Re)的层流条件下,传统的直线型微通道混合效率极低。本研究设计的反向特斯拉结构能通过不对称的流阻产生涡流和分支流汇聚,从而极大地增强了脂质乙醇相与水相缓冲液的混合效率。计算流体动力学(CFD)模拟显示,在优化的通道尺寸(200 μm宽,200 μm高)下,混合效率可超过95%。这种高效且均匀的混合是形成单分散性(低PDI)纳米颗粒的前提。
2、保障纳米颗粒的单分散性和理化性质:高效的混合确保了脂质分子能够均一地自组装成结构一致的纳米颗粒。与传统的薄膜水化法相比,微流控制备的ENPs具有更窄的粒径分布(更低的多分散指数PDI)和更均一的形态,其尺寸(≈140 nm)和结构(球形)更接近于天然的sgESC-Exos,这对于其在体内的长效循环和穿透组织的能力至关重要。
3、实现连续化生产和卓越的可扩展性:微流控系统采用连续流生产方式,克服了薄膜水化法等批次化生产工艺固有的批间差异问题。这种连续化操作模式是实现高通量、大规模生产的关键,原文指出其日产量(4.2 × 10¹⁵ particles/day)相比外泌体提取方法提升了约8万倍,彻底解决了天然外泌体产量低的瓶颈,为临床转化铺平了道路。
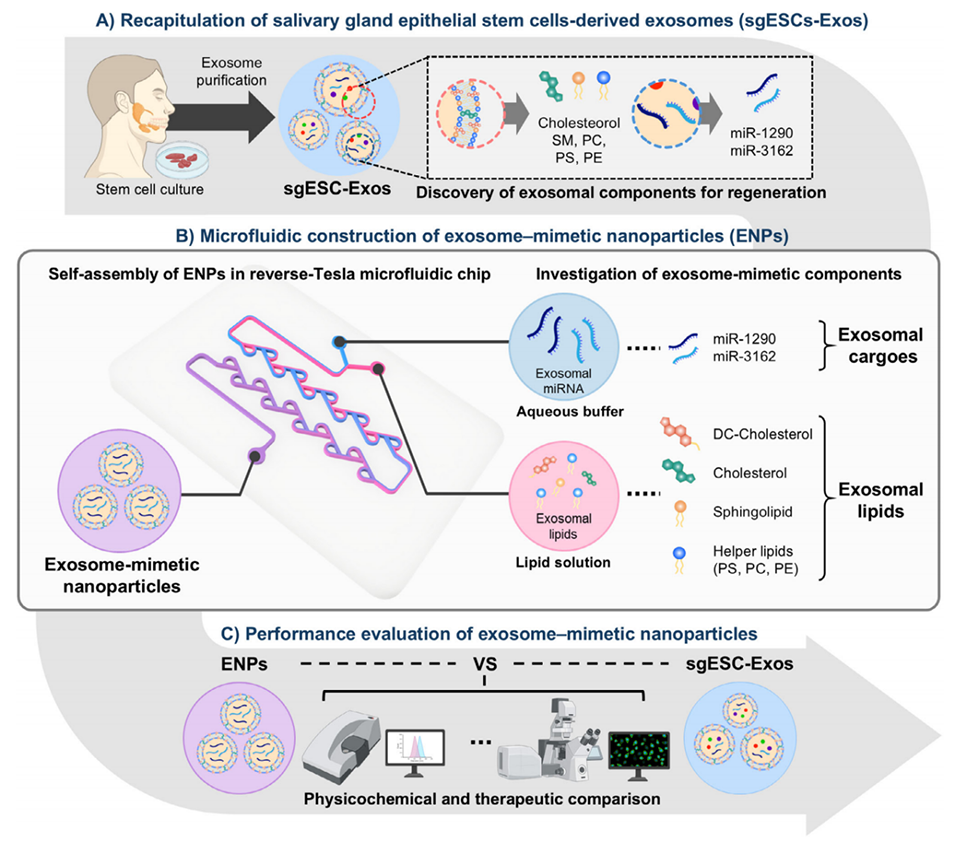
图1. 模拟唾液腺上皮干细胞外泌体(sgESC-Exos)的策略示意图,包括 A)模拟sgESC-Exos所需成分的研究、B)利用含反向特斯拉结构的微流控芯片制备模拟外泌体纳米颗粒(ENPs)的过程、C)ENPs与sgESC-Exos的理化性质表征及治疗效果对比评价。
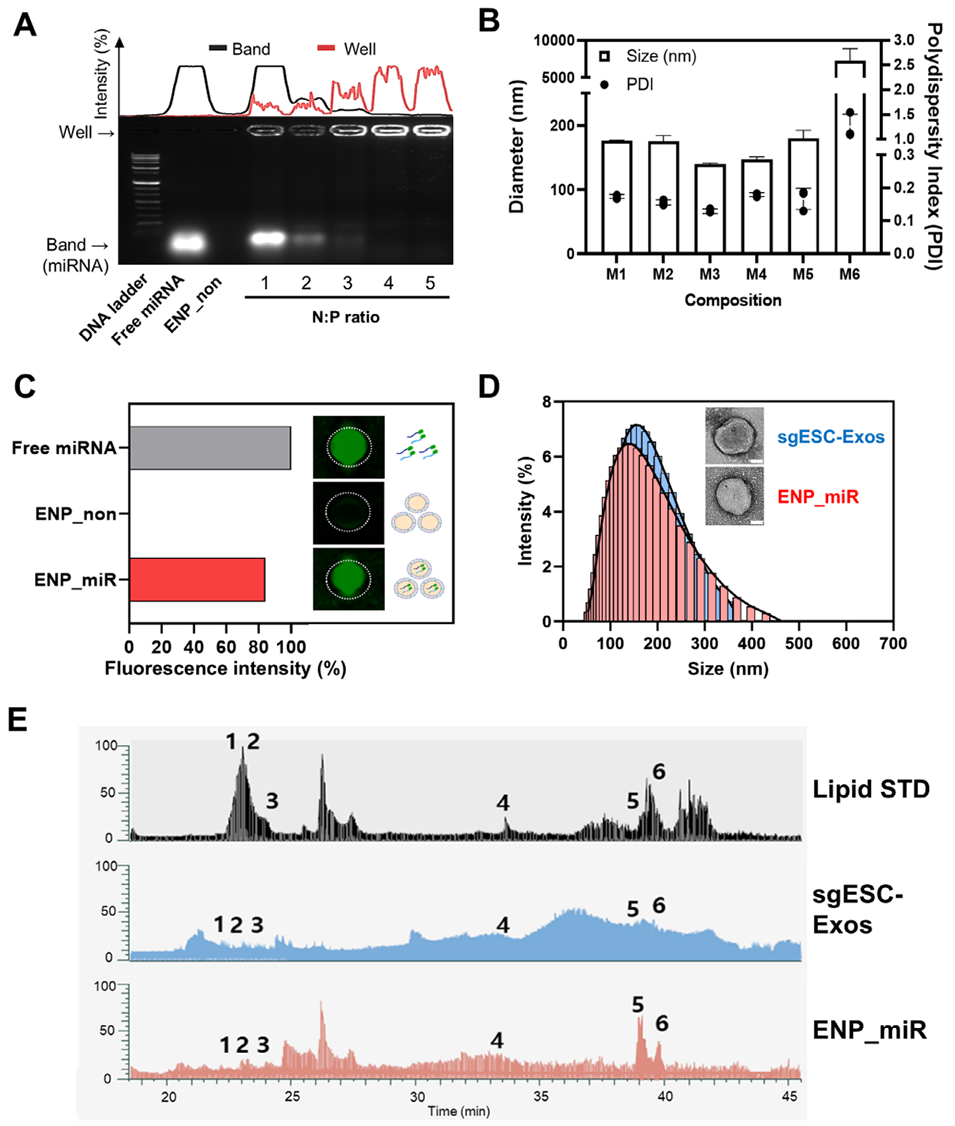
图2. 采用薄膜水化法制备的ENPs的表征与优化。
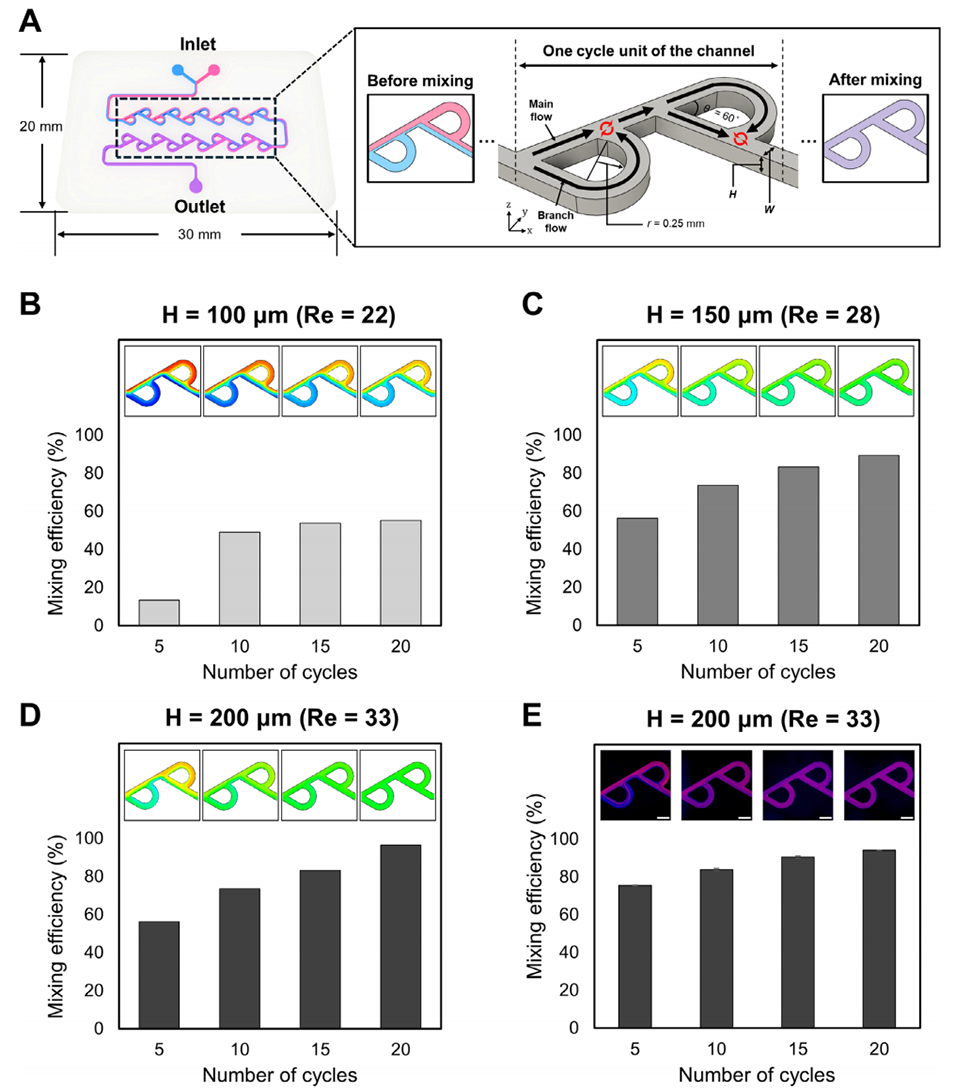
图3. ENP制备用芯片尺寸与循环次数的设计。
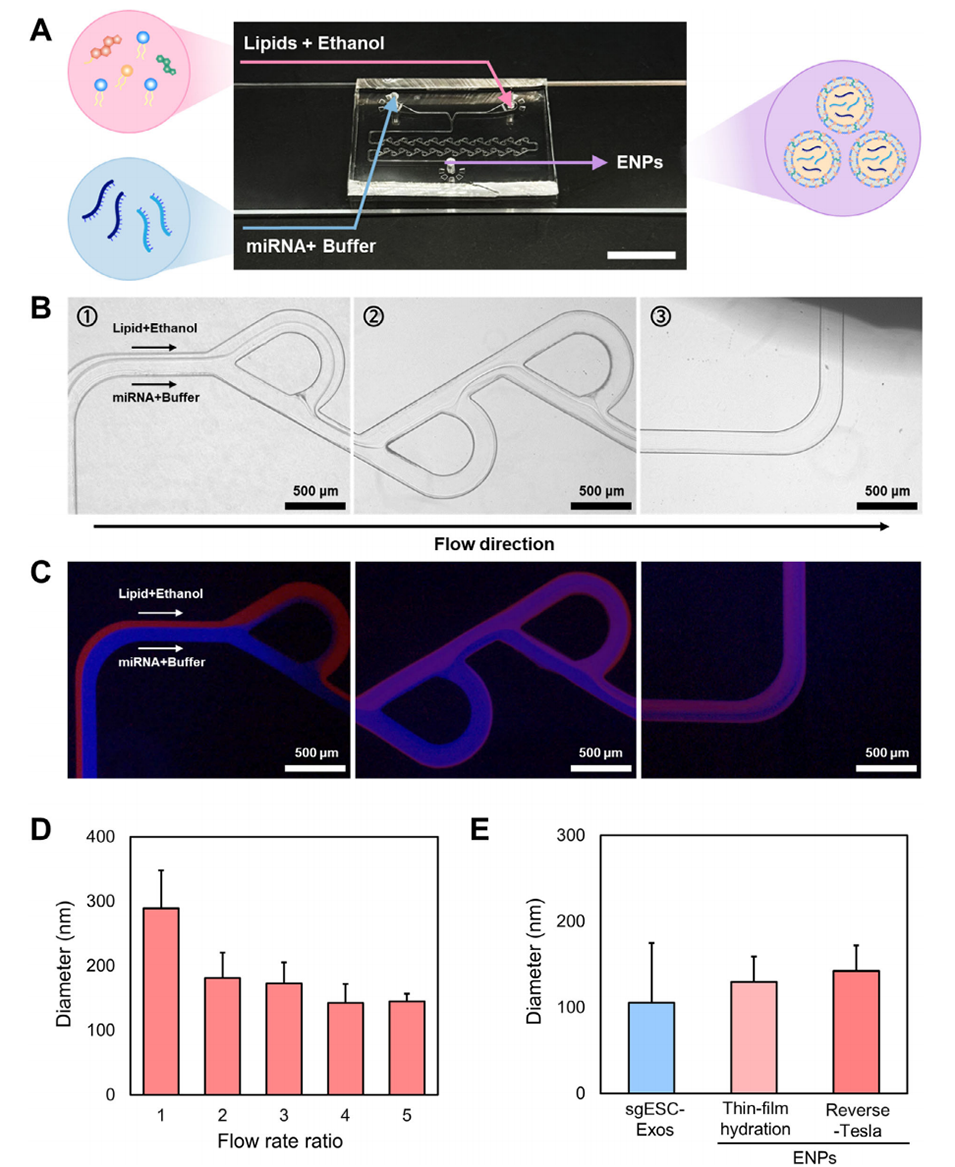
图4. 反向特斯拉微流控芯片制备ENPs的性能。
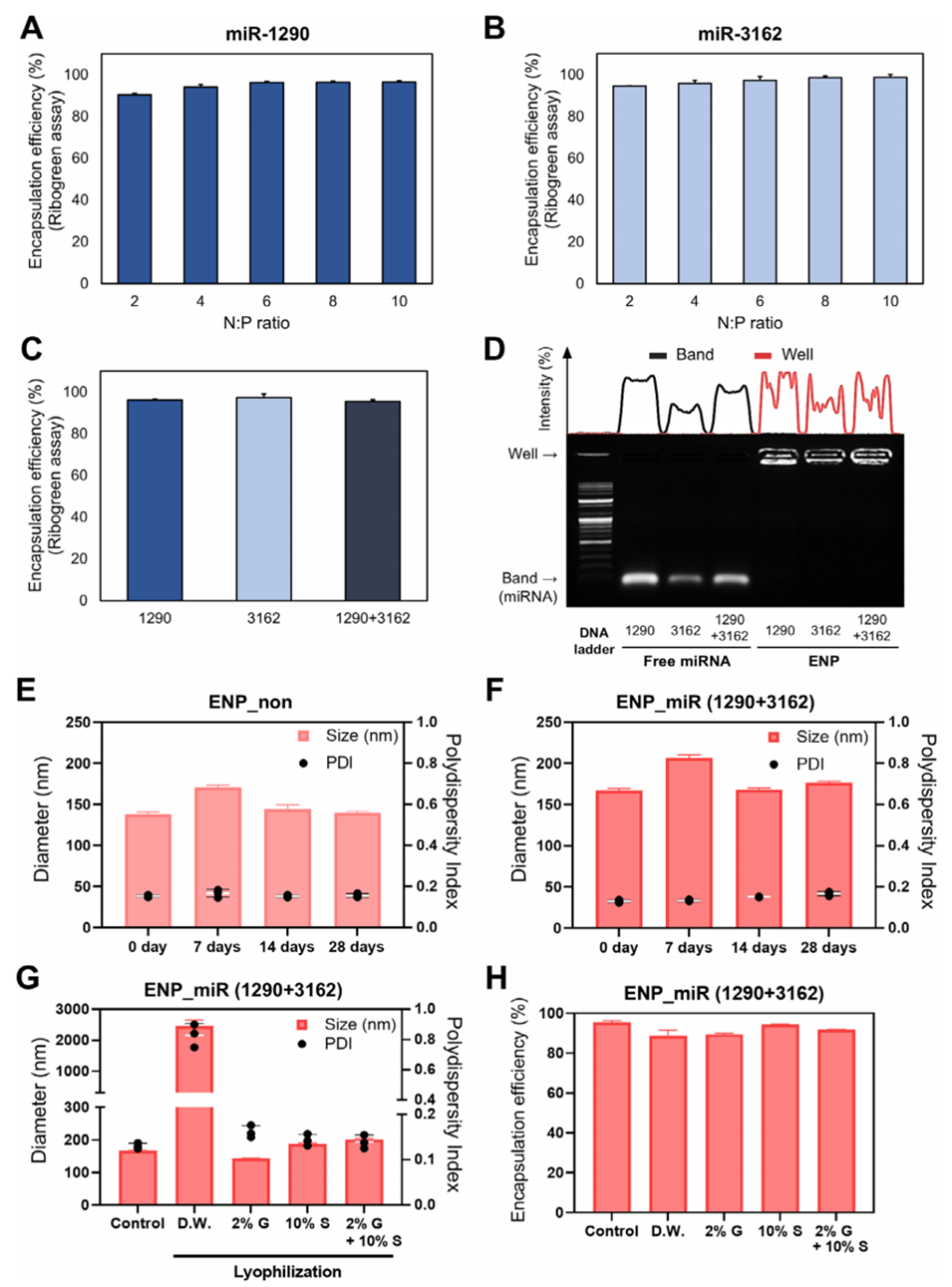
图5. 氮磷比(N:P)对miRNA负载ENPs封装效率的影响及ENPs在储存与冻干条件下的稳定性评价。
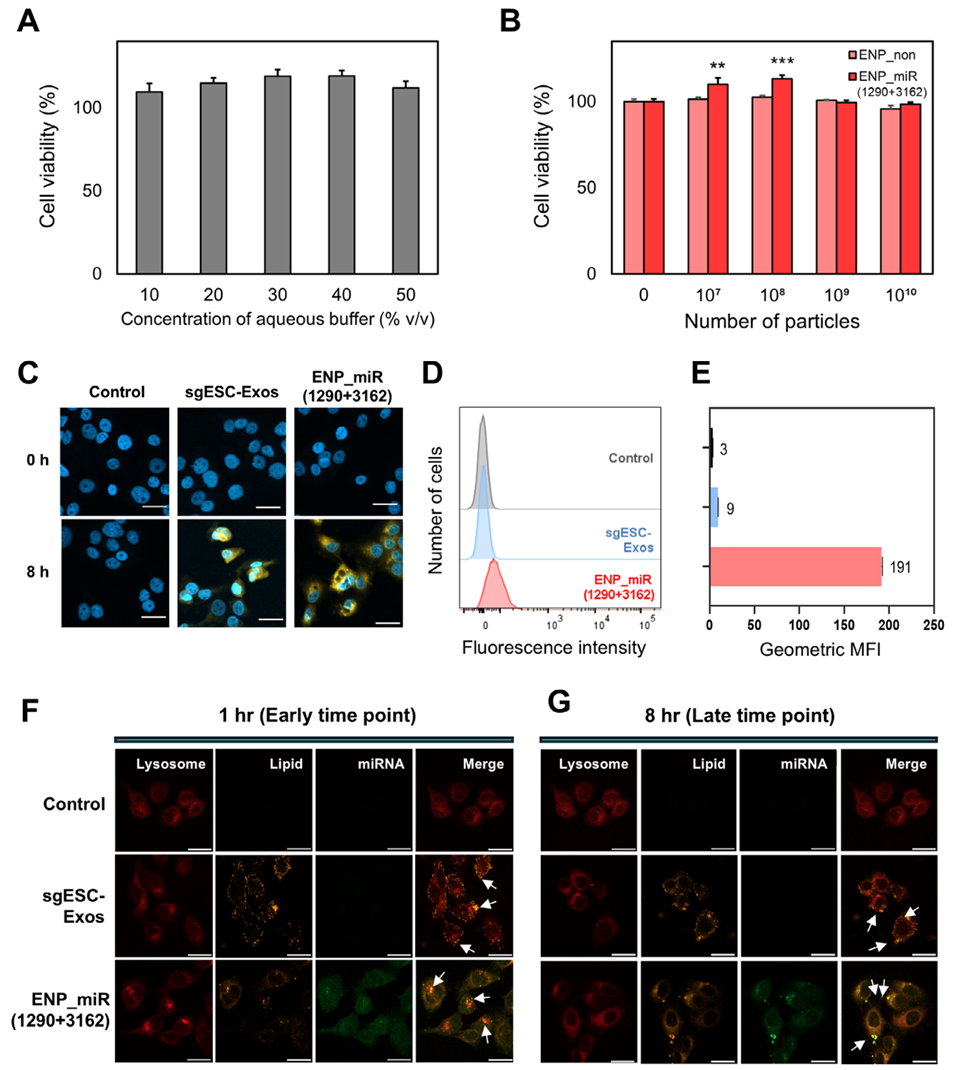
图6. ENPs的生物相容性与细胞摄取评价。
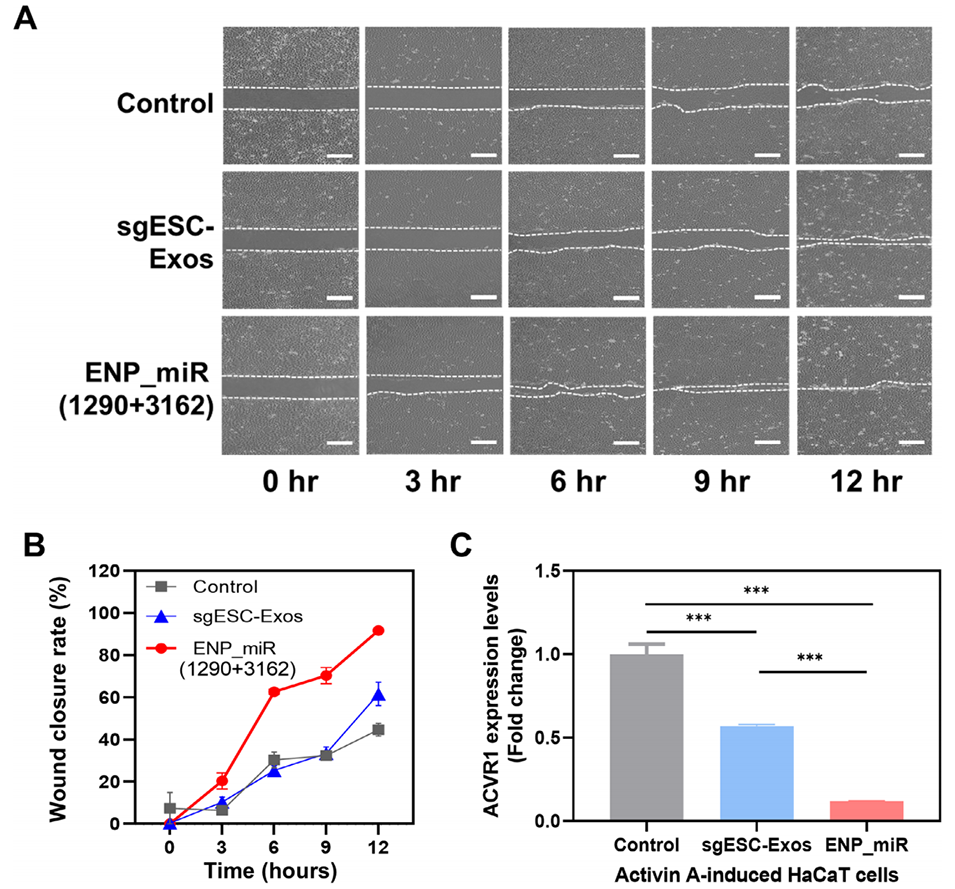
图7. ENP制剂的体外疗效评价。
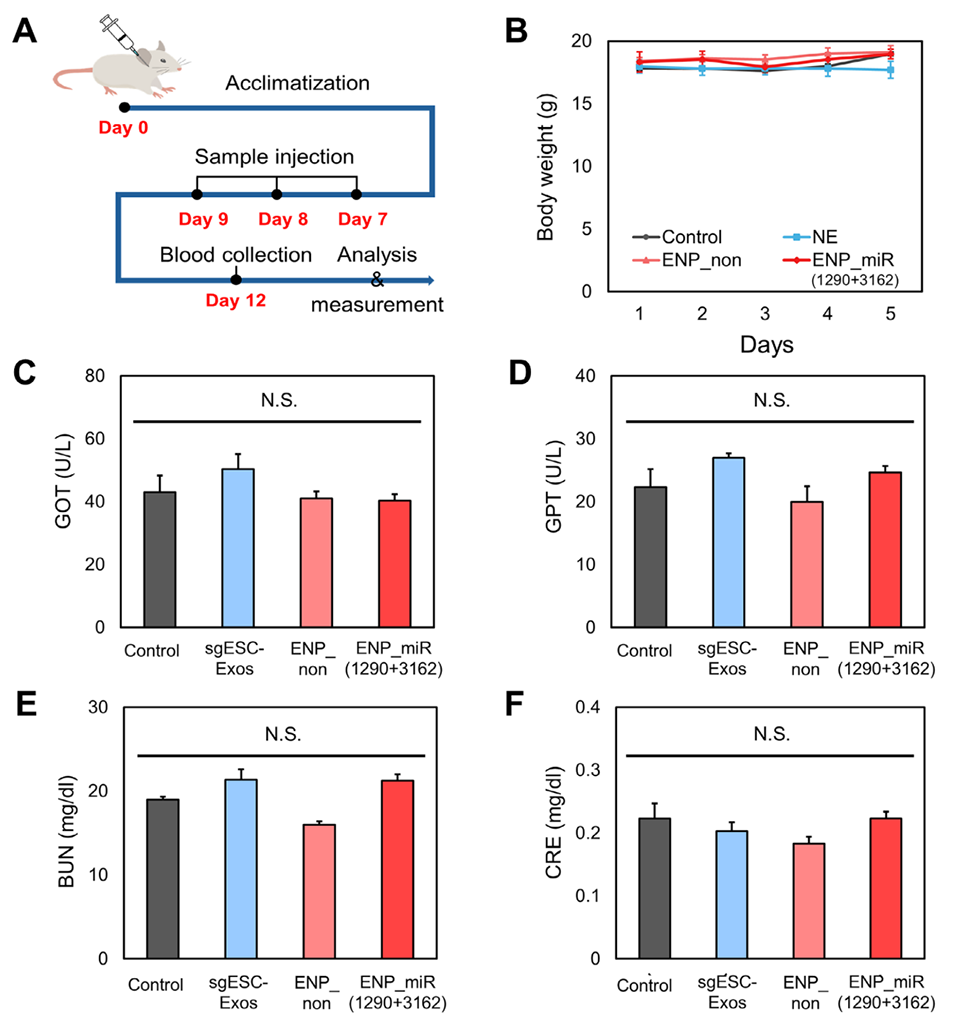
图8. A)小鼠口腔黏膜局部应用ENPs的体内毒性测试时间线示意图。B)各纳米颗粒制剂处理后小鼠的体重变化。血清生化指标:C)谷草转氨酶(GOT)、D)谷丙转氨酶(GPT)、E)血尿素氮(BUN)、F)肌酐(CRE)。数据以平均值±标准差表示(n=3)。N.S.表示与对照组无显著差异。
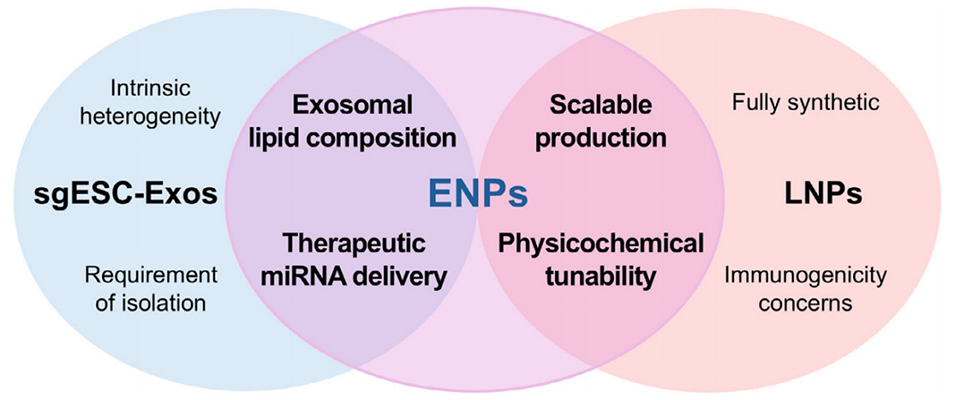
图9. 展示sgESC-Exos、ENPs与LNPs各自特征及交叉特征的维恩图。
论文链接:https://doi.org/10.1002/smll.202506162
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














