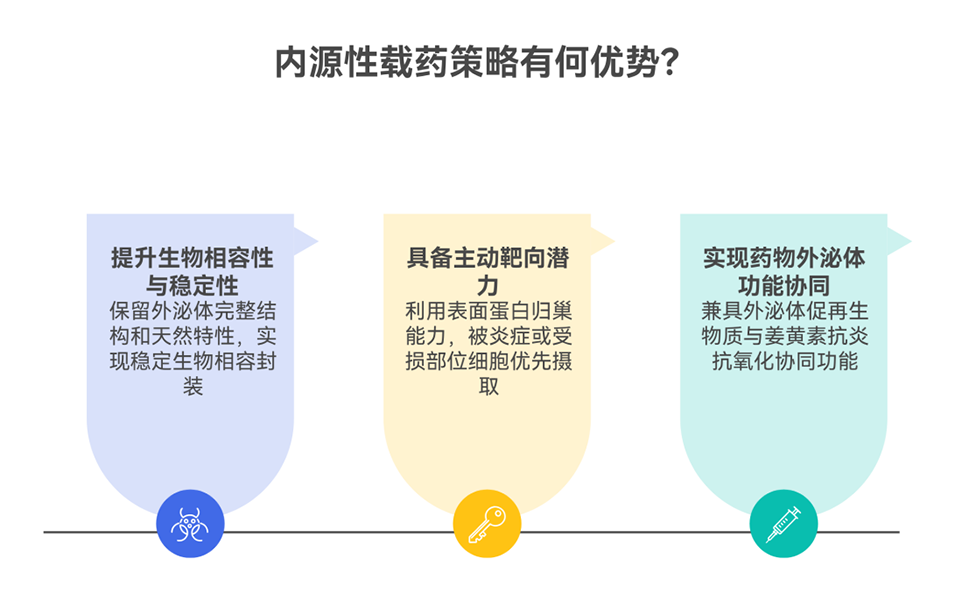
临界尺寸骨缺损修复因成骨分化受抑、骨组织微环境恶劣及炎症反应异常,一直是临床治疗的重大难题。间充质干细胞外泌体(MSC-Exos)虽在组织修复中展现出良好再生潜力,但其治疗效能有限、靶向能力不足且局部滞留率低,难以满足临床骨缺损修复需求。

鉴于此,中山大学生物医学工程学院张超教授团队联合中山大学附属第七医院Xiaorong Li等人开发了一种新型复合微球系统(CE@BP-Gel)。该系统通过微流控技术将载姜黄素外泌体(Cur@Exos)封装于双磷酸盐修饰的GelMA水凝胶微球中,实现活性成分的缓释与靶向递送。研究表明,该微球不仅可调控巨噬细胞向M2型极化、抑制破骨活性以改善免疫微环境,还可直接促进成骨分化与血管生成,并通过激活TDP1酶修复DNA损伤,从而协同促进骨缺损修复。相关研究以“Curcumin-encapsulated exosomes in bisphosphonate-modified hydrogel microspheres promote bone repair through macrophage polarization and DNA damage mitigation”为题目,发表在期刊《Materials Today Bio》上。
本文要点:
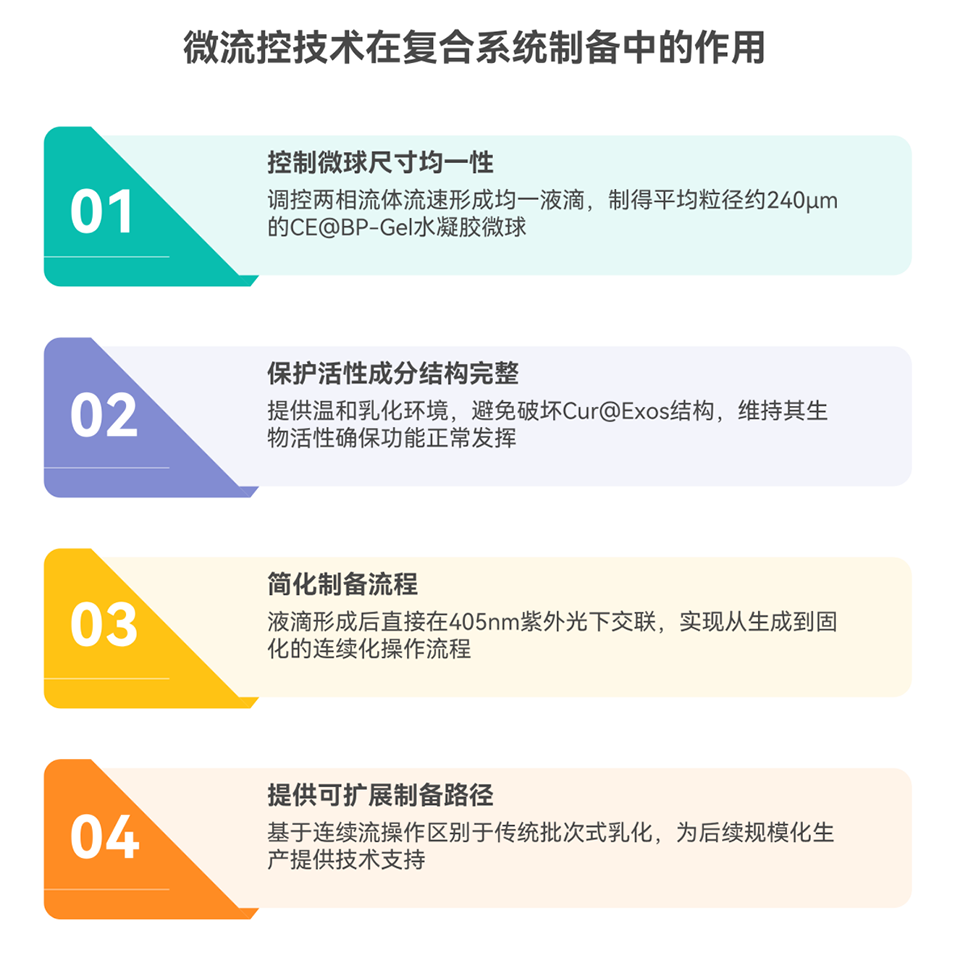
1、本研究以MSC-Exos为载体,经内源性载药制备姜黄素负载外泌体(Cur@Exos),并通过微流控技术将其封装于双膦酸盐(是抗骨吸收的一类新药)修饰的GelMA水凝胶微球(CE@BP-Gel)。
2、该微球生物相容性佳,可加速生物矿化,持续释放的Cur@Exos能调控RAW264.7细胞向M2型极化、抑制破骨活性,营造成骨免疫微环境,还可直接促进BMSCs成骨分化及HUVECs血管生成。
3、体内实验显示其显著加速SD大鼠临界尺寸颅骨缺损修复。进一步的机制研究表明,CE@BP-Gel可减轻炎症环境中ROS诱导的DNA损伤,包埋的姜黄素通过激活TDP1酶增强DNA修复,减少巨噬细胞炎症因子表达,为骨缺损修复提供新策略。
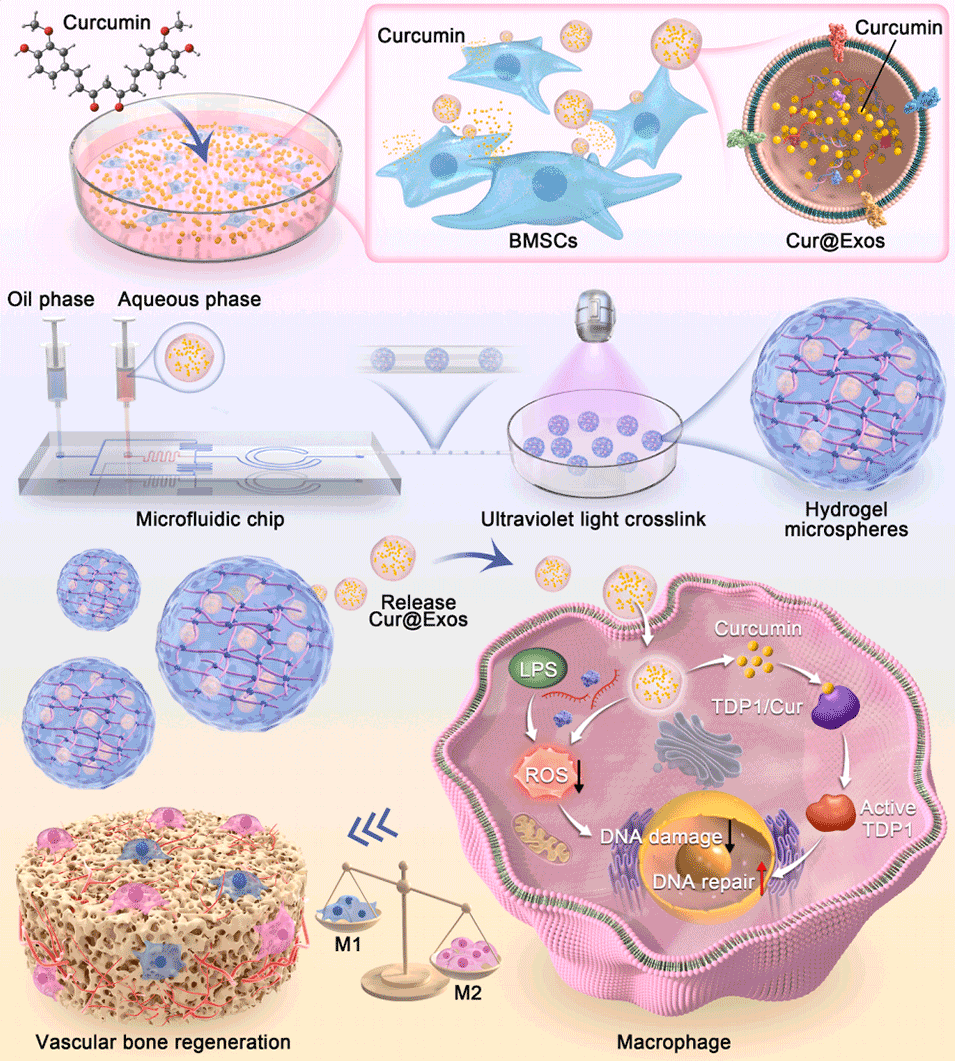
Scheme 1:CE@BP-Gel微球的制备路线及作用机制示意图
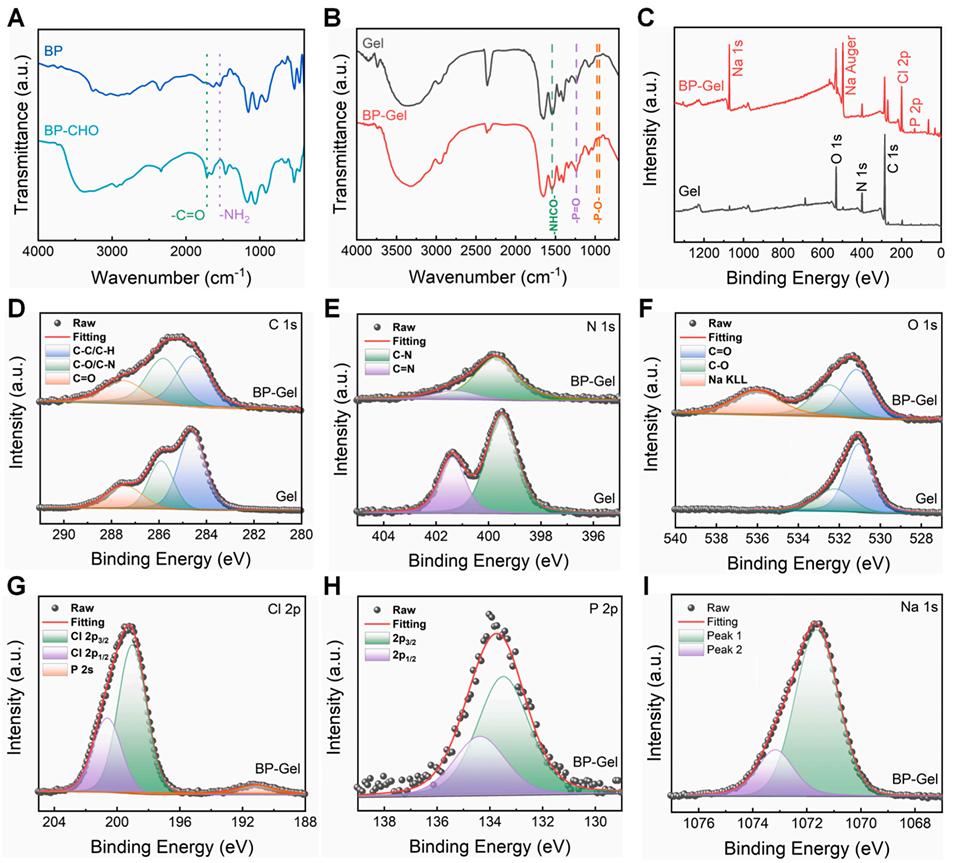
图1:双膦酸盐修饰 GelMA 水凝胶的表征。(A)醛基修饰双膦酸盐(BP-CHO)的傅里叶变换红外光谱(FTIR);(B)双膦酸盐修饰 GelMA 水凝胶(BP-Gel)的 FTIR 光谱;(C)BP-Gel 的 X 射线光电子能谱(XPS)全谱;(D-I)BP-Gel 的高分辨 XPS 谱图:(D)C 1s、(E)N 1s、(F)O 1s、(G)Cl 2p、(H)P 2p、(I)Na 1s
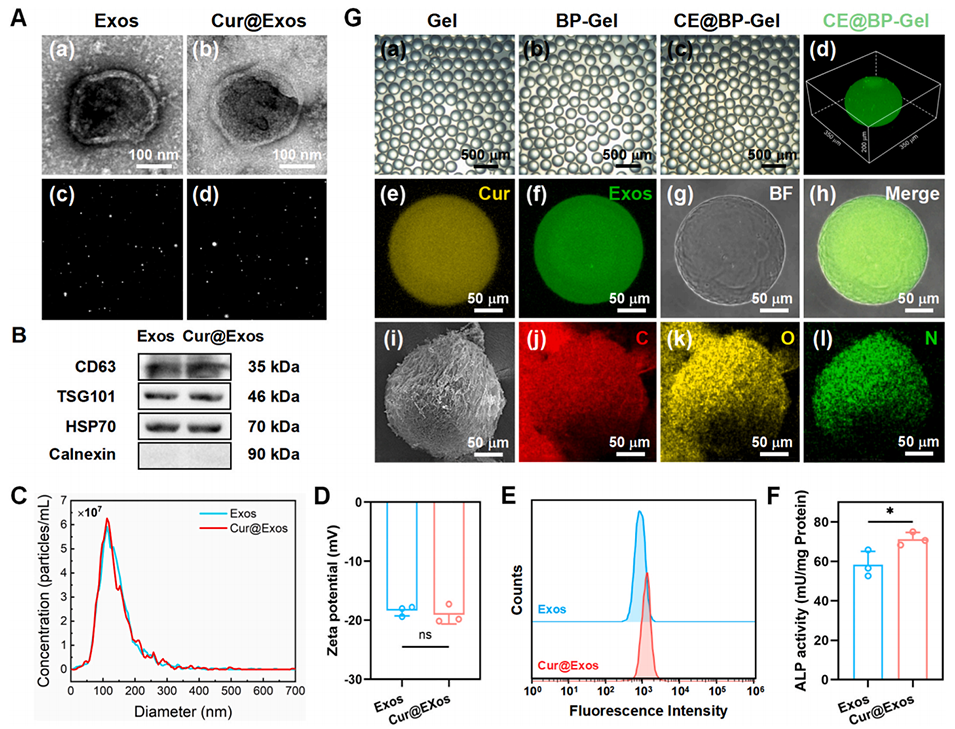
图2:姜黄素负载外泌体(Cur@Exos)及 CE@BP-Gel 微球的表征。(A)间充质干细胞外泌体(Exos)与 Cur@Exos 的透射电镜(TEM)图及布朗运动图(a、c 为 Exos;b、d 为 Cur@Exos);(B)外泌体表面标志蛋白的 Western blot 鉴定;(C)外泌体浓度与粒径分布的纳米颗粒跟踪分析(NTA);(D)Exos 与 Cur@Exos 的 zeta 电位;(E)基于流式细胞术的 Cur@Exos 免疫调控性能分析;(F)Cur@Exos 诱导骨髓间充质干细胞(BMSCs)产生的碱性磷酸酶(ALP)活性;(G)水凝胶微球表征:(a-c)水凝胶微球光学图;(d)包裹 PKH-67 标记 Cur@Exos 的水凝胶微球三维形貌图;(e-h)荧光标记 CE@BP-Gel 微球的激光共聚焦显微镜观察图;(i-l)CE@BP-Gel 微球的元素分布图(n=3,*p<0.05,**p<0.01)
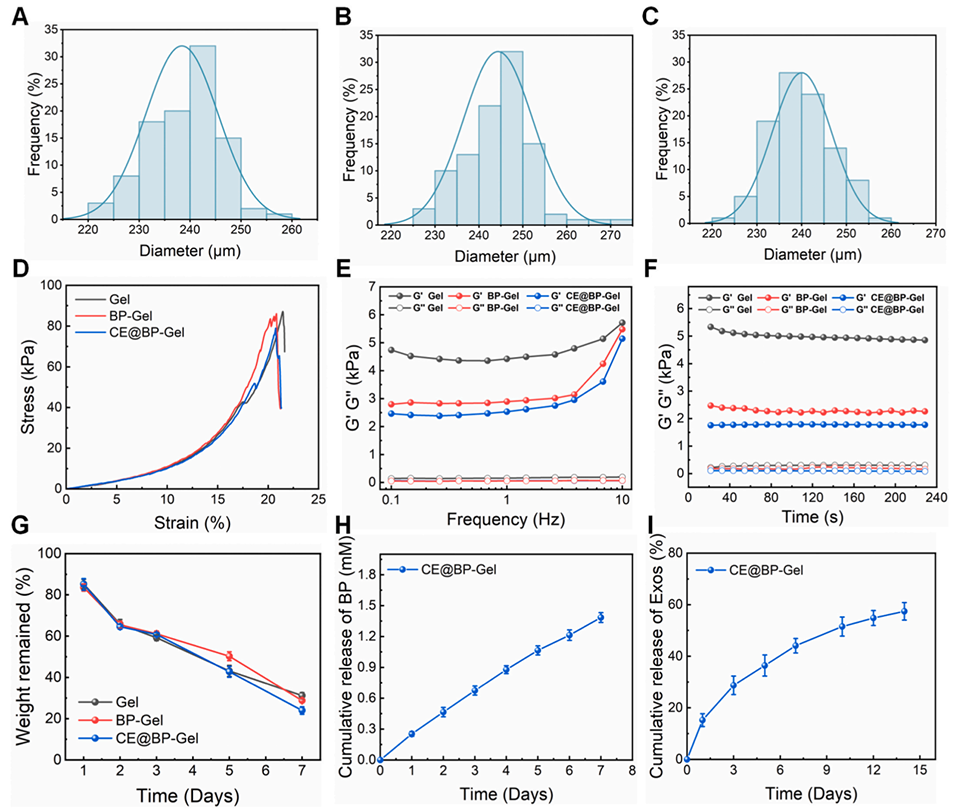
图3:水凝胶微球的表征。(A)纯 GelMA 水凝胶(Gel)、(B)BP-Gel、(C)CE@BP-Gel 的粒径分布;(D)水凝胶的压缩应力-应变曲线;(E)水凝胶的频率扫描流变曲线;(F)水凝胶的时间扫描流变曲线;(G)水凝胶微球在含 0.5 U/mL II 型胶原酶与 100 mM 过氧化氢的磷酸盐缓冲液(PBS)中的降解行为;(H)CE@BP-Gel 微球中双膦酸盐(BP)的释放曲线;(I)CE@BP-Gel 微球中外泌体的释放曲线
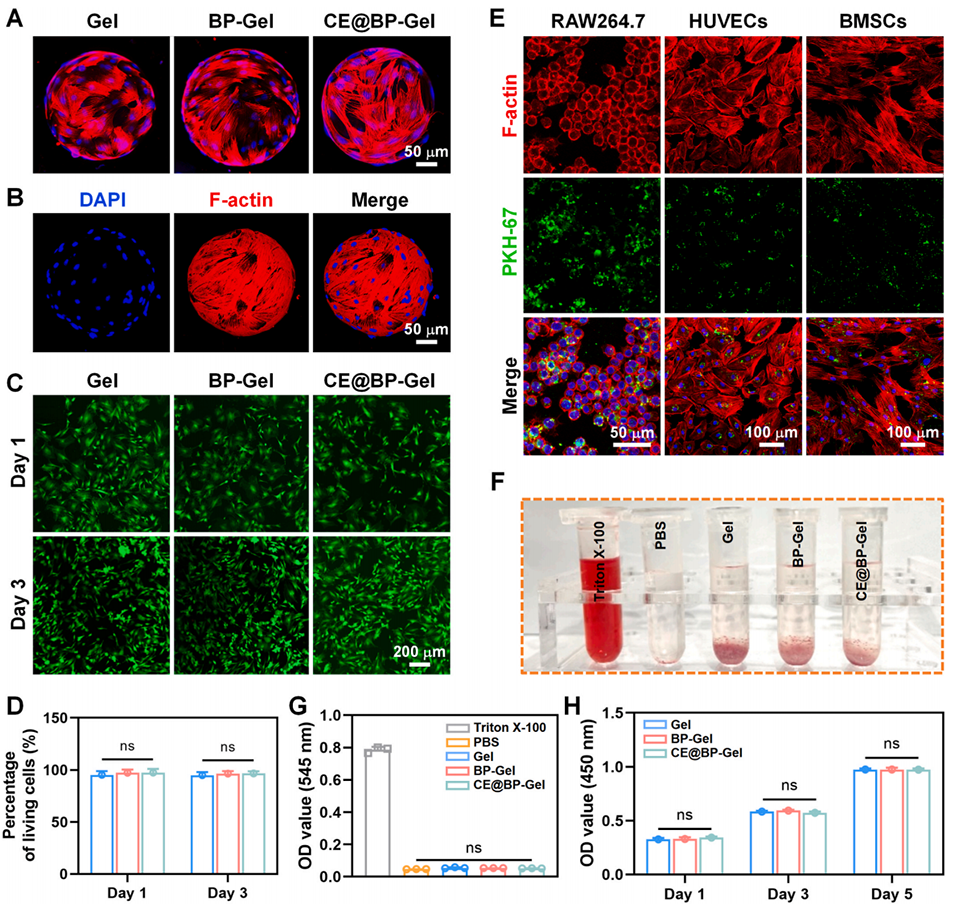
图4:水凝胶微球的生物相容性评价。(A)BMSCs 在水凝胶微球表面孵育 24 小时后的形态观察;(B)BMSCs 黏附于 CE@BP-Gel 表面的三维形貌图;(C)BMSCs 与水凝胶微球共孵育后的活/死染色(活细胞呈绿色,死细胞呈红色);(D)活细胞百分比定量统计;(E)RAW264.7 细胞、人脐静脉内皮细胞(HUVECs)及 BMSCs 对 CE@BP-Gel 中 Exos 的摄取情况;(F)溶血实验照片;(G)水凝胶微球与红细胞共孵育的溶血率检测;(H)BMSCs 在水凝胶微球浸提液中的增殖情况
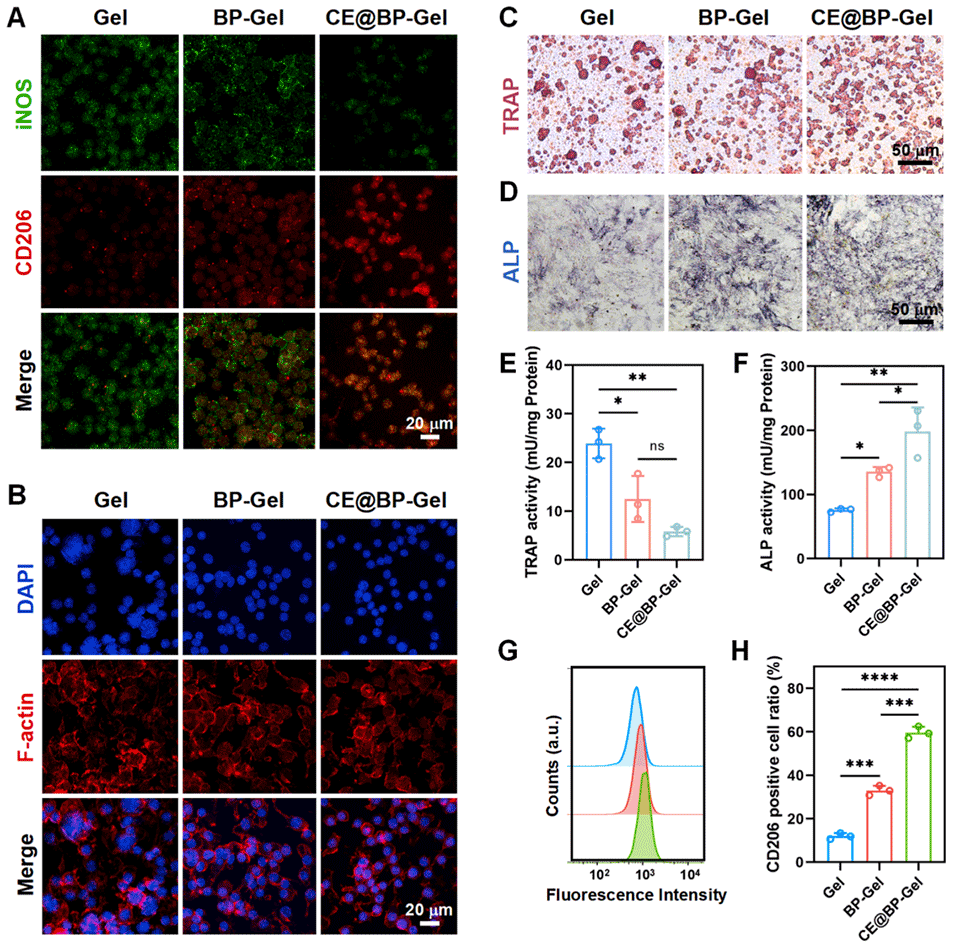
图5:水凝胶微球的免疫调控性能。(A)RAW264.7 细胞中诱导型一氧化氮合酶(iNOS)与 CD206 的代表性免疫荧光图;(B)前破骨细胞与水凝胶微球浸提液共孵育后的形态;(C)前破骨细胞与水凝胶微球浸提液共培养后的抗酒石酸酸性磷酸酶(TRAP)染色;(D)BMSCs 与 RAW264.7 细胞共培养并经 7 天成骨诱导后的 ALP 染色;(E)前破骨细胞与水凝胶微球浸提液孵育后的 TRAP 活性检测;(F)BMSCs 与 RAW264.7 细胞共培养并经 7 天成骨诱导后的 ALP 活性检测;(G)基于流式细胞术的水凝胶微球免疫调控性能分析;(H)CD206 阳性 RAW264.7 细胞的定量统计(n=3,*p<0.05,**p<0.01,***p<0.001,****p<0.0001)
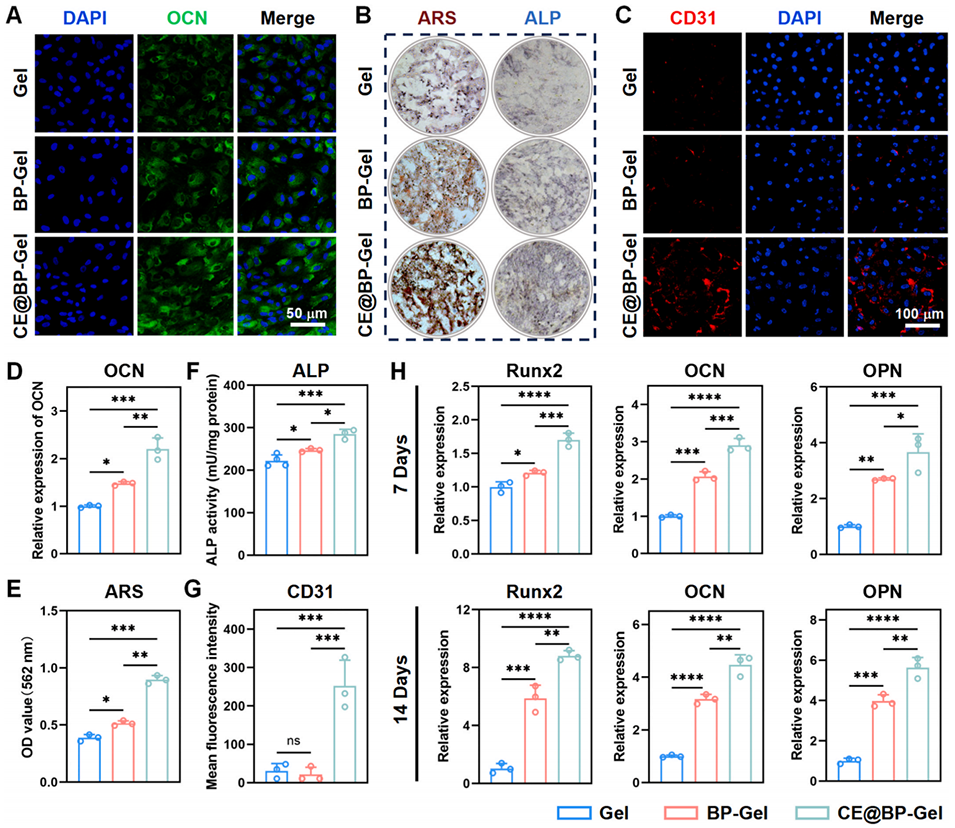
图6:水凝胶微球的成骨与血管生成性能。(A)BMSCs 经 14 天成骨诱导后的骨钙素(OCN)免疫荧光图;(B)BMSCs 经 7 天、14 天成骨诱导后的 ALP 染色与茜素红 S(ARS)染色;(C)HUVECs 中 CD31 的免疫荧光图;(D)OCN 平均荧光强度(MFI)定量统计;(E)ARS 染色液定量检测;(F)7 天龄 BMSCs 的 ALP 活性定量分析;(G)CD31 平均荧光强度定量统计;(H)BMSCs 成骨诱导后成骨相关基因的表达(n=3,*p<0.05,**p<0.01,***p<0.001,****p<0.0001)

图7:水凝胶微球的体外矿化评估。(A)CE@BP-Gel 在模拟体液(SBF)中矿化 14 天后的扫描电镜(SEM)图与元素分布图;(B)矿化水凝胶微球表面磷灰石纳米颗粒的 SEM 图;(C)CE@BP-Gel 微球表面的元素质量百分比;(D)矿化水凝胶微球的 FTIR 光谱;(E-G)矿化水凝胶微球的 XPS 分析:(E)XPS 全谱;(F)Ca 2p 谱图;(G)P 2p 谱图
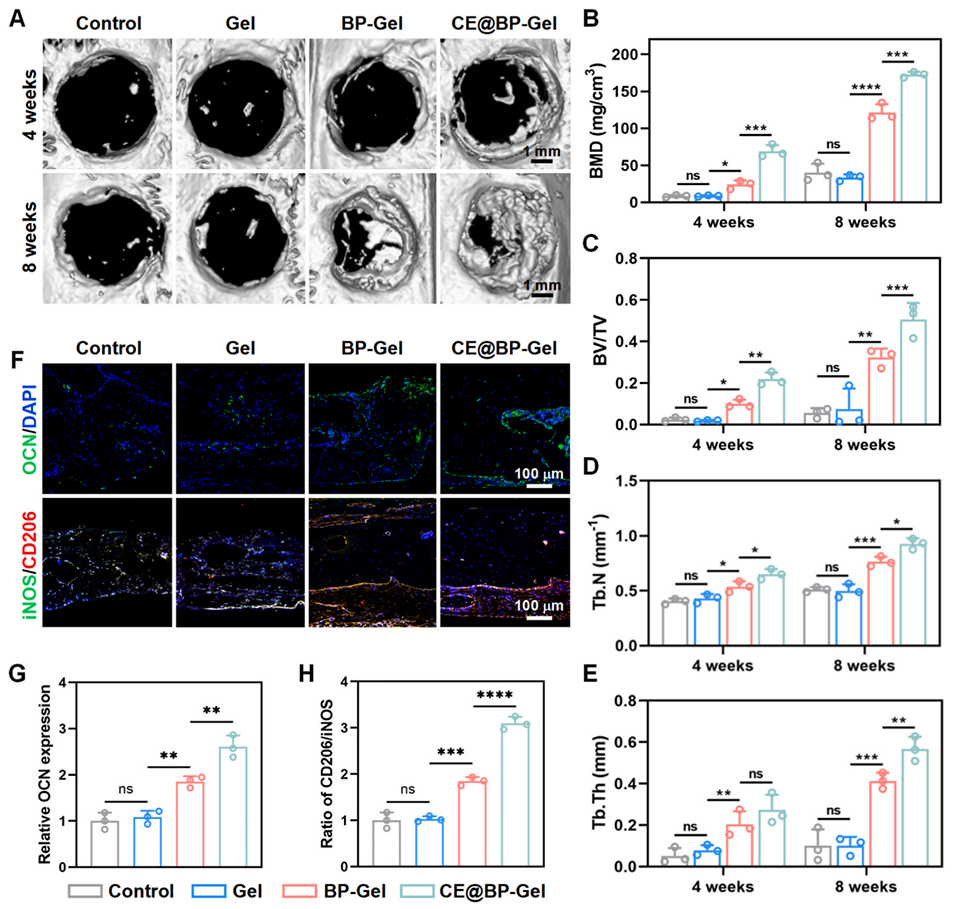
图8:水凝胶微球的体内骨修复评估。(A)SD 大鼠临界尺寸颅骨缺损的 Micro-CT 分析;新生骨组织的(B)骨矿物质密度(BMD)、(C)骨体积分数(BV/TV)、(D)骨小梁数量(Tb.N)、(E)骨小梁厚度(Tb.Th)定量统计;(F)骨缺损区 OCN、iNOS 与 CD206 的免疫荧光染色;(G)骨缺损区 OCN 的定量统计;(H)骨缺损区 CD206/iNOS 比值的定量统计(n=3,*p<0.05,**p<0.01,***p<0.001,****p<0.0001)
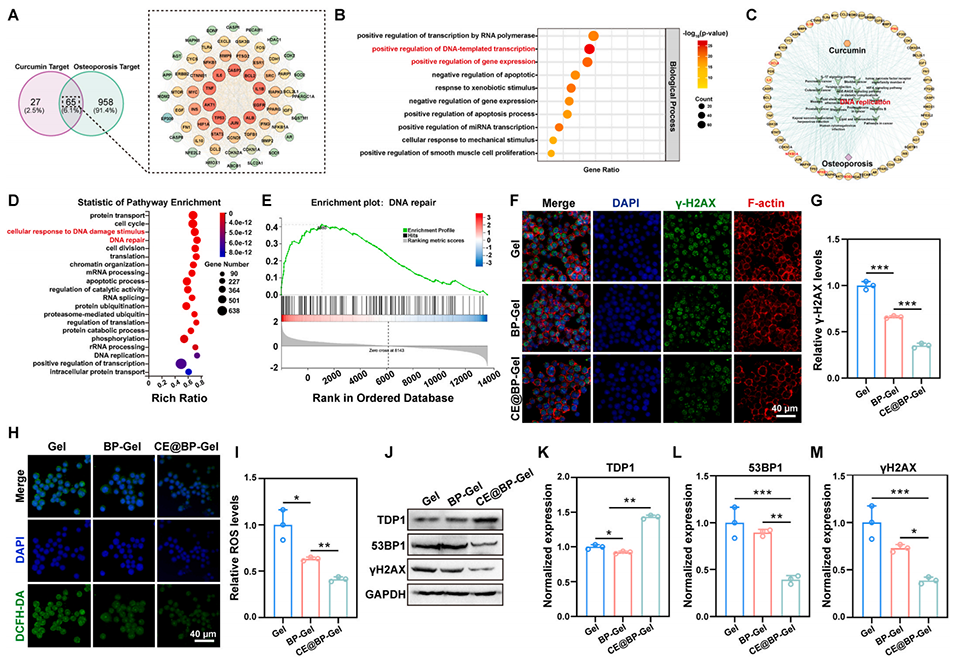
图9:CE@BP-Gel 的免疫调控机制。(A)姜黄素在免疫调控中的潜在靶点预测;(B)潜在靶点的生物学过程分析;(C)姜黄素与免疫调控的预测药物-靶点-疾病网络;(D)基于 RNA 测序的差异表达基因(DEGs)京都基因与基因组百科全书(KEGG)通路富集分析;(E)DNA 修复相关基因集的基因集富集分析(GSEA);(F)RAW264.7 细胞中 γ- 组蛋白 H2AX(γ-H2AX)的免疫荧光染色;(G)RAW264.7 细胞中 γ-H2AX 的相对表达量;(H)RAW264.7 细胞内活性氧(ROS)的表达;(I)细胞内 ROS 的相对表达量;(J)DNA 修复相关蛋白的表达;(K-L)蛋白表达的定量统计(n=3,*p<0.05,**p<0.01,***p<0.001)
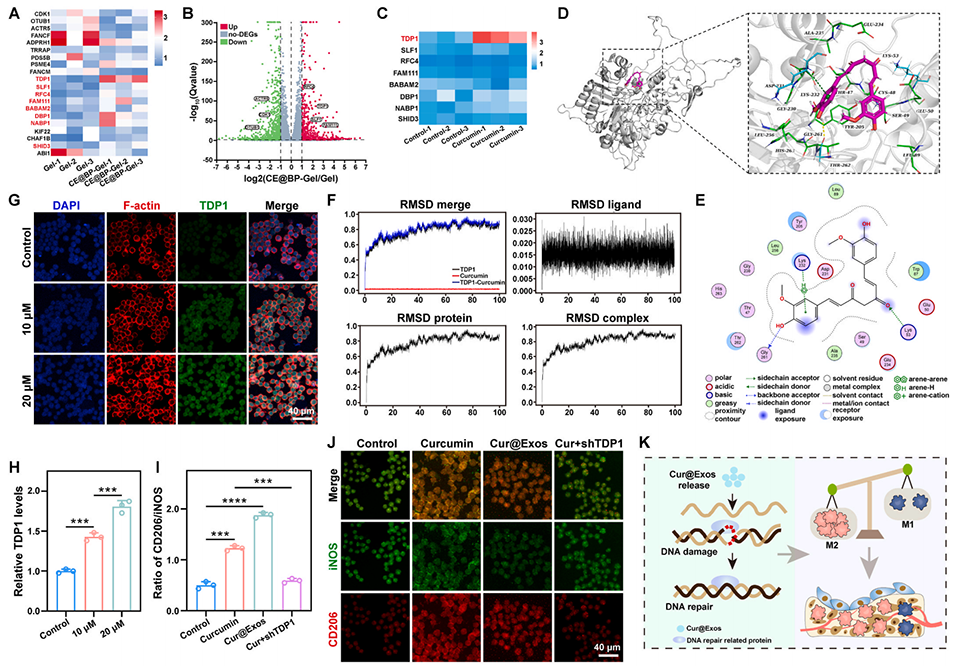
图10:CE@BP-Gel 在 DNA 损伤修复中的分子机制。(A)DNA 损伤修复相关基因的表达热图;(B)差异表达基因的火山图;(C)姜黄素诱导 RAW264.7 细胞中 DNA 损伤修复相关基因的表达;(D)姜黄素与 TDP1 靶点的分子对接;(E)姜黄素与 TDP1 蛋白结合位点的局部放大图;(F)姜黄素/TDP1 复合物的分子动力学模拟;(G)姜黄素处理 RAW264.7 细胞后 TDP1 的免疫荧光染色;(H)RAW264.7 细胞中 TDP1 的相对表达量;(I)CD206/iNOS 比值的定量统计;(J)RAW264.7 细胞中 CD206 与 iNOS 的免疫荧光染色;(K)Cur@Exos 免疫调控机制示意图(n=3,*p<0.05,**p<0.01,***p<0.001,****p<0.0001)
论文链接:https://doi.org/10.1016/j.mtbio.2025.101874
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














