当前骨修复方法(如自体骨/异体骨移植)存在免疫排斥、局部抗感染不足等问题。现有生物相容性支架虽能递送药物和细胞,但难同时满足均匀性、稳定性、可注射性及多功能性需求。此外,骨缺损修复中还面临细菌感染引发骨髓炎、活性氧(ROS)抑制成骨分化等挑战。

基于此,昆明理工大学灵长类转化医学研究院张磊副教授团队与昆明医科大学第三附属医院骨科肖砚斌副教授合作,开发了一种定制化同轴微流控系统,成功制备出兼具抗菌、活性氧(ROS)清除和促成骨功能的PDTH多孔复合微球,并通过体外实验与大鼠颅骨缺损模型验证,证实该微球能高效促进骨再生且生物安全性良好,为解决当前骨修复中免疫排斥、感染抑制及成骨效率低等难题提供了创新方案。相关研究以“Customized high-throughput microfluidic production of multifunctional porous microspheres for bone repair”为题发表于期刊《Biomaterials Advances》。
本文要点:
1、本研究开发了一种定制化同轴微流体系统,用于高通量制备多功能PDTH多孔微球(PDTH PMs),以促进骨修复。
2、该系统可精确控制微球尺寸与结构,制得均匀、稳定、具有连通孔道的PLGA微球,经聚多巴胺(PDA)修饰并负载含有妥布霉素(TOB)和羟基磷灰石(HA)的水凝胶,使其具备抗氧化、抗菌和成骨性能。
3、体外实验表明,该微球能有效促进骨髓间充质干细胞增殖、迁移及成骨分化。在大鼠颅骨缺损模型中,PDTH PMs显著增强新骨形成和骨矿物质密度,且体内生物安全性良好,未见明显器官毒性。
PDTH多孔微球各组分及其功能
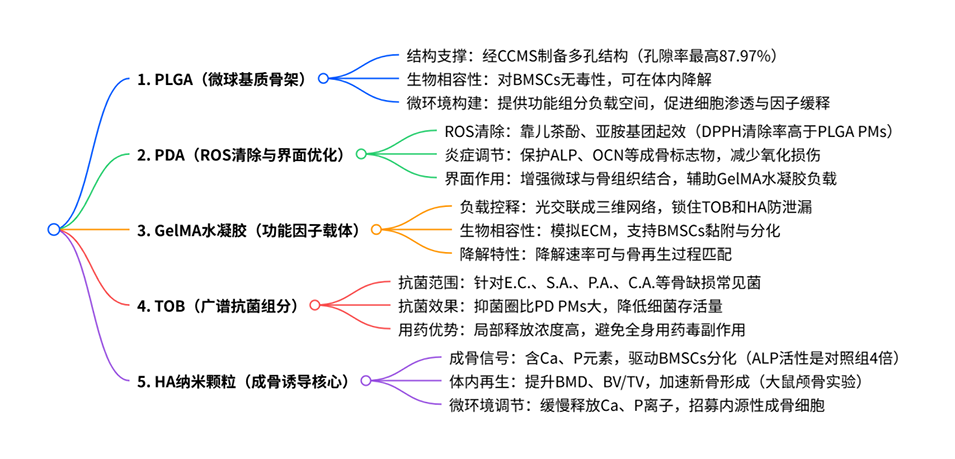
本研究的核心是“多功能集成”,但多组分(抗氧化、抗菌、成骨)的释放动力学可能并不一致。例如,妥布霉素(TOB)的快速释放可能需要在早期迅速抑制感染,而羟基磷灰石(HA)的长期缓慢释放则用于支持持续的成骨分化。这种不同步性如果设计得当,反而可以模拟骨修复的自然过程:先抗炎抗菌(早期),再促进成骨(中后期)。
本文中的策略依赖于材料自身的理化性质来控制释放,这是一种“被动”的调控。为了更智能地实现功能协同,未来的研究可以考虑:
1、层级设计:将不同功能成分封装在微球的不同层级或不同材料中。例如,将抗生素负载在最外层的凝胶中实现快速释放,而将生长因子负载在核心的PLGA中实现缓慢释放。
2、响应性释放:设计能响应微环境(如感染部位的低pH、高ROS浓度或特定酶)的智能材料。例如,ROS响应的化学键可以将抗生素的释放与炎症水平直接关联,实现“按需”释放,更加精准高效。
未来启示:多功能生物材料的设计不应是功能的简单堆砌,而应基于对病理进程的深刻理解,进行时空调控的精密设计。未来的研究将致力于开发出能够感知并响应体内微环境变化的“智能”递送系统。
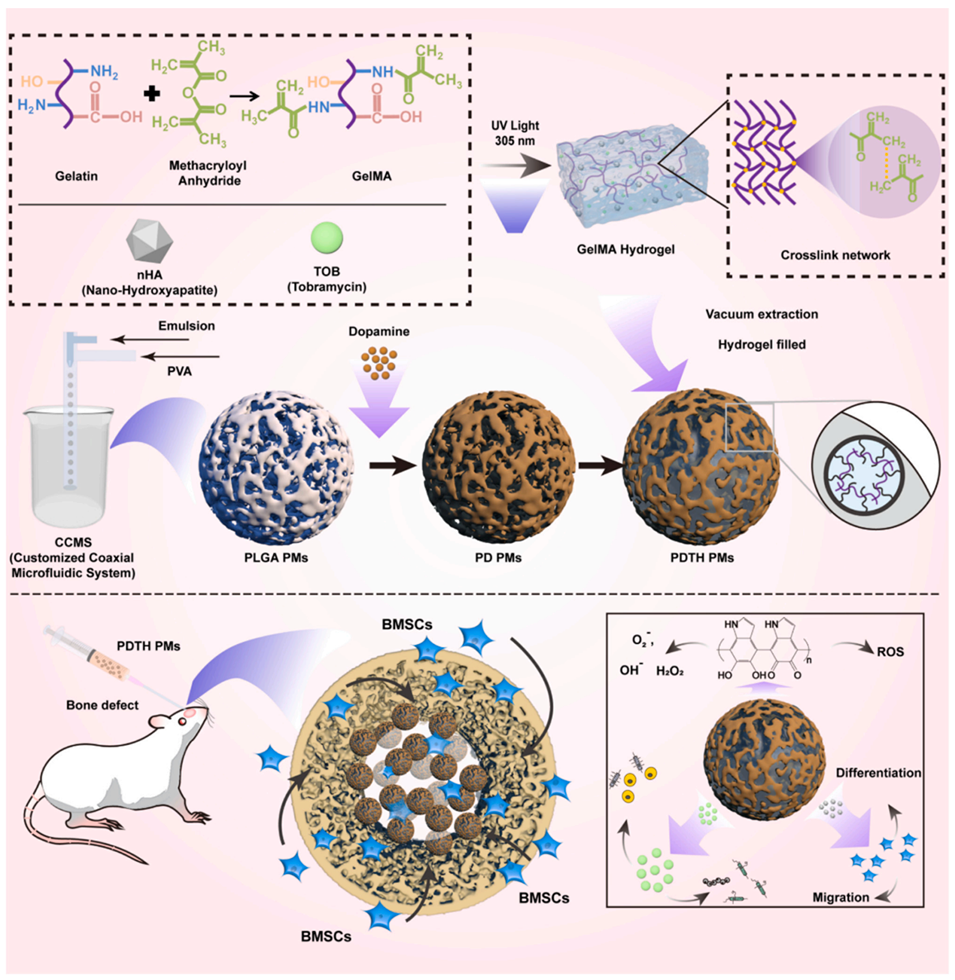
图1. PDTH PMs的制备及应用示意图。通过定制同轴微流控系统(CCMS)制备PLGA PMs,对其进行聚多巴胺(PDA)功能化修饰以赋予抗氧化活性,并负载含妥布霉素(TOB)和羟基磷灰石(HA)纳米颗粒的GelMA水凝胶,从而实现抗菌和促成骨效果。将PDTH PMs注射到大鼠颅骨缺损处,以在体内评估其骨再生效果。
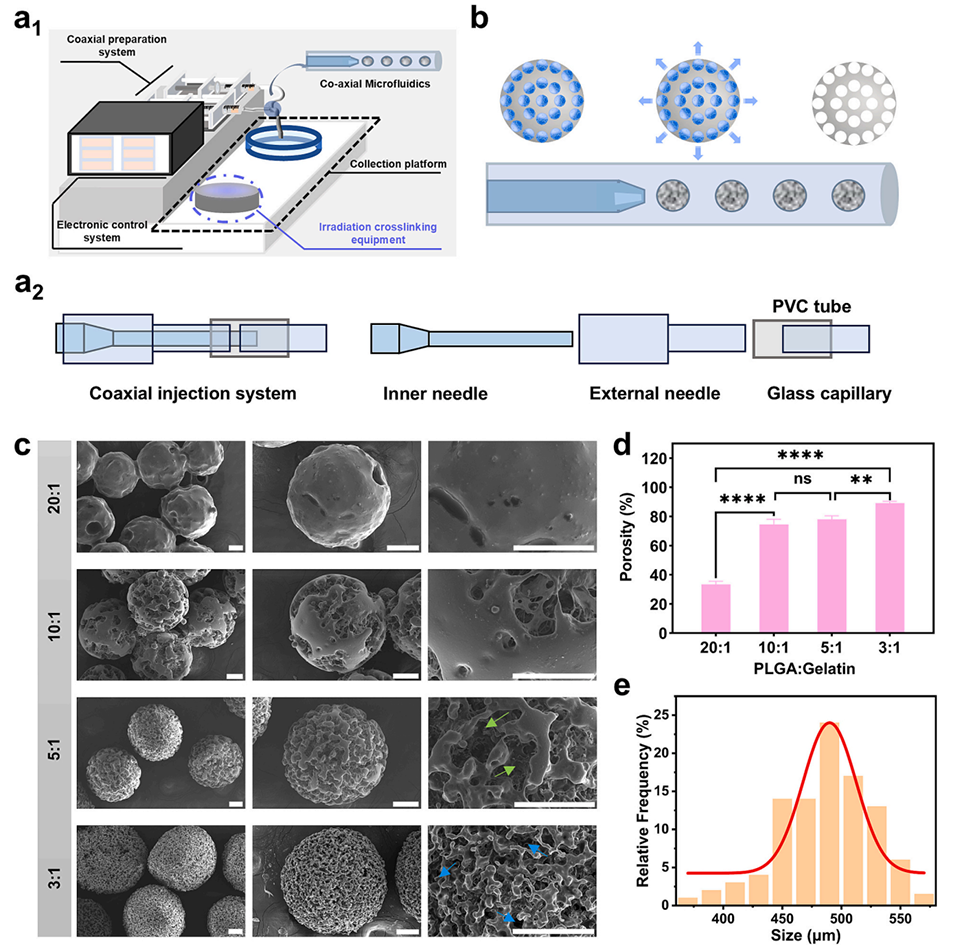
图2. PLGA PMs的制备与表征。a1)CCMS的结构示意图;a2)微流控注射系统的横截面示意图;b)利用CCMS制备PLGA PMs的过程;c)不同PLGA与明胶比例下PLGA PMs的SEM图像及形貌(比例尺=100 μm);d)不同PLGA与明胶比例下PLGA PMs的孔隙率;e)PLGA与明胶比例为3:1时PLGA PMs的粒径分布。

图3. PD PMs与PDTH PMs的制备与表征。a)PLGA PMs与PD PMs的宏观光学照片;b)PLGA PMs与PD PMs的SEM形貌图像(比例尺=100 μm);c)PD PMs的XPS表征结果;d)GelMA与明胶的¹H NMR分析;e)GelMA与明胶的FTIR分析;f)PDTH PMs的SEM形貌图像(比例尺=50 μm);g)PDTH PMs的EDX映射(主要含碳(C)、氮(N)、钙(Ca)、磷(P),比例尺=100 μm);h)PDTH PMs的半定量分析(显示各元素相对浓度比);i)PLGA PMs、PD PMs与PDTH PMs的FTIR分析。
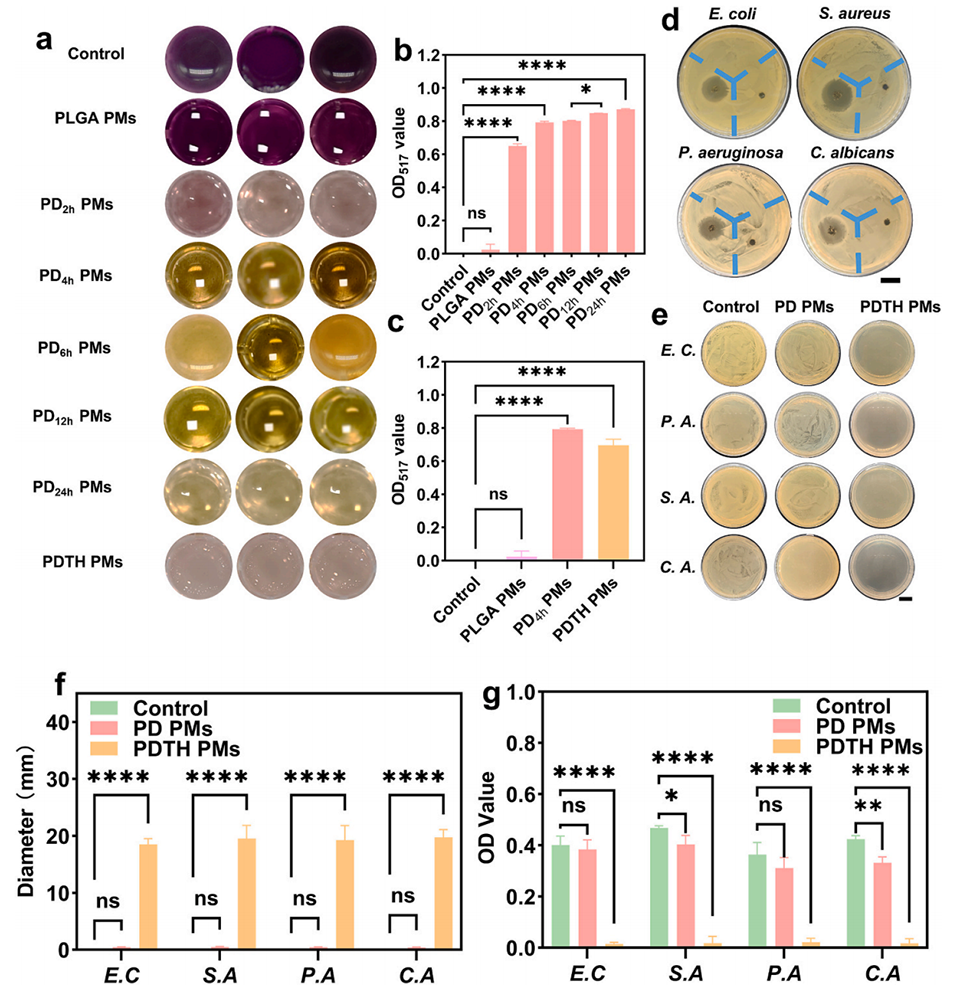
图4. 微球的ROS清除能力与抗菌性能。a-c)DPPH ROS清除实验(以PLGA PMs和PDTH PMs为对照组,同时设置不同多巴胺(DA)修饰时间的对照组);d)PD PMs与PDTH PMs的抑菌圈实验(比例尺=20 mm);e)PD PMs与PDTH PMs处理大肠杆菌(E.C.)、铜绿假单胞菌(P.A.)、金黄色葡萄球菌(S.A.)、白色念珠菌(C.A.)后的涂布平板结果(比例尺=20 mm);f)抑菌圈实验的定量分析;g)涂布平板实验的定量分析。
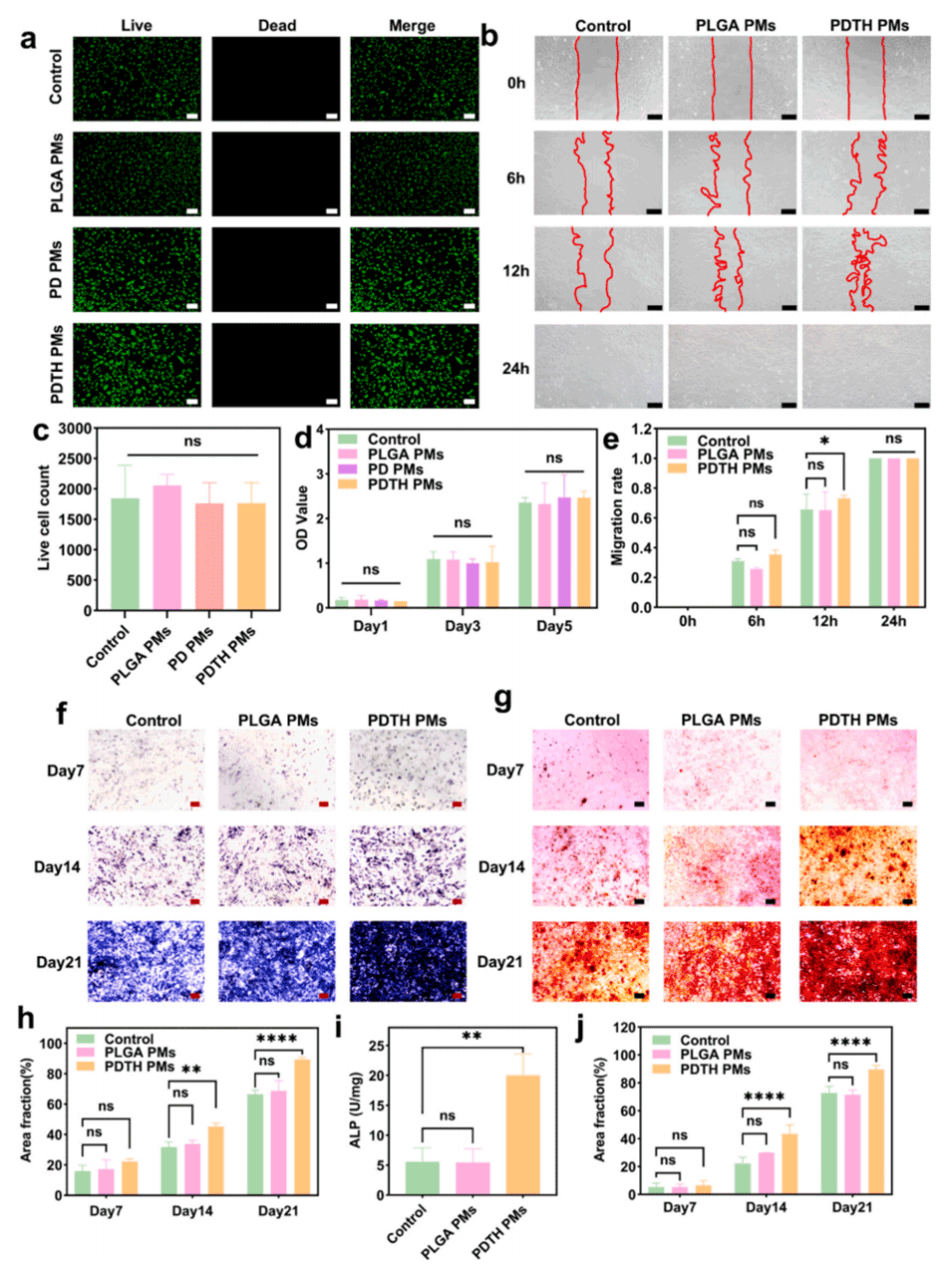
图5. 微球的生物相容性及体外促成骨诱导能力表征。a)通过Live/Dead染色实验观察PLGA PMs、PD PMs、PDTH PMs对骨髓间充质干细胞(BMSCs)的细胞毒性(绿色:钙黄绿素-AM染色活细胞,红色:碘化丙啶(PI)染色凋亡细胞,比例尺=200μm);b)不同材料培养下细胞迁移能力的划痕实验图像(比例尺=200μm);c)图5a中Live/Dead染色结果的定量分析;d)CCK-8法检测BMSCs与微球共培养1、3、5天后的增殖与活力;e)图5b中细胞迁移率的定量分析;f)BMSCs成骨分化培养后的碱性磷酸酶(ALP)染色结果(比例尺=200μm);g)BMSCs成骨分化培养后的茜素红(ARS)染色结果(比例尺=200μm);h)ALP染色面积的定量分析;i)通过ALP检测试剂盒对ALP活性的定量分析;j)ARS染色面积的定量分析。
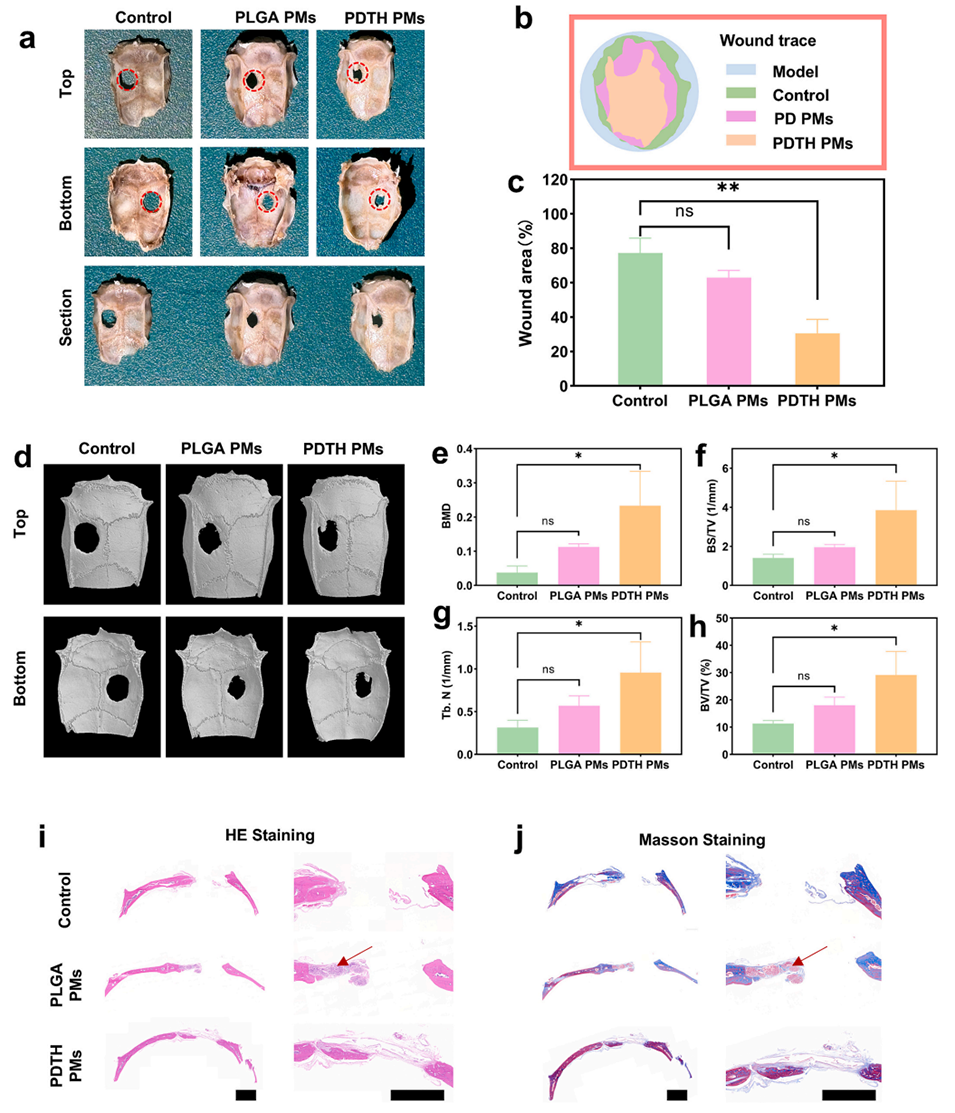
图6. PDTH PMs在体内的促成骨效果。a)不同微球处理6周后大鼠颅骨缺损的宏观图像;b)不同处理后颅骨缺损的轮廓追踪图;c)6周后各实验组的颅骨缺损面积;d)术后6周不同微球处理组大鼠颅骨缺损的Micro-CT三维重建图像;e-h)不同微球处理组缺损部位的骨矿物质密度(BMD)、骨体积/组织体积(BV/TV)、骨表面积/组织体积(BS/TV)及骨小梁数量(Tb.N);i-j)各实验组的HE染色与Masson三色染色结果(比例尺=2mm)。
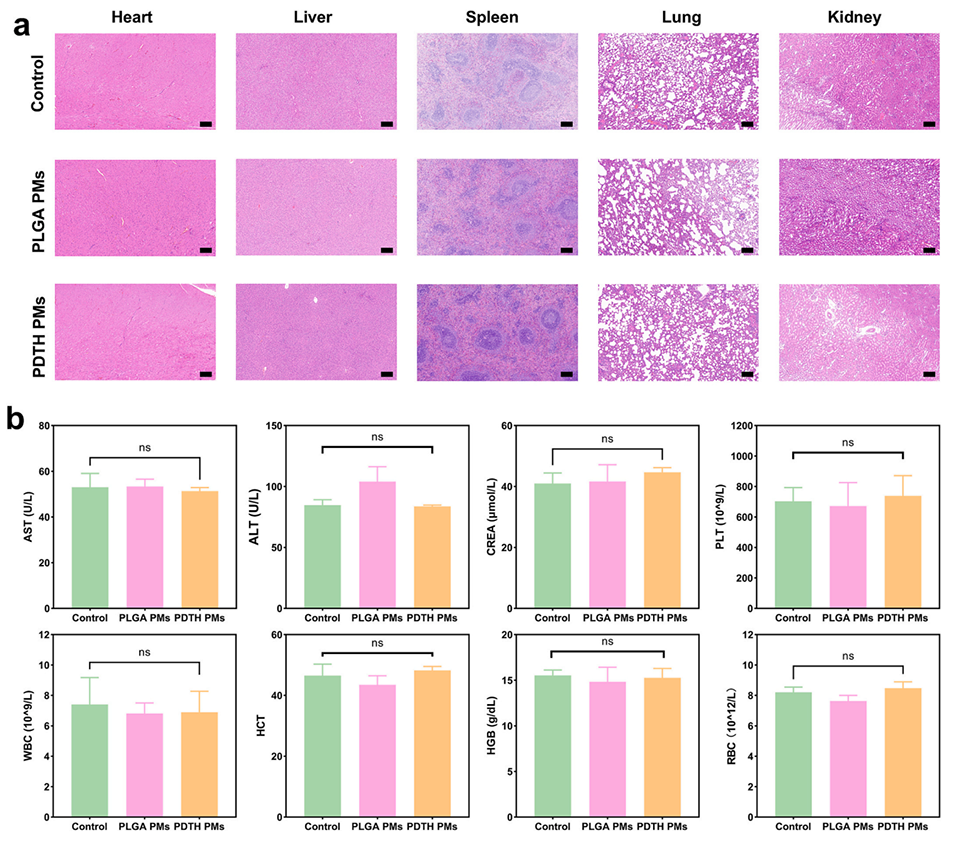
图7. PLGA PMs与PDTH PMs的体内生物安全性实验。a)注射微球6周后大鼠主要器官(心、肝、脾、肺、肾)的HE染色结果(比例尺=200μm);b)各实验组大鼠的血液生化指标分析(n=3)。
论文链接:https://doi.org/10.1016/j.bioadv.2025.214426
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














