肌腱损伤是一种常见的运动系统疾病,严重影响患者的日常活动,甚至可能导致残疾。全球每年有超过3000万人受到肌腱损伤的影响,相关医疗费用超过1400亿美元。其愈合质量直接决定临床结局,但肌腱因细胞密度低、血供差,再生能力有限,自我修复后的力学性能和功能常不理想,且术后易出现再断裂、粘连等问题。
肌腱愈合涉及内源性(肌腱细胞增殖)和外源性(成纤维细胞入侵)两种机制,其中外源性愈合中成纤维细胞的入侵是导致肌腱粘连的重要原因之一。当外源性愈合强于内源性愈合时,肌腱粘连难以避免。

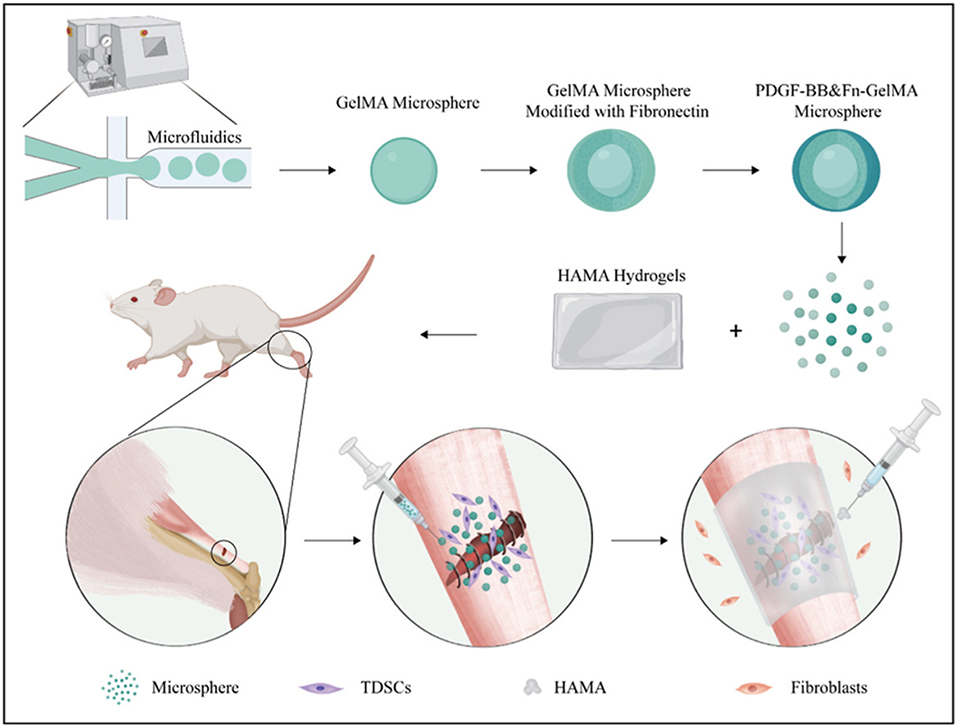
鉴于此,北京大学第三医院王健全教授、黄洪杰副研究员、程锦副研究员等人设计了一种可注射的复合微球/水凝胶膜体系,该体系由负载血小板衍生生长因子-BB(PDGF-BB)和纤连蛋白(Fn)的甲基丙烯酰化明胶(GelMA)水凝胶微球与抗粘连的甲基丙烯酰化透明质酸(HAMA)水凝胶膜组成,旨在促进跟腱愈合并防止粘连。相关研究以“Injectable composite microspheres/hydrogel membranes for Achilles tendon regeneration”为题目,发表在期刊《Materials Today Bio》上。
本文要点:
1、本研究设计了一种可注射复合微球/水凝胶膜体系,用于促进损伤跟腱再生。
2、该体系由经血小板衍生生长因子-BB(PDGF-BB)和纤维连接蛋白(Fn)修饰的甲基丙烯酰化明胶(GelMA)水凝胶微球,与甲基丙烯酰化透明质酸(HAMA)水凝胶膜组成,前者通过募集肌腱源性间充质干细胞(TDSCs)并诱导其向肌腱细胞分化以促进内源性愈合,后者通过物理屏障和润滑作用抑制外源性粘连。
3、实验验证显示,在大鼠跟腱断裂模型中,该复合体系可改善术后步态、减轻疼痛,显著提升再生肌腱的生物力学性能,并促进胶原纤维有序排列(以Ⅰ型胶原为主),为肌腱损伤治疗提供了有效策略。
复合微球/水凝胶膜通过双层结构协同作用,分别从促进跟腱愈合和防止粘连两方面发挥功效:
一、促进跟腱愈合(PDGF&Fn-GelMA水凝胶微球的作用)
1、募集与激活肌腱修复细胞:微球负载的血小板衍生生长因子-BB(PDGF-BB)具有强趋化性,可招募邻近肌腱组织的肌腱细胞和肌腱源性间充质干细胞(TDSCs)至损伤部位,同时纤连蛋白(Fn)通过其肝素结合位点增强对这些细胞的吸附,加速内源性愈合启动。
2、促进肌腱分化与功能修复:PDGF-BB能诱导TDSCs向肌腱细胞分化,上调肌腱特异性标志物(如SCX、TNMD)的表达,促进I型胶原合成,提升修复后肌腱的生物力学性能(如抗拉力、韧性)。
3、缓释生长因子:Fn修饰的GelMA微球通过微流体技术制备,可缓慢释放PDGF-BB,避免生长因子暴释的毒性作用,实现长期稳定的促愈合效果。
二、防止粘连(HAMA水凝胶膜的作用)
1、物理屏障与润滑作用:甲基丙烯酰化透明质酸(HAMA)水凝胶膜具有良好的润滑性,能模拟肌腱鞘的滑膜液环境,减少肌腱与周围组织的摩擦,同时形成物理屏障,阻止成纤维细胞入侵和瘢痕组织粘连。
2、抑制外源性愈合失衡:HAMA缺乏细胞粘附位点,可减少成纤维细胞的附着与增殖,避免外源性愈合过度(如瘢痕形成),维持内源性与外源性愈合的平衡。
3、生物相容性与降解特性:HAMA水凝胶可注射且原位交联,能适配不规则损伤部位,早期稳定包裹肌腱,后期逐步降解,避免长期残留引发的异物反应,降低粘连复发风险。
两者协同作用,既通过微球增强内源性肌腱修复,又通过水凝胶膜抑制外源性粘连,最终实现跟腱结构与功能的高质量恢复。
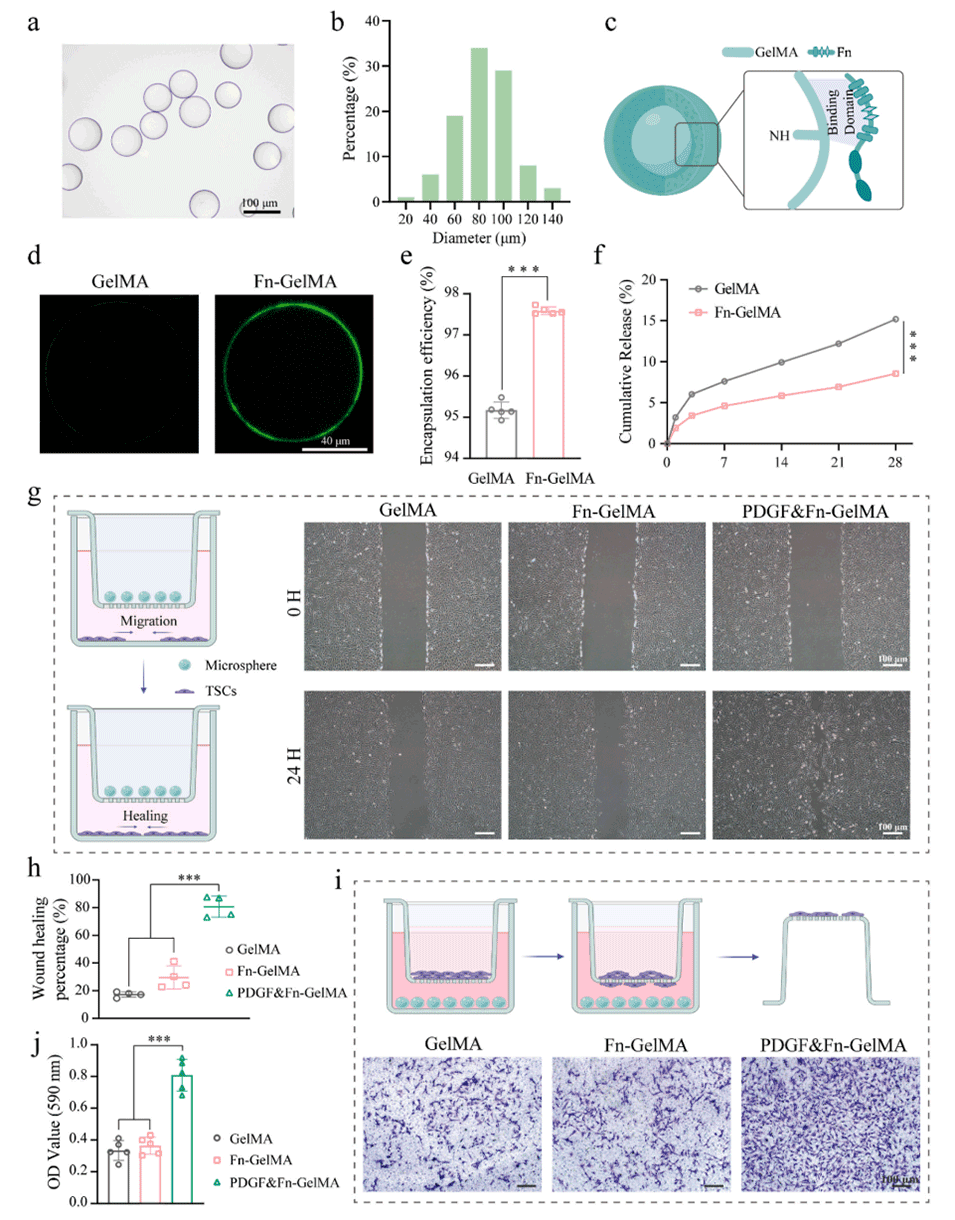
图 1. 水凝胶微球(HMs)增强细胞迁移能力。(a)水凝胶微球的显微镜图像。(b)水凝胶微球的尺寸分布。(c)甲基丙烯酰化明胶(GelMA)与纤连蛋白(Fn)相互作用的示意图。(d)GelMA 和 Fn 修饰的 GelMA 水凝胶微球的免疫荧光图像。(e)GelMA 和 Fn 修饰的 GelMA 水凝胶微球对血小板衍生生长因子 - BB(PDGF-BB)的包封效率。(f)GelMA 和 Fn 修饰的 GelMA 水凝胶微球的释放曲线。(g)划痕愈合实验的示意图及 24 小时划痕的代表性光学显微镜图像。(h)通过 Image J 分析的伤口愈合百分比。(i)趋化实验的示意图及上室迁移细胞的代表性光学显微镜图像。(j)迁移细胞数量的定量分析。采用单因素方差分析及 Tukey 事后检验计算统计学显著性,***P < 0.001。
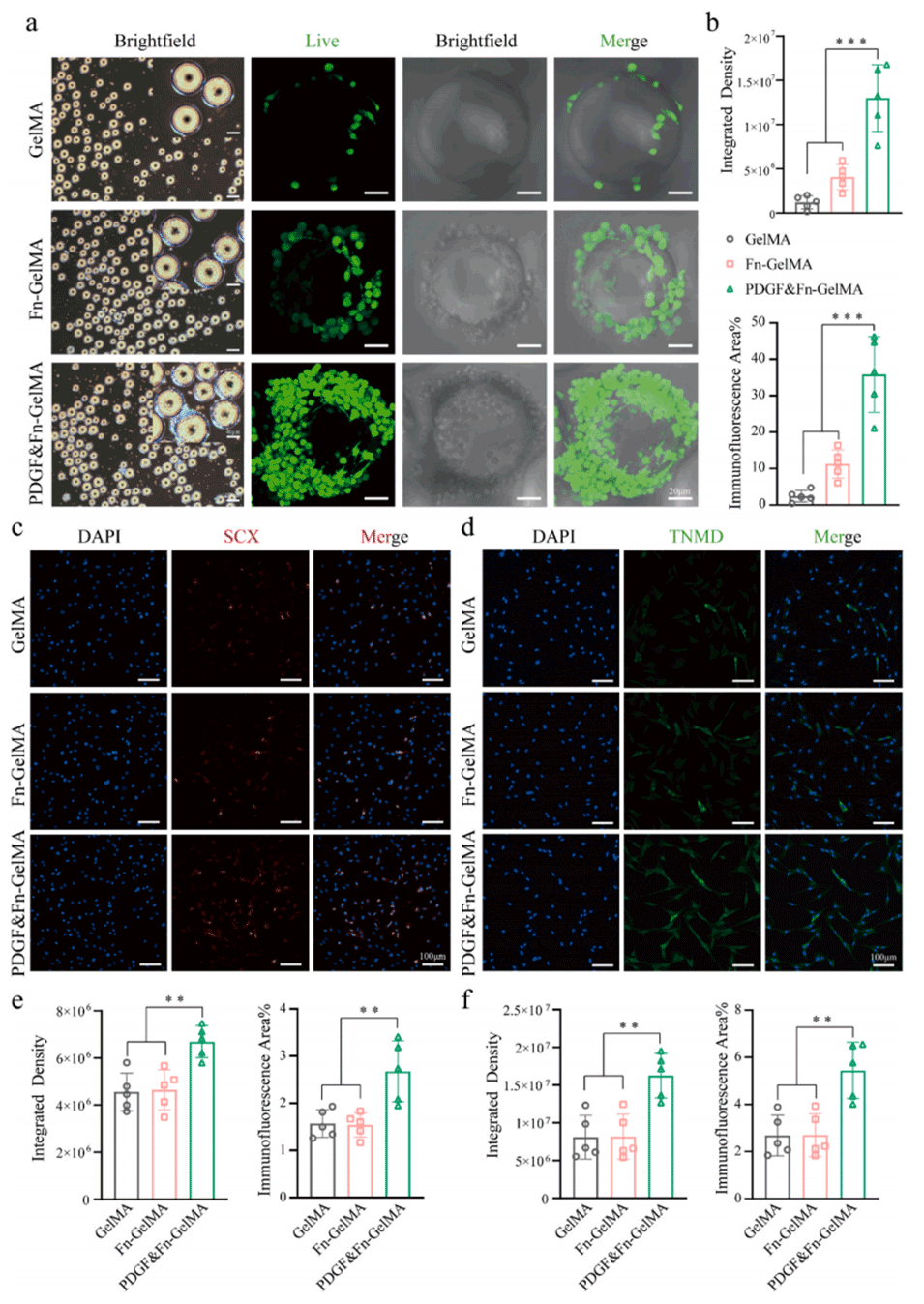
图 2. 水凝胶微球募集肌腱源性间充质干细胞(TDSCs)并诱导其向肌腱细胞分化。(a)细胞在水凝胶微球上捕获和粘附的图像。(b)通过 Image J 分析的整合密度和免疫荧光面积。三组中肌腱特异性标志物硬骨素(SCX)(c)和腱调蛋白(TNMD)(d)的荧光信号。(e)通过 Image J 分析的 SCX 的整合密度和免疫荧光面积。(f)通过 Image J 分析的 TNMD 的整合密度和免疫荧光面积。采用单因素方差分析及 Tukey 事后检验计算统计学显著性,**P < 0.01,***P < 0.001。
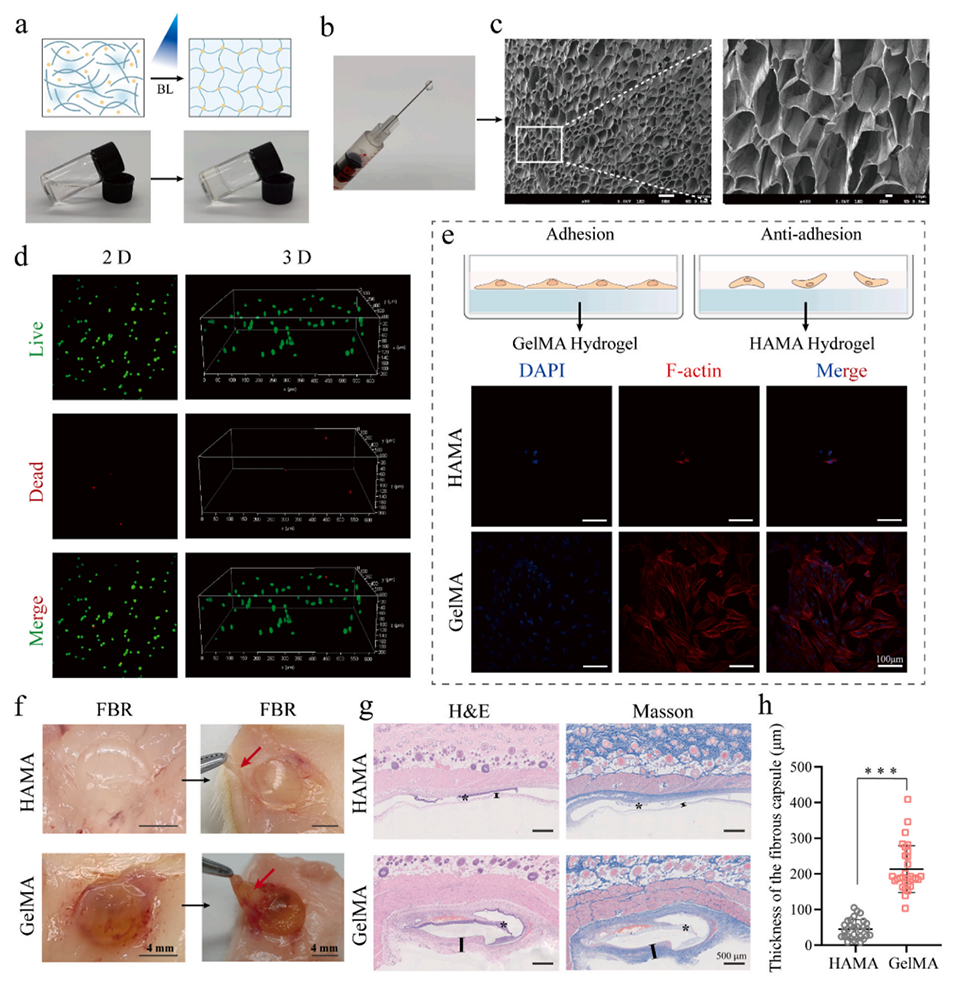
图 3. 甲基丙烯酰化透明质酸(HAMA)水凝胶的合成与表征。(a)HAMA 水凝胶交联过程的示意图及整体外观。(b)HAMA 水凝胶的可注射性。(c)冻干 HAMA 水凝胶的扫描电镜图像。(d)HAMA 水凝胶中包封的 TDSCs 的活 / 死染色结果。(e)细胞在 HAMA 和 GelMA 水凝胶表面粘附的示意图及免疫荧光细胞骨架染色。(f)不同水凝胶(HAMA/GelMA)在大鼠皮下植入 3 天后的抗细胞粘附和异物排斥反应(红色箭头指示:水凝胶周围的纤维囊)。(g)大鼠皮下植入不同水凝胶 3 天后的组织病理学切片的 H&E 和 Masson 染色结果(“*”:水凝胶,“I”:水凝胶周围纤维囊的厚度)。(h)水凝胶周围纤维囊厚度的半定量分析。采用 t 检验计算统计学显著性,***P < 0.001。
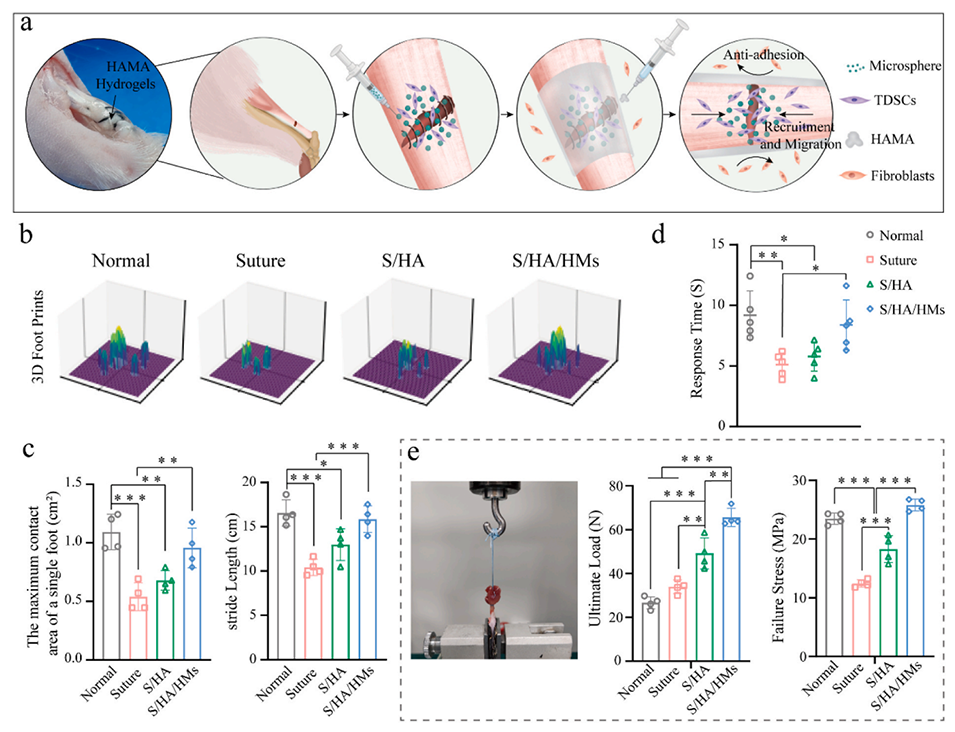
图 4. 复合微球 / 水凝胶膜在大鼠跟腱断裂修复中的行为学和生物力学评估。(a)复合微球水凝胶膜促进内源性肌腱愈合和防止外源性粘连的示意图。(b)SD 大鼠左后肢足底表面的 3D 压力分析。(c)步态分析中单足最大接触面积和步长的定量分析。(d)SD 大鼠后肢置于 55℃热板上的疼痛反应时间。(e)4 周时大鼠跟腱的生物力学性能。采用单因素方差分析及 Tukey 事后检验计算统计学显著性,*P < 0.05,**P < 0.01,***P < 0.001。
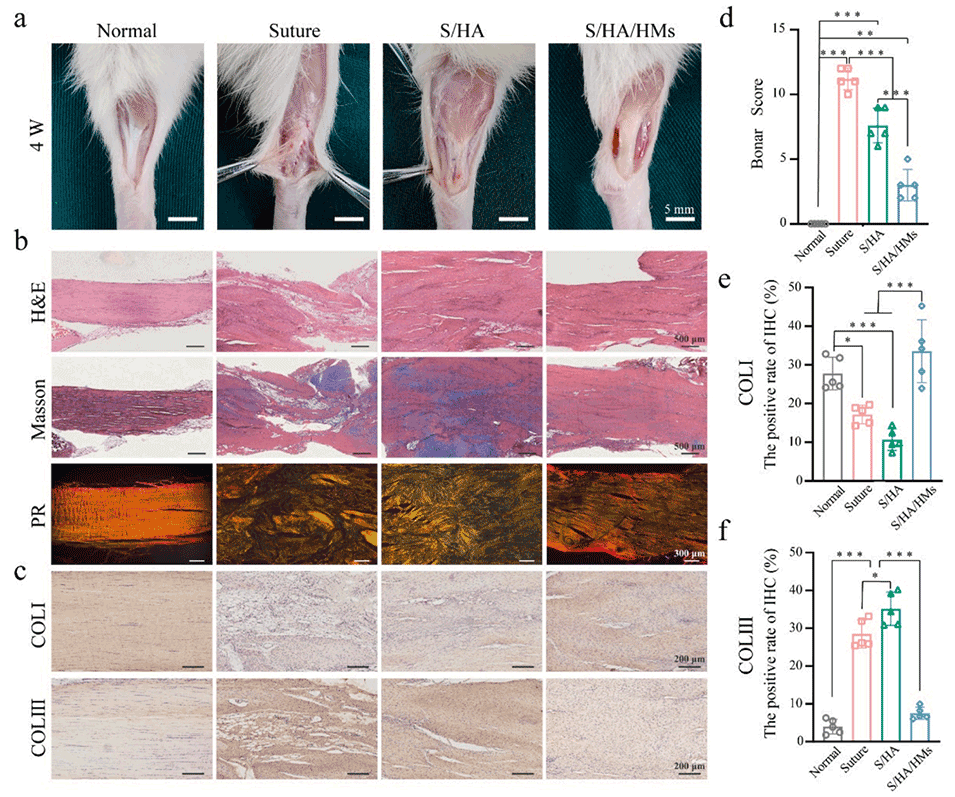
图 5. 复合微球/水凝胶膜对大鼠跟腱断裂模型的修复效果。(a)大鼠跟腱修复后 4 周的宏观外观代表性图像。(b)各组的 H&E、Masson、苦味酸天狼星红(PR)染色代表性图像。(c)I 型胶原(COL-I)和 III 型胶原(COL-III)再生的免疫组织化学染色(棕色)。(d)H&E 染色的跟腱 Bonar 评分。(e)I 型胶原阳性面积占总面积的百分比定量分析。(f)III 型胶原阳性面积占总面积的百分比定量分析。采用单因素方差分析及 Tukey 事后检验计算统计学显著性,*P < 0.05,**P < 0.01,***P < 0.001。
论文链接:https://doi.org/10.1016/j.mtbio.2025.102129
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














