溃疡性结肠炎是一种慢性炎症性肠病,全球发病率较高,且可能增加结肠癌风险,其病因与肠道微生物群、年龄、基因和生活方式等多种因素相关。植物乳杆菌(LP)作为益生菌可预防溃疡性结肠炎,但由于肠道菌群生态复杂,将足够数量的活性LP递送至结肠面临挑战,传统益生菌微囊化方法存在成本高、能耗大、粒径难控等问题。

近期,中国海洋大学食品科学与工程学院罗克副教授团队开发了一种受蛙卵启发的核壳结构微胶囊,用于协同递送益生菌(植物乳杆菌 LP)和益生元(抗性淀粉纳米颗粒 RSNP)以治疗溃疡性结肠炎。该研究利用离心驱动微喷嘴系统精准构建了双层藻酸盐微胶囊(DAM),其中LP封装于核心,RSNP均匀分布于外壳,显著提升了益生菌在胃酸环境中的存活率及长期储存稳定性,并通过增加短链脂肪酸生成、调节肠道菌群平衡,有效缓解了葡聚糖硫酸钠(DSS)诱导的小鼠结肠炎症状。相关研究以“Bioinspired core-shell microparticle for dual-delivery of prebiotic and probiotic for the treatment of ulcerative colitis”为题目,发表在期刊《Journal of Controlled Release》上。
本文要点:
1、本研究提出一种离心驱动微喷嘴系统,用于制备双层核壳海藻酸盐微胶囊(DAM),作为抗性淀粉纳米颗粒(RSNP,益生元)和植物乳杆菌(LP,益生菌)的双重递送载体,以治疗溃疡性结肠炎。
2、该系统能够分别在DAM的核和壳区域内精确加载LP和RSNP,形成的LP/RS@DAM对LP具有高包封效率(每个微珠10⁸ CFU),外壳中RSNP的密集分布有效保护LP免受酸性条件(pH2)影响,且在30天长期储存后仍能维持52%的细胞活力。
3、在葡聚糖硫酸钠(DSS)诱导的结肠炎模型中,LP/RS@DAM能有效促进短链脂肪酸产生,减少炎症细胞因子,恢复肠道微生物多样性。
4、这种创新方法为改善结肠炎管理提供了潜在解决方案,并为胃肠道疾病的干预与定制化治疗奠定了基础。
离心驱动微喷嘴系统是如何制备双层核壳海藻酸盐微胶囊的?
该系统由模块化微喷嘴、微喷嘴支架和收集管组成,通过双微喷嘴模块形成仿生核壳微结构,具体操作中,将 5mL 离心管置于 10mL 离心管中心并固定在 50mL 离心管的盖子上,把含植物乳杆菌(LP)的 2% 海藻酸盐溶液加入 5mL 离心管作为内层溶液,将含抗性淀粉纳米颗粒(RSNP)的 1% 海藻酸盐溶液加入 10mL 离心管作为外层溶液,50mL 离心管中则装入 10% 氯化钙溶液,且喷嘴与氯化钙液面距离为 0.9cm。在 50×g 至 200×g 的不同离心力作用下,混合液滴入氯化钙水溶液,最终形成的 LP/RS@DAM 经生理盐水洗涤后,于 4℃储存备用。
这一过程利用离心力驱动,使海藻酸盐溶液形成液滴,液滴在含钙离子的收集管中通过海藻酸盐中的α-L-古洛糖醛酸与二价阳离子反应形成 “蛋盒” 结构,从而实现微胶囊的制备,且通过设计微流体通道可精确控制微胶囊的大小和结构。
抗性淀粉纳米颗粒(RSNP)在壳层中的作用是否仅为物理保护?
RSNP 的作用不仅限于物理保护。其密集分布在壳层中,可通过堵塞海藻酸盐微胶囊的孔隙,减少胃酸渗透,从而保护核心的益生菌免受酸性环境破坏;
同时,RSNP 作为益生元,能在结肠被肠道菌群利用为碳源,促进短链脂肪酸(如丁酸)的生成,进而增强益生菌的定植能力和治疗效果,实现 “保护 + 营养” 的双重功能。
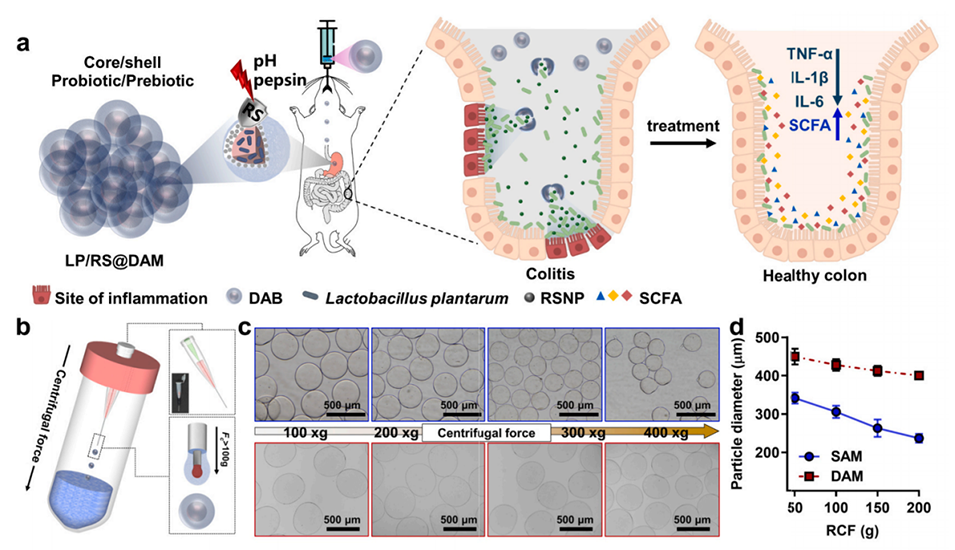
图 1. 离心驱动微喷嘴系统。(a) 负载 LP/RSNP(核/壳)的双层藻酸盐微胶囊(LP/RS@DAM)用于结肠炎治疗的示意图。(b) 用于合成藻酸盐微胶囊的离心驱动模块化微喷嘴系统示意图。(c) 不同离心力(50×g 至 200×g)下形成的单层微胶囊(SAM,上)和双层微胶囊(DAM,下)的光学显微镜图像;(d) 其平均粒径。

图 2. 微胶囊形态与包封效率表征。(a) 负载 LP 的 SAM(LP@SAM,i)、未含 RSNP 的负载 LP 的 DAM(LP@DAM,ii)、LP/RS@DAM(iii)的光学显微镜图像。下方图像为虚线框对应的高倍放大图。虚线代表 DAM 核与壳的边界。(b) LP/RS@DAM 的荧光显微镜图像。LP 和 RSNP 分别用 CFDA(i)和刚果红(ii)染色。(c) LP@SAM(i)、LP@DAM(ii)和 LP/RS@DAM(iii)的扫描电镜图像。(d) LP 在 LP@DAM 和 LP/RS@DAM 中的包封效率。(e) 初始细胞浓度为 10⁹ CFU/mL 时,单个 LP@DAM 和 LP/RS@DAM 微珠中活的 LP 数量。
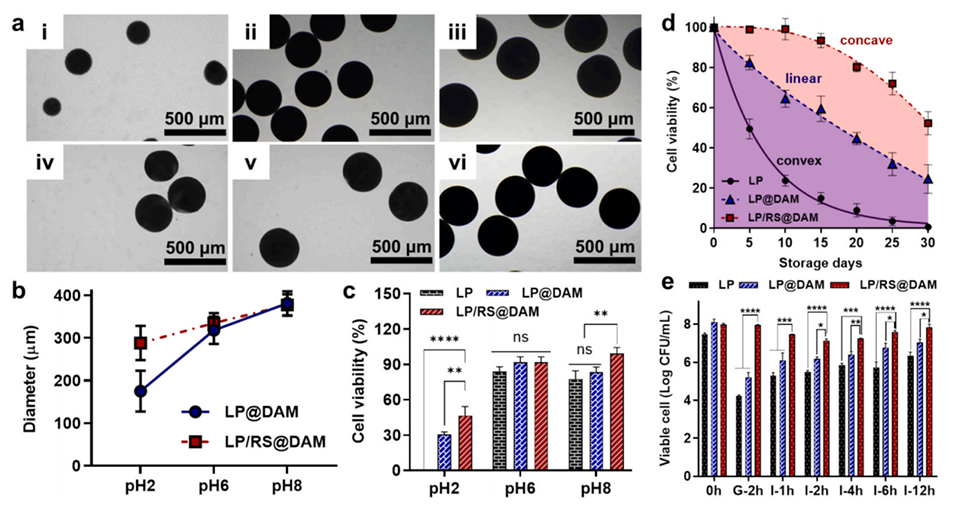
图 3. LP 的包封效率与活力。(a) LP@DAM(i-iii)和 LP/RS@DAM(iv-vi)在 pH 2(i 和 iv)、pH 5(ii 和 v)、pH 8(iii 和 vi)条件下处理后的光学显微镜图像;(b) 其平均粒径。(c) 原始 LP、LP@DAM 和 LP/RS@DAM 在不同 pH 条件下处理后的相对细胞活力。(d) 原始 LP、LP@DAM 和 LP/RS@DAM 在 4℃储存 30 天期间的长期细胞活力曲线。(e) 原始 LP、LP@DAM 和 LP/RS@DAM 在 37℃下经模拟胃液(G)和模拟肠液(I)处理 12 小时期间的活细胞数量。符号 *(p<0.05)、**(p<0.01)、***(p<0.001)和****(p<0.0001)表示存在显著差异;“ns” 表示无显著差异(p>0.05)。
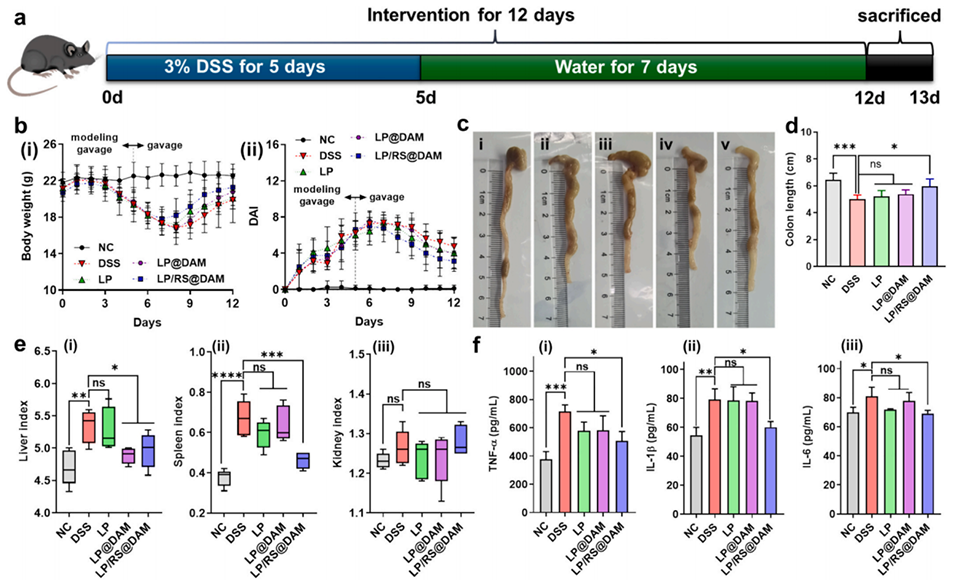
图 4. 微胶囊对小鼠结肠形态和炎症细胞因子的影响。(a) DSS 诱导小鼠结肠炎的实验方案:通过 3 个周期的 3% 葡聚糖硫酸钠(DSS)和水处理诱导结肠炎。(b) 经 DSS、LP、LP@DAM 和 LP/RS@DAM 处理的小鼠的体重(i)和疾病活动指数(DAI,ii)变化。(c) 各组小鼠肠道的代表性照片;(d) 其长度测量结果。(e) 各组小鼠的肝脏(i)、脾脏(ii)和肾脏(iii)指数分析。(f) 各组小鼠血清中肿瘤坏死因子(TNF)-α(i)、白细胞介素(IL)-1β(ii)和 IL-6(iii)的浓度。符号 *(p<0.05)、**(p<0.01)、***(p<0.001)和****(p<0.0001)表示与对照组相比存在显著差异;“ns” 表示无显著差异(p>0.05)。
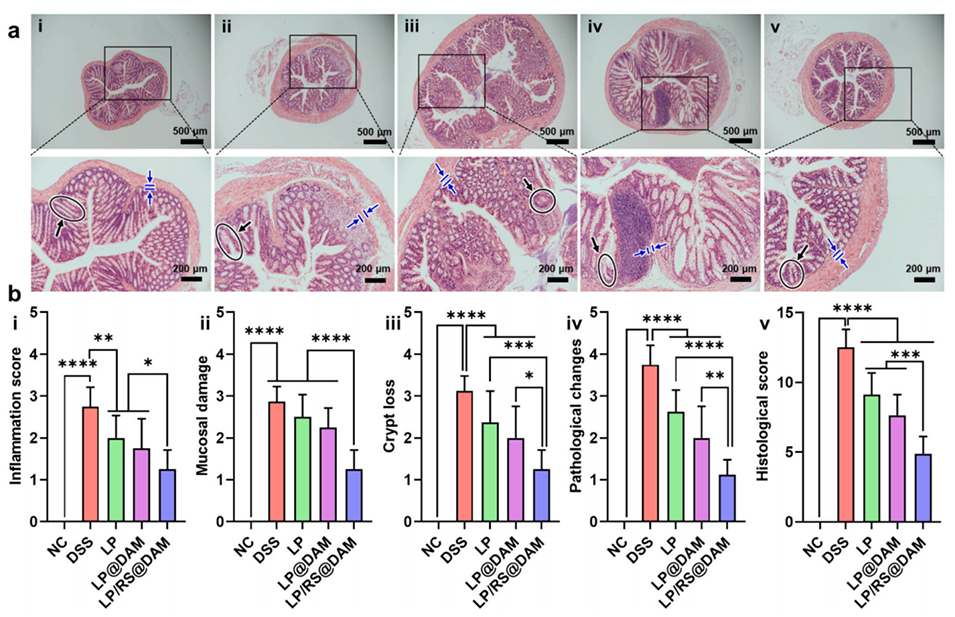
图 5. 结肠组织的组织病理学。(a) 正常对照组(NC,i)、DSS 组(ii)、LP 组(iii)、LP@DAM 组(iv)和 LP/RS@DAM 组(v)小鼠结肠组织的代表性 H&E 染色切片。(b) 结肠组织的炎症评分(i)、黏膜损伤评分(ii)、隐窝丢失评分(iii)、病理改变评分(iv)和组织学总评分(v)。
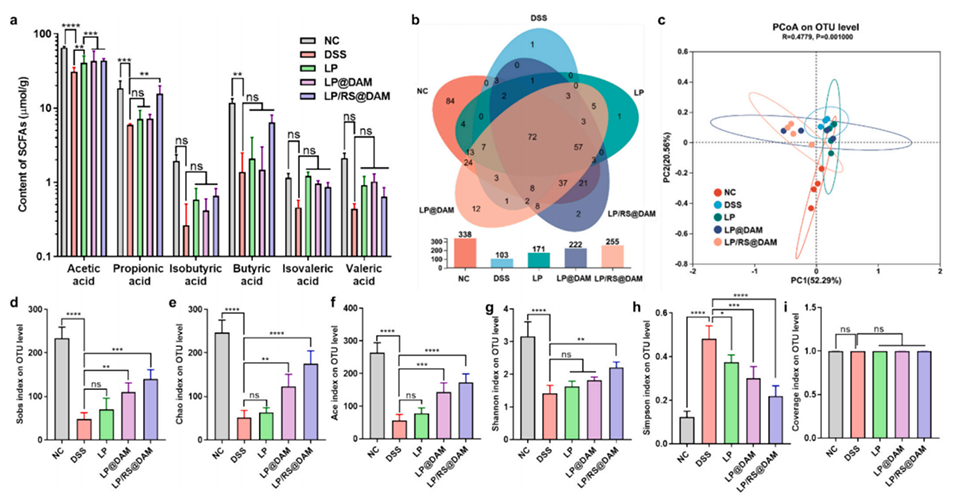
图 6. 微囊化对短链脂肪酸(SCFA)和肠道菌群多样性的影响。(a) 小鼠粪便中 SCFA 的含量。(b) 五组间共享的操作分类单元(OTU)的韦恩图。(c) 各组小鼠肠道菌群的主坐标分析(PCoA)。(d) Sobs 指数、(e) Chao 指数、(f) Ace 指数、(g) Shannon 指数、(h) Simpson 指数和 (i) 覆盖率指数。符号 **(p<0.01)、***(p<0.001)和****(p<0.0001)表示与 NC 组相比存在显著差异;“ns” 表示无显著差异(p>0.05)。
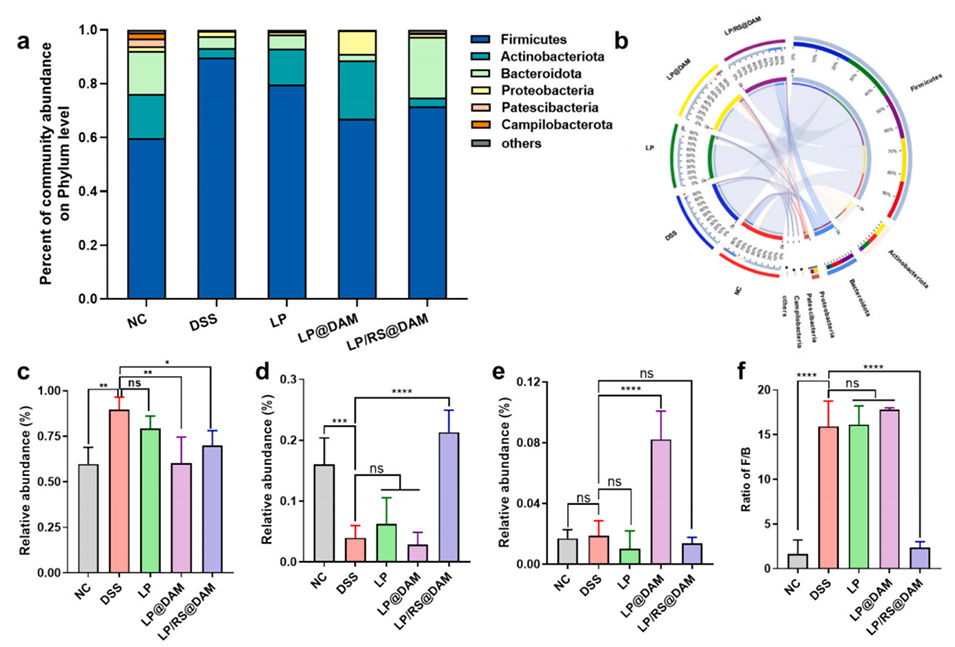
图 7. 各组小鼠粪便菌群组成分析。(a) 菌群柱状图;(b) 环形图;(c) 厚壁菌门、(d) 放线菌门、(e) 拟杆菌门的相对丰度;(f) 厚壁菌门/拟杆菌门(F/B)比值。符号 *(p<0.05)、**(p<0.01)和 ****(p<0.0001)表示与 NC 组相比存在显著差异;“ns” 表示无显著差异(p>0.05)。
论文链接:https://doi.org/10.1016/j.jconrel.2024.10.026
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














