口服益生菌疗法因其非侵入性和调节炎症的能力,在炎症性肠病(IBD)治疗中前景广阔,但由于益生菌定植不足和治疗干预不全面,其潜力仍然受到限制。

近期,武汉大学中南医院消化内科刘静教授与化学与分子科学学院王富安教授合作,研发出一种名为EcN-Ap@A/H-Ce的双层微胶囊口服系统,该系统通过将TNF-α适配体修饰的益生菌封装于海藻酸钠微球并外层复合透明质酸与CeO2纳米酶,可高效抵抗胃肠道环境、靶向结肠,通过中和TNF-α、清除ROS及调节肠道菌群发挥治疗作用,疗效优于传统口服药物且与静脉注射药物相当。相关研究以“Oral administration of TNF-α-modulating probiotics integrated by dual-layered microcapsule for effective treatment of inflammatory bowel disease”为题目,发表在期刊《Chemical Engineering Journal》上。
本文要点:
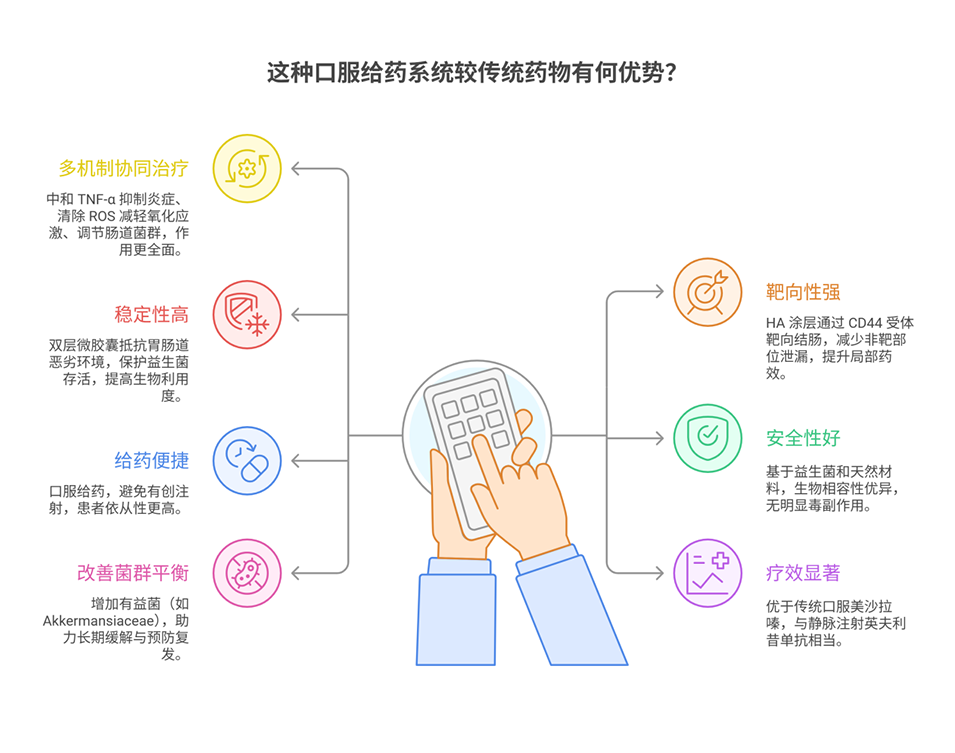
1、本文开发了一种多功能口服系统EcN-Ap@A/H-Ce,通过下调炎症细胞因子(如TNF-α)和清除活性氧(ROS)对抗慢性复发性IBD。
2、通过将TNF-α适配体偶联到大肠杆菌Nissle 1917(EcN)表面,经微流控技术封装于尺寸均一的pH响应性海藻酸钠微球中,再通过液界面自组装形成含透明质酸(HA)和CeO₂纳米酶的外层复合涂层,构建双层微胶囊系统。
3、其中大肠埃希菌 Nissle 1917,简称 EcN,是唯一一种不致病的大肠杆菌,是一种益生菌。
4、该系统能抵抗胃肠道恶劣环境,HA增强结肠靶向,CeO₂减轻氧化应激并促进EcN-Ap定植,同时EcN-Ap可中和TNF-α,抑制炎症,恢复肠道屏障完整性。
5、在小鼠结肠炎模型中,其疗效优于传统口服美沙拉嗪,与静脉注射英夫利昔单抗相当且无创。此外,这种微胶囊还能改善肠道菌群,为IBD等胃肠道疾病提供低副作用、高依从性的非侵入性疗法。
微流控技术在构建EcN-Ap@A/H-Ce双层微胶囊中发挥了哪些关键作用?其相较于传统微胶囊制备方法的技术优势是什么?
在EcN-Ap@A/H-Ce系统中,微流控技术的核心作用是实现益生菌的精准封装与微球尺寸均一化。通过微流控技术,研究团队将结合了TNF-α适配体的益生菌(EcN-Ap)均匀分散于海藻酸钠溶液中,借助流体剪切力形成尺寸可控的单分散微球,为后续外层透明质酸(HA)和CeO₂纳米酶的自组装提供了稳定的核心结构。
相较于传统乳化法等制备手段,其技术优势主要体现在以下几个方面:
1、尺寸均一性:微流控可精确调控微球直径(文中微胶囊平均尺寸为221.9 μm),避免传统方法中尺寸差异导致的靶向效率和释放性能波动;
2、生物相容性:温和的制备环境(如文中40℃条件)减少了对益生菌活性的破坏,保证了EcN-Ap的定植能力;
3、可调控性:通过调节流体流速、通道结构等参数,可灵活优化微球的孔隙率和机械强度,适配胃肠道环境的保护需求。
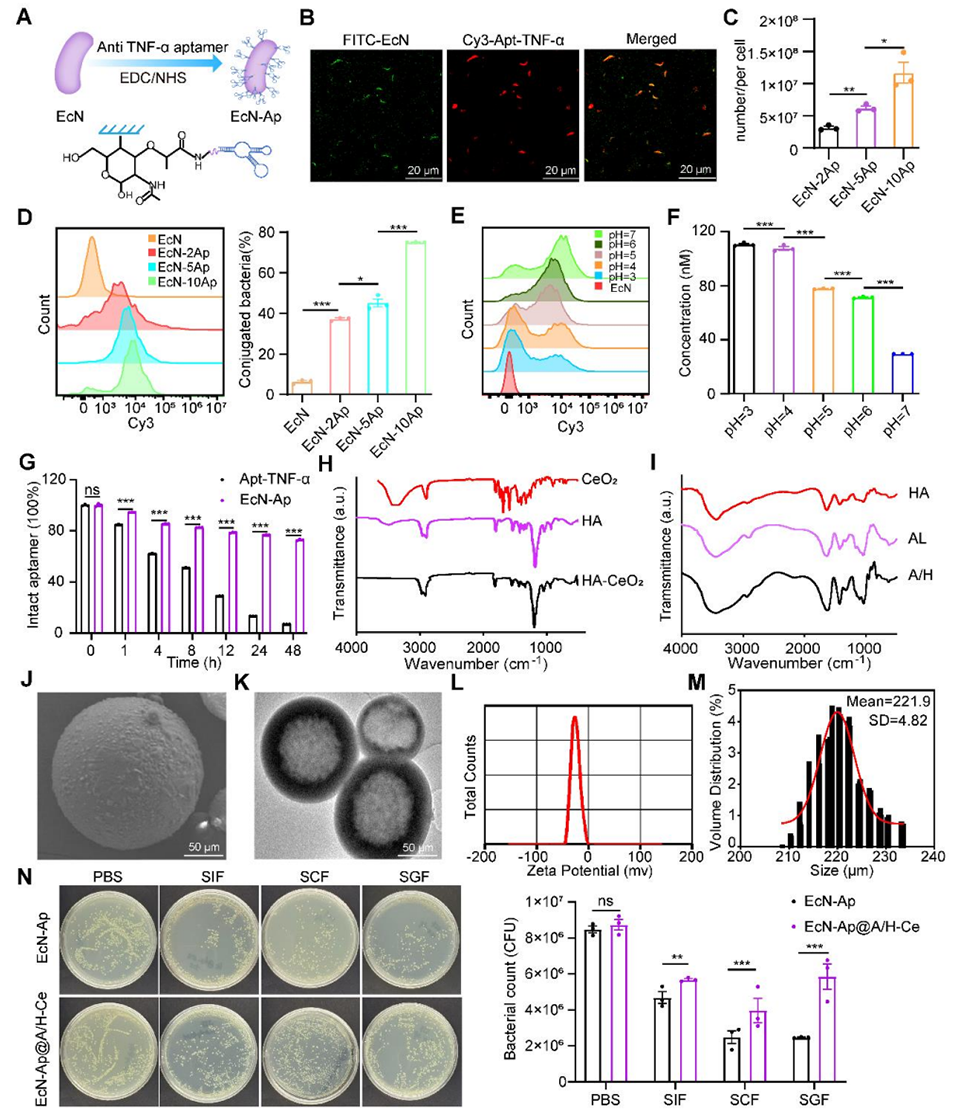
图1. EcN-Ap@A/H-Ce的制备与表征
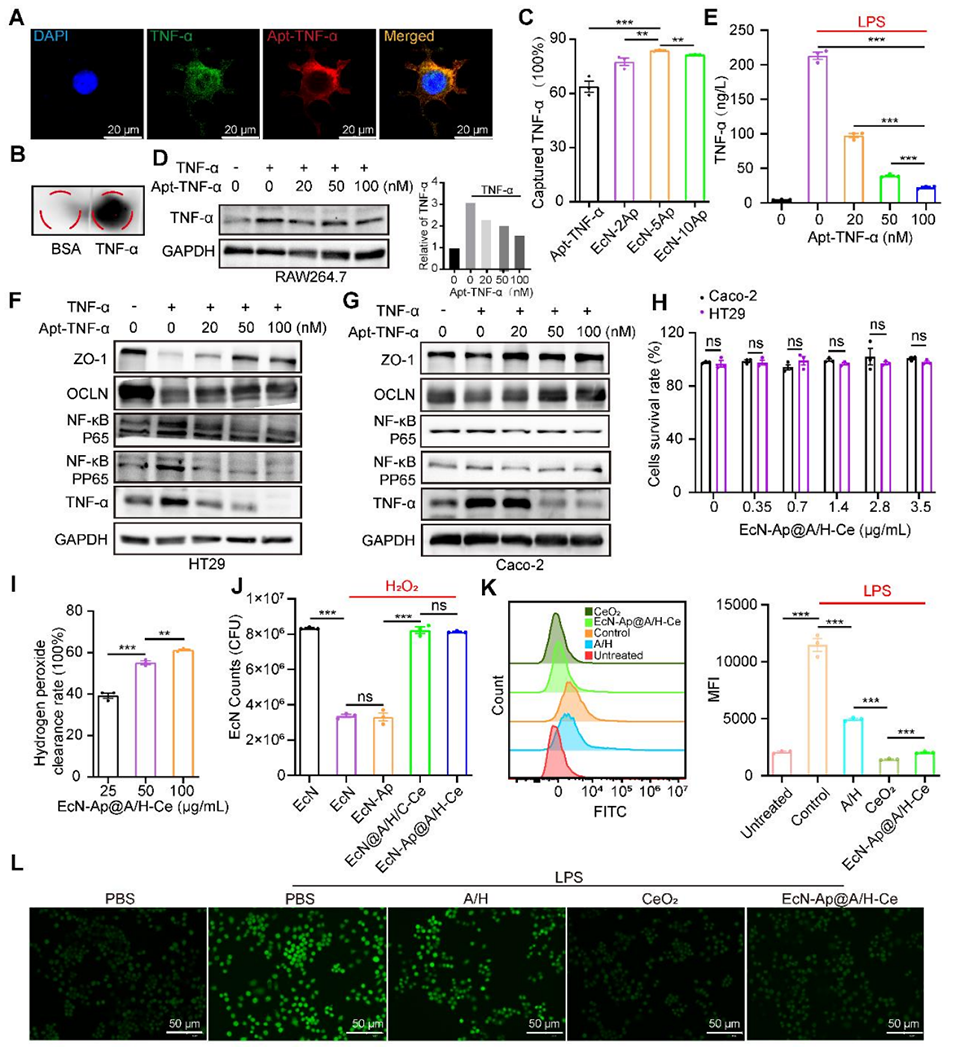
图2. EcN-Ap@A/H-Ce的体外TNF-α捕获能力及活性氧(ROS)清除能力
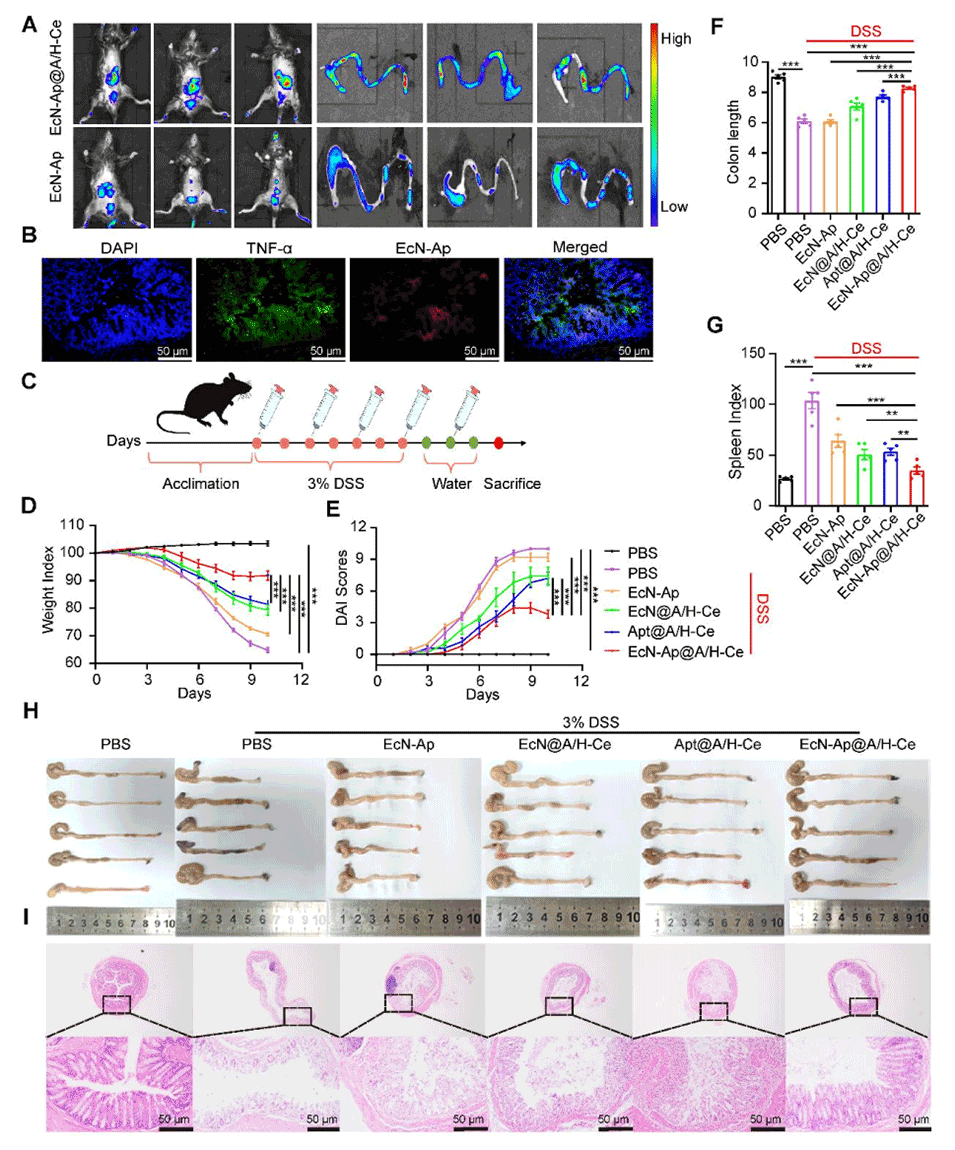
图3. EcN-Ap@A/H-Ce对DSS诱导的小鼠结肠炎的治疗效果
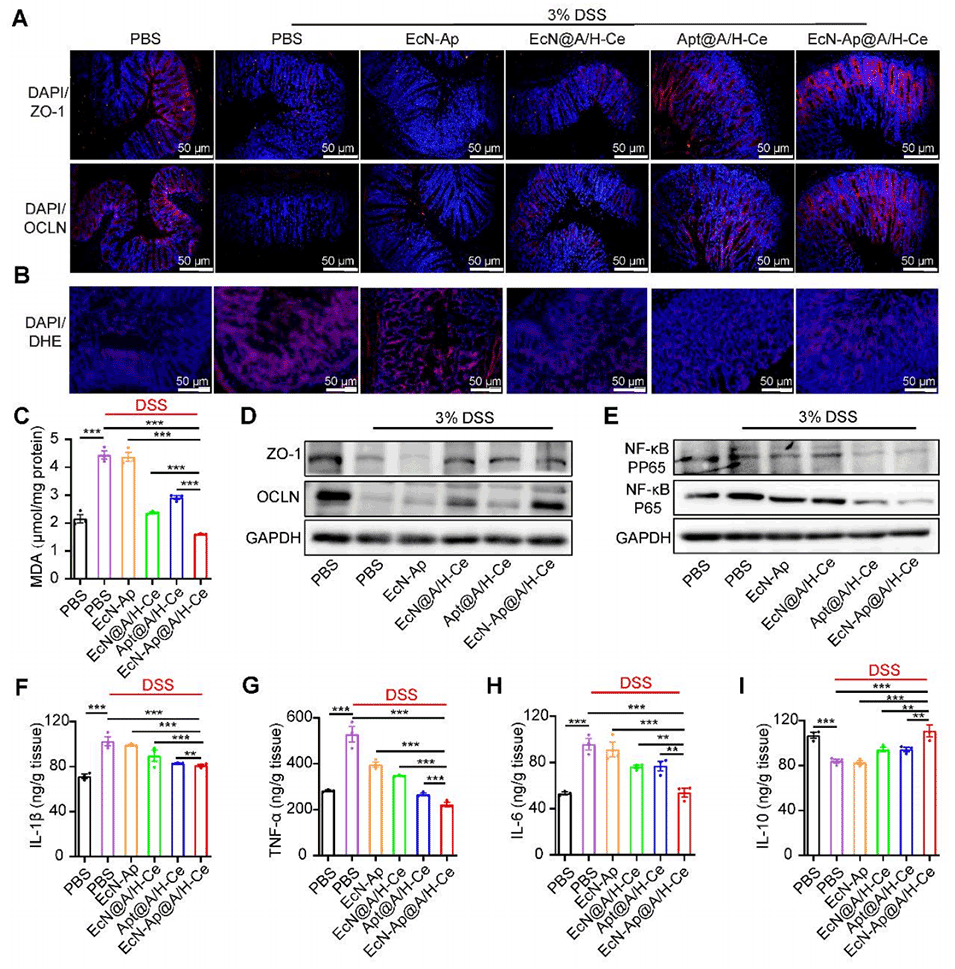
图4. EcN-Ap@A/H-Ce缓解小鼠结肠炎的多重作用机制
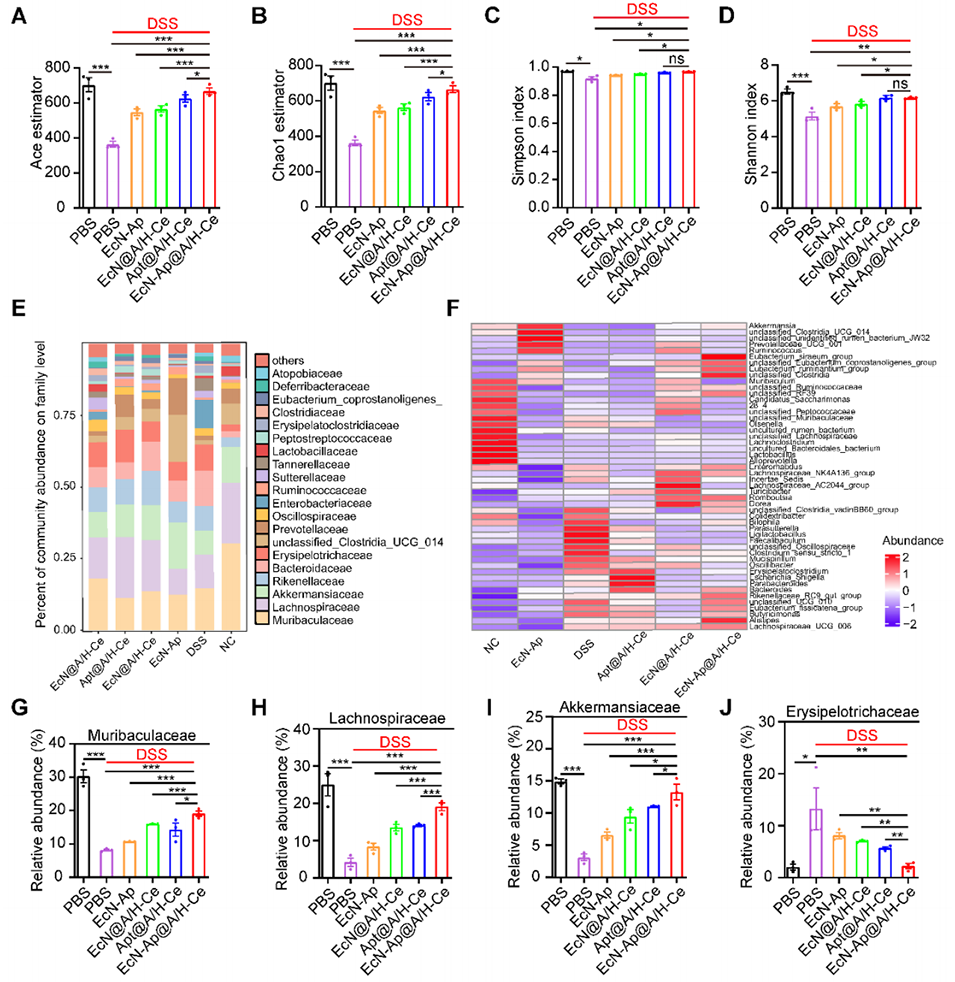
图5. EcN-Ap@A/H-Ce对肠道菌群的调节作用
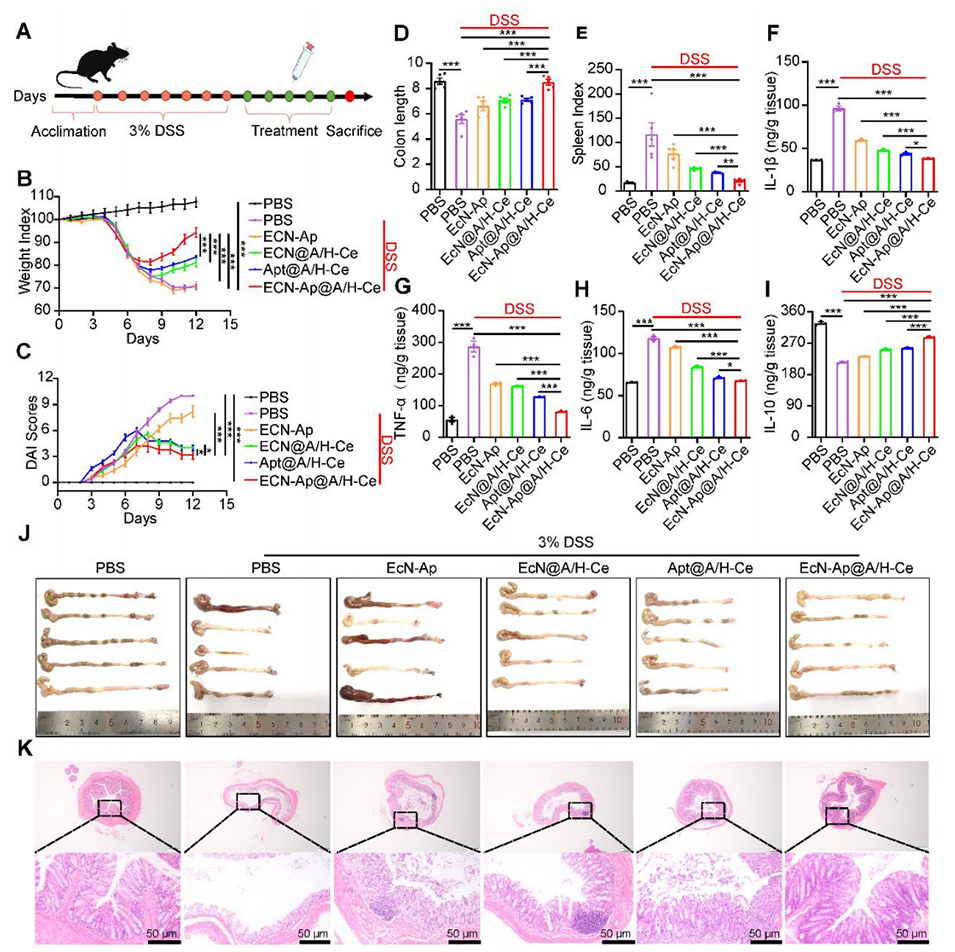
图6. EcN-Ap@A/H-Ce对DSS诱导的小鼠结肠炎的延迟治疗效果
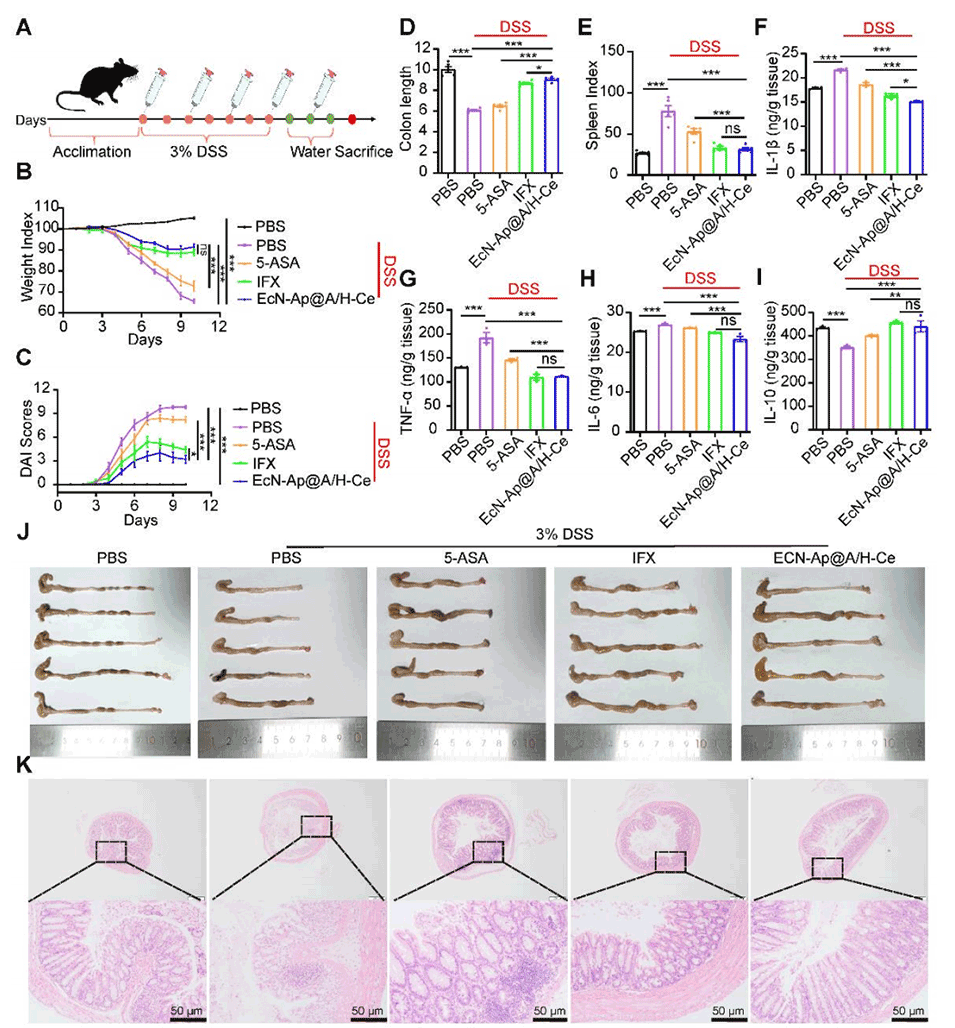
图7. EcN-Ap@A/H-Ce与临床药物的疗效对比
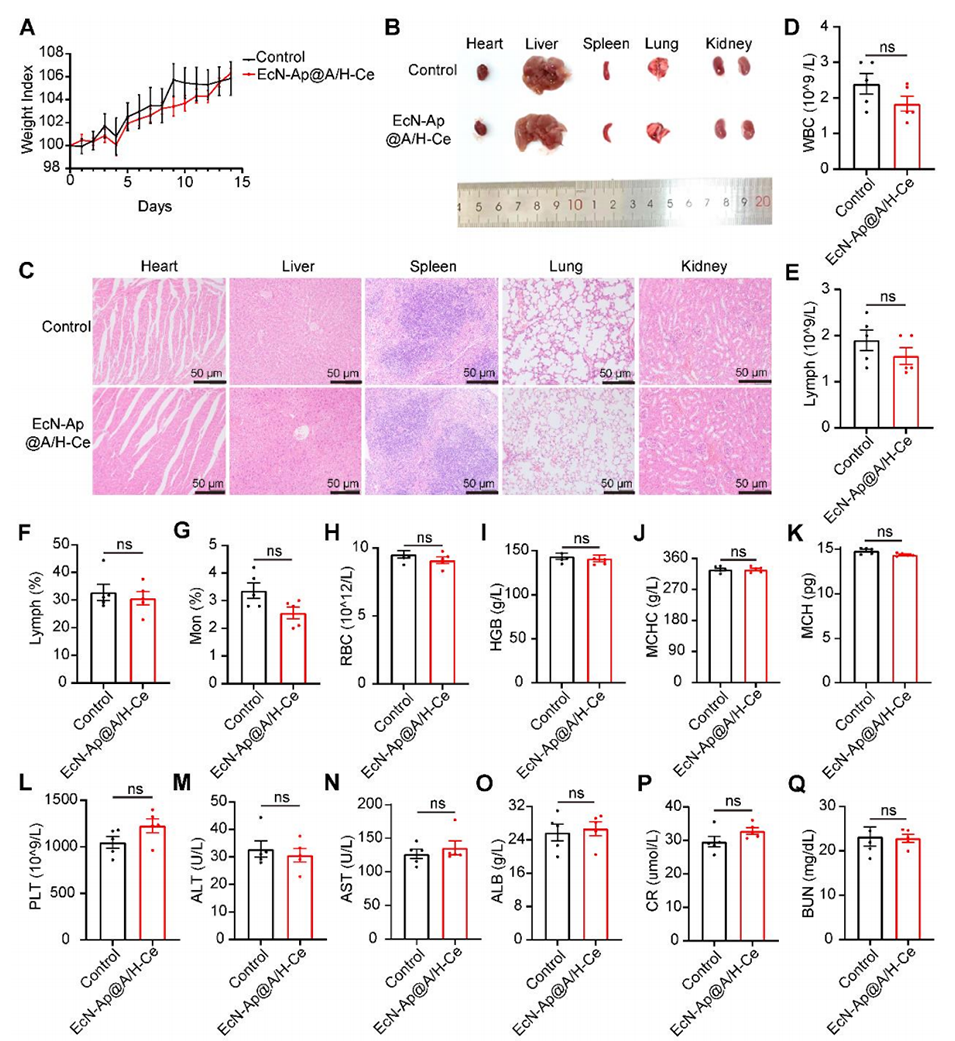
图8. EcN-Ap@A/H-Ce的体内生物安全性评价
论文链接:https://doi.org/10.1016/j.cej.2025.166413
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














