
导读:
3D细胞培养可提供具有生理相关性的微环境,促进细胞间通讯,助力发育过程并影响细胞行为。近期,有研究人员开发了一种基于微流控技术的可注射水凝胶微球,用于增强骨组织再生。该研究通过微流控液滴生成技术制备了尺寸均一的甲基丙烯酰化明胶/丝素蛋白(GelMA/SilMA)复合微球,并包载人成骨样MG-63细胞与载有地塞米松(DEX)的介孔二氧化硅纳米颗粒(DMSNs),形成具有持续药物释放功能的3D培养体系。相关研究以“Microfluidic-assisted fabrication of cell-laden GelMA/SilMA microspheres incorporated dexamethasone-loaded MSNs for promoting osteogenic differentiation”为题,发表在期刊《Chemical Engineering Journal》上。
本文要点:
1、本研究介绍了一种新型微流控方法,用于制备基于甲基丙烯酰化明胶(GelMA)/甲基丙烯酰化丝素蛋白(SilMA)的可注射、光交联水凝胶微球,该微球包含载地塞米松(DEX)的介孔二氧化硅纳米颗粒(MSNs)(DMSNs-GS),并封装人成骨细胞样MG-63细胞以诱导成骨分化。
2、采用微流控液滴生成技术制备油包水(W/O)乳液有助于精确控制GS微球的尺寸和均匀性,提供具有增强结构稳定性的可注射3D基质。
3、增强的GS水凝胶微球展现出强度与柔性的最佳平衡,从而改善了结构完整性,提高了细胞活性和分化能力。
4、DEX从DMSNs中的持续释放维持超过21天,为早期成骨分化提供了连续的骨诱导刺激,无需依赖外源性骨诱导培养基。
5、DMSNs的加入显著提高了封装细胞的增殖能力、碱性磷酸酶(ALP)活性、矿化钙沉积以及成骨标志物BMP-2和RUNX-2的表达。
6、微流控制造的DMSNs-GS微球结合持续DEX释放,提供了一个有利于成骨的定制微环境,凸显了这一创新平台在骨修复与重建的先进再生治疗中的应用潜力。
DMSNs-GS微球在体内的作用机制是什么?
1、提供结构支撑与3D微环境:GS复合水凝胶平衡力学强度与柔韧性,多孔结构(平均孔径39.5±1.9μm)利于营养与氧气输送及代谢废物排出,为封装的MG-63细胞及宿主骨相关细胞提供适宜生长空间,支持细胞黏附与增殖。
2、持续成骨诱导:DMSNs中负载的DEX通过GS水凝胶的溶胀与降解实现21天持续释放,刺激ALP活性提升、钙盐沉积及成骨标志物(RUNX-2、BMP-2)高表达,诱导MG-63细胞及宿主骨前体细胞向成骨细胞分化。
3、动态降解与组织整合:GS水凝胶降解速率与骨再生进程匹配(28天内剩余质量约31%),逐步为新骨形成腾出空间;MSNs表面硅羟基促进骨样磷灰石形成,增强微球与宿主骨组织的化学亲和性,助力新生骨整合。
4、保护细胞并促进功能发挥:微球生物相容性良好,减少体内免疫排斥,保护封装的MG-63细胞存活;随材料降解,细胞逐步融入宿主组织,参与新骨形成。
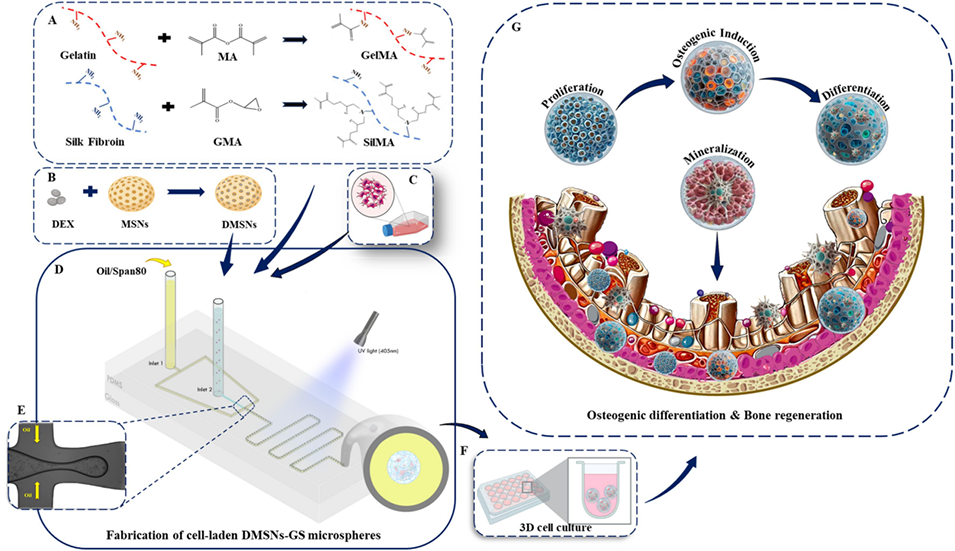
图1负载细胞的DMSNs-GS微球制备过程示意图。(A)水凝胶合成示意图。(B)载地塞米松(DEX)介孔二氧化硅纳米颗粒(MSNs)制备示意图。(C)人骨肉瘤MG-63细胞培养示意图。(D)通过微流控系统制备负载细胞的DMSNs-GS微球示意图。(E)负载细胞的DMSNs-GS液滴示意图。(F)三维细胞培养示意图。(G)微球中封装细胞的成骨分化示意图。
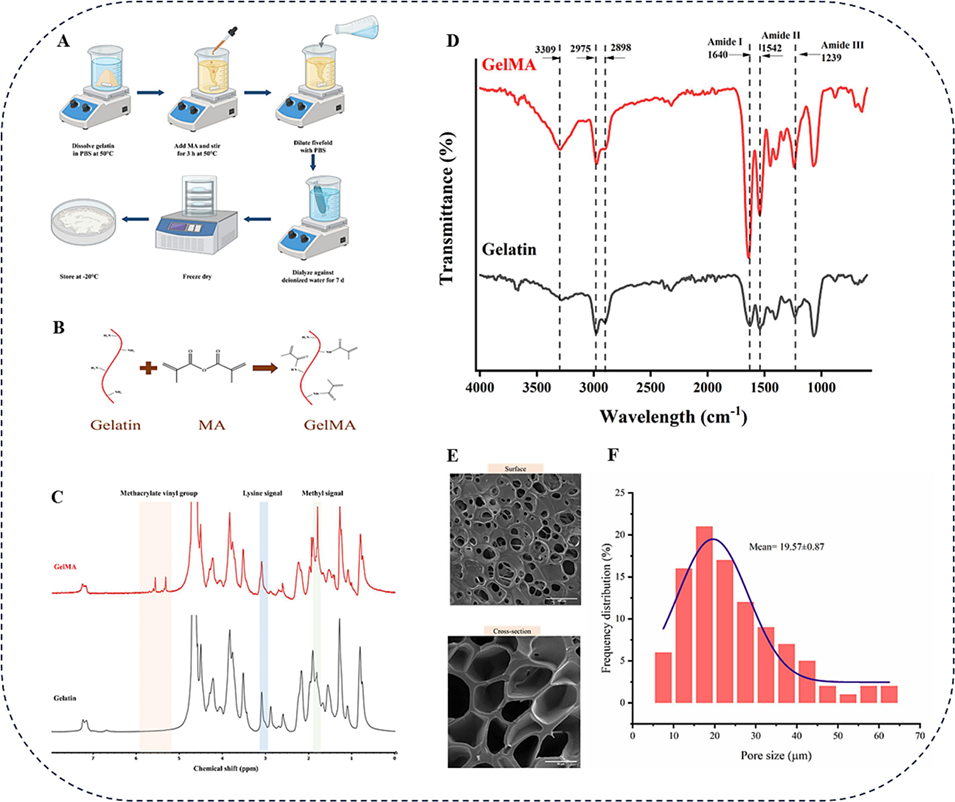
图2 GelMA的合成与表征。(A)GelMA合成流程示意图。(B)MA对明胶分子的改性。(C)明胶和GelMA的¹H NMR谱图。(D)明胶和GelMA的傅里叶变换红外光谱(FTIR)图。(E)GelMA水凝胶表面及横截面形貌的场发射扫描电子显微镜(FE-SEM)图像。(F)GelMA的孔径分布图。
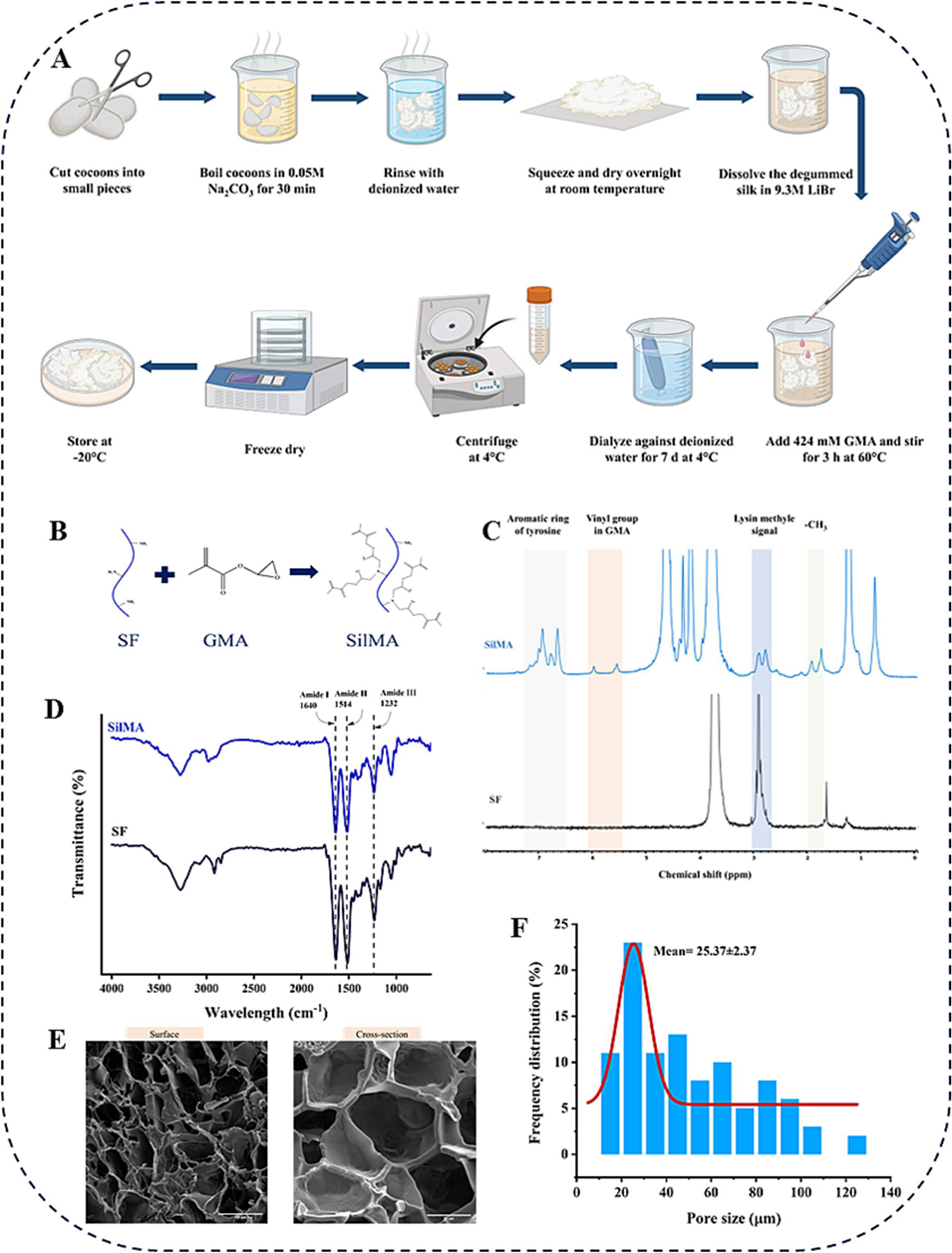
图3 SilMA的合成与表征。(A)SilMA合成流程示意图。(B)GMA对SF分子的改性。(C)SF和SilMA的¹H NMR谱图。(D)SF和SilMA的FTIR谱图。(E)SilMA水凝胶表面及横截面形貌的FE-SEM图像。(F)SilMA的孔径分布图。
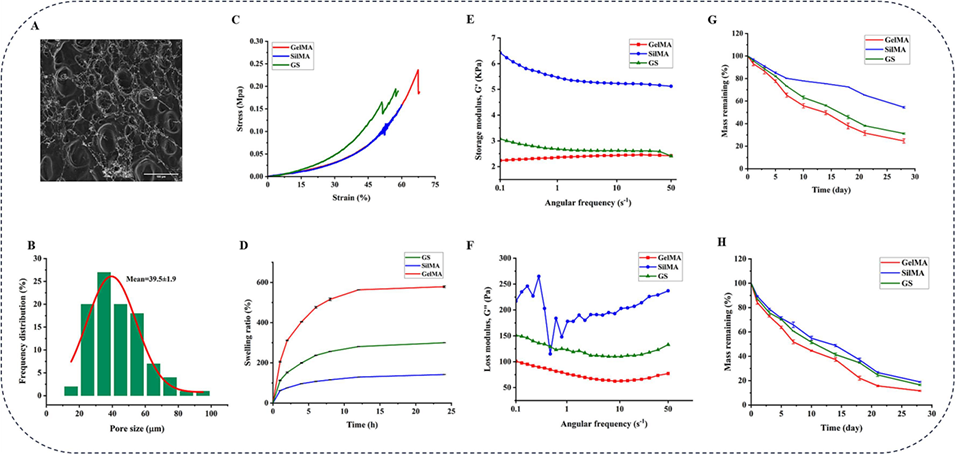
图4 GelMA/SilMA(GS)复合材料的表征。(A)GS的形貌特征。(B)GS的孔径分布。(C)压缩应力-应变曲线。(D)水凝胶的溶胀行为(n≥3)。(E)储能模量。(F)损耗模量。(G)水凝胶在磷酸缓冲盐溶液(PBS)中的降解行为(n≥3)。(H)水凝胶的酶促降解行为(n≥3)。
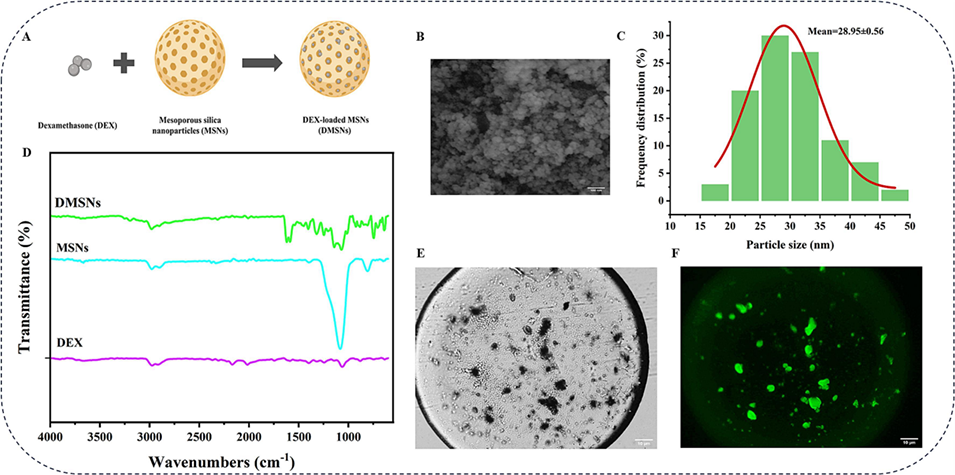
图5介孔二氧化硅纳米颗粒(MSNs)及载地塞米松(DEX)MSNs的制备。(A)DMSNs制备的示意图展示。(B)合成的MSNs的FE-SEM图像。(C)MSNs的粒径分布。(D)MSNs、DEX和DMSNs的FTIR谱图。(E)DMSNs-GS微球的显微镜图像。(F)异硫氰酸荧光素(FITC)标记的DMSNs-GS微球的荧光图像。
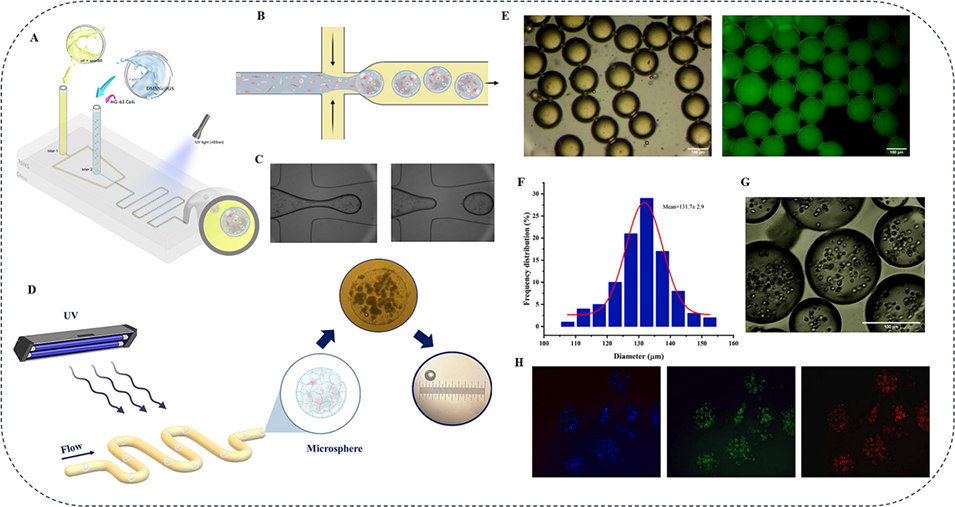
图6 DMSNs-GS微球的制备。(A)一步法制备微球的微流控系统示意图。(B)液滴生成示意图。(C)微流控芯片中的液滴形成过程。(D)水凝胶微球交联示意图。(E)生成液滴的显微镜图像。(F)液滴尺寸分布。(G)载细胞微球的代表性显微镜图像。(H)经DAPI(蓝色)、FITC(绿色)和Cy3(红色)染色的细胞荧光图像。
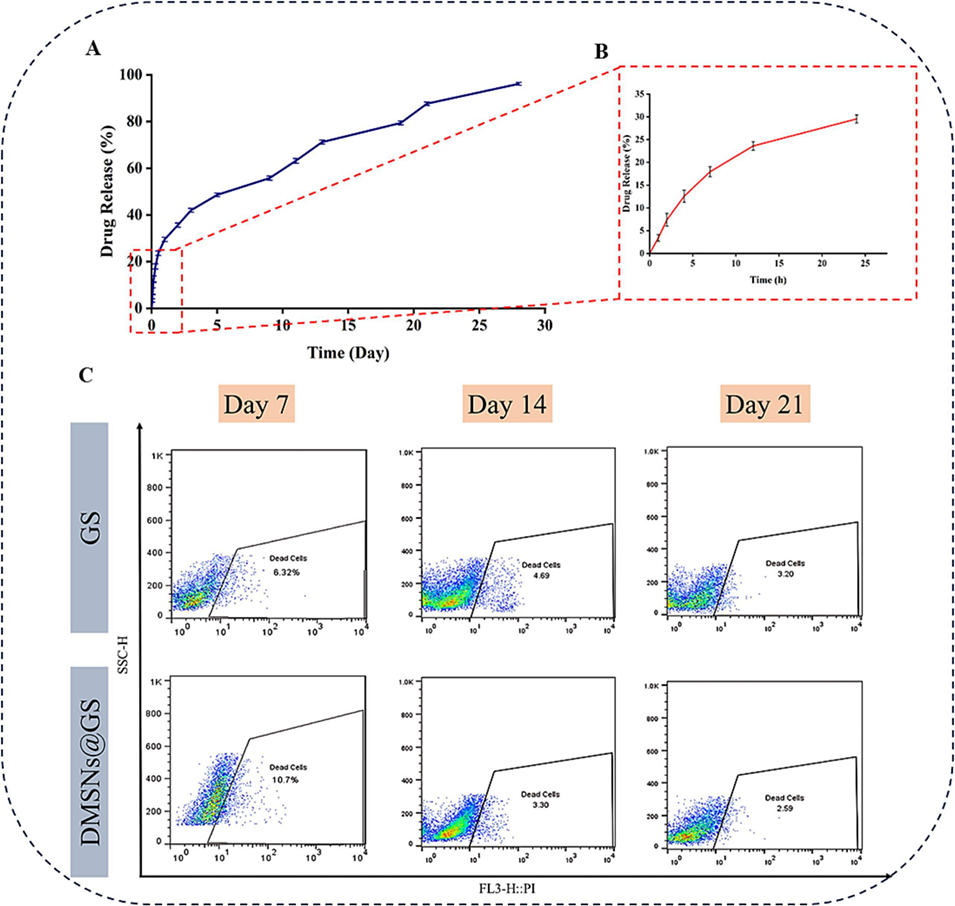
图7(A)载DEX的MSNs-GS的累积释放曲线(n≥3)。(B)载DEX的MSNs-GS的突释曲线(n≥3)。(C)第7、14和21天的流式细胞术分析结果。
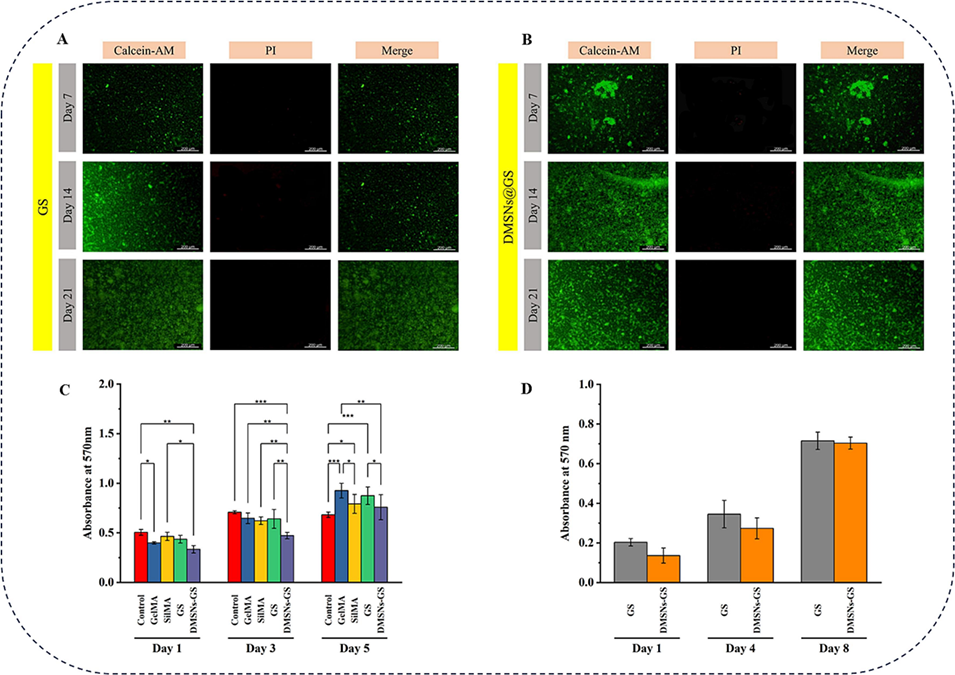
图8生物相容性及细胞增殖评估。(A)GS在第7、14和21天的代表性活/死细胞染色图像。(B)DMSNs-GS在第7、14和21天的代表性活/死细胞染色图像。(C)L929细胞与GelMA、SilMA、GS和DMSNs-GS共培养第1、3和5天的MTT法生物相容性评估(n≥3)。(D)封装在GS和DMSNs-GS中的MG-63细胞在第1、4和8天的活力及增殖情况(n≥3)。
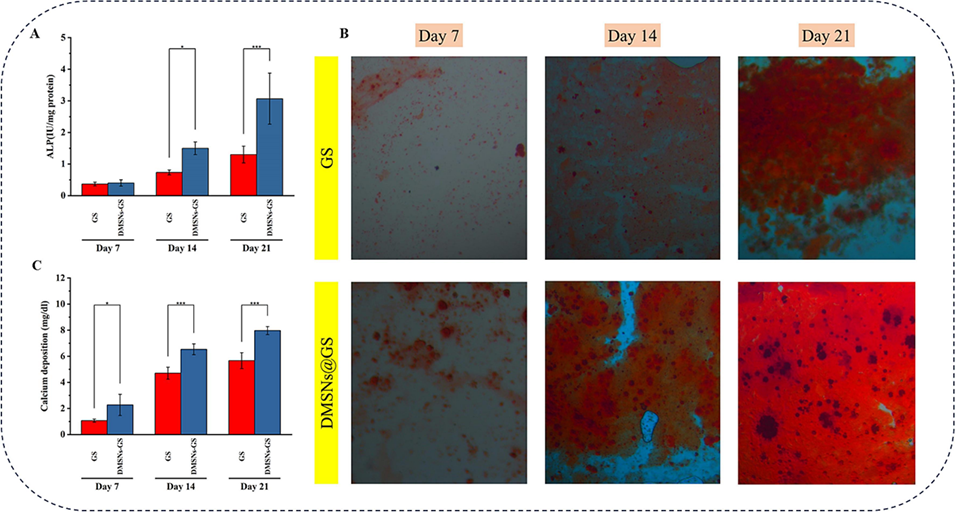
图9 GS和DMSNs-GS在第7、14和21天的成骨活性评估。(A)碱性磷酸酶(ALP)活性(n≥3)。(B)茜素红染色结果。(C)钙沉积量(n≥3)。
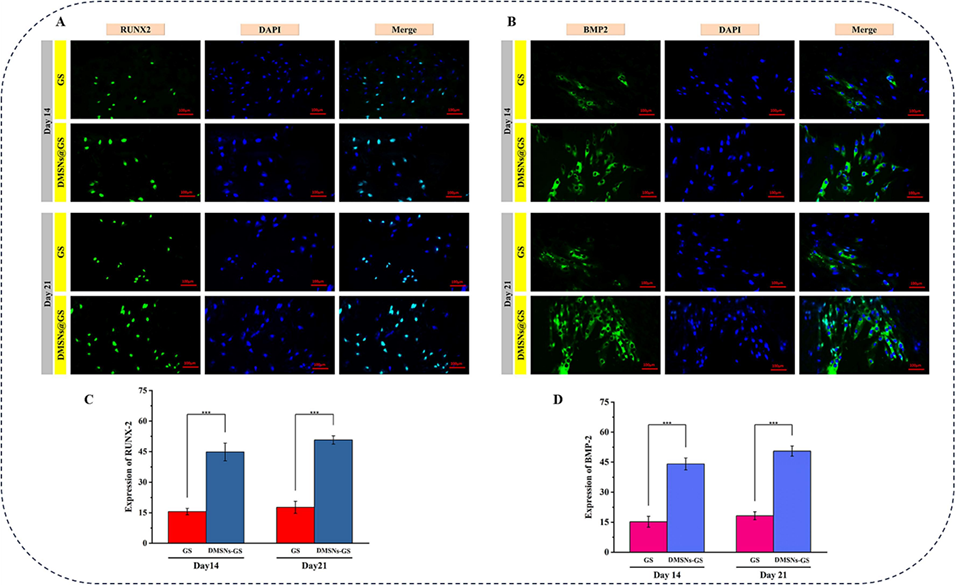
图10成骨分化活性。(A)GS和DMSNs在第14和21天的RUNX-2表达免疫荧光染色。(B)第14和21天RUNX-2表达的定量分析(n=3)。(C)GS和DMSNs在第14和21天的骨形态发生蛋白2(BMP-2)表达免疫荧光染色。(D)第14和21天BMP-2表达的定量分析(n=3)。
论文链接:https://doi.org/10.1016/j.cej.2025.166221 (本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














