
导读:
椎间盘退化(IVD)仍然是再生医学中的一个重大挑战。近期,苏州大学骨科研究所徐勇教授、何帆教授以及常州市第一人民医院丁文鸽副教授等人开发了一种新型双网络水凝胶微球(GelMA-FCD-GA),通过模拟髓核细胞细胞外基质(ECM)的力学与生化特性,显著增强髓核再生能力。该微球结合GelMA的静态机械支撑与岩藻多糖-明胶动态网络的粘弹性,在体外提升线粒体功能和抗氧化能力,并在大鼠模型中成功恢复椎间盘高度(↑38.7%)及II型胶原沉积(↑6.7倍),为椎间盘退变治疗提供新策略。相关研究以“Dynamic dual-network hydrogel microspheres for enhanced nucleus pulposus regeneration via extracellular matrix mimicry”为题目,发表在期刊《Composites Part B: Engineering》上。
本文要点:
1、本研究开发了一种新型动态双网络水凝胶微球(GelMA-FCD-GA),旨在模拟髓核细胞(NPC)的天然细胞外基质(ECM)。
2、该微球结合甲基丙烯酰化明胶(GelMA)和岩藻多糖(FCD),并进一步用醛基(GA)修饰,以建立能够转导机械信号和促进细胞功能的动态粘弹性支架。
3、体外实验显示,其可增强NPCs的线粒体功能和抗氧化能力,表现为呼吸链因子表达增加、活性氧水平降低。
4、在体内,将负载NPC的GelMA-FCD-GA微球移植到大鼠尾椎间盘中显示出显著的再生效果,与对照组相比,MRI信号得到改善,椎间盘高度恢复,组织学结果良好。
5、该设计结合生物活性材料的力学优势与岩藻多糖的生物活性,支持细胞黏附和生长,且能动态适应生理环境,为椎间盘再生提供了高效平台。
GelMA-FCD-GA微球的双网络结构通过以下方式模拟天然细胞外基质(ECM):
第一网络(静态机械支撑网络):由GelMA的化学交联形成,保留明胶的RGD序列和基质金属蛋白酶(MMP)氨基酸序列,为髓核细胞(NPCs)提供黏附、生长的位点,同时赋予微球基础机械强度和结构稳定性,模拟天然ECM的胶原纤维骨架功能。
第二网络(动态粘弹性网络):通过醛基化岩藻多糖(FCD-ALD)与明胶的氨基形成席夫碱键构建而成,赋予微球应力松弛特性(τ1/2≈150s),接近天然髓核组织的粘弹性(τ1/2≈100s),可动态响应机械信号并参与细胞介导的重塑,模拟天然ECM随生理环境动态变化的特性。
此外,双网络结构使微球孔隙率(26.4±6.6μm)与天然髓核组织(29.8±9.7μm)接近,利于营养交换和细胞活动;岩藻多糖作为硫酸化多糖,模拟天然ECM中硫酸软骨素等成分的生物活性,协同促进NPCs的软骨表型维持和ECM合成。
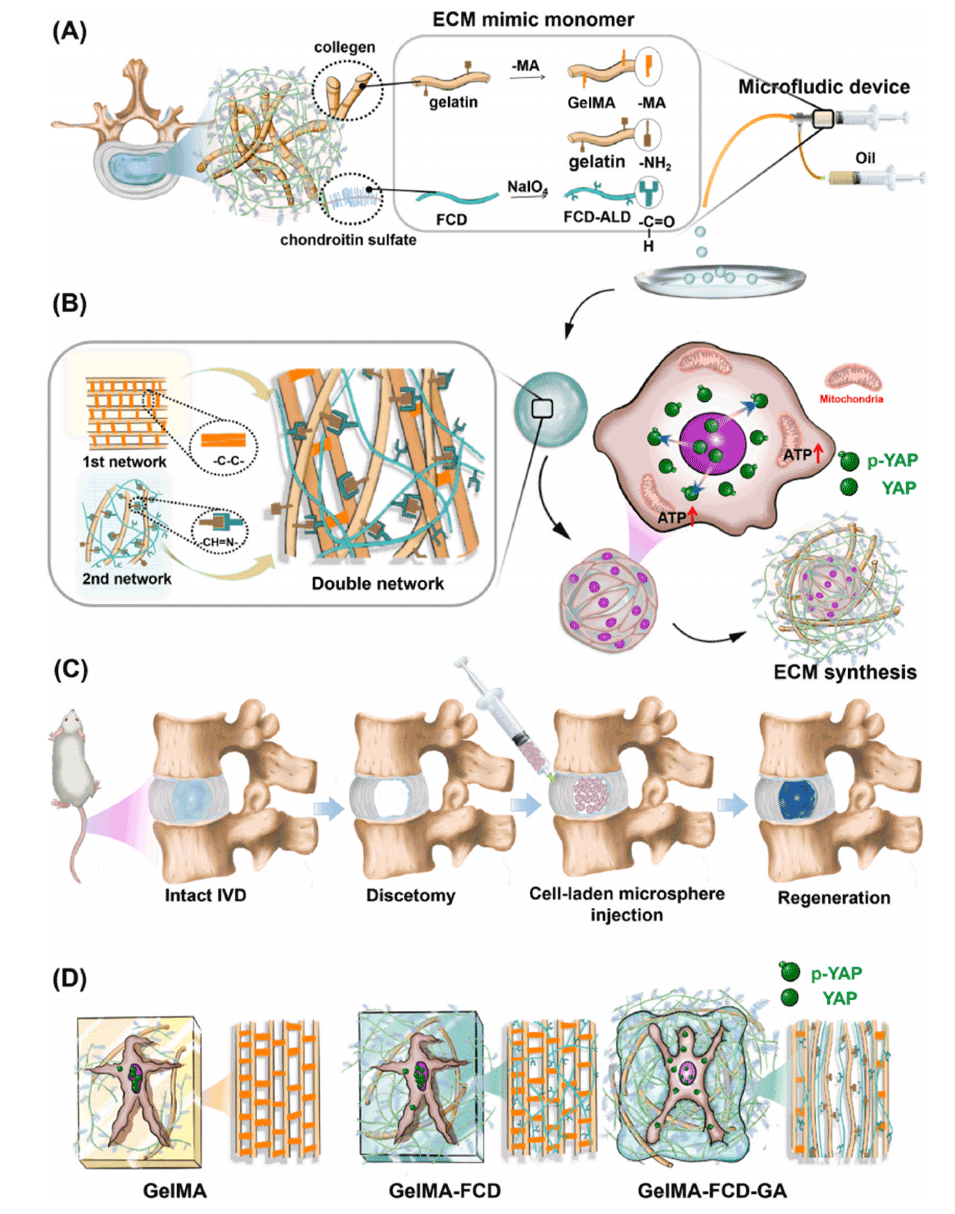
Scheme 1. 本研究示意图。(A) ECM模拟单体的选择及利用微流控设备制备双网络水凝胶微球的过程。(B) 双网络水凝胶微球的结构及其对粘附其上的NPCs的生物学影响。(C) 椎间盘切除过程及负载NPCs的双网络水凝胶微球的再生效果。(D) 与其他类型相比,具有粘弹性的双网络水凝胶微球能为NPCs提供适宜的微环境。
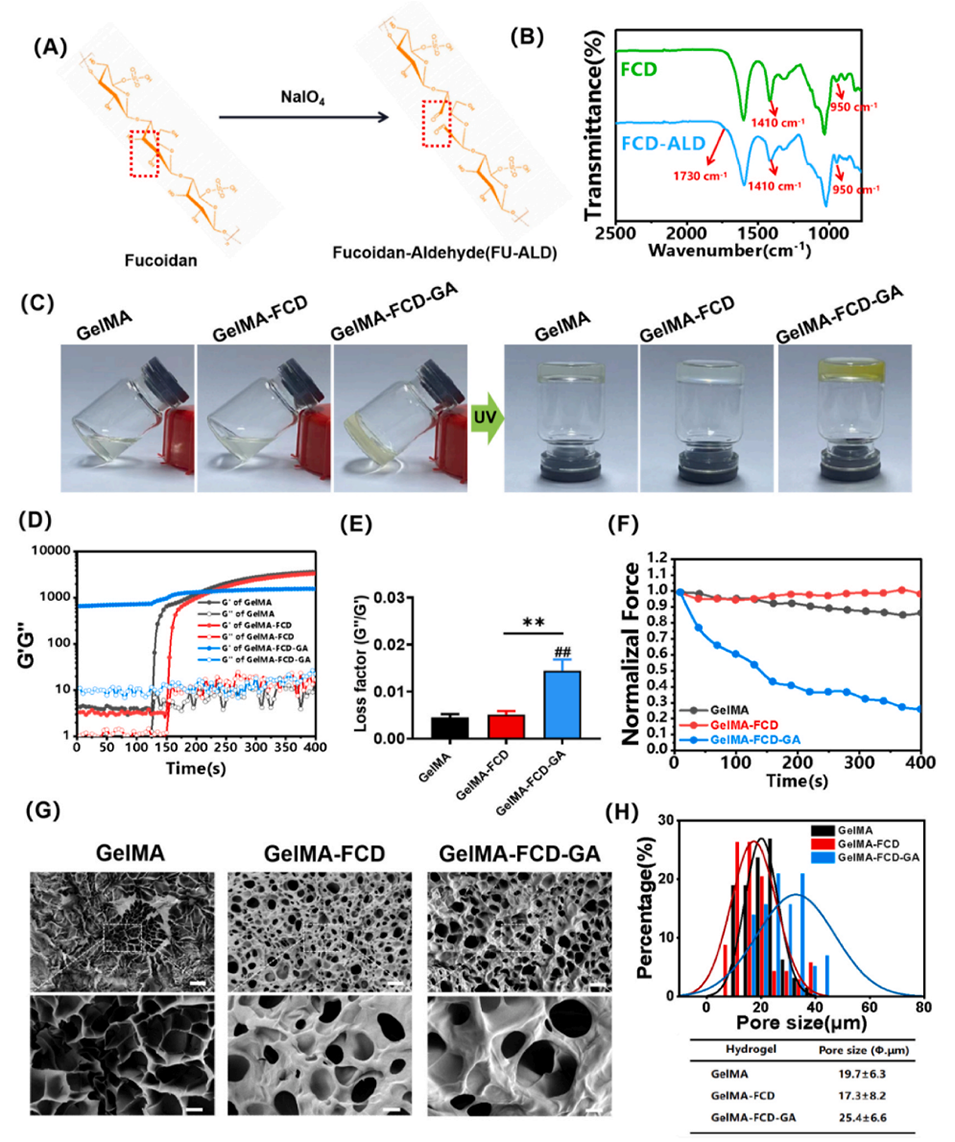
图1. 水凝胶的表征。(A) 制备FCD-ALD的合成路线图。(B) 傅里叶变换红外光谱(FTIR)分析。(C) 水凝胶形成过程的照片。(D) 水凝胶形成过程的流变学特性。(E) 损耗因子分析。(F) 应力松弛测试。(G) 水凝胶的扫描电镜(SEM)图像。上图比例尺= 50 μm,下图比例尺= 10 μm。(H) GelMA、GelMA-FCD和GelMA-FCD-GA水凝胶的孔径。
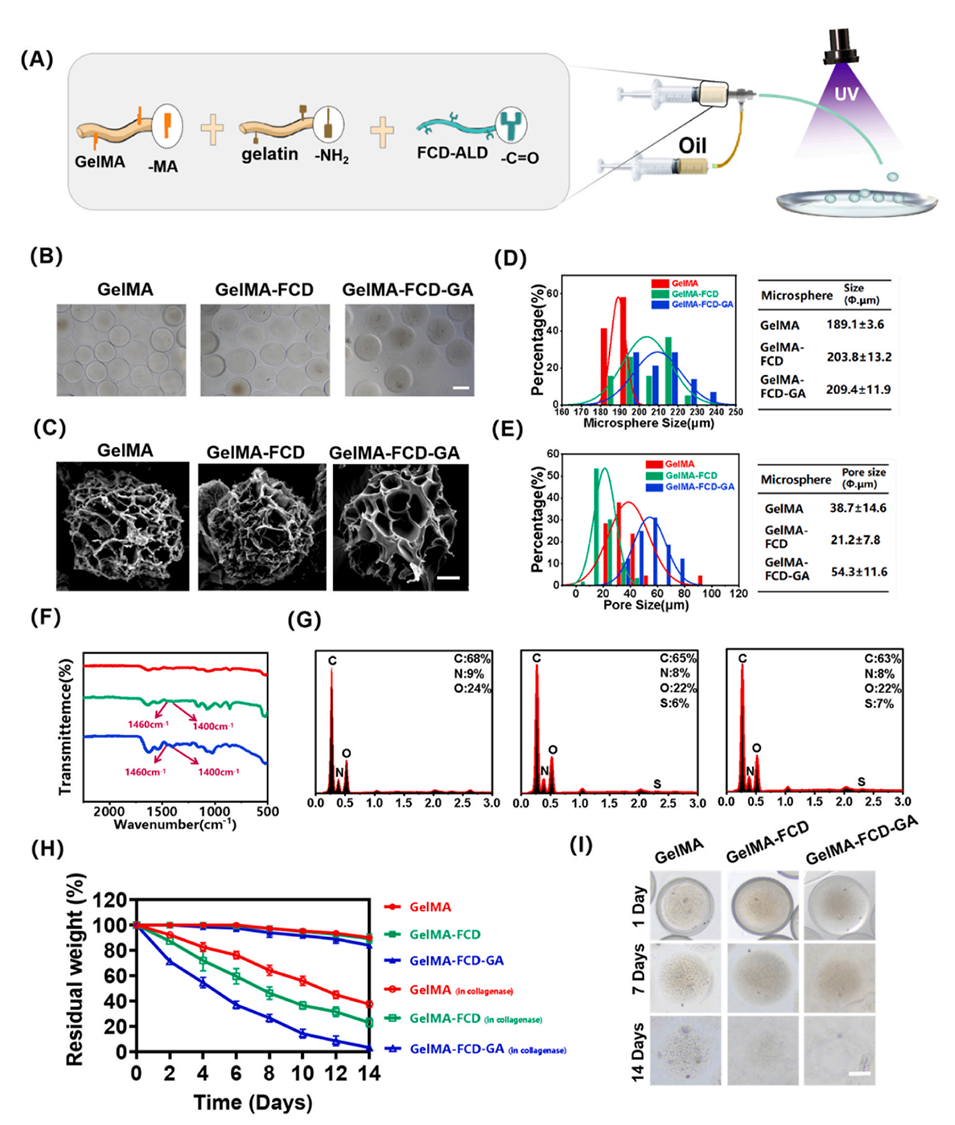
图2. 水凝胶微球的特性。(A) 水凝胶微球制备示意图。(B) 水凝胶微球的显微镜图像,比例尺= 200 μm。(C) 水凝胶微球的SEM图像,比例尺= 50 μm。(D) 水凝胶微球的尺寸分布。(E) 水凝胶微球的孔径。(F) FTIR分析。(G) 能谱(EDS)分析。(H) 水凝胶微球的降解速率。(I) 降解后微球的显微镜图像。降解实验的定量数据来自3次独立实验。

图3. 水凝胶和水凝胶微球的生物相容性。(A) 第5天,在水凝胶和水凝胶微球上增殖的NPCs的显微镜图像。在水凝胶(B)和水凝胶微球(C)上培养的NPCs的细胞骨架染色荧光图像,水凝胶比例尺= 200 μm,水凝胶微球比例尺= 100 μm。在水凝胶(D)和水凝胶微球(E)上培养1天、3天、5天的活/死染色结果,水凝胶比例尺= 1 mm,水凝胶微球比例尺= 100 μm。在水凝胶(F)和水凝胶微球(G)上培养1天、3天、5天的NPCs存活率。在水凝胶(H)和水凝胶微球(I)上培养1天、4天、7天的NPCs增殖情况。将p值<0.05设定为具有统计学意义的显著差异(不同指示组间比较:*p<0.05,**p<0.01;与GelMA组比较:#p<0.05,##p<0.01)。
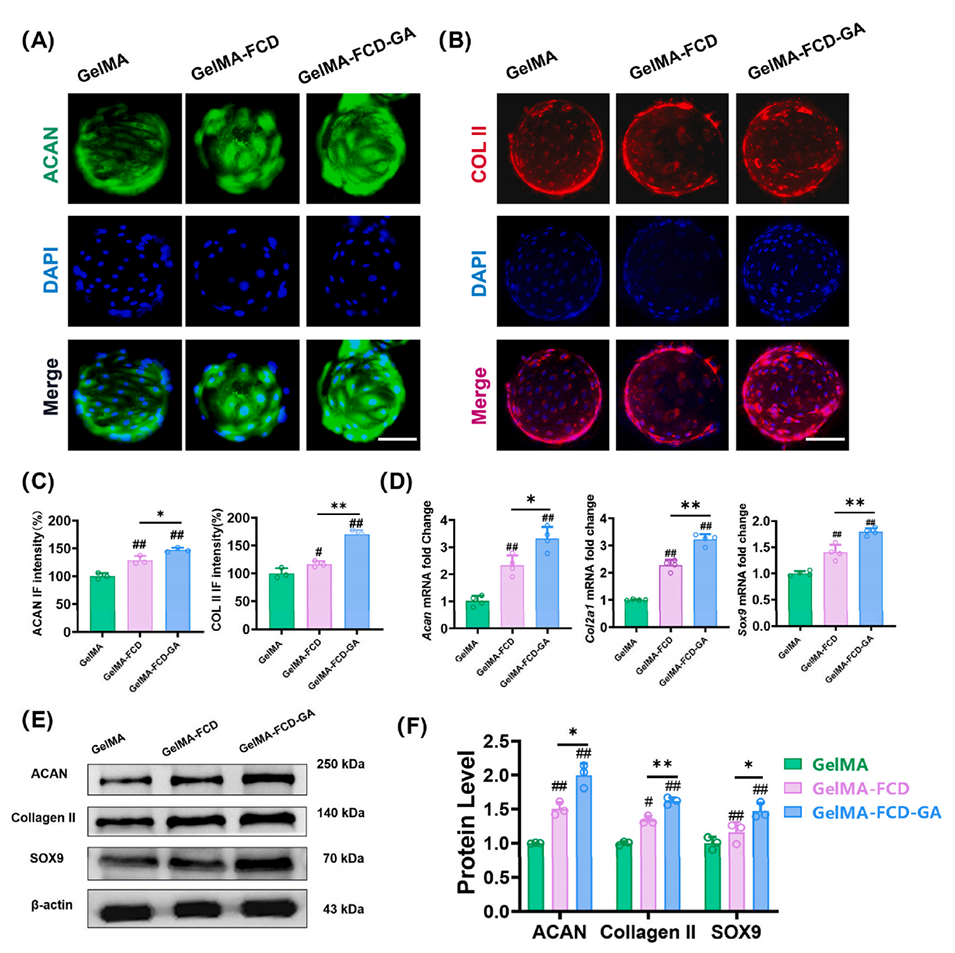
图4. 在水凝胶微球上培养的NPCs的基质合成能力。NPCs在水凝胶微球上的ACAN(A)和COL II(B)的免疫荧光染色,比例尺= 100 μm。(C) ACAN和COL II荧光强度的定量分析。(D) NPCs的Acan、Col2a1和Sox9基因水平。(E) NPCs中基质蛋白的Western blot结果。(F) Western blot的半定量分析。定量数据来源于RT-PCR实验的4个重复样本,以及Western blot和免疫荧光实验的3个重复样本。将p值<0.05设定为具有统计学意义的显著差异(不同指示组间比较:*p<0.05,**p<0.01;与GelMA组比较:#p<0.05,##p<0.01)。
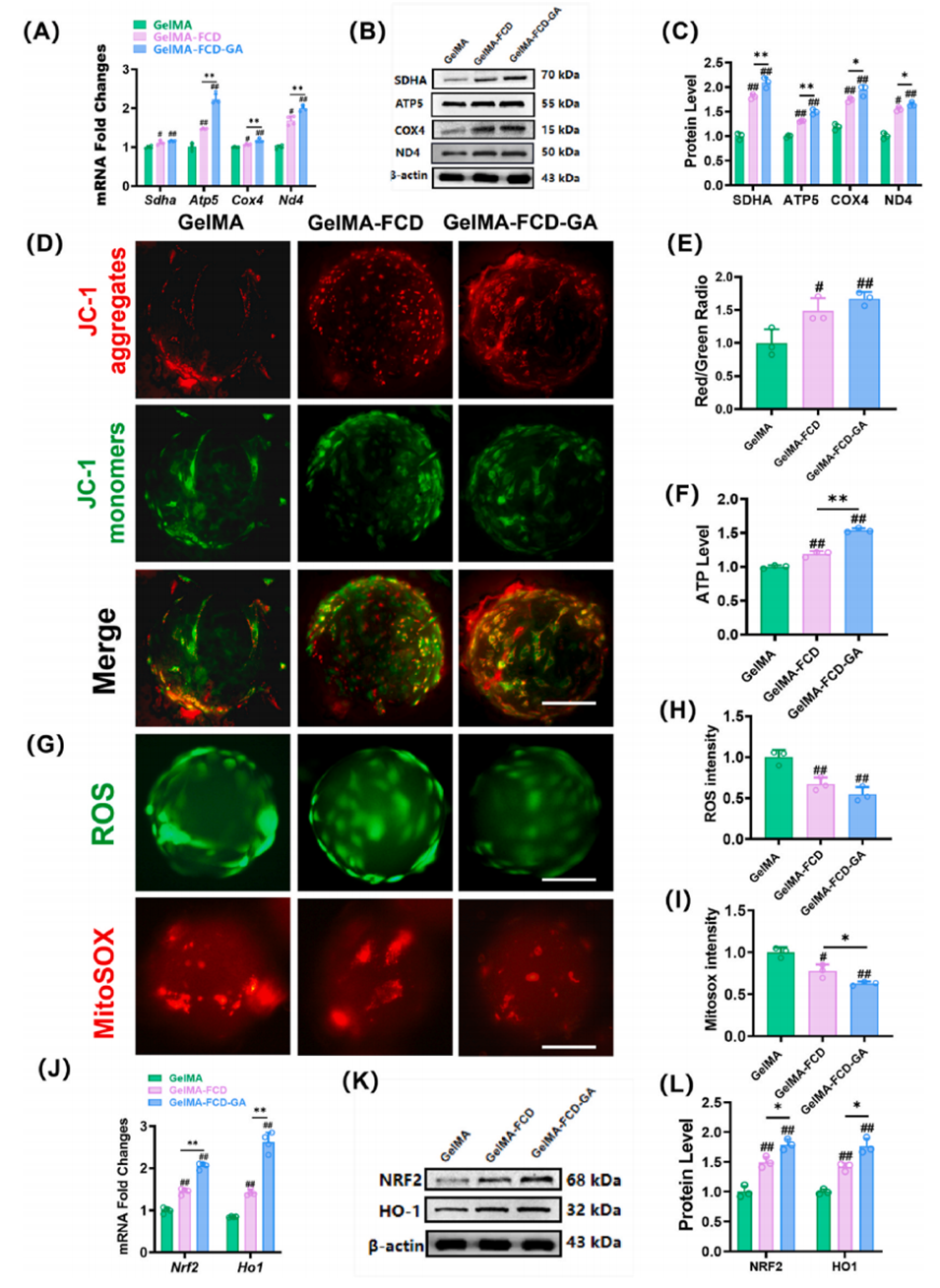
图5. 水凝胶微球上NPCs的线粒体功能和抗氧化能力。
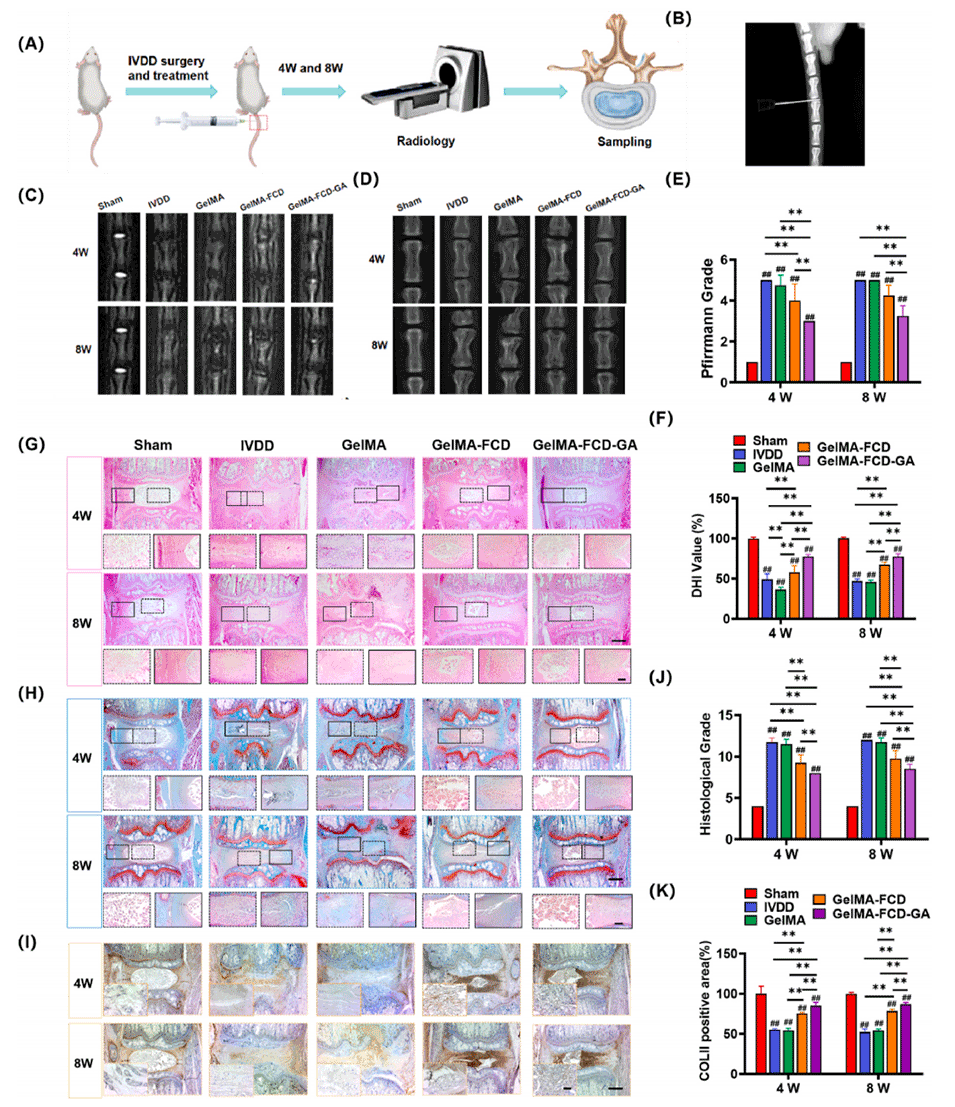
图6. 注射不同微球预防髓核退变。
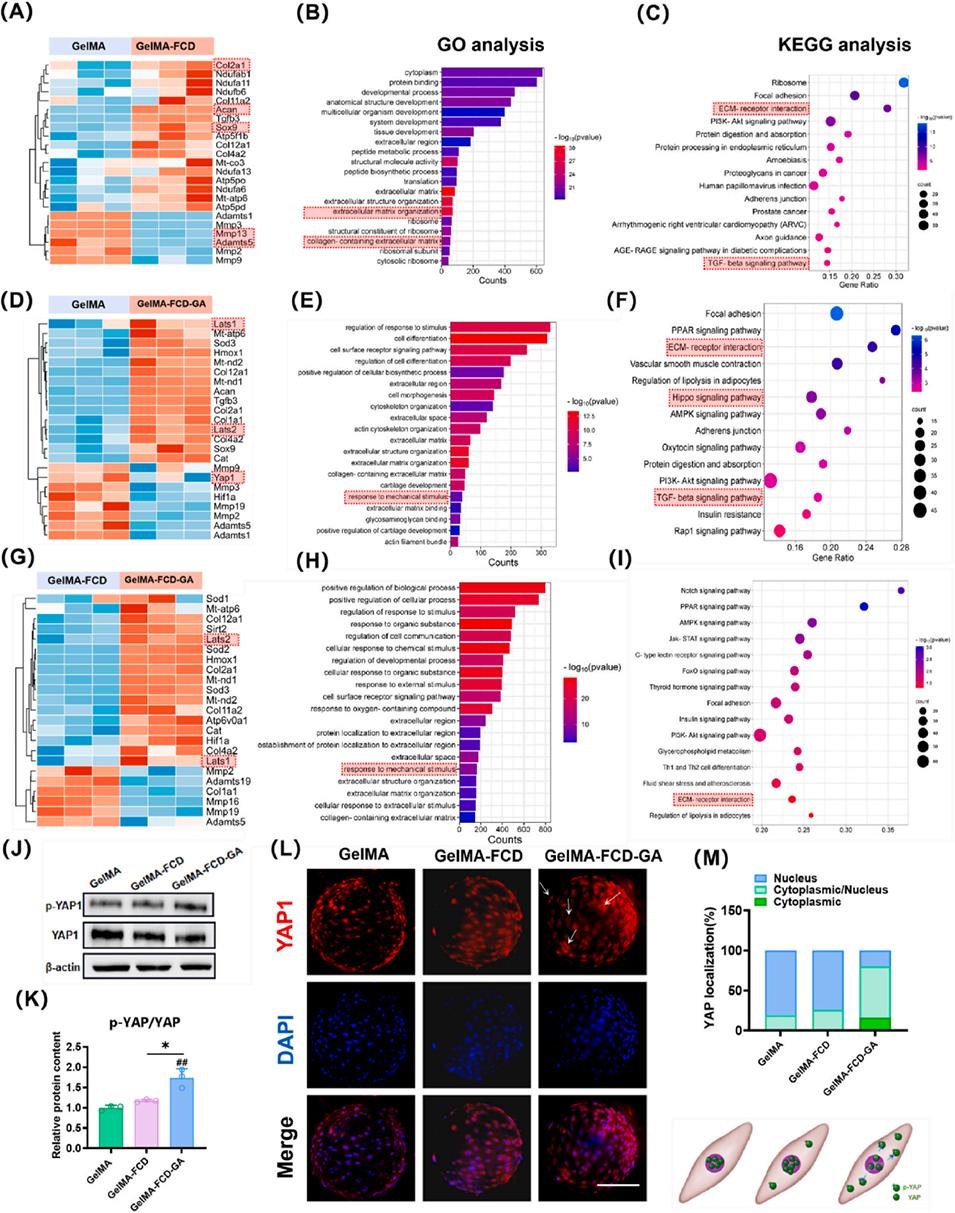
图7. 在GelMA、GelMA-FCD和GelMA-FCD-GA微球上培养的NPCs的RNA测序分析。
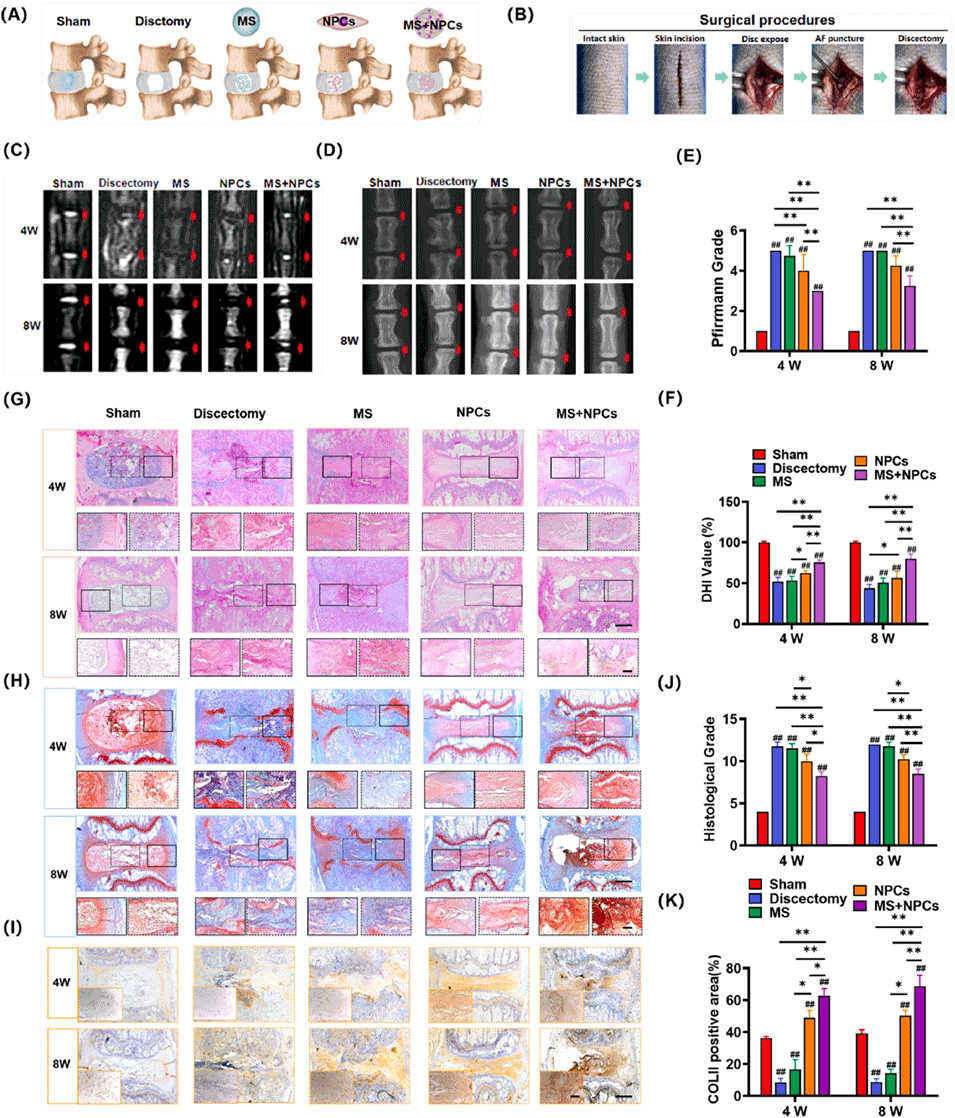
图8. 注射负载细胞的微球用于髓核再生。(A) 实验组示意图。(B) 椎间盘切除手术流程。(C) 第4周和第8周的MRI代表性图像。(D) 第4周和第8周的X射线代表性图像。(E) 目标椎间盘的Pfirrmann分级。(F) 目标椎间盘的DHI百分比变化。(G–I) 第4周和第8周椎间盘的HE染色(G)、S-O染色(H)、COL II免疫组化(I)代表性图像,比例尺= 1 mm,高倍镜比例尺= 100 μm。(J) 不同组的组织学评分。(K) COL II水平的定量分析。Pfirrmann分级、DHI评估、组织学评分和定量免疫组化的定量数据来自4次独立实验。将p值<0.05设定为具有统计学意义的显著差异(不同指示组间比较:*p<0.05,**p<0.01;与假手术组比较:#p<0.05,##p<0.01)。
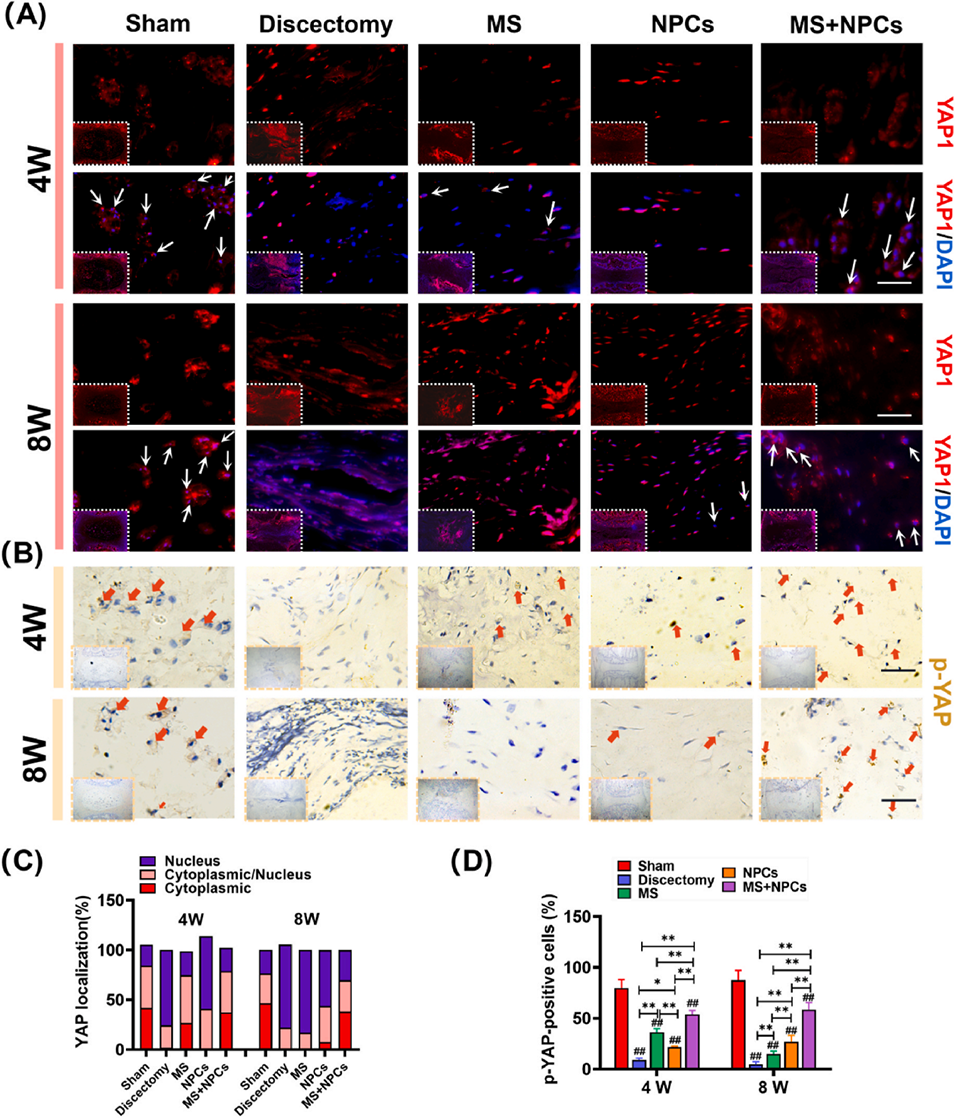
图9. (A) YAP1的荧光免疫染色,比例尺= 100 μm,白色箭头标注的是YAP1主要分布于细胞质中的代表性 NPCs。(B) p-YAP1的免疫组化染色,比例尺= 100 μm,红色箭头指示的是p-YAP1阳性的代表性NPCs。(C) YAP1定位分析。(D) p-YAP水平的定量分析。统计不同组中p-YAP1阳性细胞的数量及表达强度,数据来源于4次独立实验。将p值<0.05设定为具有统计学意义的显著差异(不同指示组间比较:*p<0.05,**p<0.01;与假手术组比较:#p<0.05,##p<0.01)。
论文链接:https://doi.org/10.1016/j.compositesb.2025.112715 (本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














