骨关节炎(OA)因发病机制复杂、治疗手段有限,其临床诊疗极具挑战性。脐带间充质干细胞来源的外泌体凭借低免疫原性、高生物相容性和优异的跨膜特性,在OA治疗中展现出巨大研究价值。健康软骨细胞的细胞外基质合成代谢对软骨稳态至关重要,而软骨细胞中miR-148a的异常减少会损害这一过程,加速OA进展,故增加软骨细胞中miR-148a是一种潜在的OA治疗策略。但关节软骨致密的细胞外基质会阻碍外泌体和微RNA递送,加之它们在体内留存时间短,极大地限制了其临床应用。

鉴于此,温州医科大学附属第五医院何登伟、陈振中团队联合台州医院洪正华团队研发了一种搭载软骨细胞靶向外泌体的可生物降解微球(CAP-EXOs/miR-148a@GAM),以实现miR-148a的持续递送,该微球在体外和体内实验中均展现出促进软骨细胞合成代谢、延缓软骨退变的良好效果。相关研究以“A microsphere loaded with chondrocyte-targeting exosomes continuously deliver miR-148a for osteoarthritis therapy”为题目,发表在期刊《Materials Today Bio》上。
本文要点:
1、本研究通过微流控系统合成了含甲基丙烯酰化明胶和链霉亲和素的微球(GAM),将miR-148a载入经软骨靶向肽CAP修饰的外泌体(CAP-EXOs),并将其包封入GAM,得到CAP-EXOs/miR148a@GAM。
2、体外实验显示该微球可促进软骨细胞合成代谢,维持软骨稳态;体内实验表明其能有效延缓骨关节炎软骨退变。
3、此外,还对相关机制进行了探究,如miR-148a通过靶向Robo2并负调控MAPK信号通路促进细胞外基质合成代谢等,同时对所构建的外泌体和微球的特性及效果进行了验证。
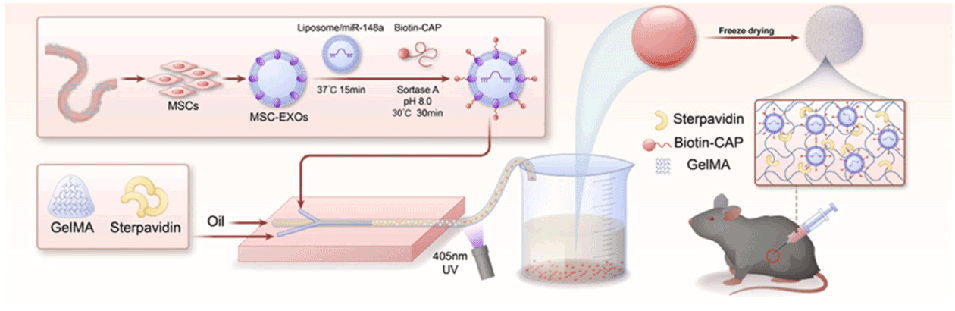
GAM微球是如何制备的?
1、材料准备
水相:将10%(w/v)甲基丙烯酰化明胶(GelMA)溶解在含有0.5%光引发剂LAP的PBS中,再按2:1的比例混入链霉亲和素。
油相:采用含8%(v/v)Span-80的液体石蜡。
2、微流控装置搭建
微流控系统由塑料导管(内径500 μm)、毛细管玻璃管(内径300 μm)和注射器针头组成,塑料导管同轴放置并通过毛细管玻璃管连接,针头侧向插入一端塑料导管,所有连接处均用胶水固定以确保密封。
3、微球形成
控制油相和水相的泵送速率,油相为5 mL/min,水相为0.5 mL/min,利用液体在微流控装置中的剪切力和表面张力,生成水相球形液滴。
借助GelMA的光交联特性,用405 nm波长的紫外灯照射水相液滴,使其固化形成微球。
4、纯化处理
收集微球后,用丙酮洗涤以去除石蜡,再用PBS纯化,冻干后通过扫描电镜(SEM)进行观察。
通过该方法制备的GAM微球粒径约124.3 μm,具有多孔结构(平均孔径8 μm),具备良好的生物相容性和可降解性,为后续负载靶向外泌体奠定了基础。
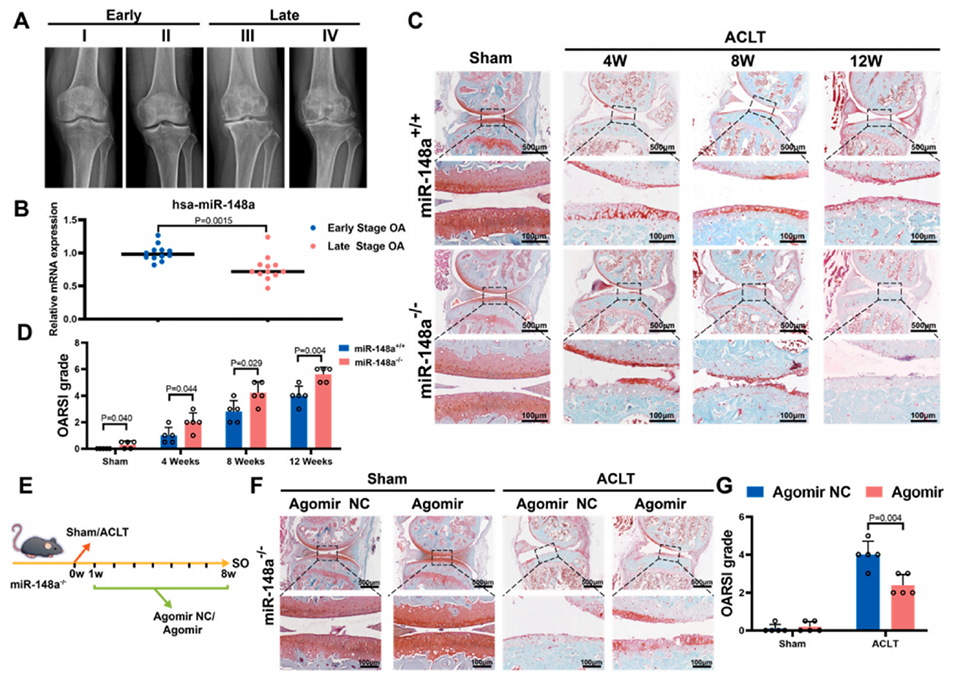
图1. miR-148a在ACLT诱导的骨关节炎中保护软骨退变
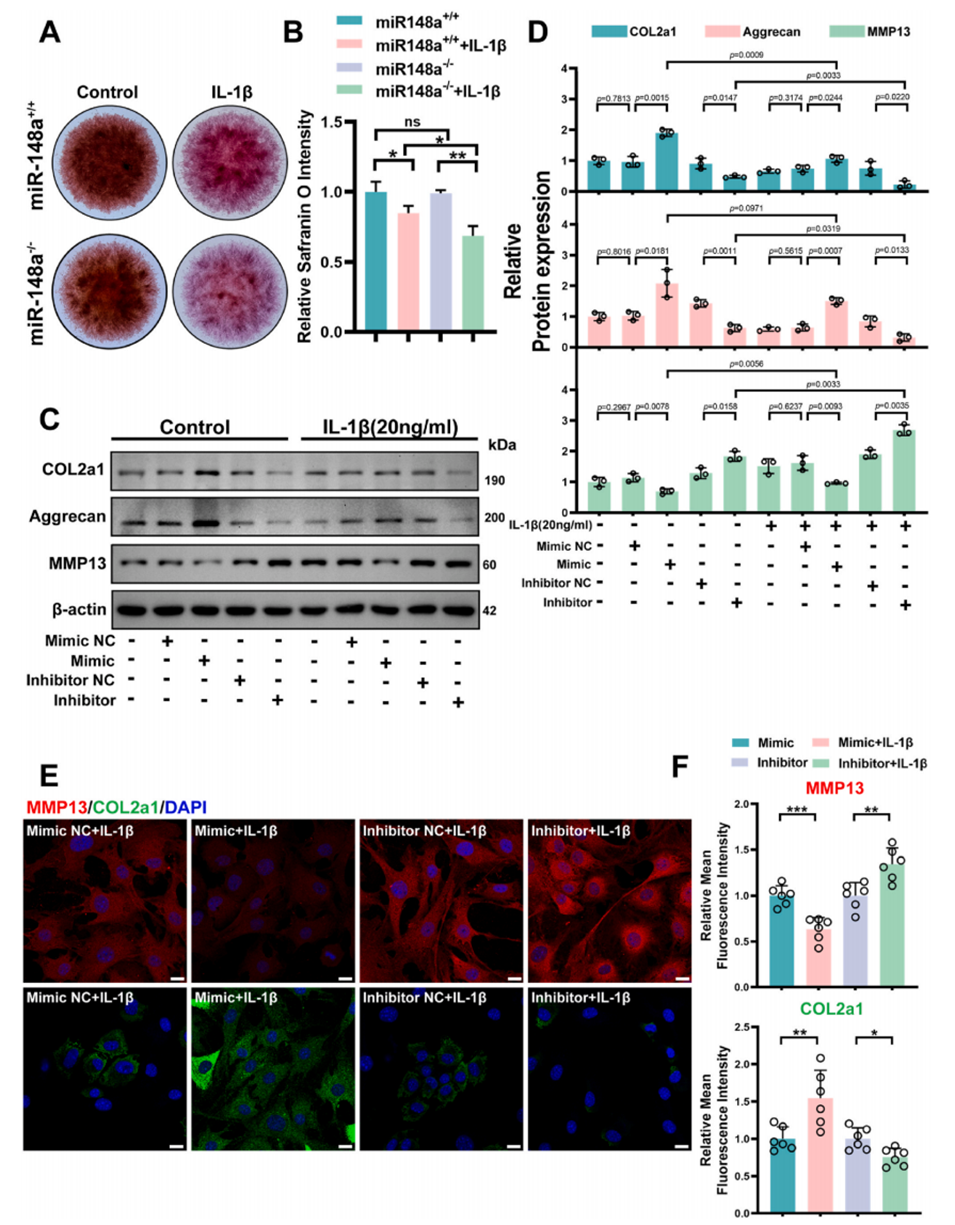
图2. miR-148a通过抑制IL-1β诱导的细胞外基质分解代谢阻碍软骨退变
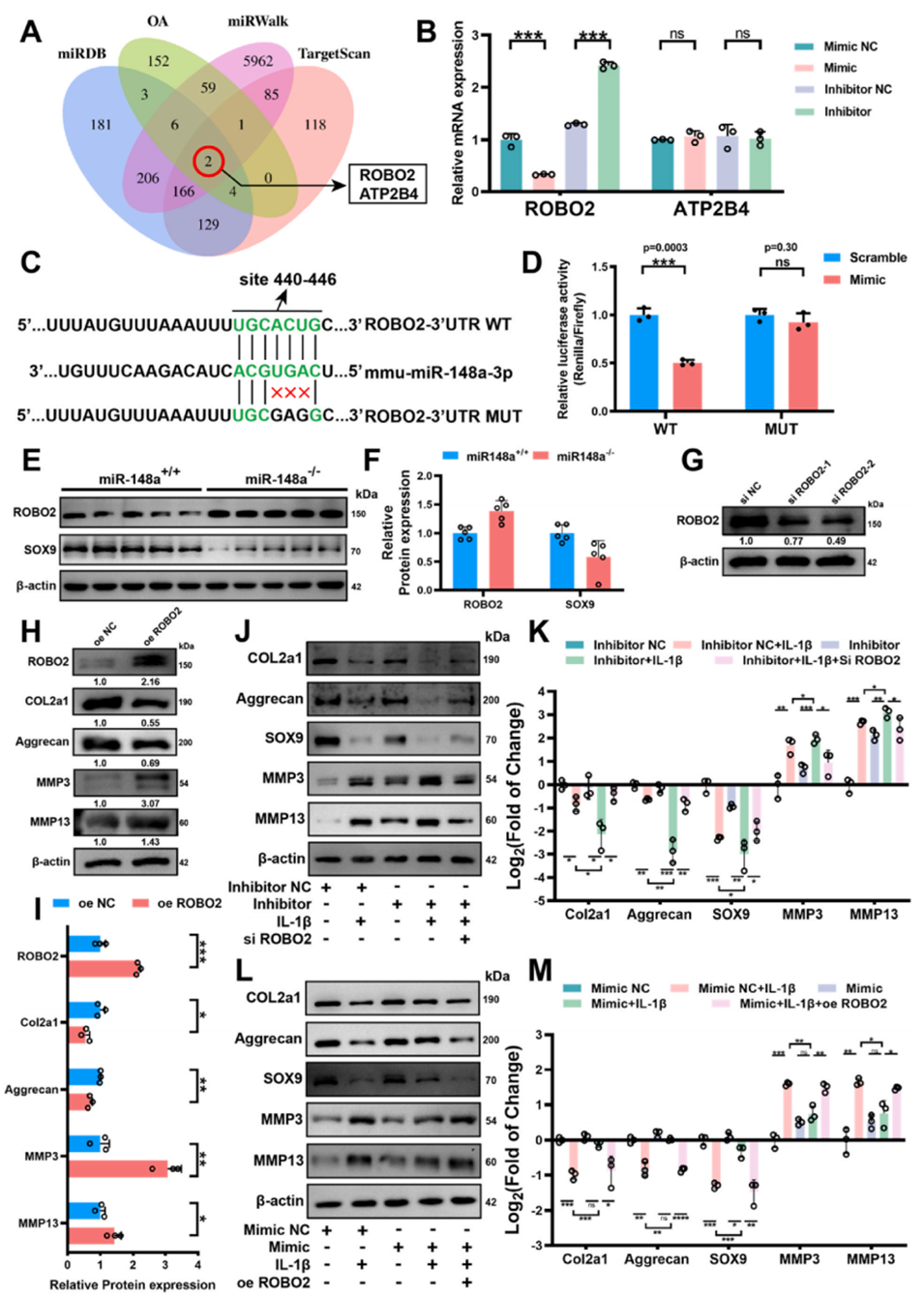
图3. miR-148a通过Robo2促进软骨细胞合成代谢
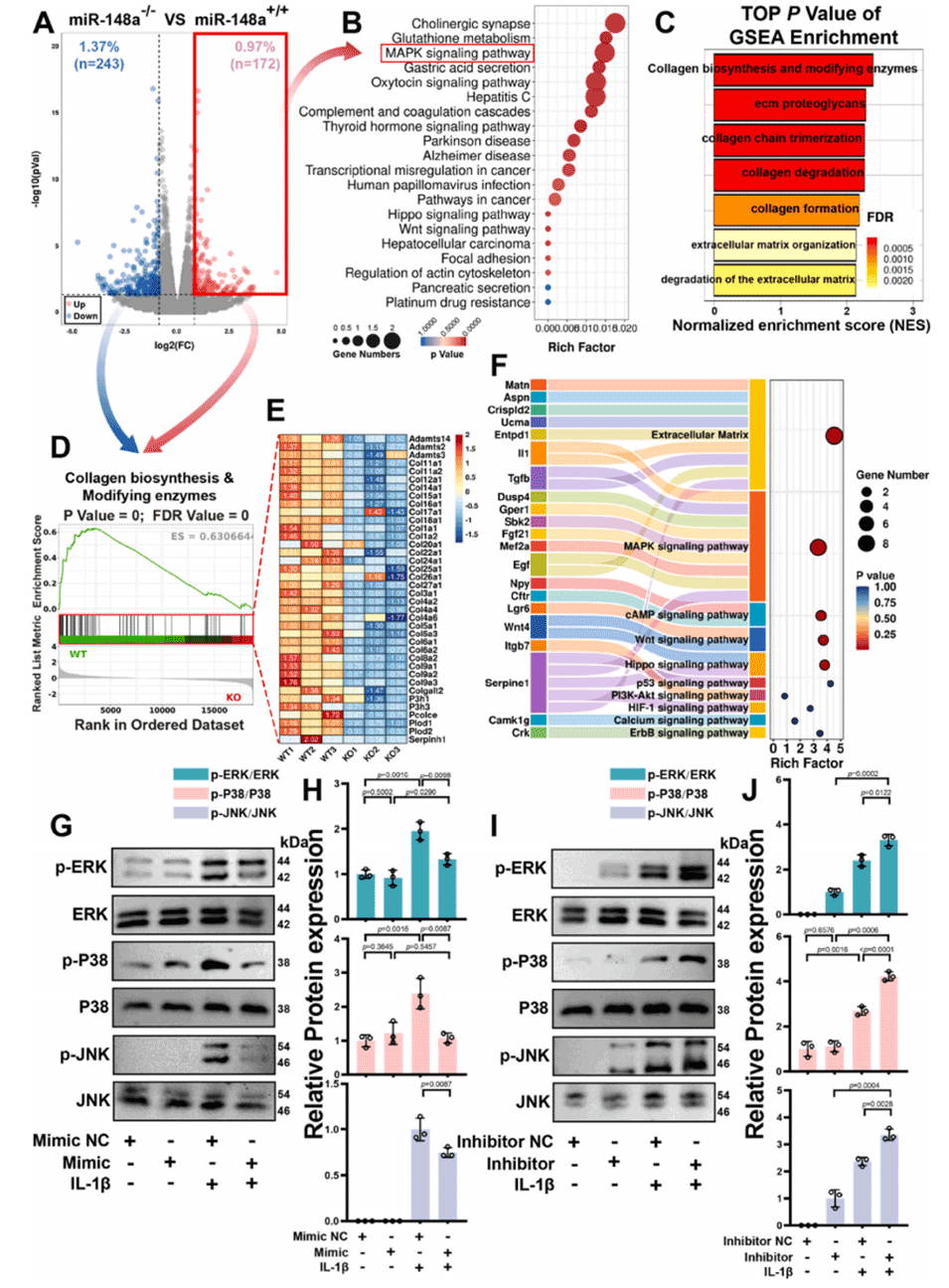
图4. miR-148a通过抑制MAPK信号通路的激活改善IL-1β诱导的细胞外基质分解代谢
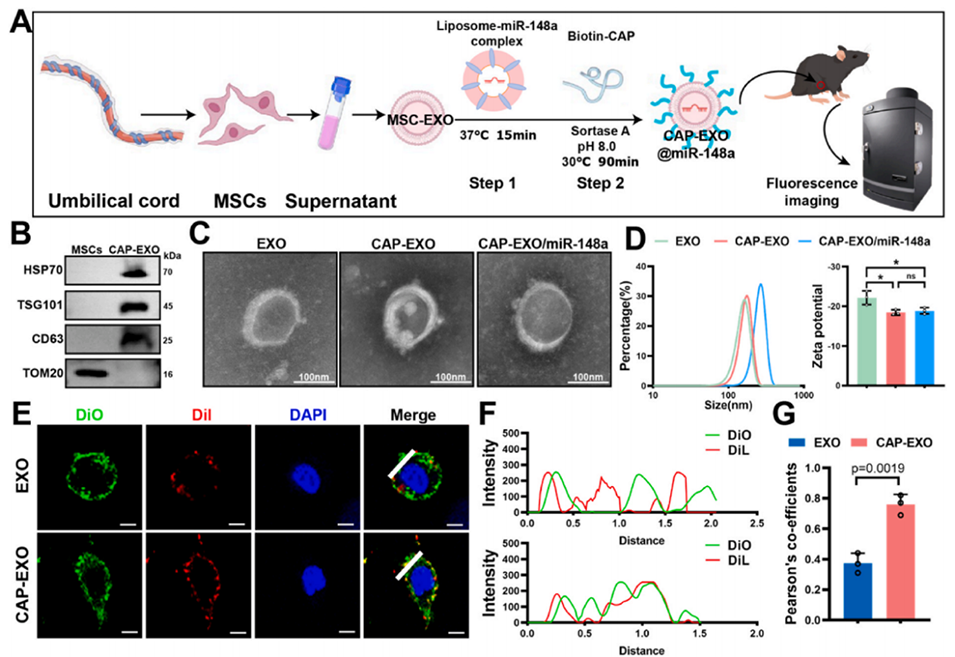
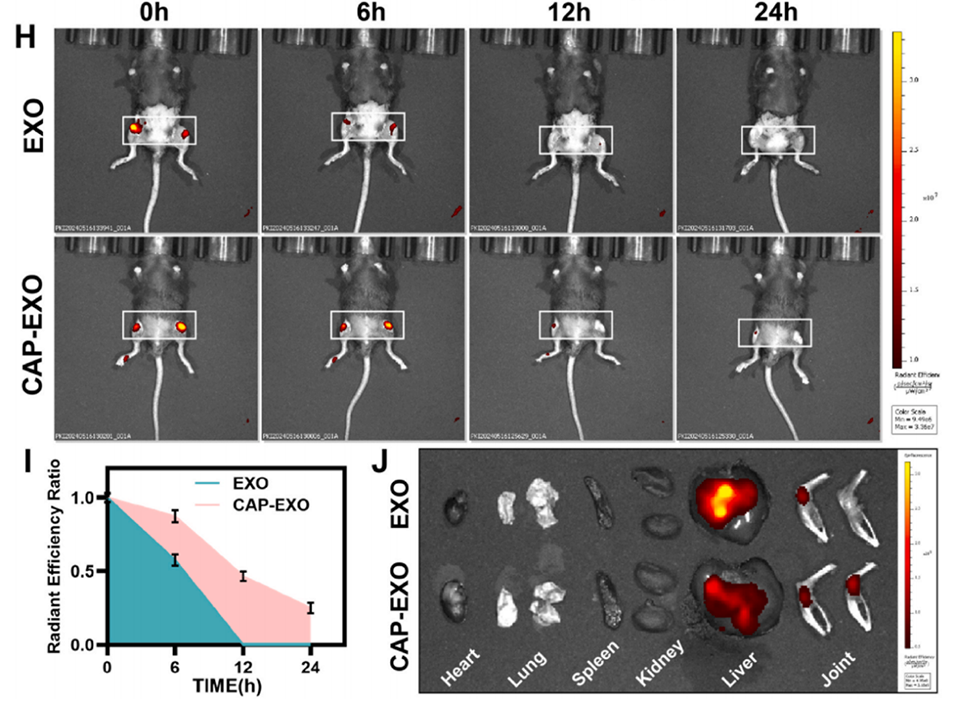
图5.具有软骨细胞靶向能力的CAP-EXO@miR-148a的分离、工程化及表征
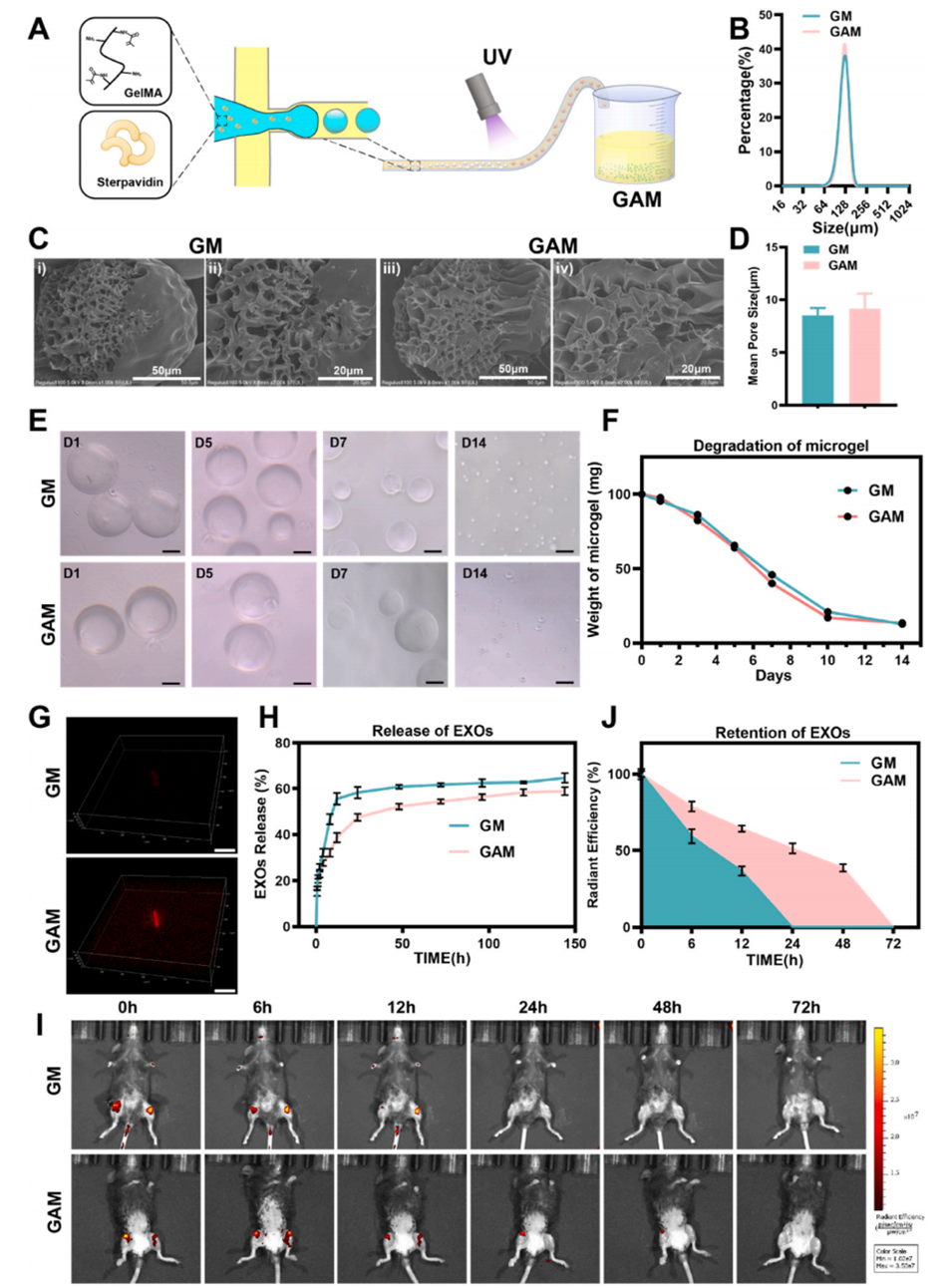
图6.基于生物素-亲和素系统的微球缓释平台的制备与表征
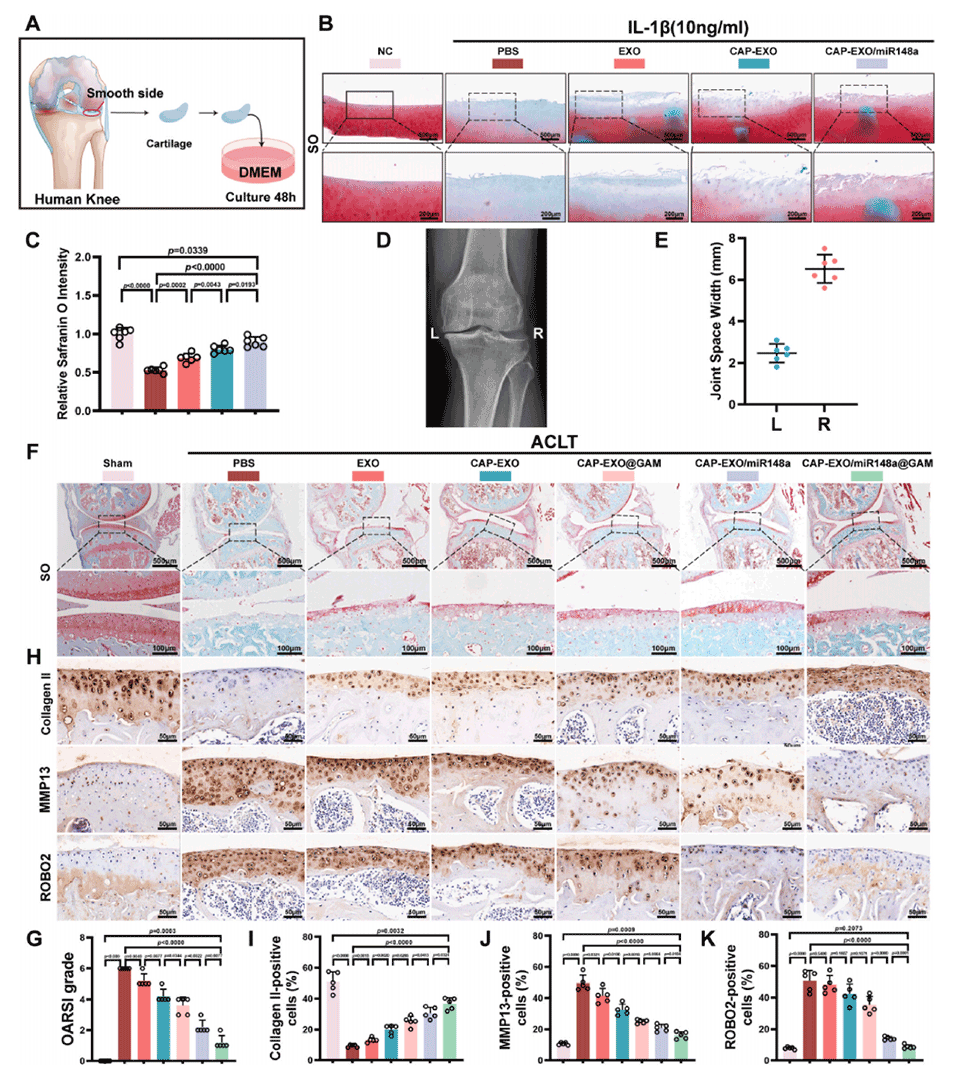
图7. CAP-EXO/miR-148a和CAP-EXO/miR-148a@GAM的综合疗效评估
读后启示
微流控技术可进一步与仿生微环境构建相结合,在体外模拟关节腔力学与生化条件,从而更精准地筛选和优化CAP-EXOs/miR-148a@GAM的递送效率。
本研究通过体外降解实验和释放实验验证了GAM微球的缓释性能,但未考虑关节腔动态力学环境(如摩擦、压力)对微球结构及药物释放的影响。微流控技术的优势在于可集成力学加载模块(如流体剪切力、周期性压力)和生化因子梯度(如IL-1β等炎症因子),构建仿生关节微环境芯片。
例如,可在微流控芯片中模拟关节滑液流动、软骨表面摩擦,并引入软骨细胞三维培养体系,评估不同力学条件下GAM微球的降解速率、CAP-EXOs的靶向结合效率及miR-148a的释放动力学。这种“芯片上的关节”模型能更真实地预测体内效果,帮助优化微球的材料硬度、孔隙结构及表面修饰策略,从而提高递送系统的临床适用性,减少动物实验的盲目性。
论文链接:https://doi.org/10.1016/j.mtbio.2025.101944














