急性肺损伤(ALI)是一种严重的肺部疾病,其特征是肺部高水平的活性氧(ROS)和促炎介质,这些因素可导致肺泡毛细血管屏障的破坏和炎症反应的加剧。如果不进行适当治疗,ALI可能会进展为急性呼吸窘迫综合征(ARDS),危及患者生命。因此,开发有效的治疗策略以减轻ALI中的氧化应激和炎症反应至关重要。

近期,浙大高分子系高长有教授和浙大二院感染科徐峰教授合作,研发了一种由炎性巨噬细胞膜包覆的水凝胶微粒,通过清除活性氧和中和促炎因子,有效缓解ALI引发的炎症。相关研究以“Inhalation of macrophage membrane-coated hydrogel microparticles for inflammation alleviation of acute lung injury in vivo”为题目,发表在期刊《Acta Biomaterialia》上。
本文要点:
1、本研究使用膜乳化装置设计并制备了一种具有清除活性氧(ROS)和中和促炎细胞因子功能的水凝胶微粒(HMPs),用于治疗急性肺损伤(ALI)。
2、HMPs由双键修饰的透明质酸和含有硫醇键和不饱和双键的ROS可裂解超支化聚合物(HBPAK)组成,并通过静电力作用包覆了炎性巨噬细胞(M1)细胞膜,形成膜涂层HMPs(mem HMPs)。
3、体外和体内实验表明,mem HMPs具有强大的ROS清除和抗炎特性。
4、在ALI小鼠模型中,通过吸入给药,mem HMPs显著减少了中性粒细胞浸润和组织氧化损伤,从而缓解了肺部炎症。
这种水凝胶微粒(HMPs)的制备过程如下:
1、合成HAMA和HBPAK:
HAMA(甲基丙烯酰化透明质酸)是通过透明质酸(HA)和甲基丙烯酸酐(MA)之间的酯化反应合成的。
超支化聚合物HBPAK是通过聚乙二醇二丙烯酸酯(PEGDA)和含硫酮键的二胺(TK)之间的迈克尔加成反应合成的。
2、制备HMPs:
使用油包水(W/O)乳化方法和快速膜乳化机(配备Shirasu多孔玻璃(SPG)膜)来制备HMPs。
水相包含HAMA、HBPAK和光引发剂LAP,油相是由石蜡油和石油醚混合而成的,含有Span 80和Tween 80。
水相和油相混合后通过SPG膜多次,形成均匀的W/O乳液,然后在紫外线下交联固化。
3、制备膜涂覆HMPs(mem HMPs):
通过振荡器将HBPAK HMPs与巨噬细胞(M1型)膜囊泡共孵育,利用静电作用使M1型巨噬细胞膜涂覆在HMPs表面。
优化了膜蛋白与HMPs的质量比,以提高细胞膜的涂覆效率。
4、表征HMPs:
使用扫描电子显微镜(SEM)和光学显微镜观察HMPs的形态。
使用ImageJ软件分析HMPs的尺寸分布。
通过共聚焦激光扫描显微镜(CLSM)观察膜涂覆HMPs的形态,并使用荧光标记来确认细胞膜的成功涂覆。
这个制备过程涉及到化学合成、乳化技术和物理表征等多个步骤,最终得到了具有特定功能的水凝胶微粒,用于急性肺损伤的治疗。
使用水凝胶微粒(HMPs)治疗急性肺损伤(ALI)具有以下优势:
1、清除活性氧(ROS):HMPs含有硫缩酮键,能够高效清除ALI微环境中过量的ROS,从而减轻氧化应激对肺组织的损伤。
2、中和促炎因子:HMPs通过其组成材料的特性,能够中和促炎性细胞因子,抑制炎症反应,降低肺部炎症的严重程度。
3、靶向抗炎性能:通过静电作用包覆炎性巨噬细胞(M1)细胞膜,HMPs获得了靶向炎症部位的能力,进一步增强了抗炎效果。
4、非侵入性治疗:HMPs通过吸入方式给药,避免了传统治疗的侵入性操作,提供了一种微创、便捷的治疗方法。
5、减少组织损伤:在ALI小鼠模型中,HMPs显著减少了中性粒细胞的浸润和组织氧化损伤,从而有效缓解肺部炎症。
6、多功能治疗平台:HMPs不仅具有抗氧化和抗炎作用,还可以通过材料设计实现多功能性,具有广泛的应用潜力。
综上,水凝胶微粒在清除ROS、抗炎、靶向性和微创治疗方面展现出显著优势,为急性肺损伤提供了一种高效且创新的治疗策略。
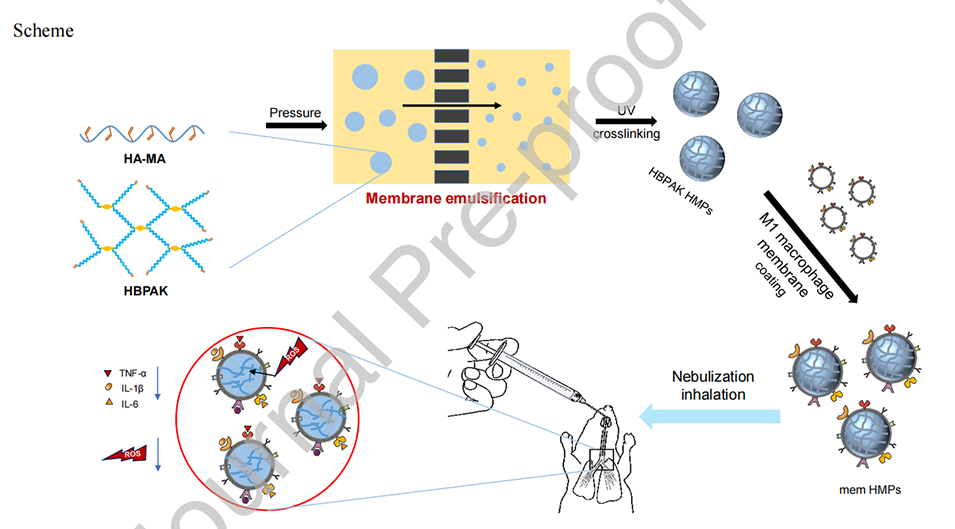
Scheme 1.吸入巨噬细胞膜包被的ROS清除水凝胶微粒(HMPs)用于体内治疗急性肺损伤(ALI)。HBPAK HMPs是通过使用膜乳化机的W/O乳化法制备的,然后在紫外线照射下交联HAMA和HBPAK。随后,HBPAK HMPs被M1型巨噬细胞膜包裹,通过雾化吸入的方式给予ALI小鼠。
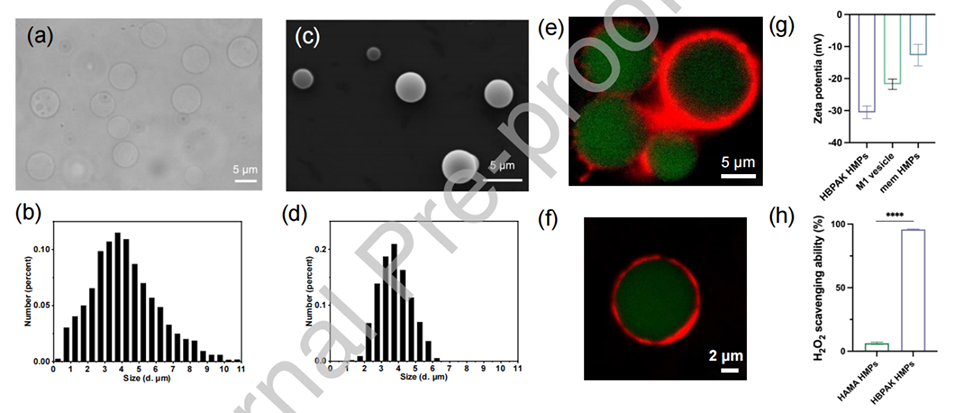
图1.(a)湿HBPAK HMPs的光学显微镜图像和(b)尺寸分布。(c)干燥HBPAK HMPs的SEM图像和(d)尺寸分布。(e-f)mem HMPs的CLSM图像。HBPAK HMPs用FITC标记,细胞膜囊泡用DiI染色。(g)M1囊泡和HMPs的Zeta电位。(h)HBPAK HMPs和HAMA HMPs各自的H2O2清除能力。***p<0.001。
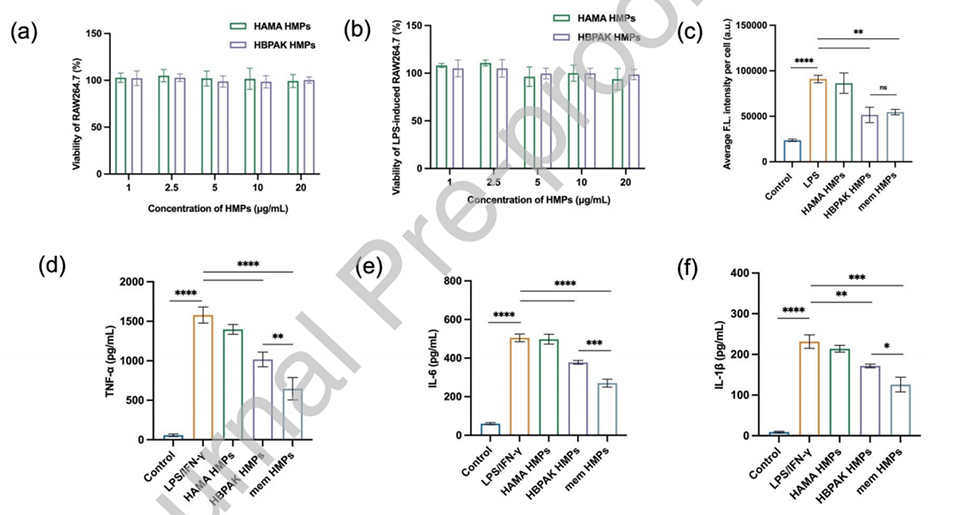
图2.与不同浓度HMPs孵育24小时后,(a)RAW264.7细胞和(b)LPS诱导的RAW264.7细胞的相对存活率。(c)不同处理的RAW264.7细胞内ROS的平均荧光强度。(d)RAW264.7细胞在LPS激活并用PBS、HAMA HMPs、HBPAK HMPs或mem HMPs处理后分泌的TNF-α、(e)IL-6和(f)IL-1β。*p<0.05、**p<0.01、***p<0.001和****p<0.0001。
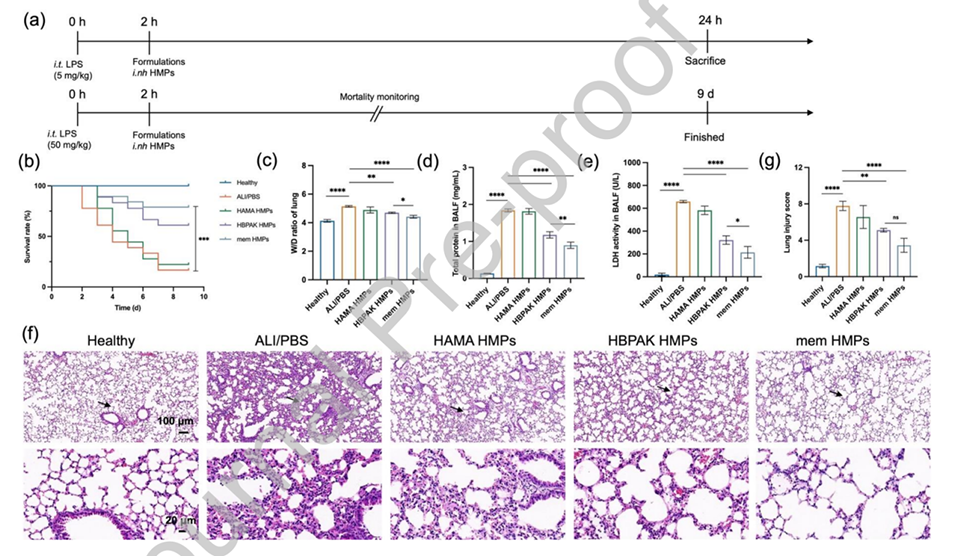
图3.mem HMPs在体内减轻LPS诱导的ALI小鼠的肺损伤。
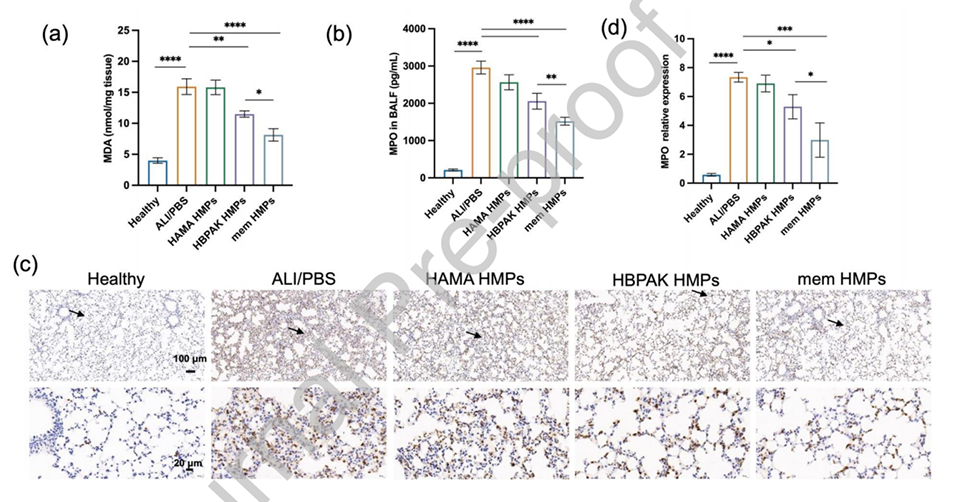
图4.mem HMPs在体内减轻LPS诱导的ALI小鼠的氧化损伤和ROS水平。
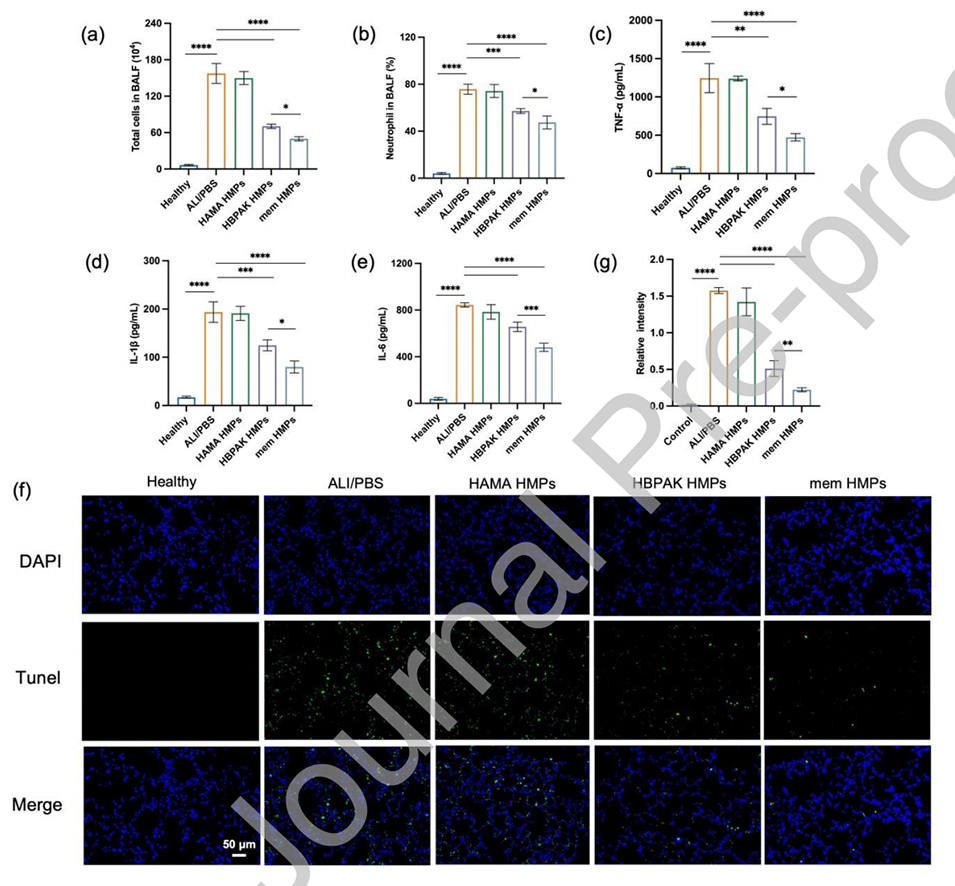
图5.mem HMPs在体内减轻LPS诱导的ALI小鼠炎症细胞浸润,抑制炎症反应。
论文链接:https://doi.org/10.1016/j.actbio.2024.12.015














