炎症性肠病(IBD)以胃肠道不同部位的慢性或复发性炎症为特征。己酮可可碱(PTX)作为一种甲基黄嘌呤衍生物,主要用于改善周围血管疾病的血流状况,其已被证实具有抗炎和免疫调节特性,在减轻IBD相关炎症方面具有潜在应用价值。然而,PTX在IBD中的临床应用仍受到限制,部分原因在于其半衰期短且对炎症肠组织的靶向性较差,因此亟需提高其生物利用度和组织特异性递送效率的策略。

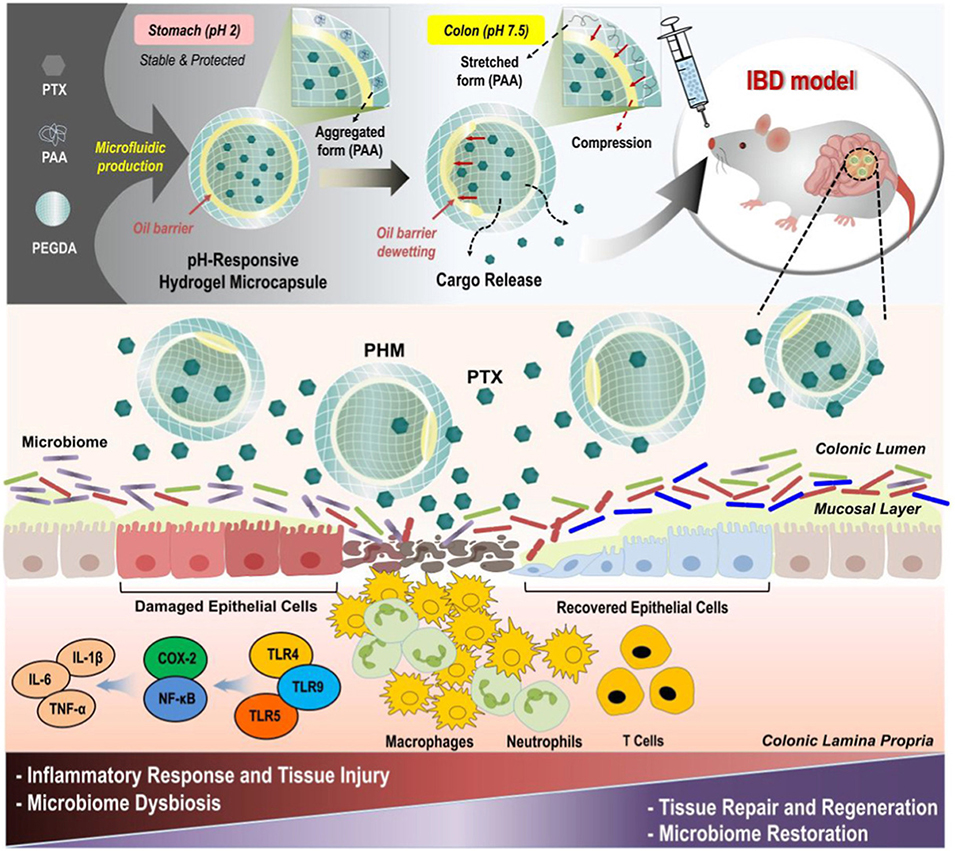
近期,有研究人员通过三重乳液微流控技术构建了含中间油层的pH响应型核壳微胶囊(PHM),实现己酮可可碱(PTX)的口服高效递送;其不仅能保护PTX免受胃部酸性环境破坏、靶向富集于炎症结肠,还能通过抗炎与菌群调节双重作用改善IBD病理状态。相关研究以“Triple-Emulsion Microfluidic Core–Shell Hydrogel Microcapsules for Oral Pentoxifylline Delivery: Ameliorating Colitis and Rebalancing Gut Microbiome”为题目,发表于期刊《Materials Today Bio》。
本文要点:
1、该研究开发了一种基于三重乳液微流控技术的pH响应型核壳水凝胶微胶囊(PHM),用于口服递送己酮可可碱(PTX)以治疗炎症性肠病(IBD)。
2、PHM由PAA-PEGDA壳层、PEGDA核心和中间油层组成,油层可保护PTX在胃部酸性环境(pH2)中稳定,在结肠碱性环境(pH7.5)下PAA壳层溶胀触发油层破裂,实现PTX的靶向释放。
3、微流控制备工艺能确保微胶囊尺寸均一,药物包封率高达99.6%,可通过调节流速精准控制胶囊尺寸和壳层厚度。
4、体外实验显示,PHM在模拟胃液中稳定、在模拟肠液中快速释放PTX,且对肠道上皮细胞、肝细胞等无细胞毒性。
5、在DSS诱导的IBD小鼠模型中,PHM能延长PTX在肠道的滞留时间,显著减轻体重下降、结肠缩短等症状,使疾病活动指数(DAI)降低38.5%,同时抑制IL-1β、IL-6、TNF-α等促炎因子表达,减少巨噬细胞浸润,修复肠道黏膜屏障。
6、此外,PHM还能调节肠道菌群平衡,抑制Bacteroides acidifaciens等促炎菌,富集Lachnospiraceae相关PAC001120等产短链脂肪酸(SCFA)的有益菌。
7、PHM通过靶向递送PTX,同时发挥抗炎作用和肠道菌群调节功能,为IBD治疗提供了一种安全有效的口服给药策略,具有良好的临床转化潜力。
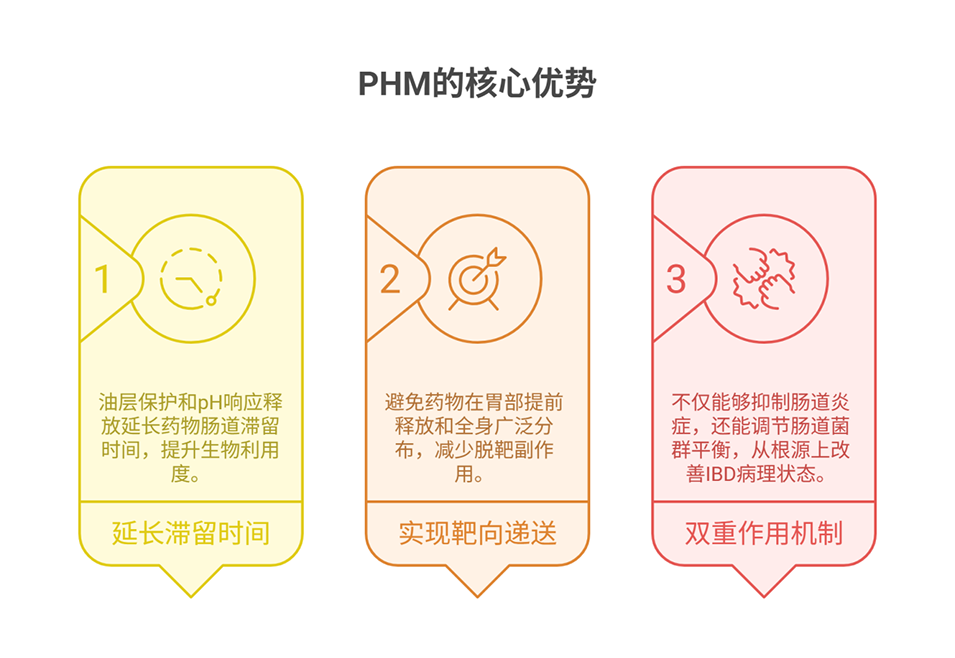
PAA壳层溶胀如何精准触发油层破裂?
PAA壳层的pH响应溶胀是触发油层破裂的关键。在结肠5环境下,PAA分子链上的羧基大量电离为羧酸盐(-COO⁻),分子链间静电排斥力显著增强,同时结合水分子引发渗透压升高,推动壳层三维伸展并产生径向压缩力;
中间油层为液态薄屏障,无刚性抵抗能力,且内侧PEGDA核心机械稳定、不易变形,进一步限制油层收缩空间,导致油层局部压力骤增、界面失稳,最终从局部破裂扩展至完全破裂,实现PTX靶向释放。
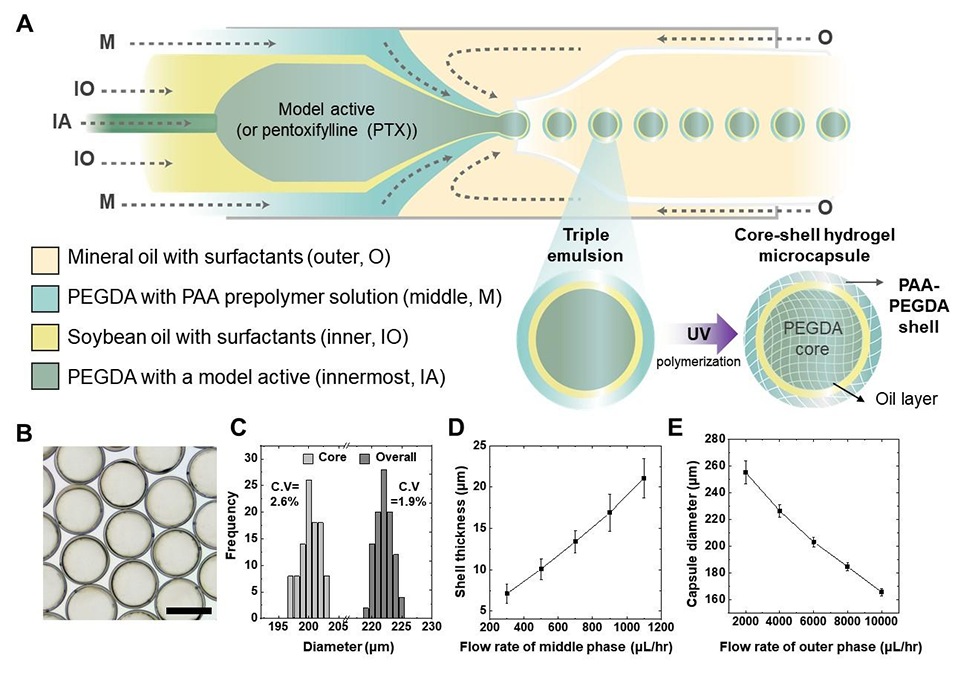
图1. 基于三重乳液微流控技术制备负载PTX的核壳水凝胶微胶囊。(A)示意图展示了实现PAA-PEGDA壳层微胶囊可靠制备的微流控装置。(B)制备的负载PTX胶囊的光学显微镜图像,显示出均一的球形形貌。比例尺代表200μm。(C)通过图像分析获得的核层和壳层尺寸测量图表。(D)壳层厚度随中间相流速变化的图表,证实了水凝胶屏障的可控调节。(E)胶囊直径随连续相流速变化的图表,验证了胶囊尺寸的流体动力学调控。
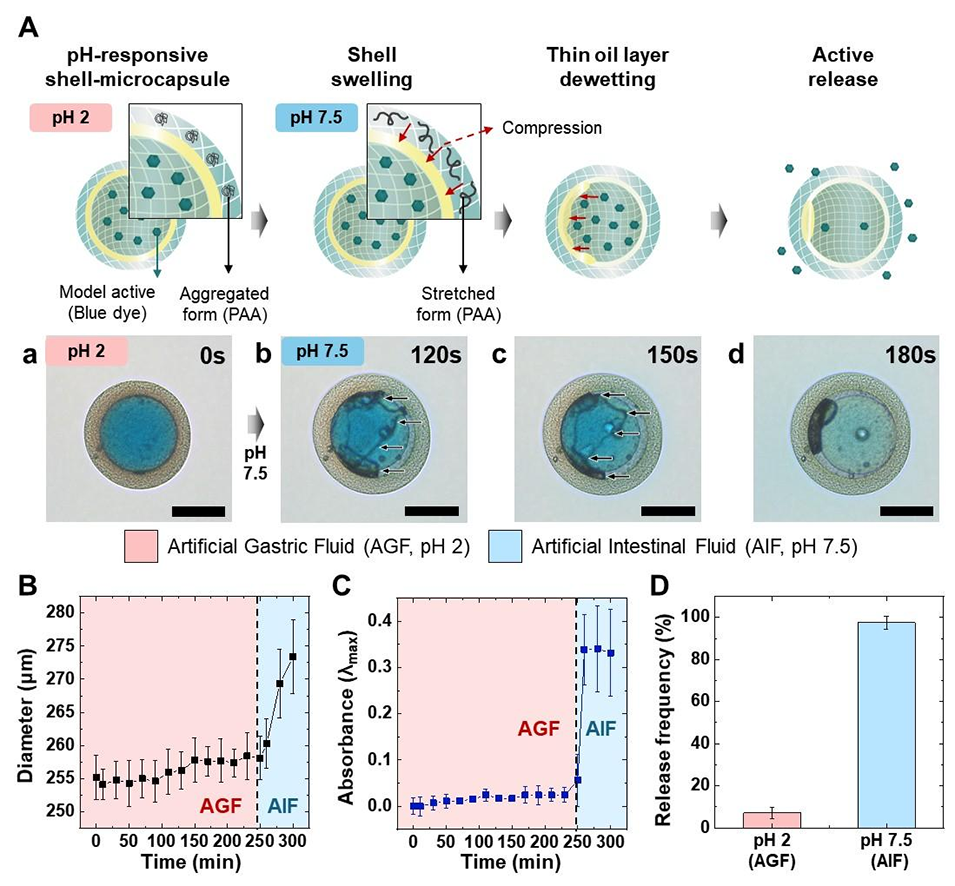
图2. 用于靶向药物递送的pH响应型水凝胶微胶囊。(A)示意图展示了释放机制:PAA-PEGDA壳层的pH响应型溶胀以及随后油层的破裂,最终实现活性物质的释放。负载PTX的胶囊在酸性(pH2,人工胃液)和碱性(pH7.5,人工肠液)条件下的光学显微镜图像:(a)pH2时形貌稳定;(b)120s时油层开始破裂;(c)150s时破裂持续进行;(d)180s时完全破裂并释放染料。比例尺为100μm。(B)胶囊在人工胃液(pH2)中随后转入人工肠液(pH7.5)后的时间依赖性直径变化。(C)封装染料的吸光度测量结果,显示在人工胃液中释放量可忽略,在人工肠液中快速释放。(D)胶囊在酸性和碱性条件下的释放频率,证实其在人工胃液中结构稳定,在人工肠液中选择性释放。
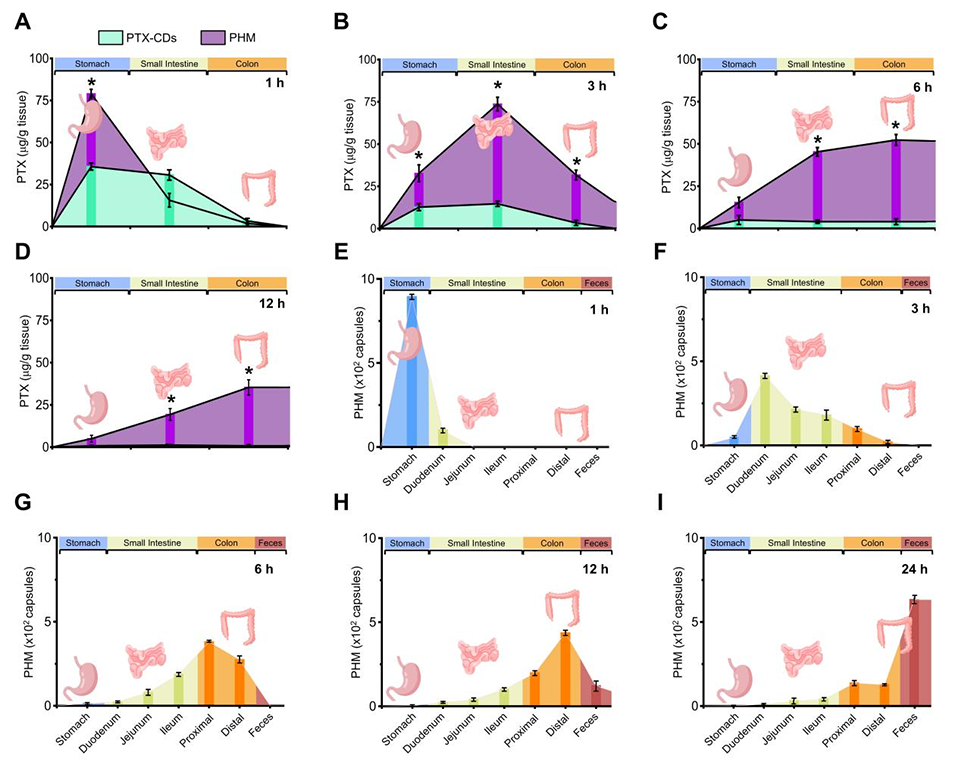
图3. PTX和PHM的生物分布。ICR小鼠口服给予PTX-碳点(PTX-CDs,100 mg/kg)或封装PTX-CDs的PHM(1×10⁴个胶囊/mL,相当于100 mg/kg PTX-CDs)后,PTX在胃肠道组织中的分布情况。在1h(A)、3h(B)、6h(C)和12h(D)时对组织匀浆中的PTX浓度进行定量,采用分光光度法,激发/发射波长为362-396 nm/432-480 nm。*p≤0.05 vs PTX-CDs。数据以平均值±标准偏差表示(n=5)。口服给药壳层掺入荧光素异硫氰酸酯-葡聚糖(FITC-DEX,分子量=2,000,000)的PHM(浓度为1×10⁴胶囊/mL)后,PHM在胃肠道中的时间依赖性分布和清除情况。在给药后1h(E)、3h(F)、6h(G)、12h(H)和24h(I)时,对胃、小肠、结肠和粪便中的荧光信号进行定量,采用FITC荧光检测(激发波长488nm,发射波长520nm)。数据以平均值±标准偏差表示(n=5)。
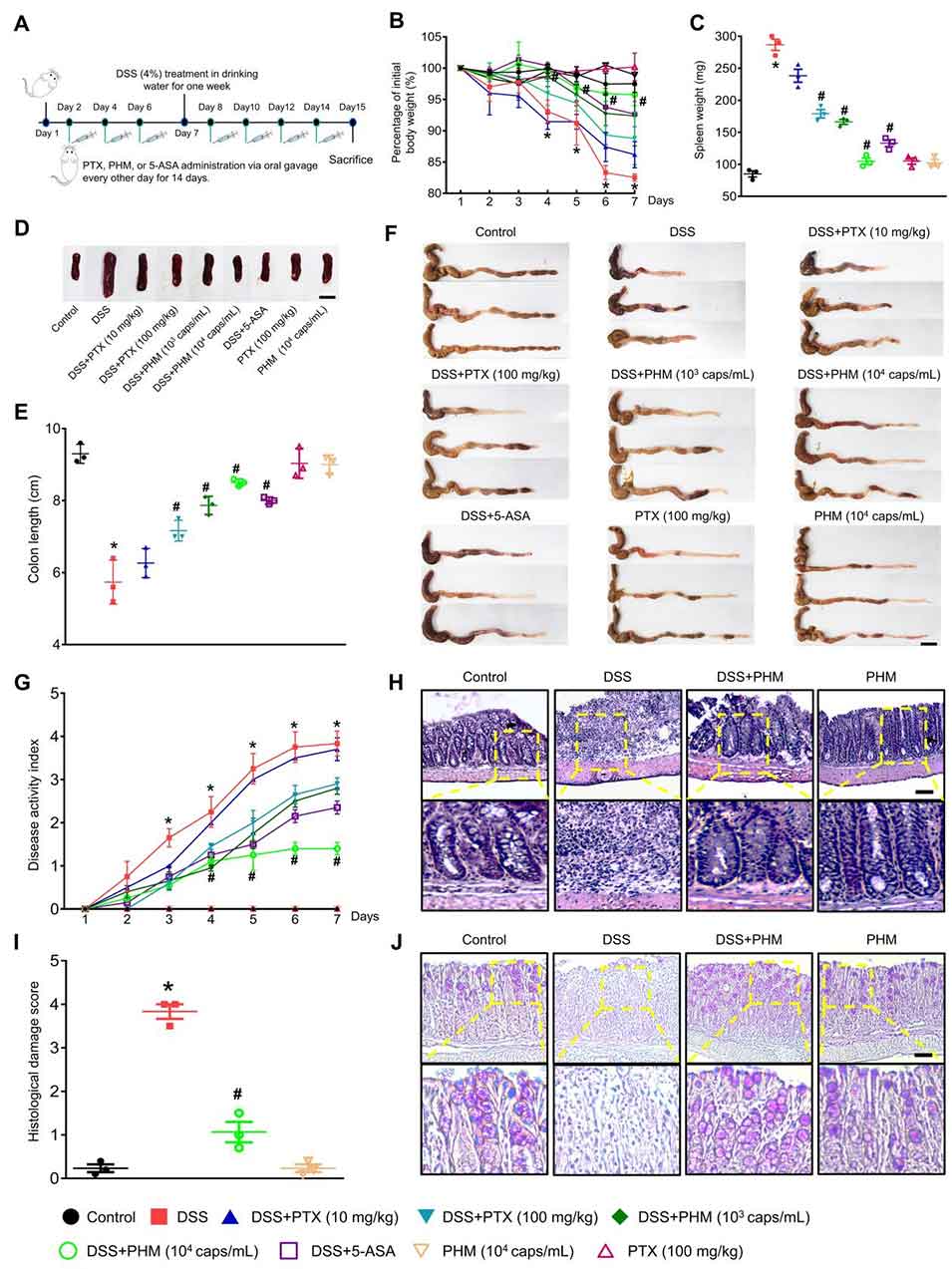
图4. PHM缓解IBD症状的治疗效果。(A)ICR雄性小鼠(n=5)每两天口服给药PTX(10或100 mg/kg)、PHM(10³或10⁴个胶囊/mL,相当于10或100 mg/kg PTX)或标准IBD药物5-ASA(200 mg/kg),持续14天。从第7天开始,在饮用水中加入4%DSS,持续7天以诱导急性结肠炎。对照组小鼠全程饮用不含DSS的常规饮用水。(B-C)测量体重和脾脏重量的变化。*p≤0.05 vs对照组,#p≤0.05 vs DSS组。n=5。(D)脾脏的代表性图像。比例尺为1cm。(E)PHM对结肠长度的影响。*p≤0.01 vs对照组,#p≤0.01 vs DSS组。n=3。(F)结肠的代表性图像。比例尺为1cm。(G)实验期间记录的疾病活动指数(DAI)评分。*p≤0.01 vs对照组,#p≤0.05 vs DSS组。n=5。(H)结肠组织HE染色的代表性切片。比例尺为100μm(放大倍数×100)。(I)评估组织学损伤评分。*p≤0.01 vs对照组,#p<0.01 vs DSS组。n=3。(J)结肠组织PAS染色的代表性切片。比例尺为100μm(放大倍数×100)。
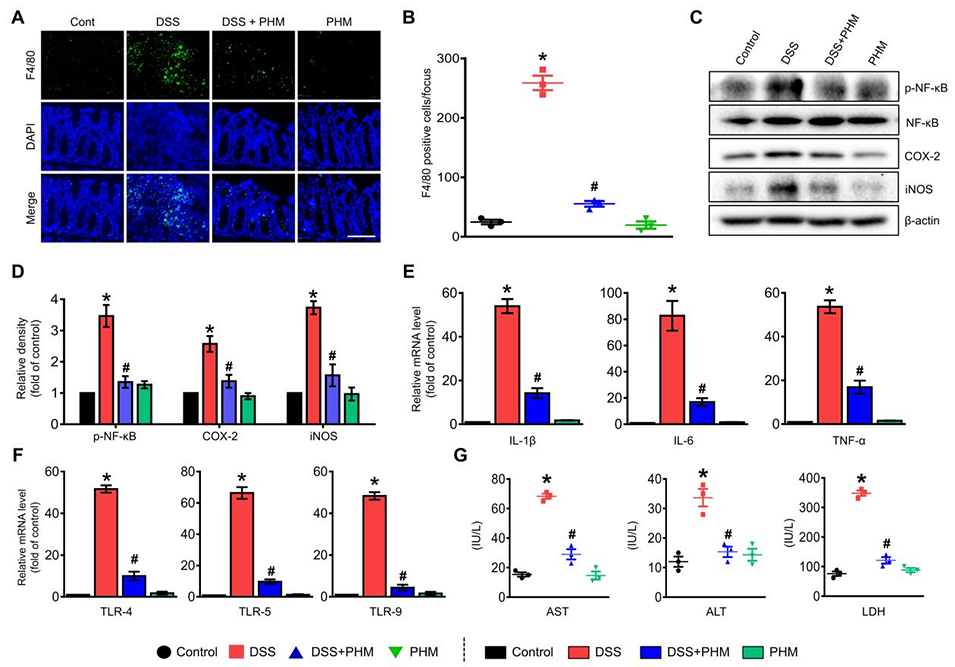
图5. PHM缓解DSS诱导的小鼠IBD模型结肠炎症的治疗效果。(A)通过共聚焦显微镜观察结肠中促炎F4/80⁺巨噬细胞的表达(绿色),细胞核采用DAPI染色(蓝色)。比例尺为100μm(放大倍数×200)。n=3。(B)每视野F4/80⁺巨噬细胞的定量结果。*p≤0.01 vs对照组,#p≤0.01 vs DSS组。n=3。(C-D)通过蛋白质印迹分析评估磷酸化NF-κB(p-NF-κB)、COX-2和iNOS的蛋白表达水平,以评价炎症信号通路。*p≤0.01 vs对照组,#p≤0.01 vs DSS组。n=5。(E-F)测量促炎细胞因子和Toll样受体(TLR)的水平,以确定PHM的调控作用。*p≤0.001 vs对照组,#p≤0.01 vs DSS组。n=5。(G)血清中组织损伤标志物(AST、ALT和LDH)的水平,用于评估全身毒性。*p≤0.001 vs对照组,#p≤0.01 vs DSS组。n=3。
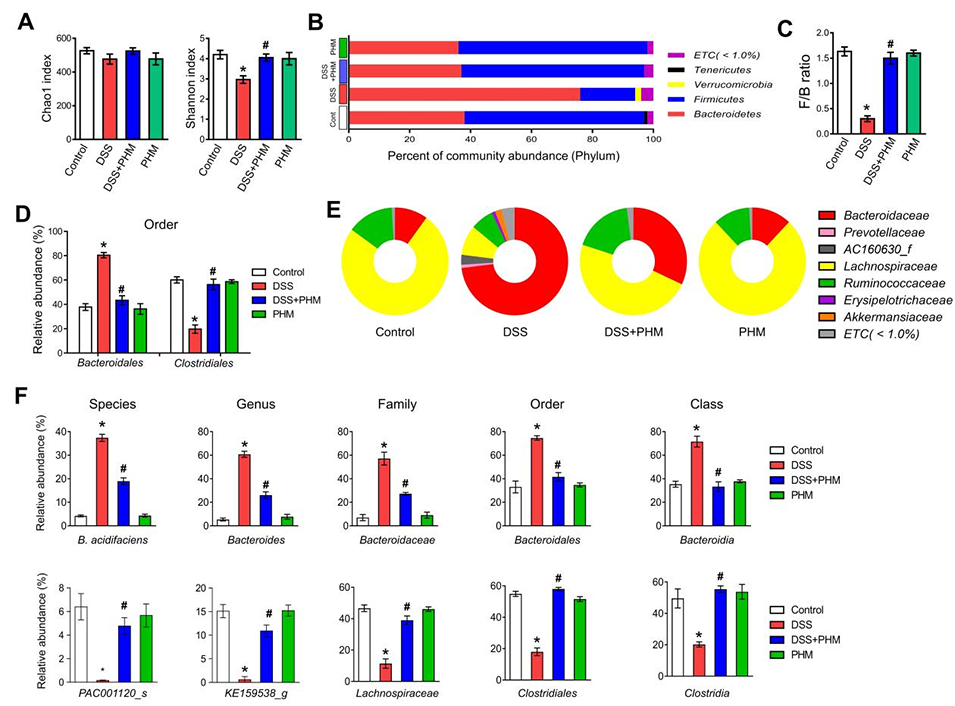
图6. PHM有助于平衡和改善肠道微生物群组成。(A)采用Shannon指数和Chao1指数分别评估微生物均匀度、群落多样性以及物种丰富度。*p≤0.05 vs对照组,#p≤0.05 vs DSS组。n=3。(B)门水平上群落丰度百分比的柱状图。(C)DSS处理小鼠在给予或不给予PHM后的厚壁菌门与拟杆菌门(F/B)比值。*p≤0.01 vs对照组,#p≤0.01 vs DSS组。n=3。(D)目水平上微生物类群相对丰度的柱状图。*p≤0.01 vs对照组,#p≤0.01 vs DSS组。n=3。(E)采用饼图展示肠道微生物群的科水平分类组成。(F)箱线图展示每个样本中两种优势物种(产酸拟杆菌和PAC001120)的肠道分类群。*p≤0.01 vs对照组,#p≤0.01 vs DSS组。n=3。
论文链接:https://doi.org/10.1016/j.mtbio.2026.102881
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)
下一篇:暂无














