每年有超过1000万人经历骨折,其中5%-10%的骨折会出现愈合延迟或不愈合的情况。全球范围内,数百万患者因骨缺损需要接受骨移植手术,骨缺损的治疗仍然是一个巨大的挑战,并伴随着沉重的经济和社会负担。传统的人工骨移植材料常常引发异物反应,导致过度或持续的炎症,进而损害骨缺损的愈合,甚至导致骨不连或手术失败。目前,缺乏能够完全满足临床需求的理想骨移植替代物。骨愈合是一个复杂的过程,涉及多个生理阶段,包括炎症期、软痂期、硬痂期和骨重塑期,每个阶段都有其特定的时空模式和生理功能。然而,现有的支架材料往往不能完全与缺损区域匹配,也无法很好地调控复杂的骨再生过程。

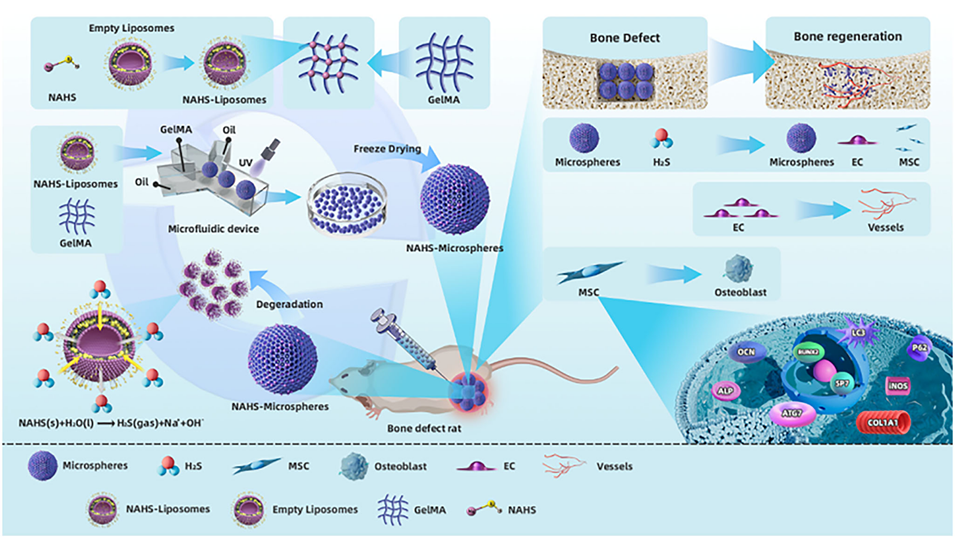
近期,温州医科大学附属第二医院、育英儿童医院骨科联合浙江大学医学院附属第二医院骨科在国际知名期刊《Small》上发表题为“Multifunctional Biomimetic Hematoma Microspheres for Sustained Local Hydrogen Sulfide (H2S) Delivery to Enhance Vascularized Bone Regeneration”的研究论文。该研究创新性开发了基于微流控技术的双层仿血肿微球系统,以pH响应型甲基丙烯酰化明胶(GelMA)为外层、载硫氢化钠(NaHS)脂质体为核心;可在骨缺损酸性微环境中时空可控释放硫化氢(H2S),通过抗炎、促血管生成、激活干细胞自噬及成骨通路,高效解决复杂骨缺损修复难题。
本文要点:
1、该研究针对大面积骨缺损愈合复杂、现有骨移植替代物存在异物反应等问题,开发出一种基于微流控技术的双层仿血肿微球系统,用于可控储存和持续释放硫化氢(H2S)以促进血管化骨再生。
2、微球系统以气球结构为灵感,外层为pH响应型甲基丙烯酰化明胶(GelMA),可靶向酸性骨缺损环境;内核为负载硫氢化钠(NAHS,H2S供体)的脂质体,能时空可控释放H2S。
3、该系统具有良好的生物相容性、可控的粒径与孔隙结构,可实现H2S的缓慢持续释放,避免了直接使用NAHS时释放过快导致的细胞毒性和作用时间短的问题。
4、实验证实,该复合微球通过多重协同机制发挥作用:抑制炎症因子释放以减轻慢性炎症、激活骨髓间充质干细胞(BMSC)自噬、促进血管内皮细胞迁移和成管以增强血管生成、通过Wnt/β-连环蛋白信号通路促进BMSC成骨分化。体内外实验均表明,其在骨缺损修复中能显著提升新骨形成和血管化水平,优于游离NAHS和空白微球。
5、该系统突破了传统骨移植仅提供被动结构支撑的局限,实现了主动生物调控,且避免了自体/异体移植相关的供体部位损伤和免疫排斥,为复杂骨缺损修复提供了新的解决方案。
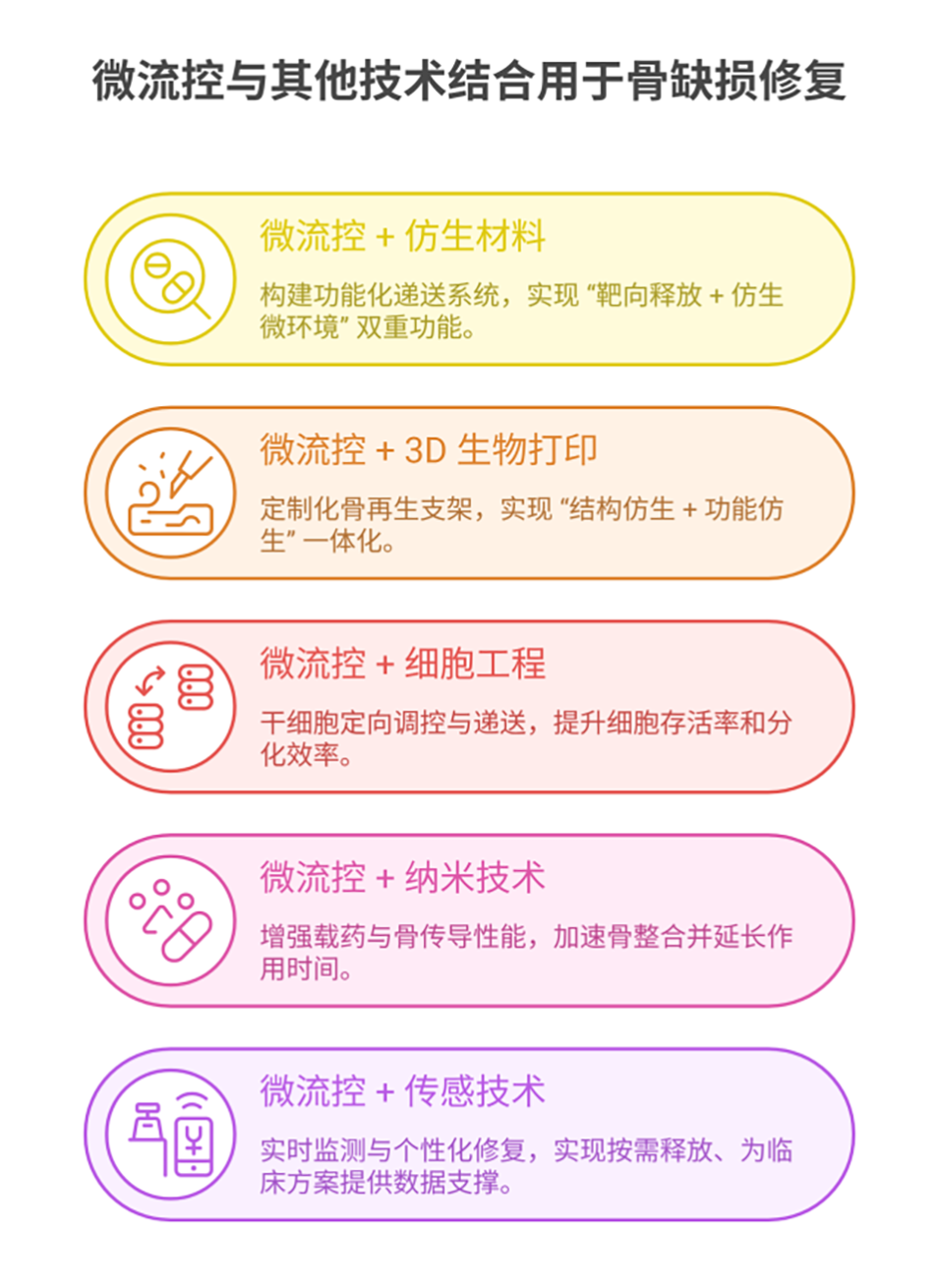
该双层仿血肿微球系统在骨缺损修复中的优势是什么?
1、仿生设计适配骨修复微环境:模拟天然血肿的再生功能与微环境,从传统材料的“被动结构支撑”转向“主动生物调控”。外层pH响应型GelMA可靶向骨缺损部位的酸性环境降解,同时避免传统人工骨易引发的异物反应,减少过度炎症对修复的干扰。
2、可控缓释匹配骨再生周期:通过“GelMA外层+脂质体核心”的双层结构,实现H₂S的时空可控释放。释放周期延长至21天,匹配骨再生的多阶段需求,既避免了游离H₂S快速释放导致的细胞毒性,又解决了其半衰期短、作用不持久的问题。
3、多效协同提升修复效率:整合抗炎、促血管生成、激活自噬、推动成骨四大功能,形成协同修复网络。既能抑制INOS、IL-1β等炎症因子,又能增强HUVEC血管形成能力和BMSCs成骨分化活性,通过Wnt/β-catenin通路调控骨再生全流程,修复效果显著优于游离NaHS。
4、临床转化潜力突出:具备可注射性,可贴合不规则骨缺损部位,适配复杂修复场景;由磷脂(脂质体)和GelMA组成,生物相容性优异,避免了自体/异体骨移植的供区损伤与免疫排斥问题。同时,微流控制备工艺可保证批量生产的均一性,为临床推广提供技术支撑。
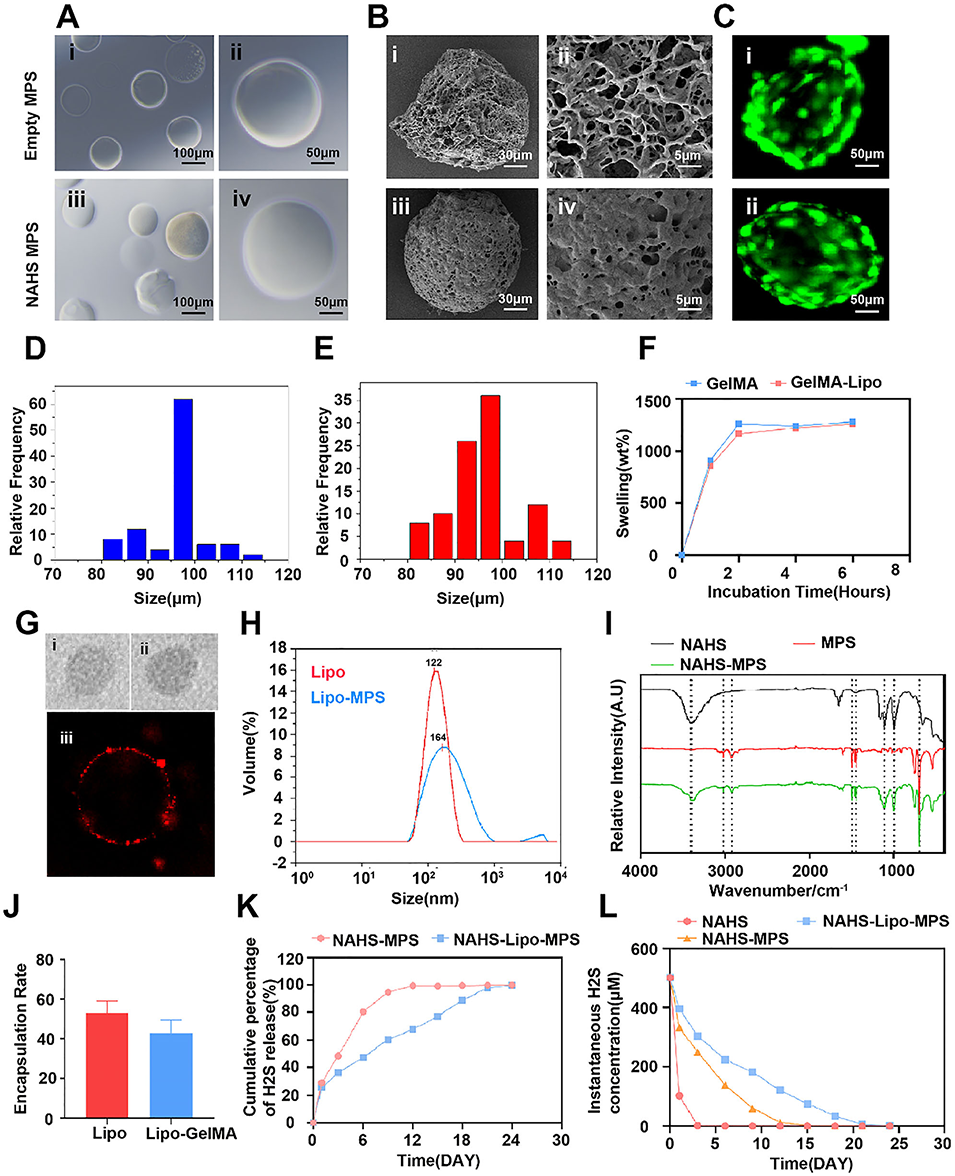
图1可注射微流控水凝胶微球(MPS)的表征。A:空白微球与载NaHS脂质体微球的表征,包括分散微球(i、iii)和单个微球(ii、iv),比例尺分别为100μm和50μm;B:空白微球的扫描电子显微镜(SEM)全景图(i)和局部图(ii),载NaHS脂质体微球的SEM全景图(iii)和局部图(iv),比例尺分别为30μm和5μm;C:空白微球与载NaHS脂质体微球的荧光图像,比例尺为50μm;D、E:分别为空白微球和载NaHS脂质体微球的粒径;F:GelMA-NAHS微球与GelMA-脂质体-NaHS微球的溶胀率曲线;G:空白脂质体(i)与载NaHS脂质体(ii)的透射电子显微镜(TEM)图像,载NaHS脂质体的荧光显微镜图像(iii);H:空白脂质体与载NaHS脂质体的粒径分布;I:NaHS、空白微球及载NaHS微球(NAHS-MPS)的傅里叶变换红外光谱(FTIR);J:NaHS在脂质体及脂质体-GelMA中的包封率;K:NAHS-MPS与载NaHS脂质体微球的H₂S释放曲线;L:游离NaHS、NAHS-MPS及载NaHS脂质体微球的H₂S瞬时浓度曲线。
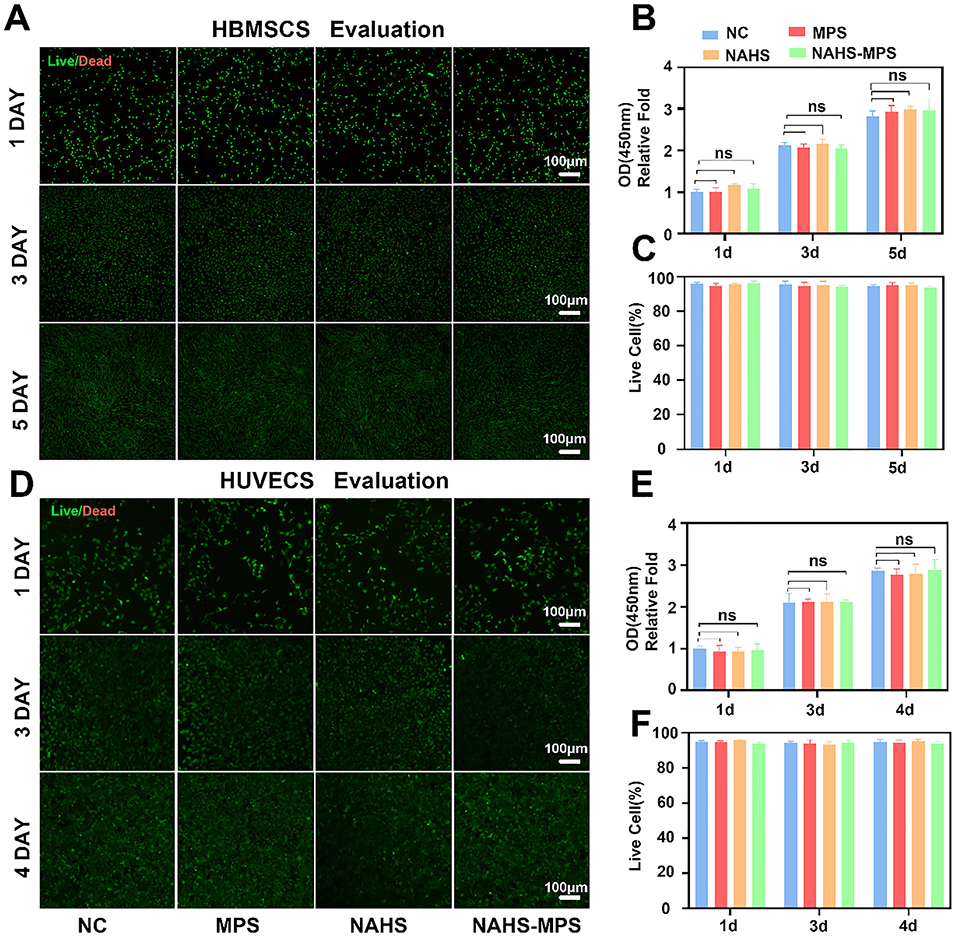
图2 游离NaHS、空白微球及NAHS-MPS的生物相容性评估。人脐静脉内皮细胞(HUVECs)与人骨髓间充质干细胞(HBMSCs)的代表性活/死染色图像及CCK-8检测分析结果。(A):空白微球、游离NaHS及NAHS-MPS分别与HBMSCs共培养1天、3天、5天的活/死染色图像,比例尺为100μm;(B):空白微球、游离NaHS及NAHS-MPS分别与HBMSCs共培养的CCK-8检测结果;(C):HBMSCs各时间点活/死染色的定量分析;(D):空白微球、游离NaHS及NAHS-MPS分别与HUVECs共培养1天、3天、4天的活/死染色图像,比例尺为100μm;(E):空白微球、游离NaHS及NAHS-MPS分别与HUVECs共培养的CCK-8检测结果;(F):HUVECs活/死染色的定量分析,ns表示无统计学意义。所有实验至少重复三次。
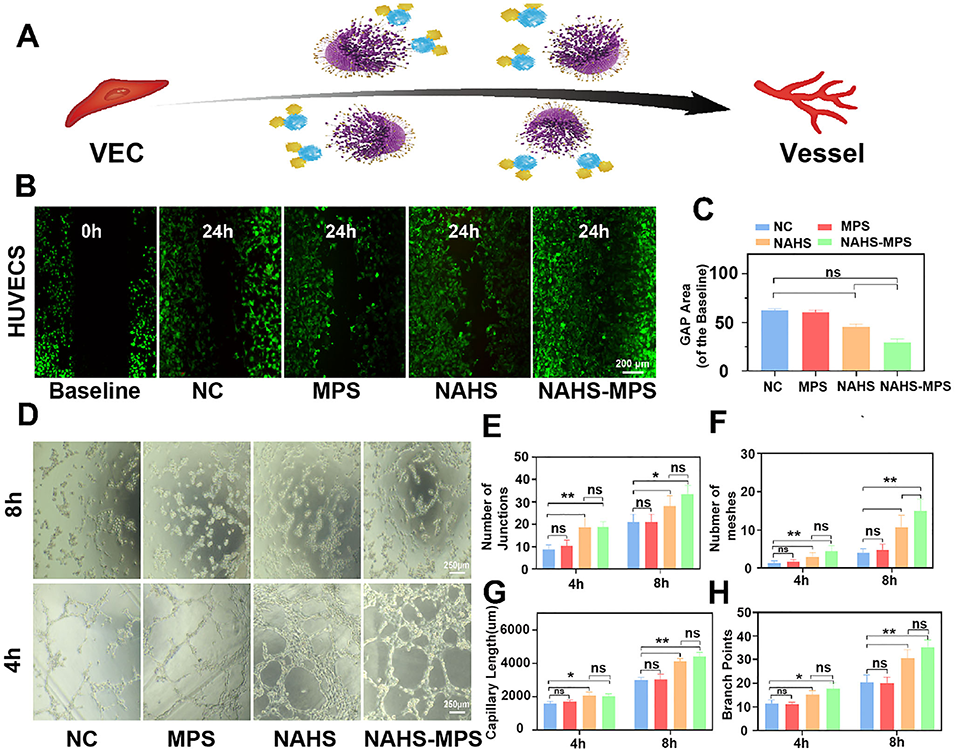
图3 (A):NaHS与NAHS-MPS可促进HUVECs迁移并增强其血管形成能力。(B):不同组HUVECs迁移的免疫荧光图像;(C):评估HUVECs迁移能力的间隙面积分析;(D):4小时和8小时时不同组HUVECs的血管形成图像;(E–H):HUVECs的连接点数量、网格数量、毛细血管长度及分支点数量的定量分析。数据以平均值±标准差表示,*p<0.05表示与对照组相比有统计学差异,**p<0.01表示与对照组相比有显著统计学差异。所有实验重复三次。
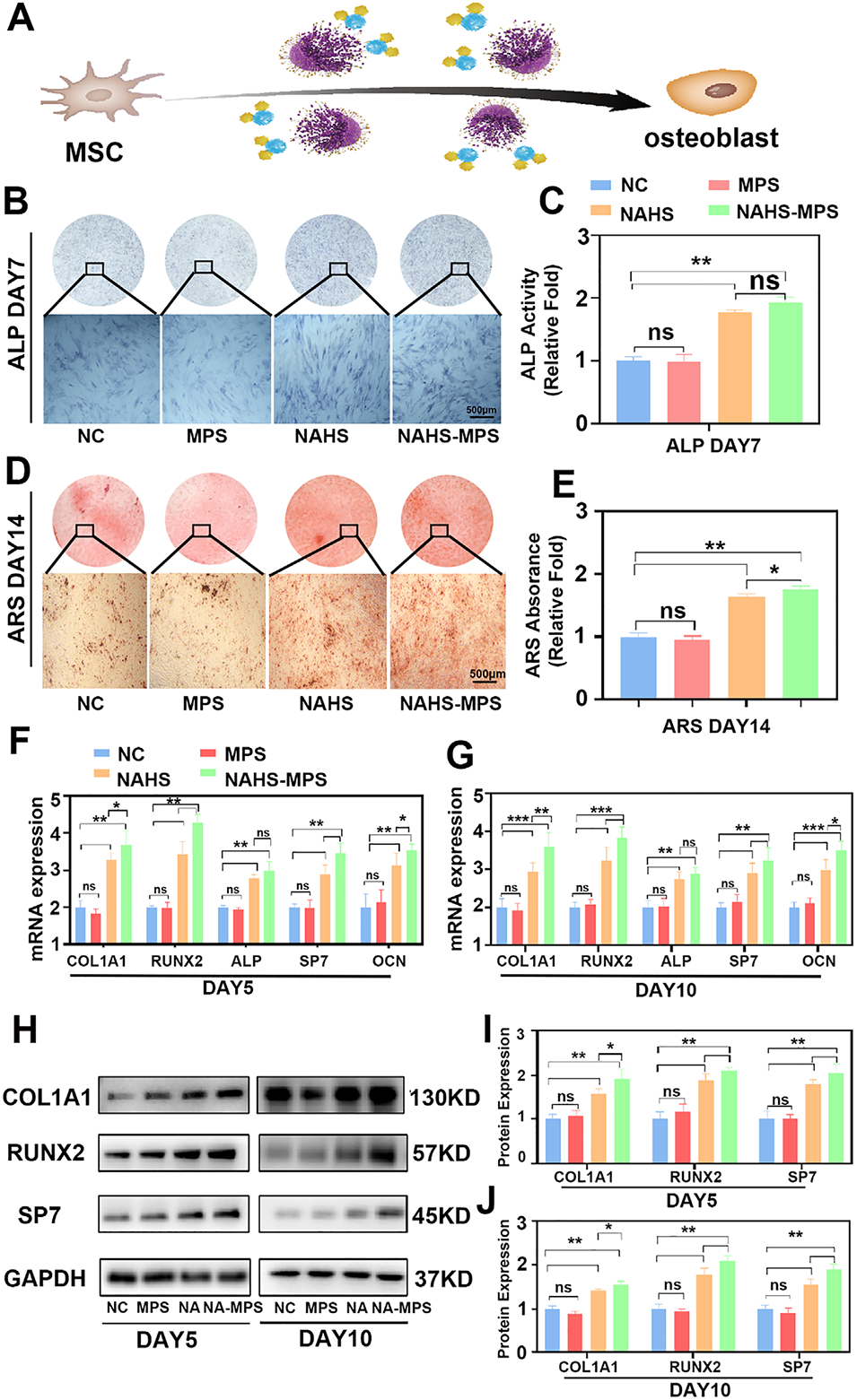
图4 (A):游离NaHS与NAHS-MPS的体外成骨作用评估。(B、C):成骨分化第7天的碱性磷酸酶(ALP)染色及ALP活性检测,比例尺为500μm;(D、E):成骨分化第14天的茜素红染色(ARS)及ARS定量分析,比例尺为500μm;(F、G):分别在成骨分化第5天和第10天,通过实时荧光定量PCR(qPCR)检测成骨分化相关mRNA的表达水平;(H–J):分别在成骨分化第5天和第10天,通过蛋白质印迹(Western blotting)检测COL1A1、RUNX2及SP7蛋白的表达水平。所有实验至少重复三次,*p<0.05表示有统计学差异,**p<0.01表示有显著统计学差异。
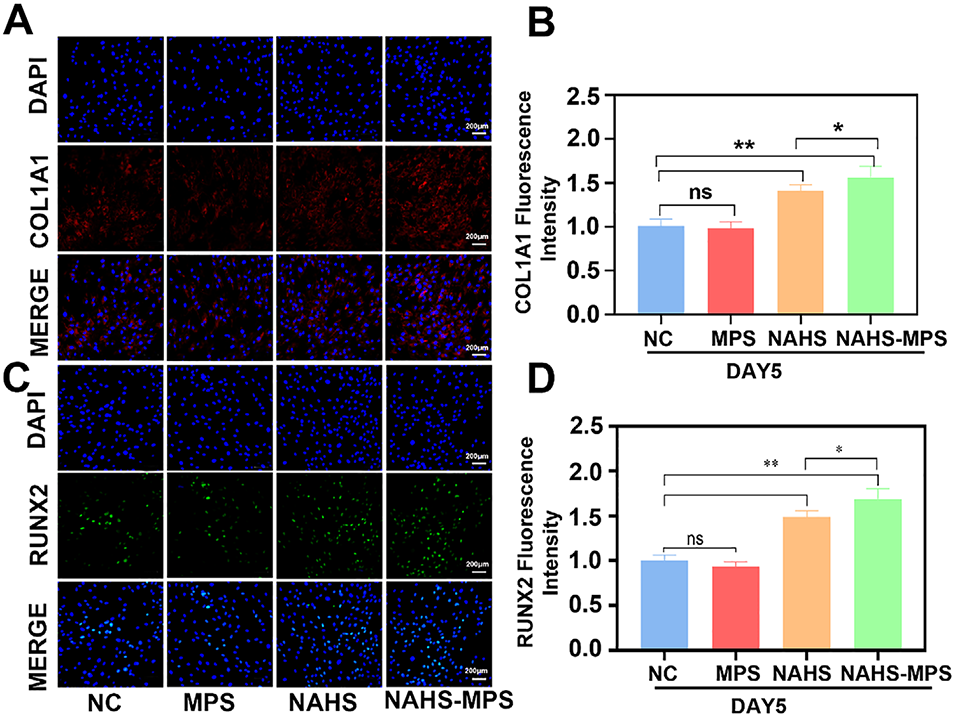
图5 采用免疫荧光检测法分析大鼠骨缺损模型的成骨过程,检测指标为COL1A1和RUNX2的表达水平。(A):游离NaHS组、空白微球组及NAHS-MPS组中COL1A1和RUNX2的免疫荧光图像;(B、C):不同组COL1A1和RUNX2荧光强度的半定量分析,*p<0.05表示有统计学差异,**p<0.01表示有显著统计学差异。
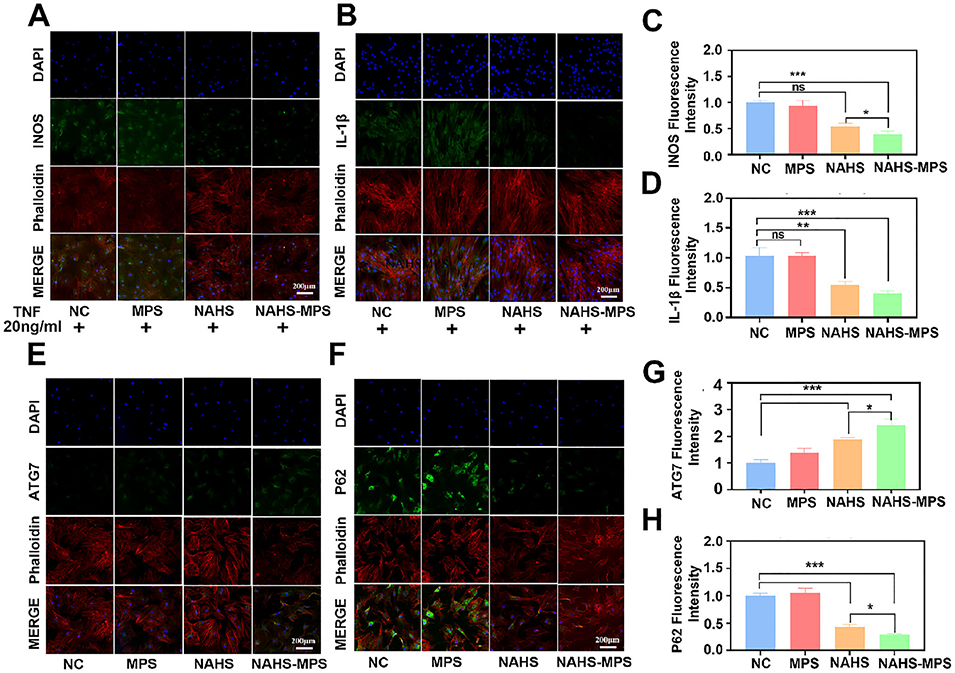
图6 不同组对骨髓间充质干细胞(BMSCs)的抗炎作用及自噬调控评估。(A、B):诱导型一氧化氮合酶(INOS)和白细胞介素-1β(IL-1β)的代表性免疫荧光染色图像(绿色),鬼笔环肽染色F-肌动蛋白(红色),4',6-二脒基-2-苯基吲哚(DAPI)染色细胞核(蓝色);(C、D):不同组INOS和IL-1β免疫荧光强度的半定量结果;(E、F):自噬相关蛋白ATG7和P62的代表性免疫荧光染色图像(绿色),鬼笔环肽染色F-肌动蛋白(红色),DAPI染色细胞核(蓝色);(G、H):不同组ATG7和P62免疫荧光强度的半定量结果,*p<0.05表示有统计学差异,**p<0.01表示有显著统计学差异,***p<0.001表示有极显著统计学差异。
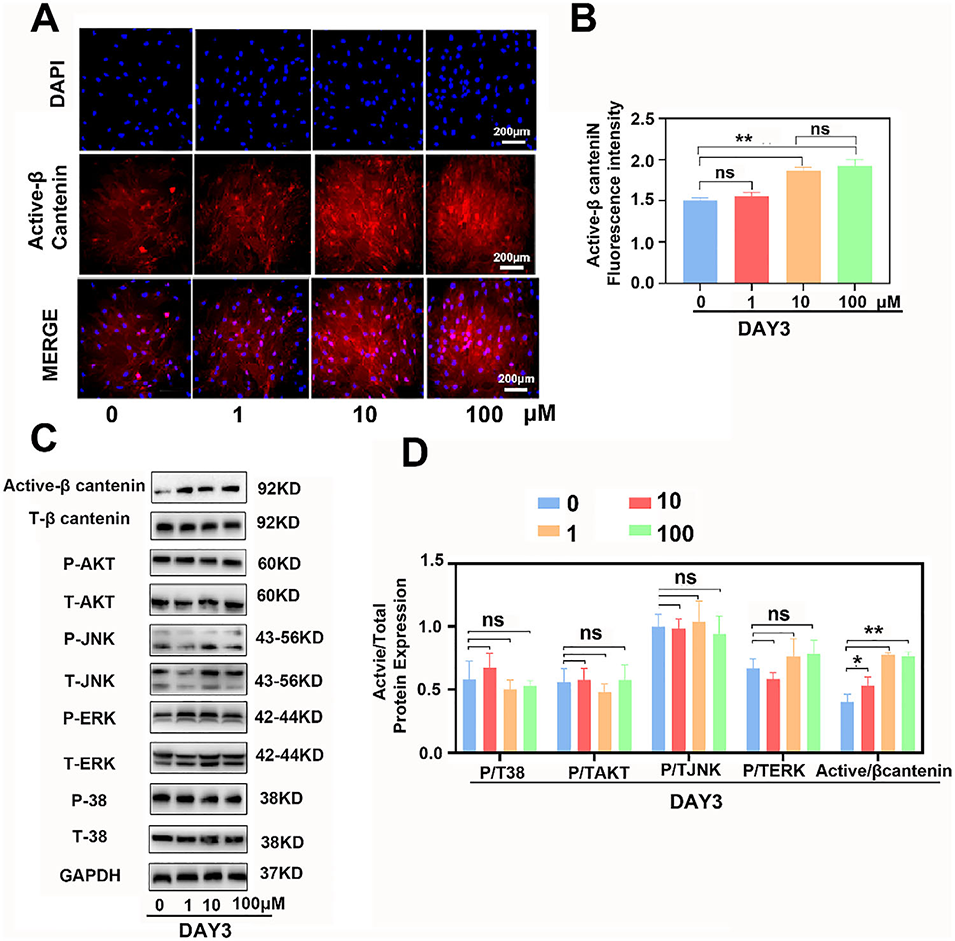
图7 NaHS通过激活Wnt/β-连环蛋白信号通路促进HBMSCs成骨分化。(A):免疫荧光结果显示NaHS可上调非磷酸化(活性)β-连环蛋白的表达;(B):非磷酸化β-连环蛋白荧光强度的半定量分析;(C):第3天通过蛋白质印迹检测成骨分化相关信号通路的磷酸化蛋白与总蛋白表达水平;(D):活性蛋白与总蛋白表达量及各信号通路比值的定量分析。数据以平均值±标准差表示,*p<0.05表示与第3天对照组相比有统计学差异,**p<0.01表示与第3天对照组相比有显著统计学差异。所有实验至少重复三次。
图8 (A、B) 体内NAHS微球的降解评估。
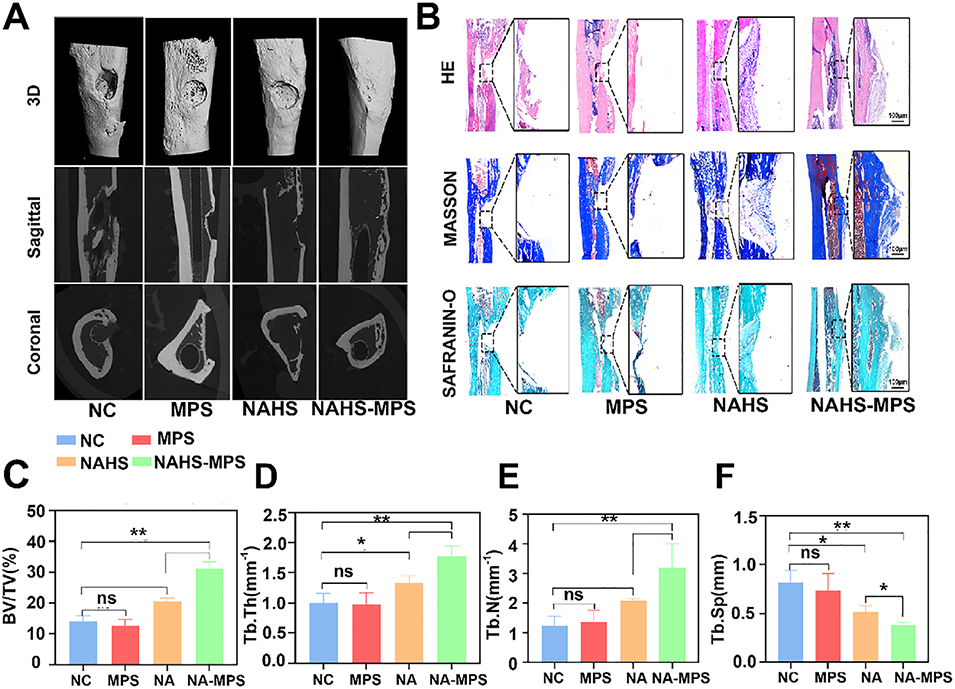
图9 术后4周的活体标本显示,NAHS-MPS可促进大鼠胫骨缺损的骨再生。(A):术后4周新生骨形成的三维重建微计算机断层扫描(Micro-CT)图像、矢状位及冠状位扫描图像;(B):术后4周缺损部位新生骨的苏木精-伊红(HE)染色、Masson三色染色及番红O染色结果;(C–F):术后4周新生骨的骨体积/总体积(BV/TV)、平均骨小梁厚度(Tb.Th)、平均骨小梁数量(Tb.N)及平均骨小梁分离度(Tb.Sp)的定量分析。BV=骨体积,Tb.N=平均骨小梁数量,Tb.Th=平均骨小梁厚度,Tb.Sp=平均骨小梁分离度。数据以平均值±标准差表示,*p<0.05表示与对照组相比有统计学差异,**p<0.01表示与对照组相比有显著统计学差异。所有实验重复三次。
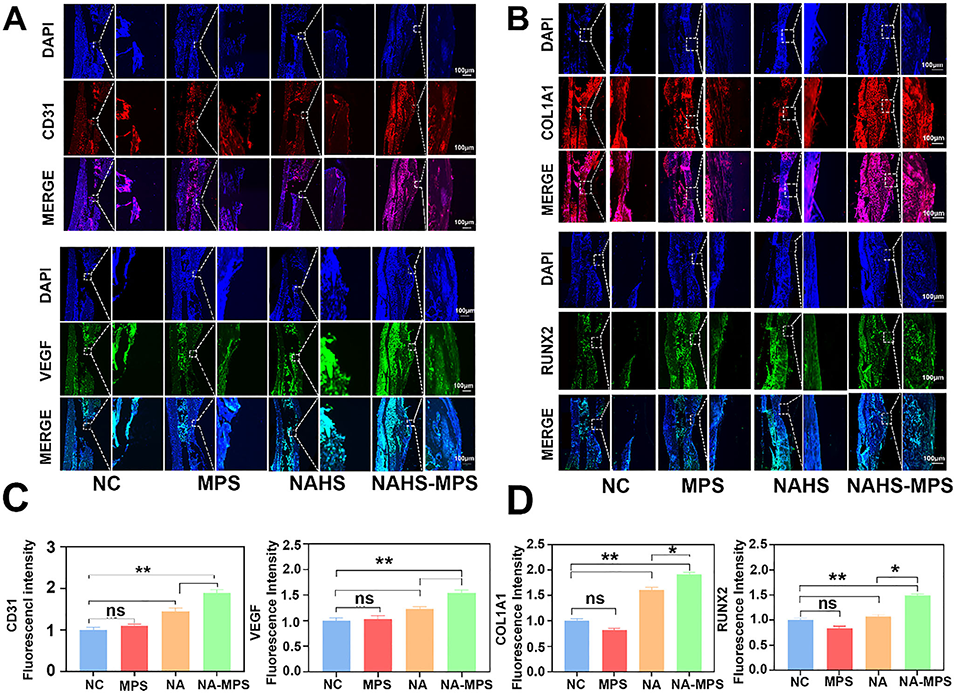
图10 术后4周不同组的体内血管生成及成骨作用评估。(A):术后4周骨组织中CD31(红色)和血管内皮生长因子(VEGF,绿色)的代表性免疫荧光染色图像,细胞核(蓝色);(B):术后4周骨组织中COL1A1(红色)和RUNX2(绿色)的代表性免疫荧光染色图像,细胞核(蓝色);(C):不同组CD31和VEGF免疫荧光强度的半定量结果;(D):不同组COL1A1和RUNX2免疫荧光强度的半定量结果,数据以平均值±标准差表示,*p<0.05表示有统计学差异,**p<0.01表示有显著统计学差异。
论文链接:https://doi.org/10.1002/smll.202509368
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)
上一篇:液滴微流控结合溶剂蒸发,可控制备仿生花粉状聚合物微粒
下一篇:暂无














