研究背景和目的
阿尔茨海默病(AD)是一种普遍且致命的神经退行性疾病,随着全球老龄化社会的到来,其发病率急剧上升,预计到2050年患者数量将超过1.5亿,给医疗和社会经济带来巨大负担。AD的主要病理特征包括β-淀粉样蛋白(Aβ)沉积、氧化应激和神经炎症,这些病理过程相互交织,形成恶性循环,加剧神经元损伤和疾病进展。尽管针对Aβ沉积的药物开发投入巨大,但过去二十年中,美国食品药品监督管理局(FDA)仅批准了三种Aβ靶向的单克隆抗体药物,且大多数新型Aβ靶向药物因疗效不足而在临床试验中失败。因此,开发能够同时针对Aβ生成、氧化应激和神经炎症的多靶点治疗策略显得尤为迫切。
本研究旨在开发一种能够通过鼻腔给药实现脑靶向的多功能脂质纳米颗粒(LNP)平台,用于同时递送BACE1 siRNA(siB)和槲皮素(QU),以多靶点干预AD的病理过程。通过siB沉默BACE1基因减少Aβ生成,同时利用QU的抗氧化和抗炎特性,改善AD的氧化应激和神经炎症微环境,从而恢复Aβ稳态和氧化还原平衡,减轻神经炎症和神经元损失,最终改善AD模型的认知功能。相关研究以“Intranasal delivery of Odorranalectin-modified lipid nanoparticles for multi-targeted therapy of Alzheimer's disease”为题目,发表于期刊《Materials Today Bio》。

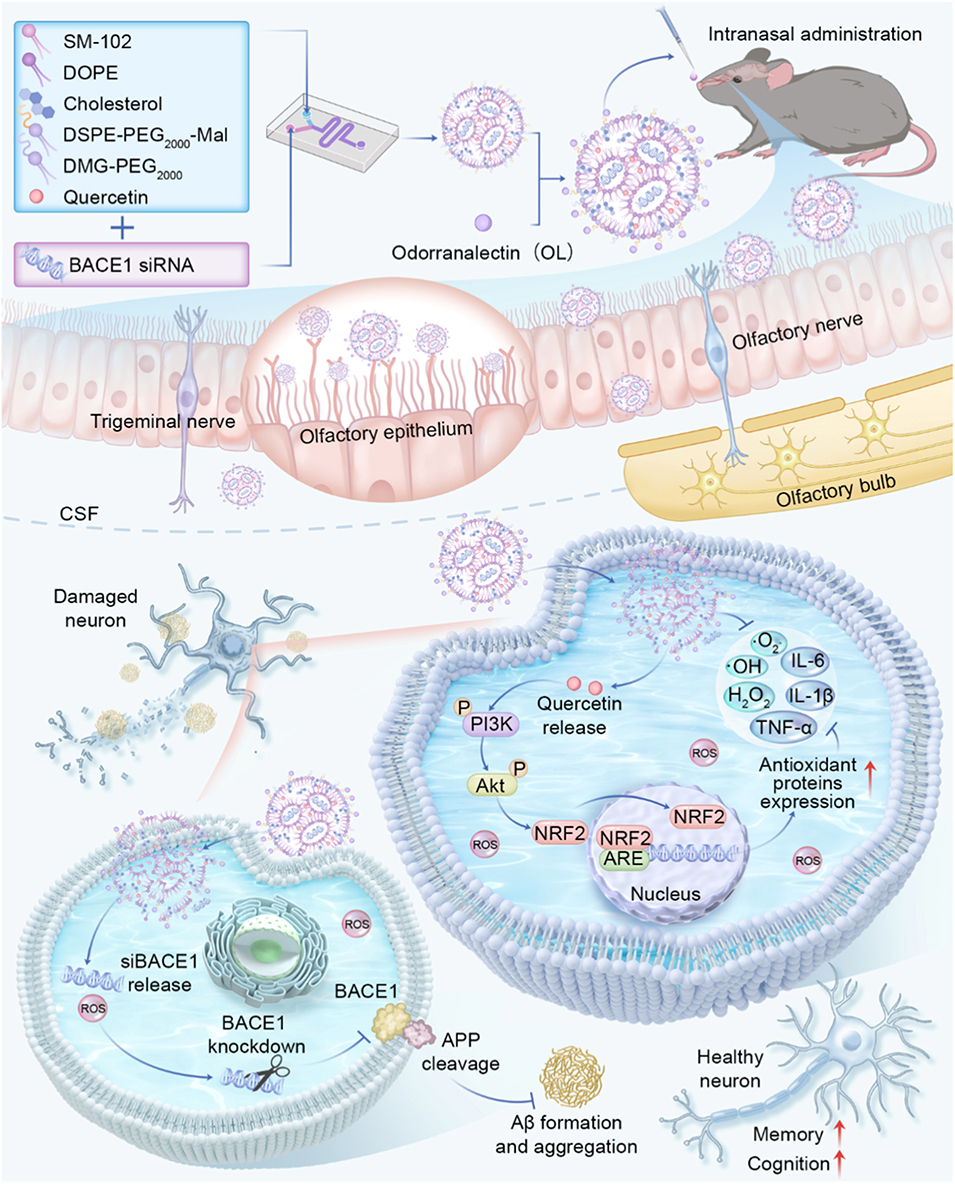
本文要点:
1、该研究构建了一种经臭蛙凝集素(OL)修饰的脂质纳米颗粒(siB/QU@L-OL),用于鼻内共递送BACE1小干扰RNA(siB)和槲皮素(QU),以多靶点治疗阿尔茨海默病(AD)。
2、纳米颗粒通过微流控技术制备,具有均一的粒径分布、高包封率和良好稳定性,OL修饰可增强其与嗅上皮的结合,减少黏膜纤毛清除,促进脑内递送。
3、体外实验显示,siB能沉默BACE1表达、抑制β-淀粉样蛋白(Aβ)生成,QU可通过激活PI3K/Akt/Nrf2通路减轻氧化应激和神经炎症,二者协同抑制神经元凋亡。
4、在APP/PS1转基因小鼠中,经鼻内给药后,该纳米平台可恢复Aβ稳态和氧化还原平衡,减轻神经炎症与神经元损失,显著改善小鼠认知功能。
5、转录组分析证实其能调控AD相关多条信号通路,且体内安全性评估未发现明显毒副作用。该研究为AD的多模态治疗提供了兼具靶向递送与协同药效的纳米医学新策略。
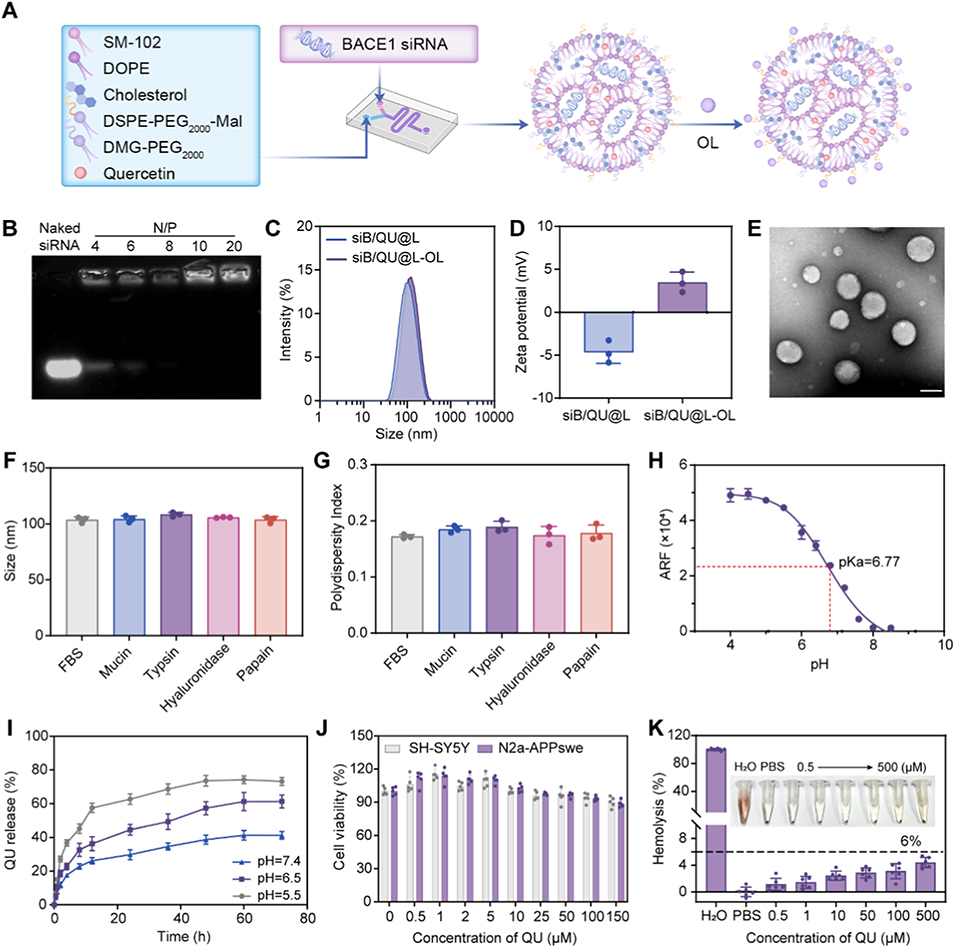
图1. siB/QU@L-OL 的制备与表征。
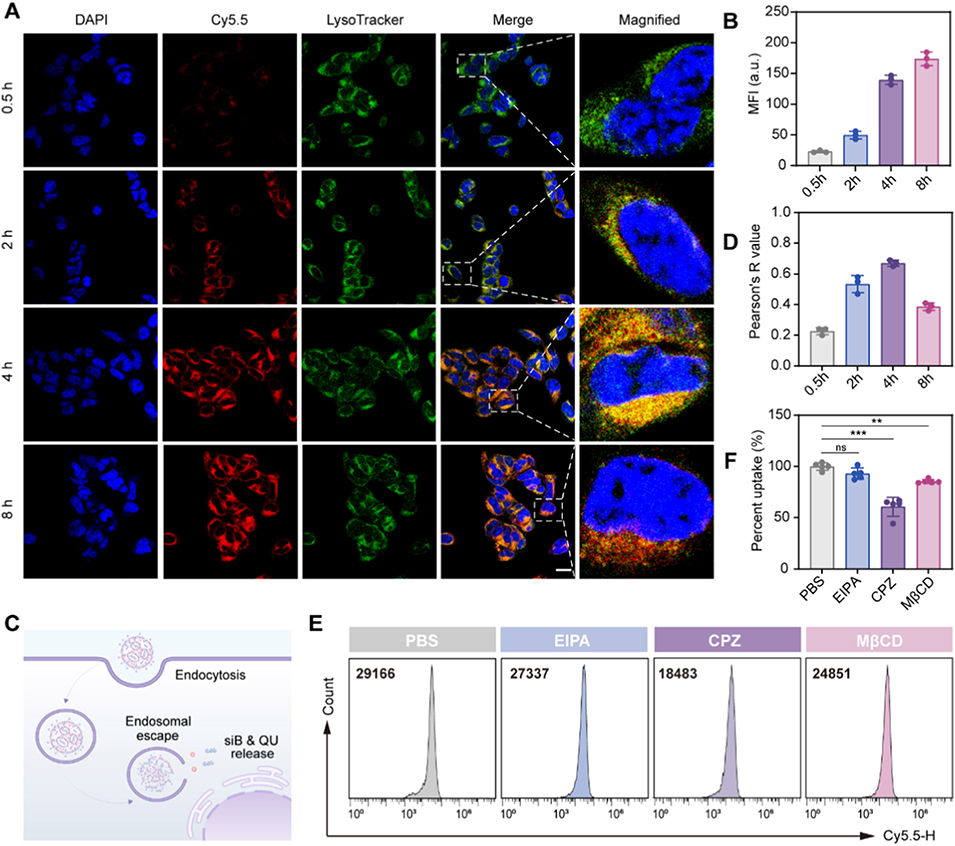
图2. 脂质纳米粒(LNPs)的细胞摄取与溶酶体逃逸研究。
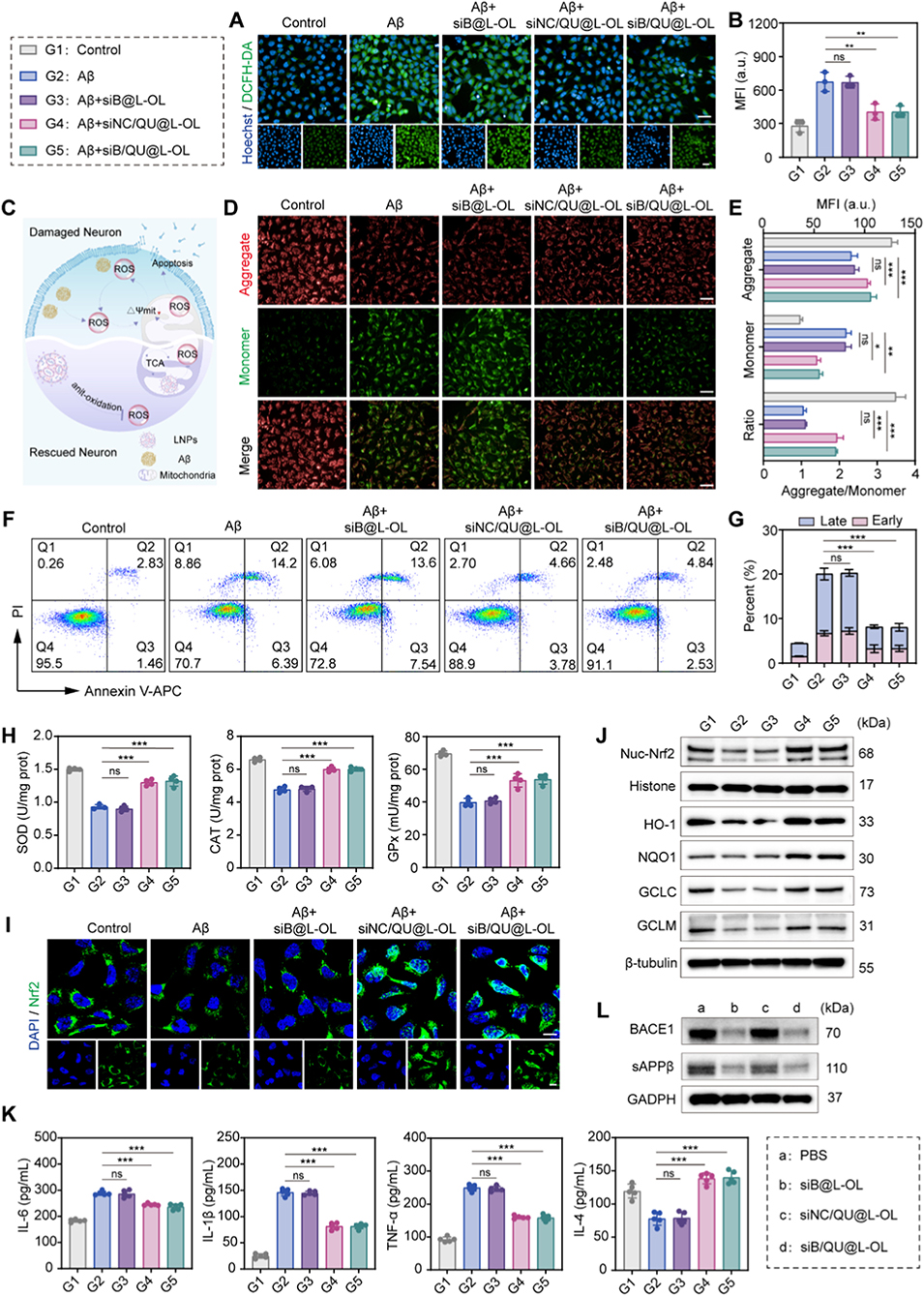
图3. 体外神经保护作用及潜在机制。
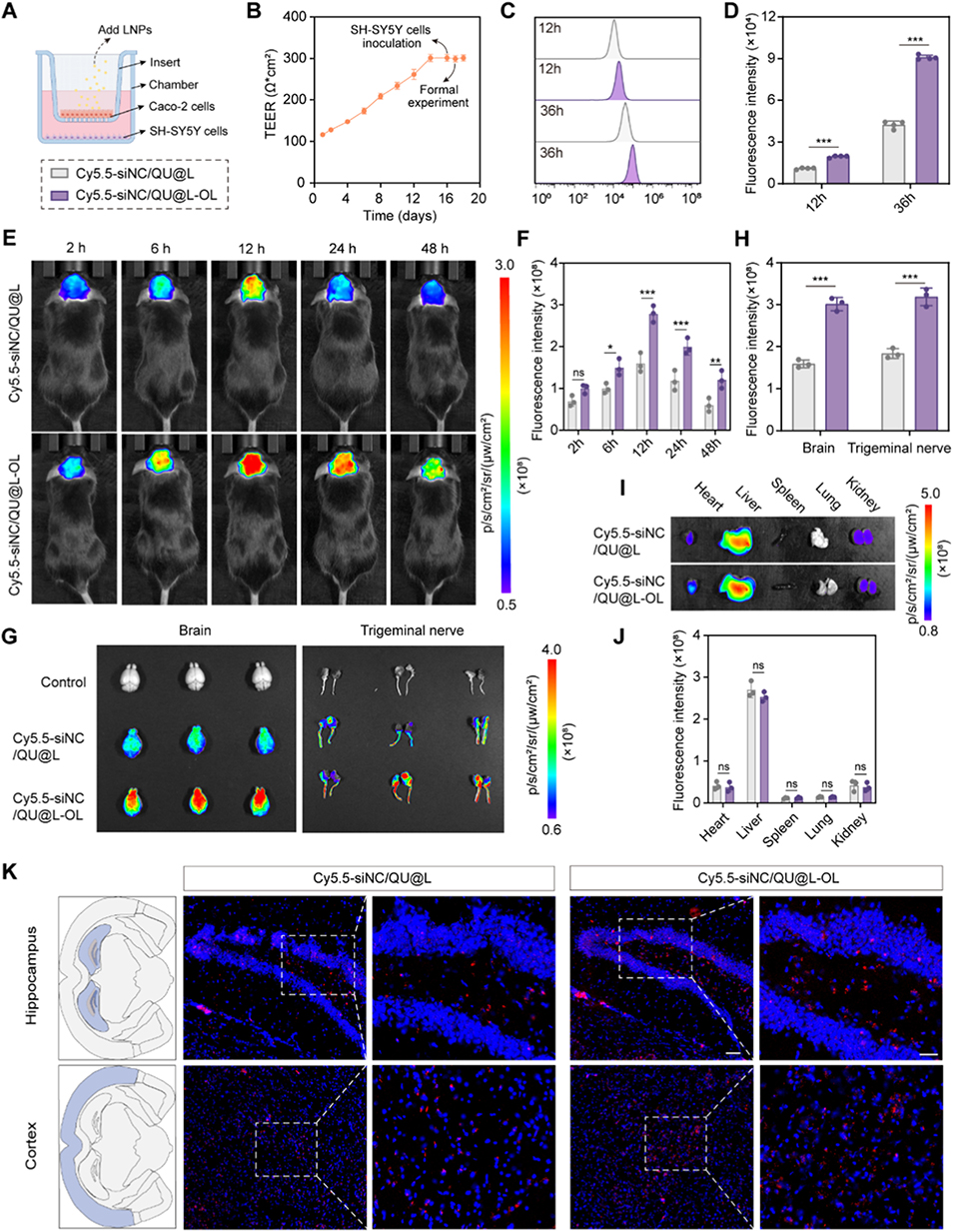
图4. 鼻脑靶向效率的体外和体内评价。
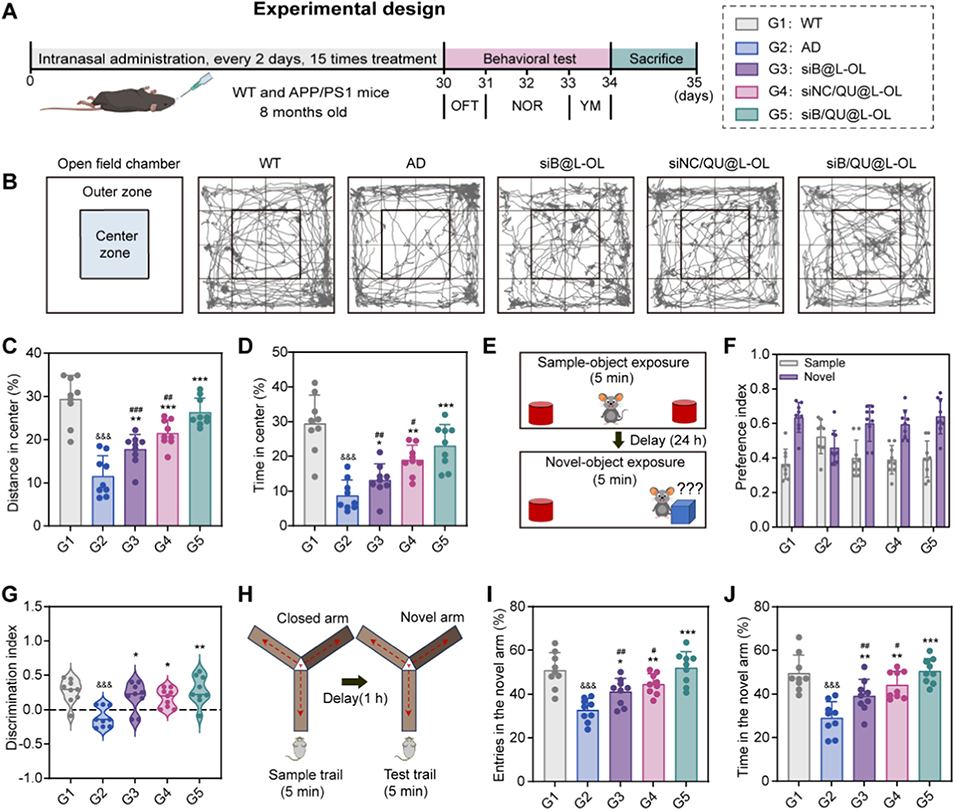
图5. 脂质纳米粒治疗 8 月龄 APP/PS1 小鼠的行为学评价。
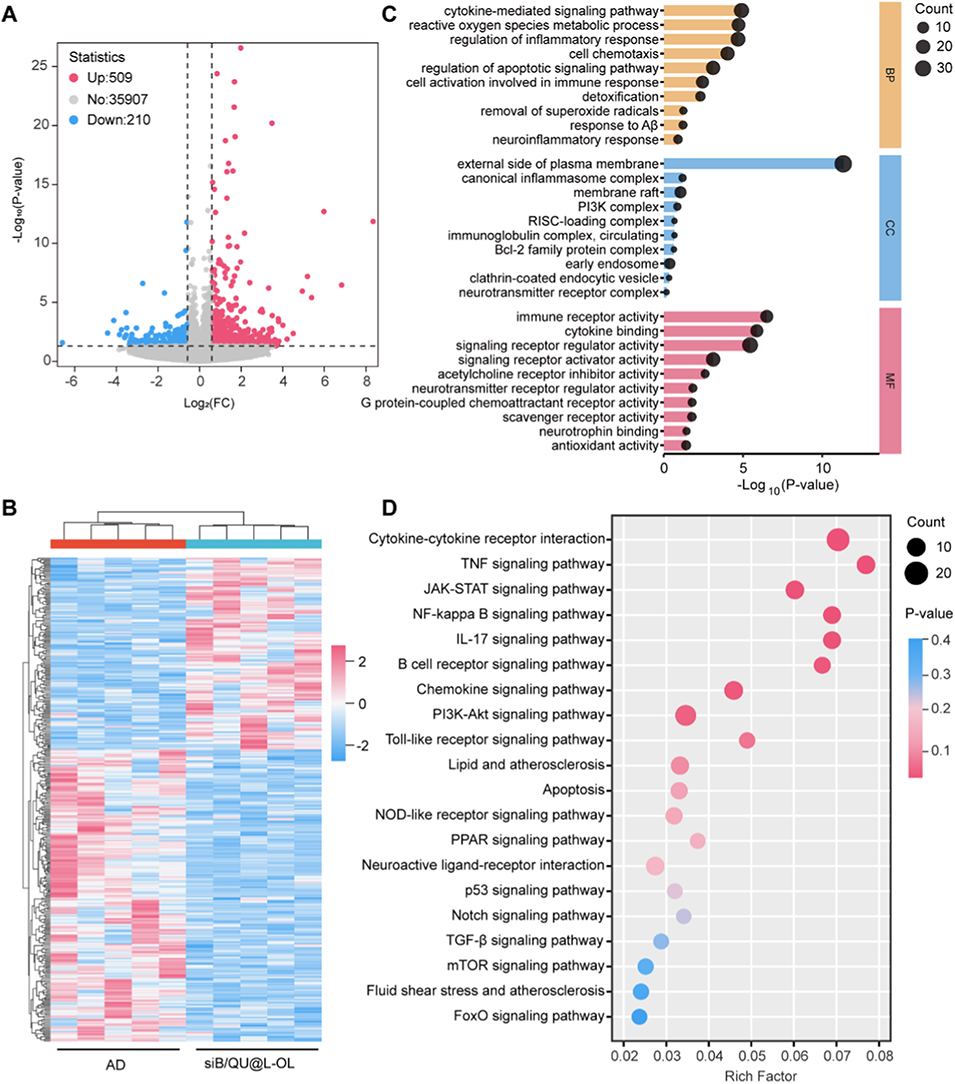
图6. 脂质纳米粒治疗效果的体内转录组学分析。
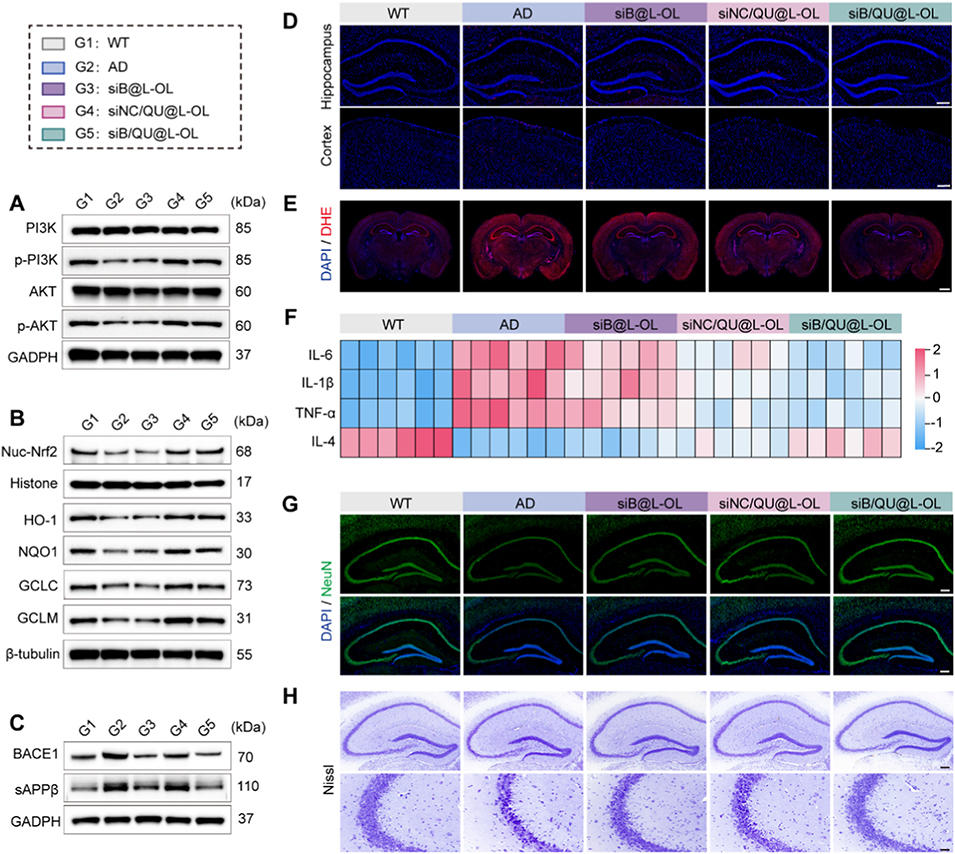
图7. 阿尔茨海默病(AD)多靶点治疗的体内评价。
论文链接:https://doi.org/10.1016/j.mtbio.2026.102764
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














