急性肝衰竭(ALF)是一种进展迅速、危及生命的严重肝病,其核心病理特征为活性氧/氮物种(RONS)过量积累引发的氧化应激和炎症风暴,导致肝细胞大量死亡及肝功能快速丧失。传统肝移植面临供体短缺、终身免疫抑制等困境,间充质干细胞(MSC)治疗虽展现潜力,但存在体内清除快、病灶植入率低、功能发挥受限等瓶颈。

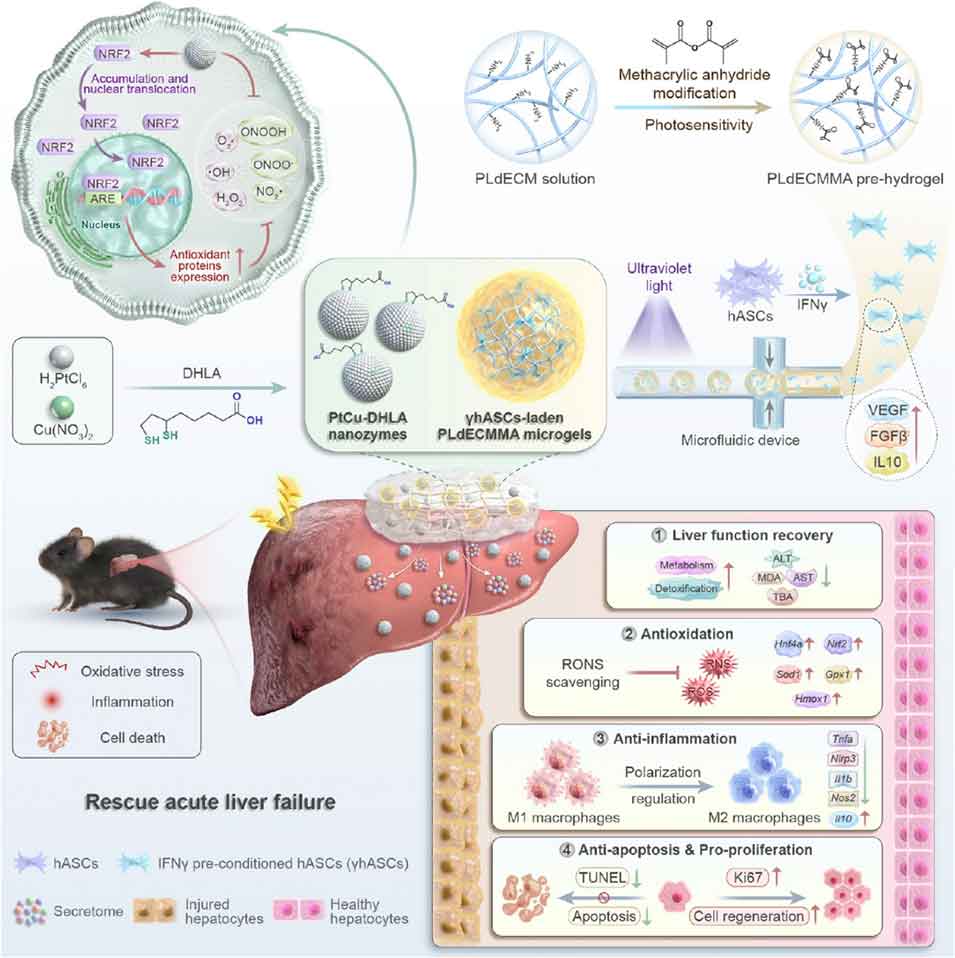
为此,中山大学附属第三医院陶玉研究员、李明强研究员团队构建了一种整合多功能纳米酶与干细胞负载微凝胶的生物活性脱细胞外基质(dECM)治疗平台。该平台以猪肝来源的脱细胞外基质(PLdECM)为基础,通过甲基丙烯酸酐(MA)修饰获得光敏性水凝胶(PLdECMMA),利用微流控技术制备干扰素γ(IFNγ)预处理的人脂肪源性间充质干细胞(γhASCs)负载微凝胶,并与二氢硫辛酸(DHLA)保护的铜掺杂铂纳米簇(PtCu-DHLA)纳米酶共递送,形成协同治疗体系(PMPC)。在四氯化碳(CCl₄)诱导的ALF小鼠模型中,该平台通过抗氧化、抗炎、促增殖、促血管生成的协同作用,有效修复肝损伤、恢复肝功能,为ALF治疗及再生医学领域提供了全新策略。相关研究以“Bioactive Decellularized Extracellular Matrix Platform Integrating Multifunctional Nanozymes and Cell-Laden Microgels for Acute Liver Failure Treatment”为题目,发表于期刊《ACS Nano》。
本文要点:
核心组件设计与制备
PtCu-DHLA纳米酶:通过筛选配体(DHLA)和掺杂金属(Cu)获得最优性能,粒径仅4±0.3nm,zeta电位为-23.7mV,具有良好的稳定性和生物相容性。其兼具超氧化物歧化酶(SOD)和过氧化氢酶(CAT)模拟活性,可高效清除O₂⁻、H₂O₂、・OH等RONS,同时具备抗炎、促肝细胞增殖和血管生成的多重功能。
γhASCs负载微凝胶:采用微流控技术将IFNγ预处理的hASCs封装于PLdECMMA水凝胶中,微凝胶粒径均一(7±10.9μm),多孔结构利于营养交换。IFNγ预处理使hASCs分泌VEGF、IL-10等免疫调节因子的能力提升1.3-2.4倍,微凝胶封装则形成免疫保护屏障,延长细胞在病灶的存活时间。
PMPC复合平台:以PLdECM水凝胶为载体,实现PtCu-DHLA纳米酶与γhASCs负载微凝胶的共递送。PLdECM外层可快速释放纳米酶以应对急性病理过程,微凝胶则可持续释放治疗性细胞和因子,形成“即时缓解+长期修复”的双重治疗效应。
多维度协同治疗机制
抗氧化:PtCu-DHLA直接清除RONS,同时激活NRF2信号通路,上调Hnf4a、Nrf2、Sod1等抗氧化基因表达,增强肝细胞内源性防御能力。
抗炎:纳米酶调控巨噬细胞从促炎M1型向抗炎M2型极化,降低Tnfa、Nos2等促炎基因表达,γhASCs进一步强化免疫调节,共同抑制炎症风暴。
促修复:PtCu-DHLA促进肝细胞增殖(Ki67阳性率恢复)和血管生成(HUVEC迁移率达6%),γhASCs则通过旁分泌效应加速肝组织再生,减少肝细胞凋亡。
显著的体内外治疗效果
细胞实验:PtCu-DHLA可显著降低氧化应激损伤肝细胞的ROS/RNS水平,提升细胞存活率;γhASCs负载微凝胶在体外培养3天仍保持高细胞活性。
动物实验:治疗1天后,ALF小鼠血清ALT、AST等肝功能指标显著下降,肝坏死面积缩小;治疗3天,肝组织病理结构接近健康水平,Ki67阳性增殖细胞数量达峰值,且未观察到明显免疫毒性。

PtCu-DHLA纳米酶的核心优势在于“多功能协同”与“双重作用机制”的结合。相比传统抗氧化剂稳定性差、作用单一的局限,以及单一成分纳米材料功能不全的问题,它既具备直接清除多种RONS的级联酶模拟活性,可快速缓解氧化应激;又能激活细胞内源性NRF2抗氧化信号通路,从源头增强肝细胞防御能力。同时,其额外具备的抗炎、促增殖、促血管生成功能,可同步改善ALF的多重病理环节,避免了单一治疗手段难以应对复杂病理微环境的缺陷,为干细胞移植创造了最优条件。
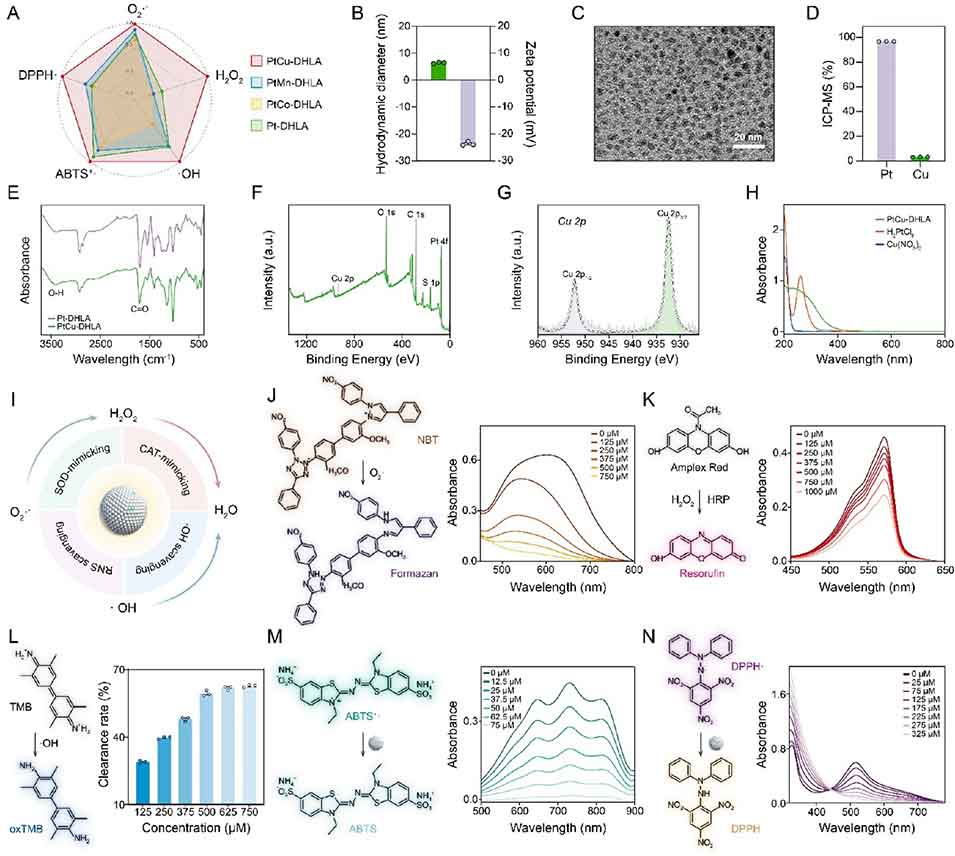
图1. PtCu-DHLA纳米酶的合成与表征

图2. PtCu-DHLA在H₂O₂损伤肝细胞中的抗氧化活性
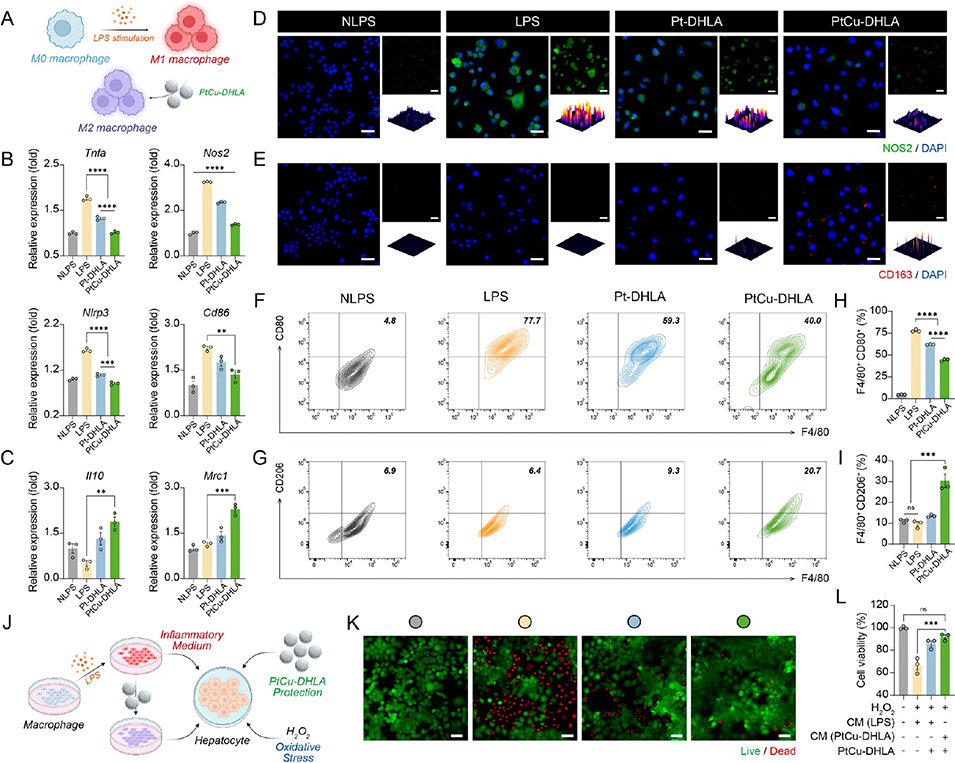
图3. PtCu-DHLA在脂多糖刺激巨噬细胞中的抗炎活性
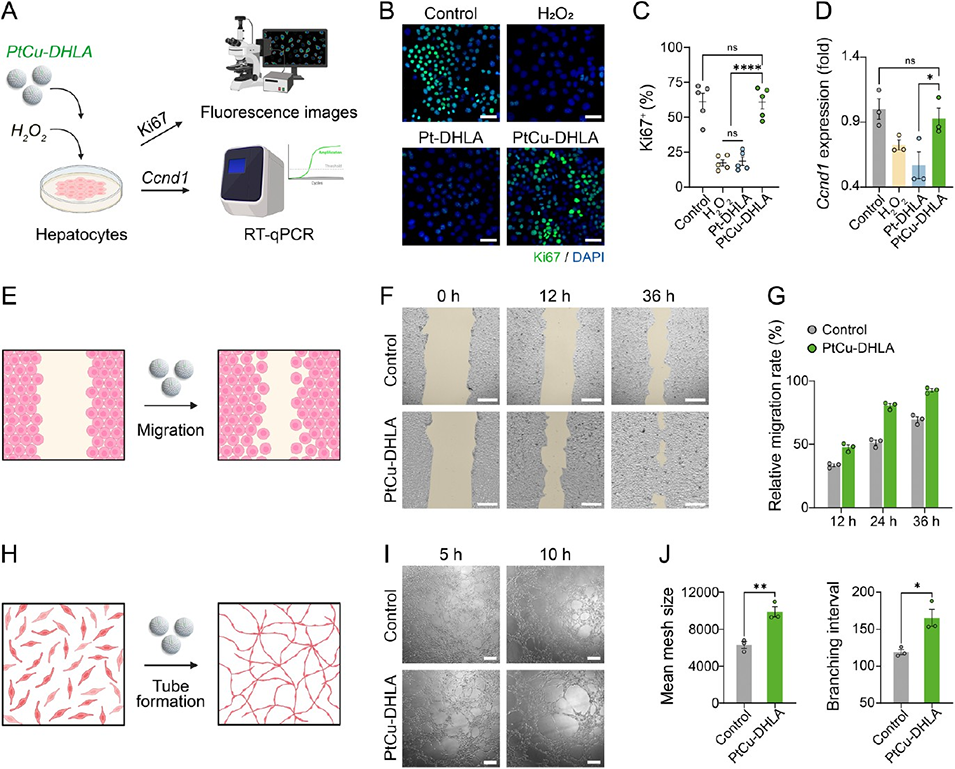
图4. PtCu-DHLA的促增殖与促血管生成潜能
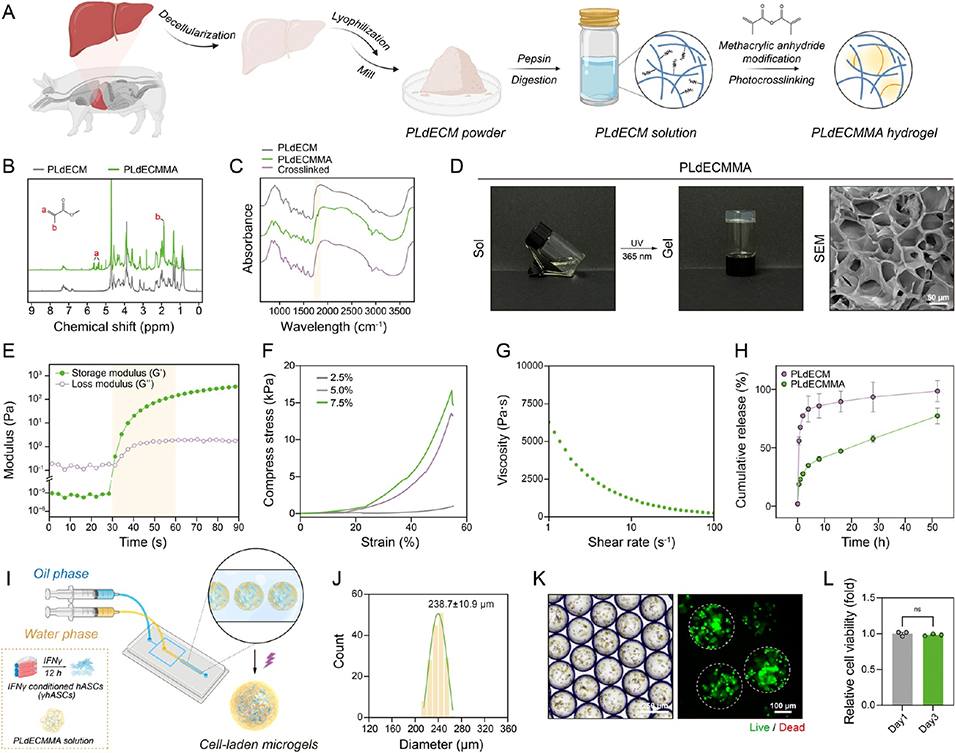
图5. 基于微流控技术制备细胞负载型PLdECMMA微凝胶

图6. PMPC复合平台对CCl₄诱导急性肝衰竭的治疗效果
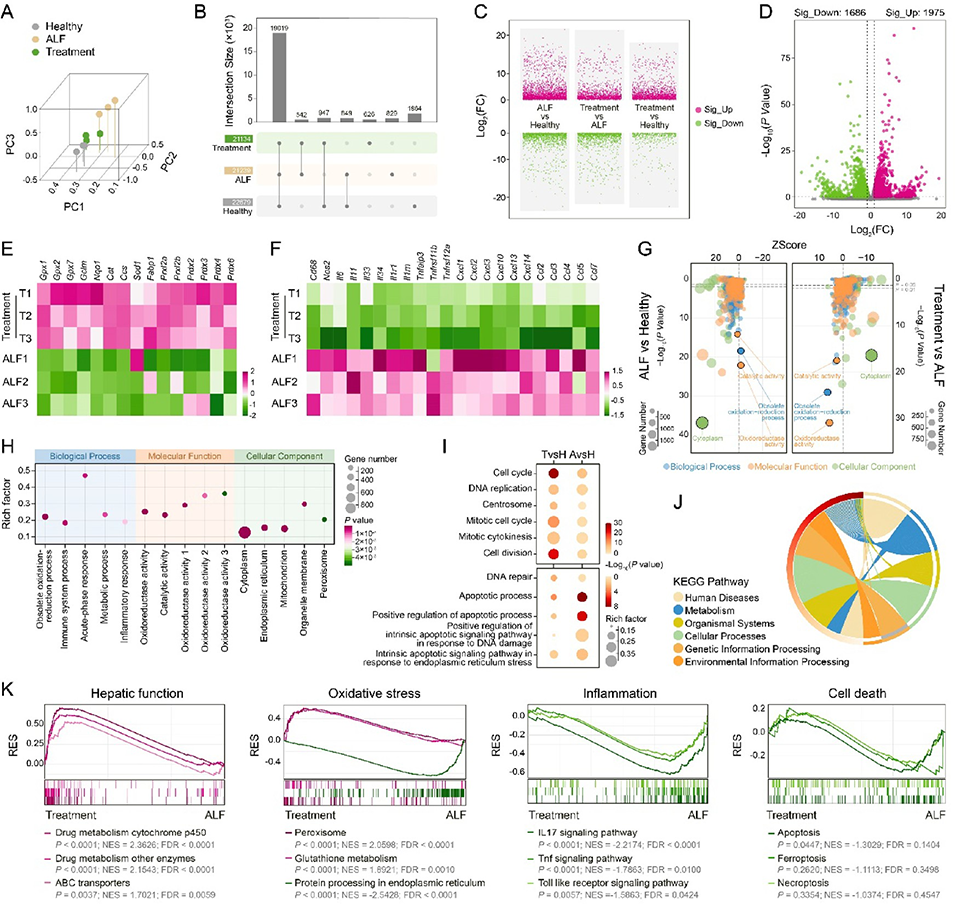
图7. 肝组织转录组分析
总结
该研究创新性地将多功能纳米酶与干细胞治疗相结合,构建了兼具“环境调控”和“细胞修复”功能的生物活性dECM平台。通过PtCu-DHLA纳米酶改善病理微环境,γhASCs负载微凝胶强化细胞治疗效果,两者协同作用有效突破了ALF治疗的现有瓶颈。该方案不仅为急性肝衰竭提供了更高效、安全的治疗策略,也为再生医学领域中复杂疾病的协同治疗提供了重要借鉴,有望拓展至其他炎症相关疾病的治疗应用。
论文链接:https://doi.org/10.1021/acsnano.4c13709
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














