
导读:
在脊髓损伤(SCI)的病理过程中观察到金属离子浓度的动态变化。因此,以阶段匹配的方式战略性供应金属离子有望通过防止病理损伤来促进受伤的脊髓修复。为了实现这一目标,扬州大学陈昊教授、王永祥教授、王辉辉等人借助微流控技术构建了核-壳结构嵌合水凝胶微球,以负载Zn²⁺的PLGA为核、Mg²⁺交联的PBA修饰GelMA为壳,可实现金属离子的时序释放,早期抗炎、后期促神经再生,显著改善了SCI模型的运动功能恢复。相关研究以“Phase-adapted metal ion supply for spinal cord repair with a Mg–Zn incorporated chimeric microsphere”为题目,发表于期刊《Biomaterials》。
本文要点:
1、该研究聚焦脊髓损伤(SCI)修复,设计了一种“核-壳”结构的嵌合水凝胶微球(P−Zn2+@G−P−Mg2+),实现金属离子的阶段匹配释放以促进损伤脊髓修复。
2、微球以负载Zn2+的聚乳酸-乙醇酸共聚物(PLGA)为核、负载Mg2+的苯硼酸(PBA)修饰甲基丙烯酰化明胶(GelMA)为壳,通过微流控技术制备而成。
3、SCI后早期,壳层降解释放Mg2+,调节巨噬细胞从促炎M1表型向抗炎M2表型极化,减少促炎细胞因子分泌,抑制瘢痕形成;后期核层降解释放Zn2+,促进神经细胞增殖、轴突再生,激活成熟神经元、中间神经元和运动神经元。
4、体外实验验证了微球的生物相容性、降解特性及离子可控释放能力;体内实验显示,该微球可显著改善SCI小鼠的运动功能(BMS评分提升、步态恢复),减轻炎症反应,减少胶质瘢痕形成,促进神经再生,且长期植入安全性良好,未对主要脏器造成损伤。
5、该研究证实了不同阶段金属离子在SCI修复中的关键作用,所构建的嵌合微球为脊髓损伤治疗提供了一种有潜力的策略。
现有微球通过材料本身降解特性实现“Mg²⁺早期释放、Zn²⁺后期释放”,但SCI严重程度(如挫伤、横断伤)不同,炎症持续时间、神经修复启动时机存在差异。可从以下三方面进行优化:
调控材料降解参数:通过调整GelMA浓度(现有15%)或PLGA的乳酸-羟基乙酸比例(现有50:50),改变壳层降解速率,适配轻度SCI(炎症期3-5天)或重度SCI(炎症期7-10天)的Mg²⁺需求;
引入智能响应机制:在GelMA壳层或PLGA核层接入炎症因子敏感键(如基质金属蛋白酶响应肽),让Mg²⁺释放速率随损伤部位炎症强度动态调整,炎症越重释放越快,炎症消退后自动减缓;
定制离子负载梯度:通过微流控技术精准控制Mg²⁺/Zn²⁺的负载浓度梯度,针对不同SCI类型预设释放峰值时间(如轻度SCI的Zn²⁺释放提前至第5天,重度SCI延迟至第10天),实现“个体化阶段适配”。
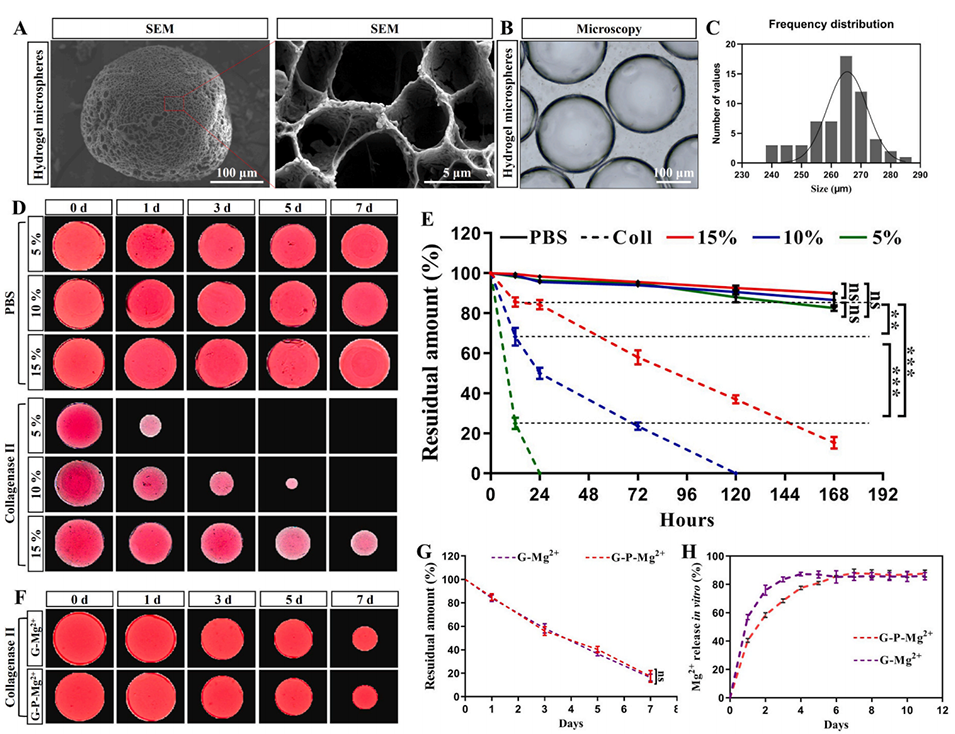
图1 微流控技术合成的GelMA微球的表征及降解测试
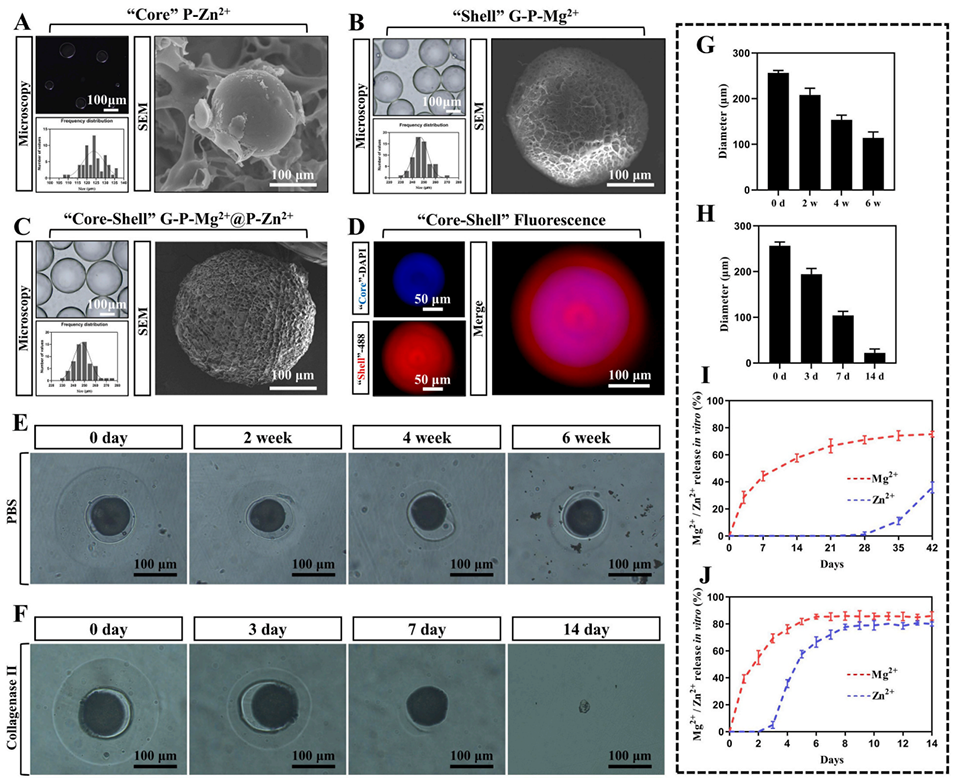
图2 Mg–Zn嵌合微球的体外表征
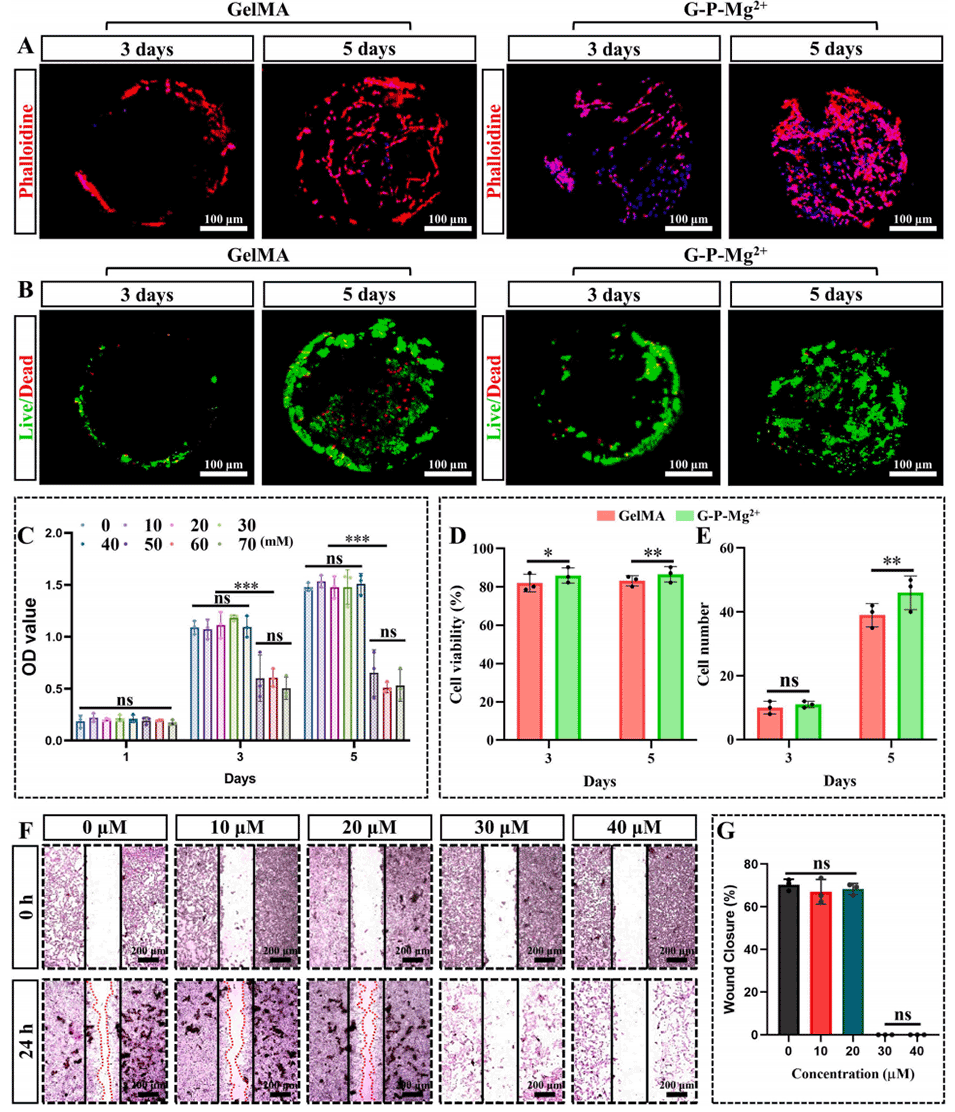
图3 Mg–Zn嵌合微球对小胶质细胞和神经细胞的生物相容性
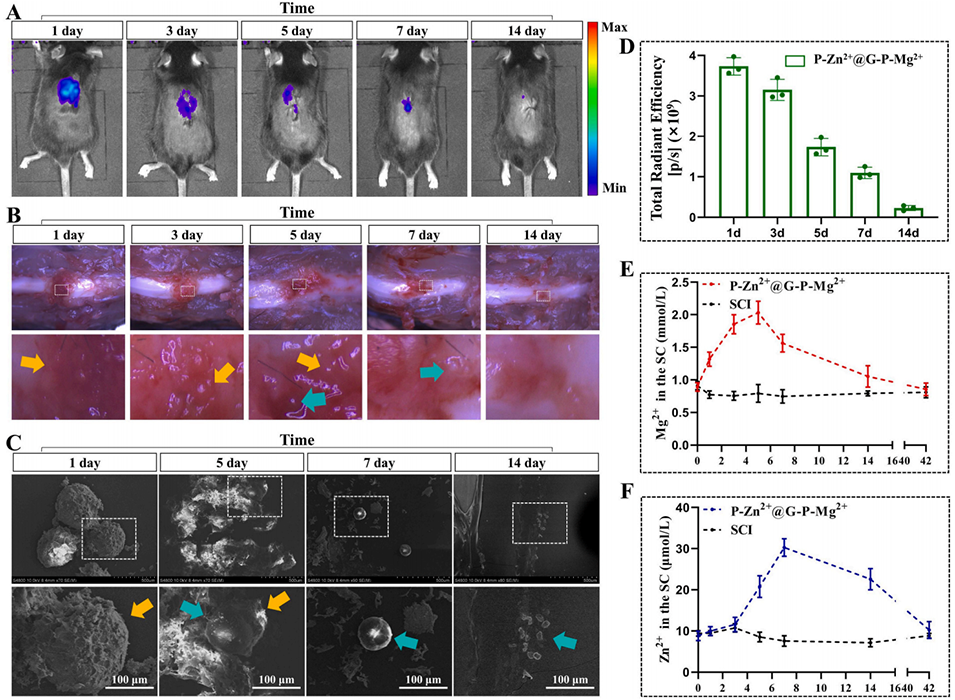
图4 Mg–Zn嵌合微球的体内降解及安全性
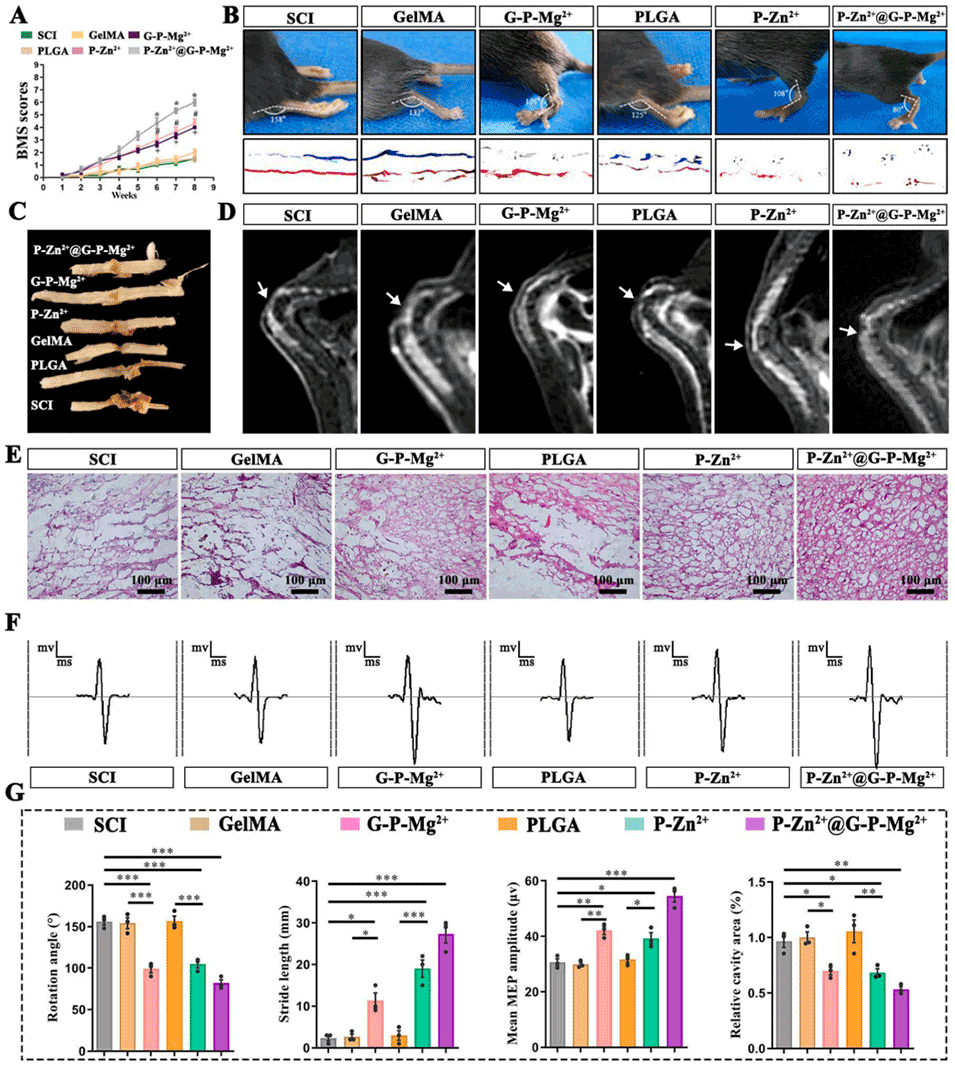
图5 注射Mg–Zn嵌合微球的脊髓损伤小鼠的功能恢复
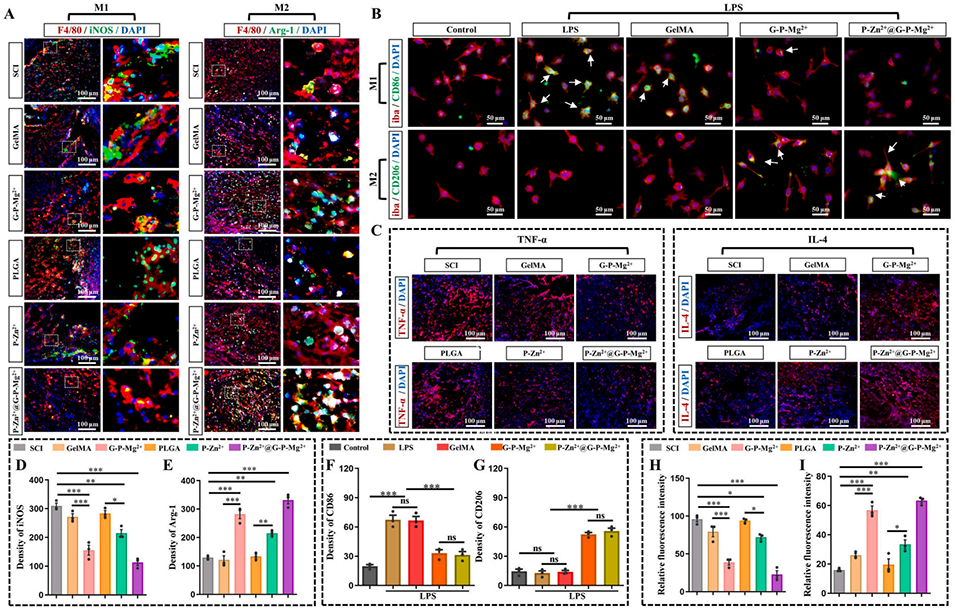
图6 P-Zn²⁺@G-P-Mg²⁺微球在体内外均能抑制脊髓损伤后的早期炎症
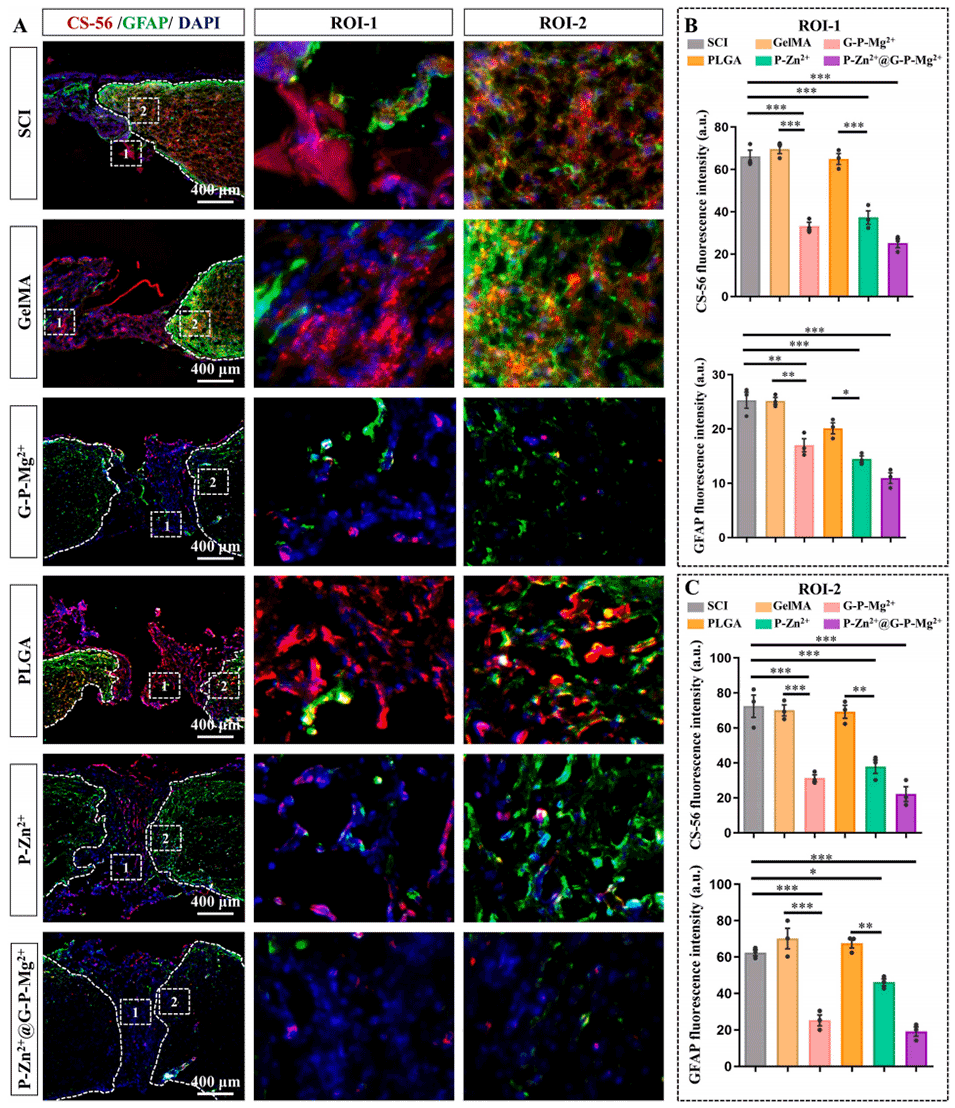
图7 P-Zn²⁺@G-P-Mg²⁺微球在体内抑制瘢痕形成
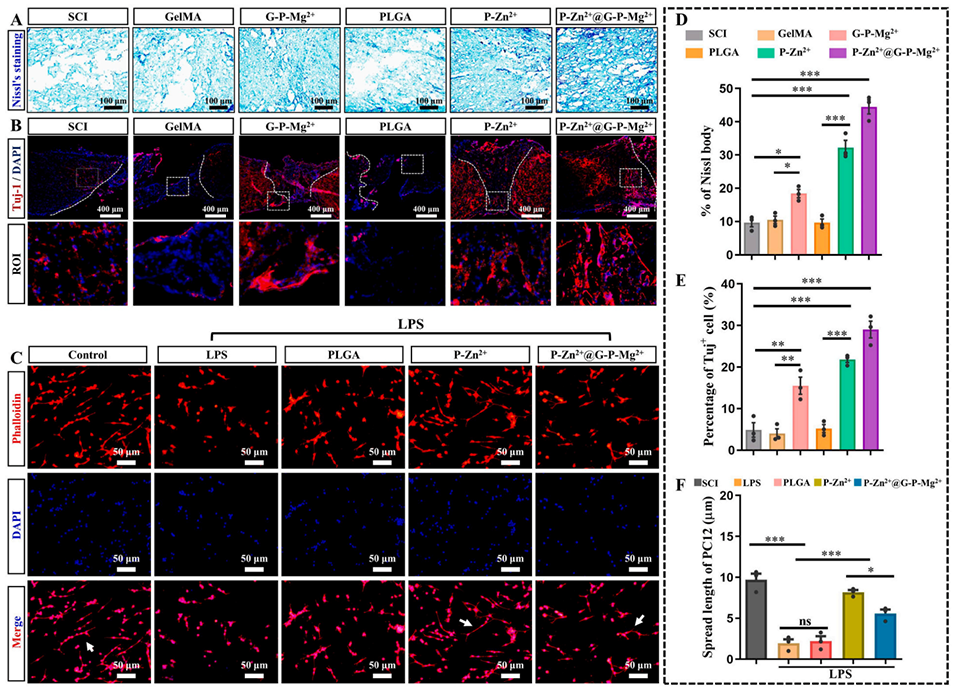
图8 P-Zn²⁺@G-P-Mg²⁺微球在体内外促进突触再生
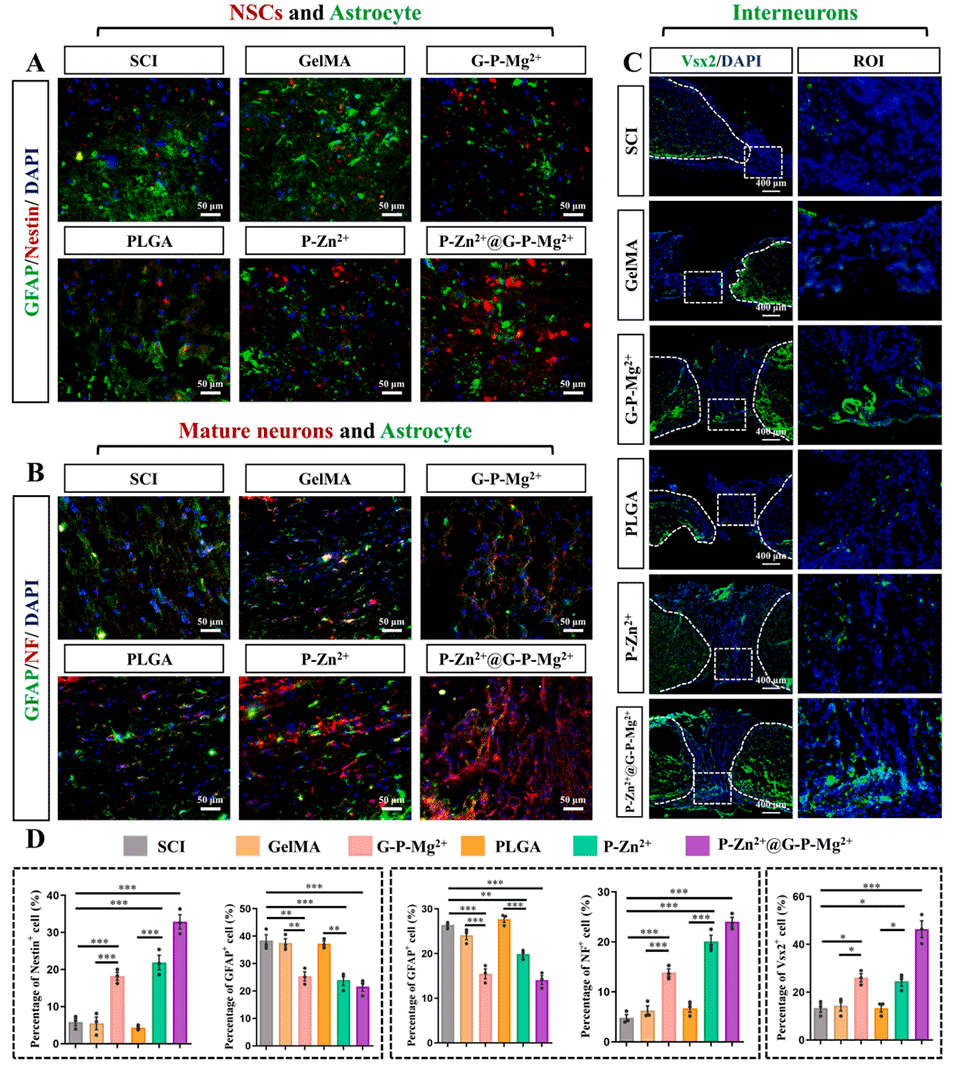
图9 P-Zn²⁺@G-P-Mg²⁺微球在体内促进神经干细胞、成熟神经元及中间神经元的生长
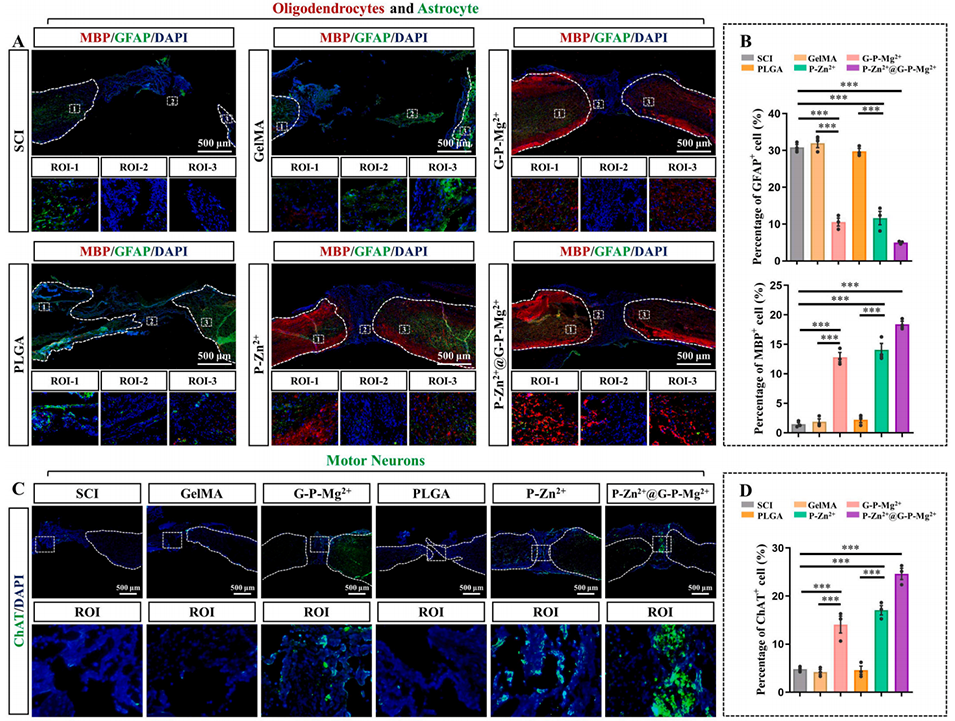
图10 P-Zn²⁺@G-P-Mg²⁺微球在体内促进少突胶质细胞和运动神经元的生长
论文链接:https://doi.org/10.1016/j.biomaterials.2025.123253
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














