
导读:
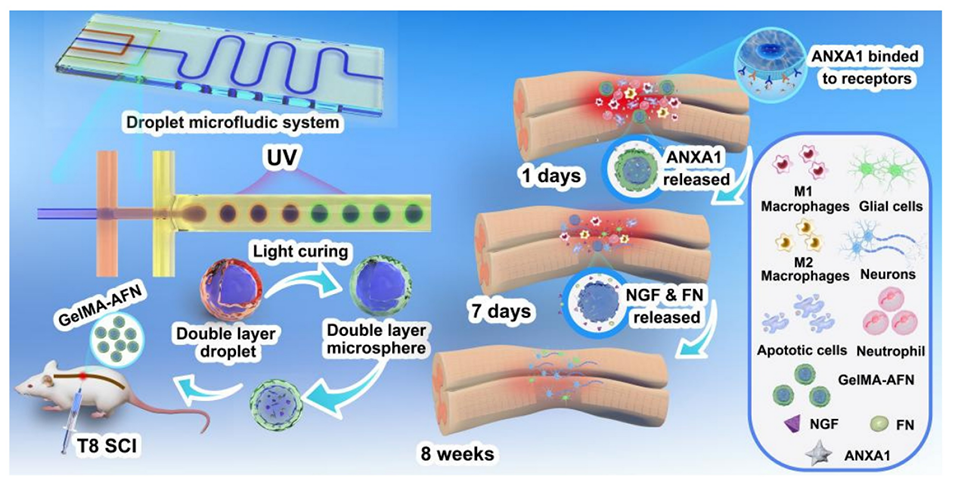
脊髓损伤(SCI)会引发炎症反应和神经元丢失,导致永久性感觉与运动功能障碍,现有疗法难以同时应对损伤不同阶段需求。鉴于此,西安交通大学附属红会医院朱雷、贺宝荣、王志远等人开发了一种仿生核壳结构GelMA微球,可时序释放膜联蛋白A1、神经生长因子与纤连蛋白,实现了早期抗炎与中后期促再生的协同治疗。该微球在大鼠SCI模型中显著抑制炎症、促进轴突再生与髓鞘修复,并改善了运动功能恢复。相关研究以“Biomimetic core-shell GelMA microspheres co-delivering ANXA1, NGF, and fibronectin enable phase-matched immunomodulation and neurorepair after spinal cord injury”为题目,发表于期刊《Theranostics》。
本文要点:
1、本研究通过紫外交联微流控芯片制备了具有双层结构的GelMA-AFN仿生微球(直径约50 μm):外层含低浓度GelMA与膜联蛋白A1(ANXA1),可持续释放7天以抑制早期炎症;内层含高浓度GelMA、纳米粘土、纤连蛋白(FN)和神经生长因子(NGF),可释放超过6周以支持神经修复。
2、体外实验表明,该微球可抑制神经元凋亡、促进轴突生长并增强氧化应激下的细胞存活。
3、在大鼠SCI模型中,GelMA-AFN能减少早期中性粒细胞浸润、促进巨噬细胞向M2型极化,8周后显著促进轴突延伸、髓鞘再生、有益ECM沉积,并减少胶质瘢痕形成,从而改善神经电信号传导与运动功能。
4、转录组分析证实其上调抗炎与轴突生长相关基因,下调促炎基因。结果表明,GelMA-AFN通过时空匹配的递送策略,为SCI提供了一种有前景的治疗方法。
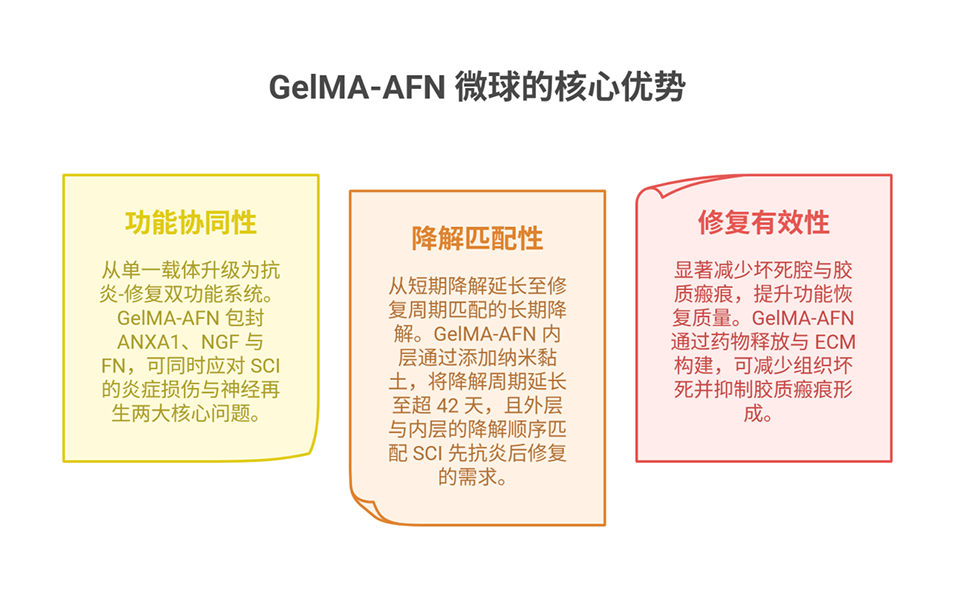
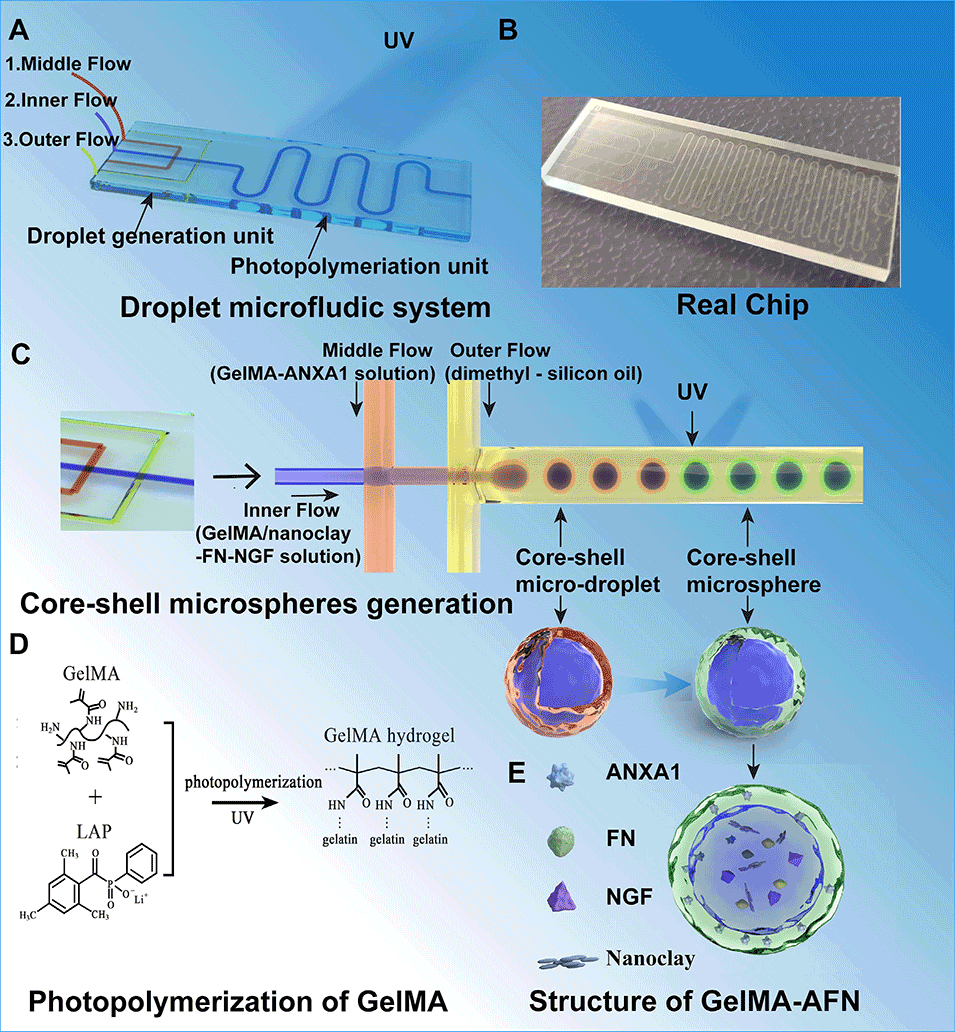
图1:本示意图展示了微流控芯片的结构及双层微球GelMA-AFN的制备过程。
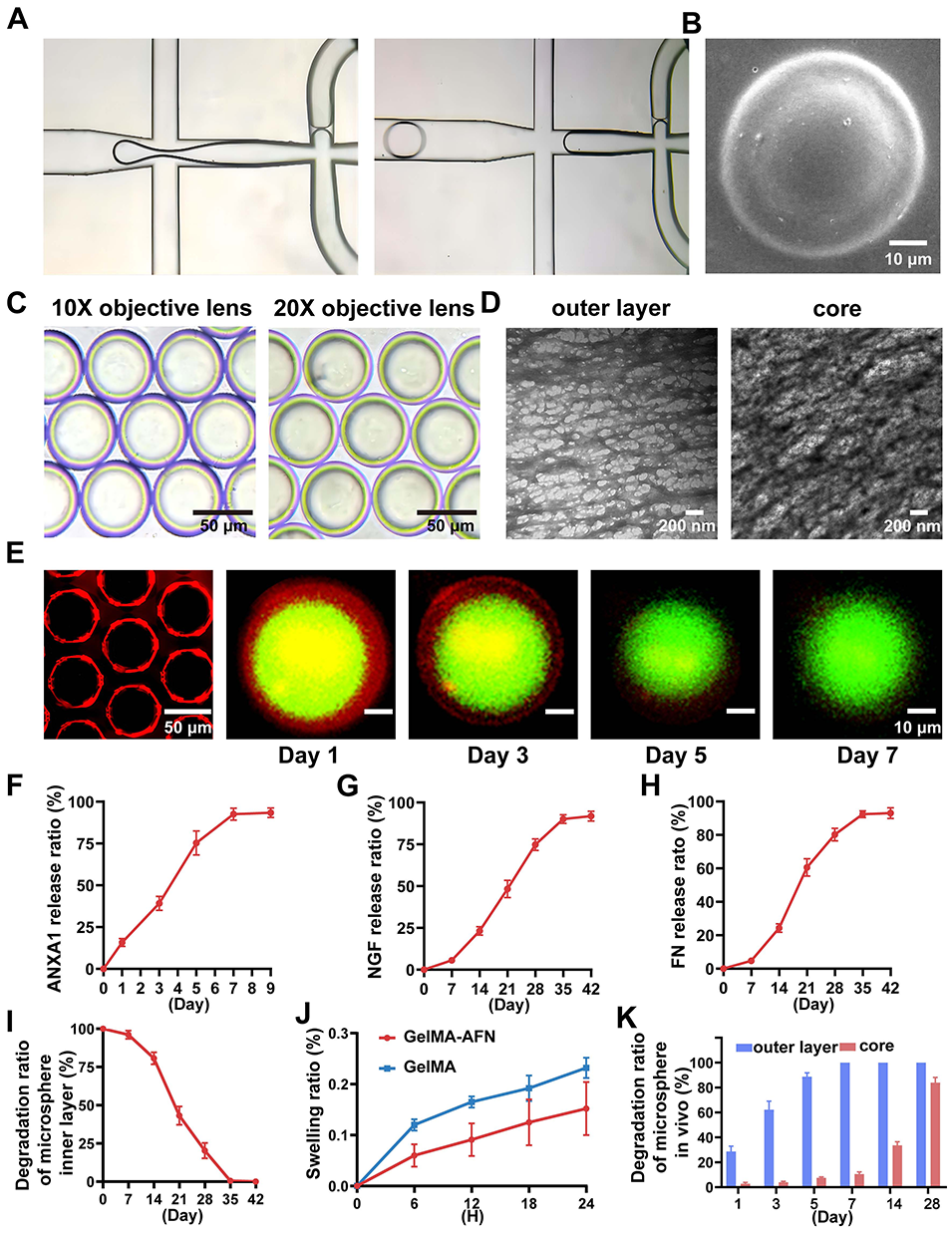
图2:GelMA-AFN的制备与表征。
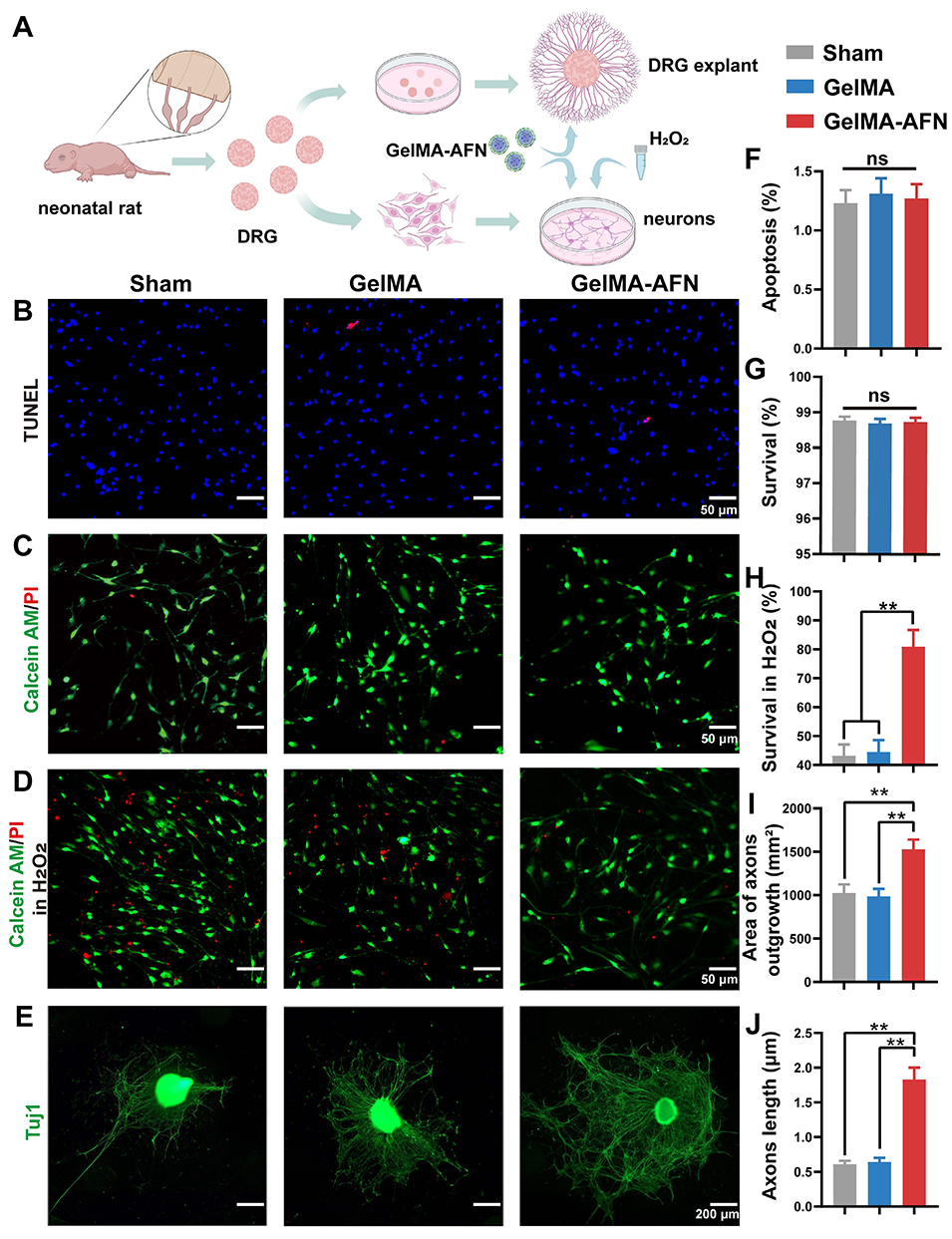
图3:GelMA-AFN的细胞毒性检测结果——体外过氧化氢环境下,GelMA-AFN可减少神经元死亡,并促进背根神经节外植体的轴突生长。
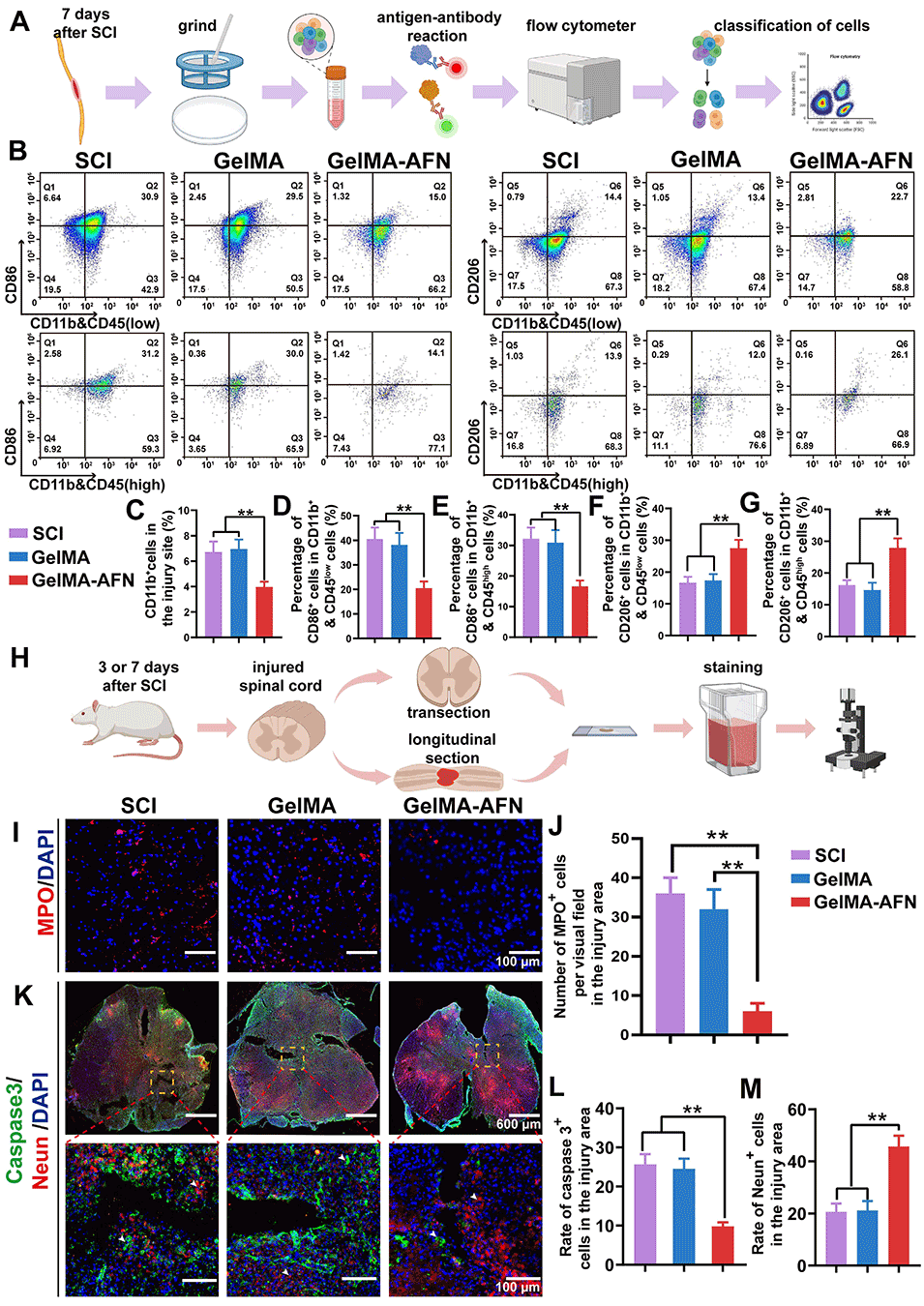
图4:体内实验显示,GelMA-AFN通过减轻早期炎症和抑制细胞凋亡,促进细胞存活。
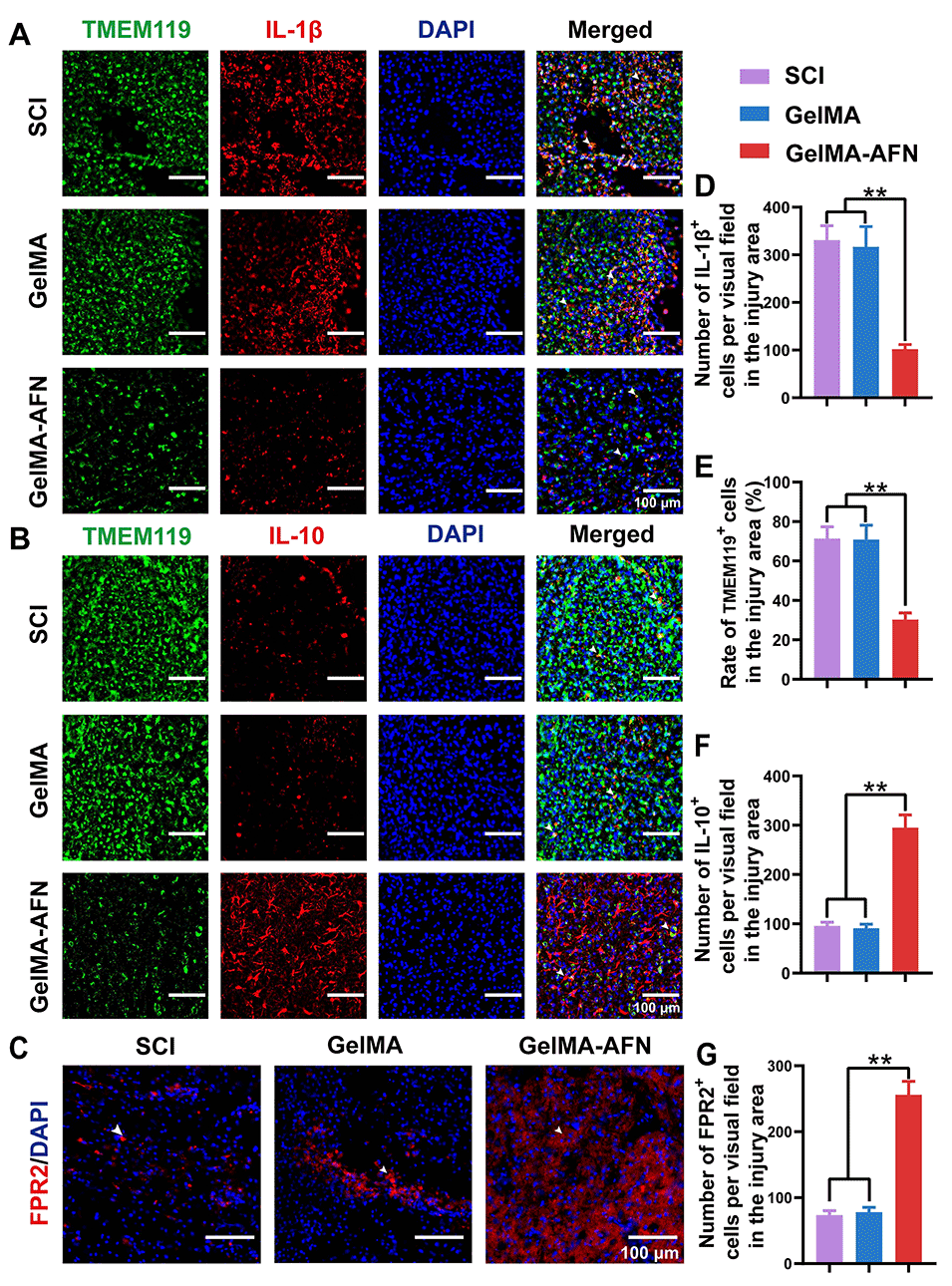
图5:GelMA-AFN可激活FPR2受体,并调节细胞因子水平。
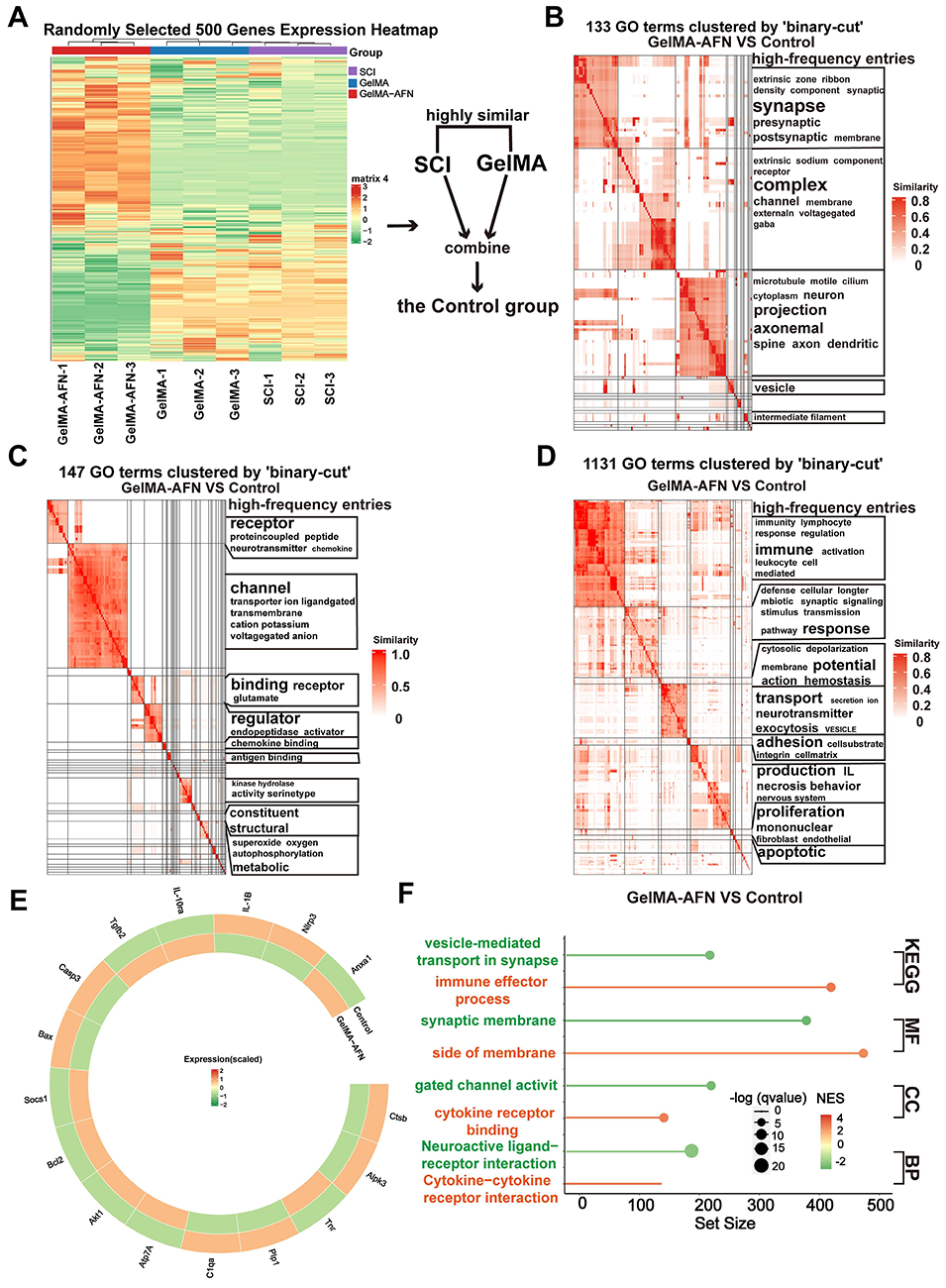
图6:脊髓损伤后7天,GelMA-AFN诱导脊髓组织产生的基因表达变化。
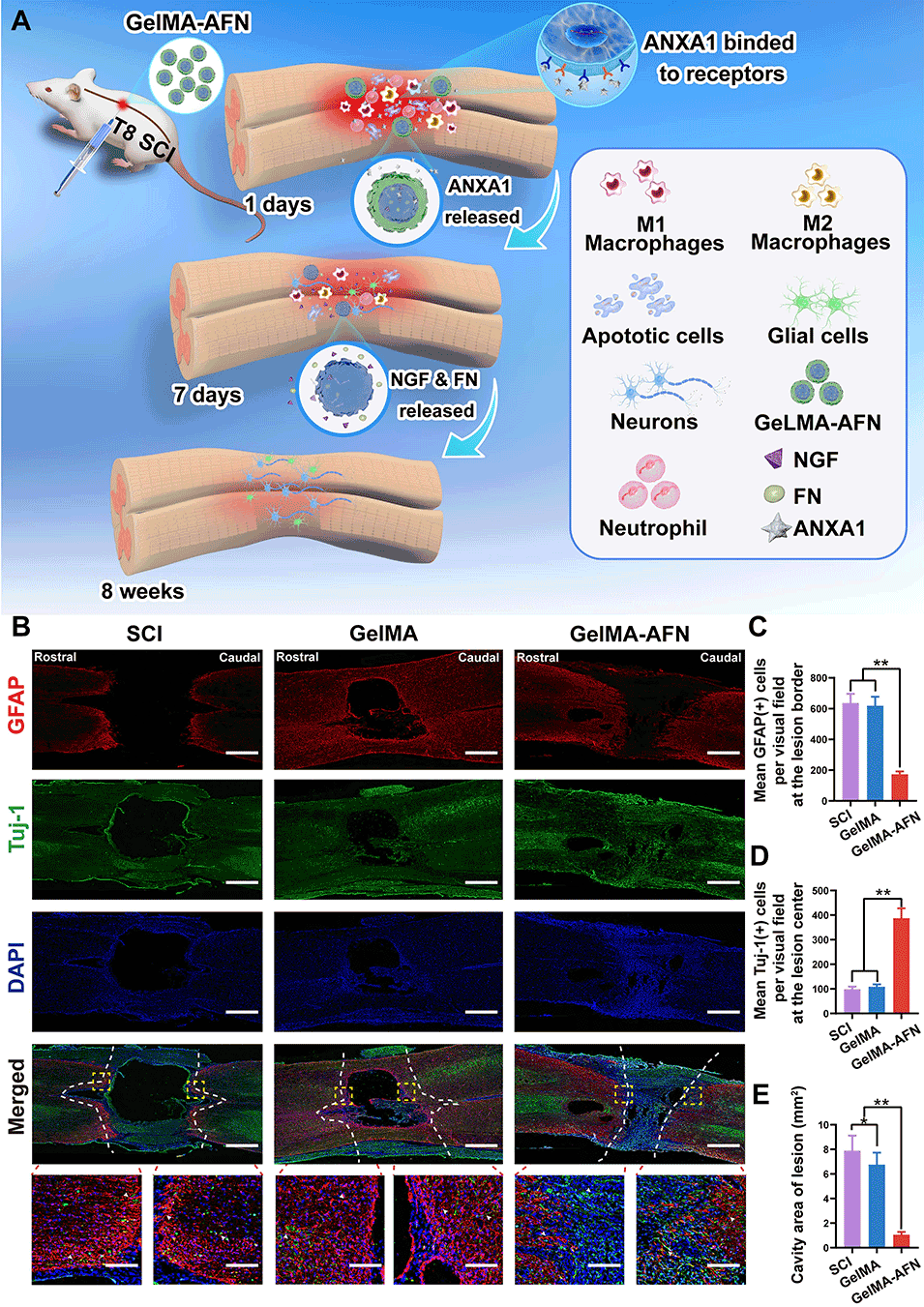
图7:GelMA-AFN的生物学作用机制,及其在体内促进神经轴突再生同时减少反应性星形胶质细胞增生的效果。
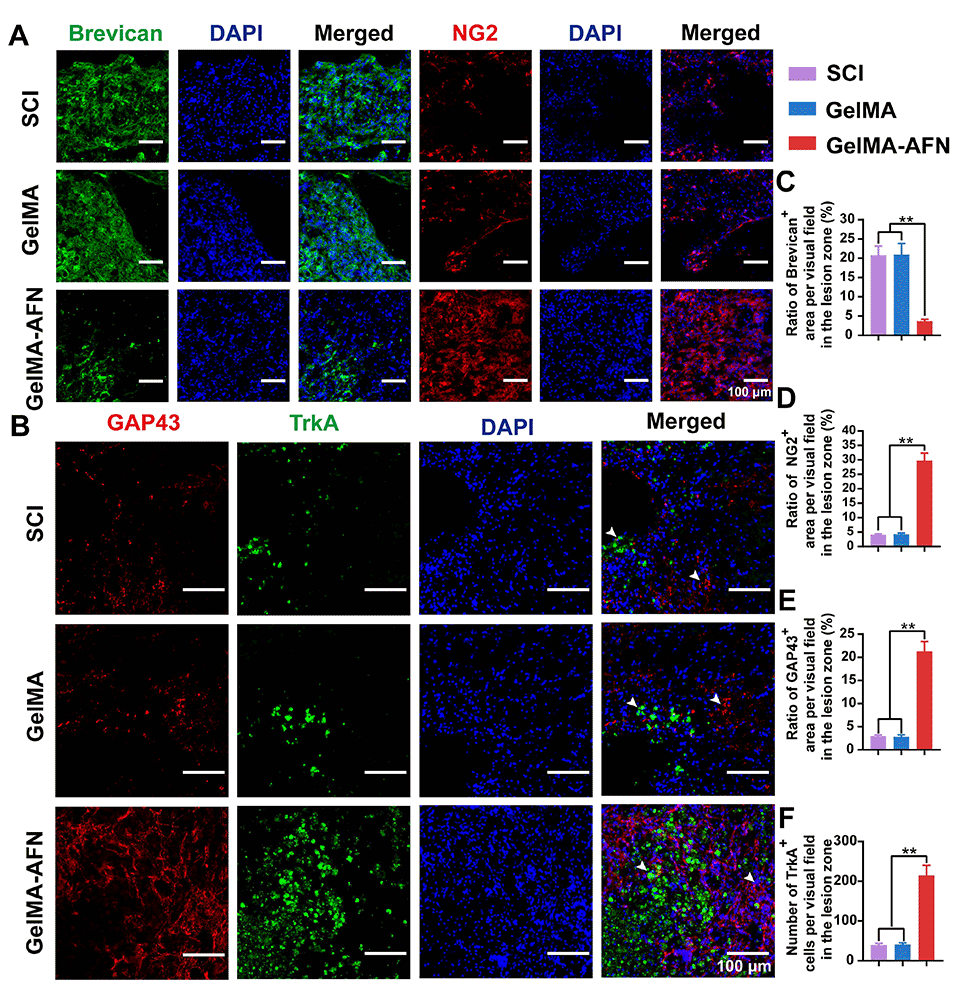
图8:体内实验显示,GelMA-AFN可调控硫酸软骨素蛋白多糖成分,并激活TrkA受体。
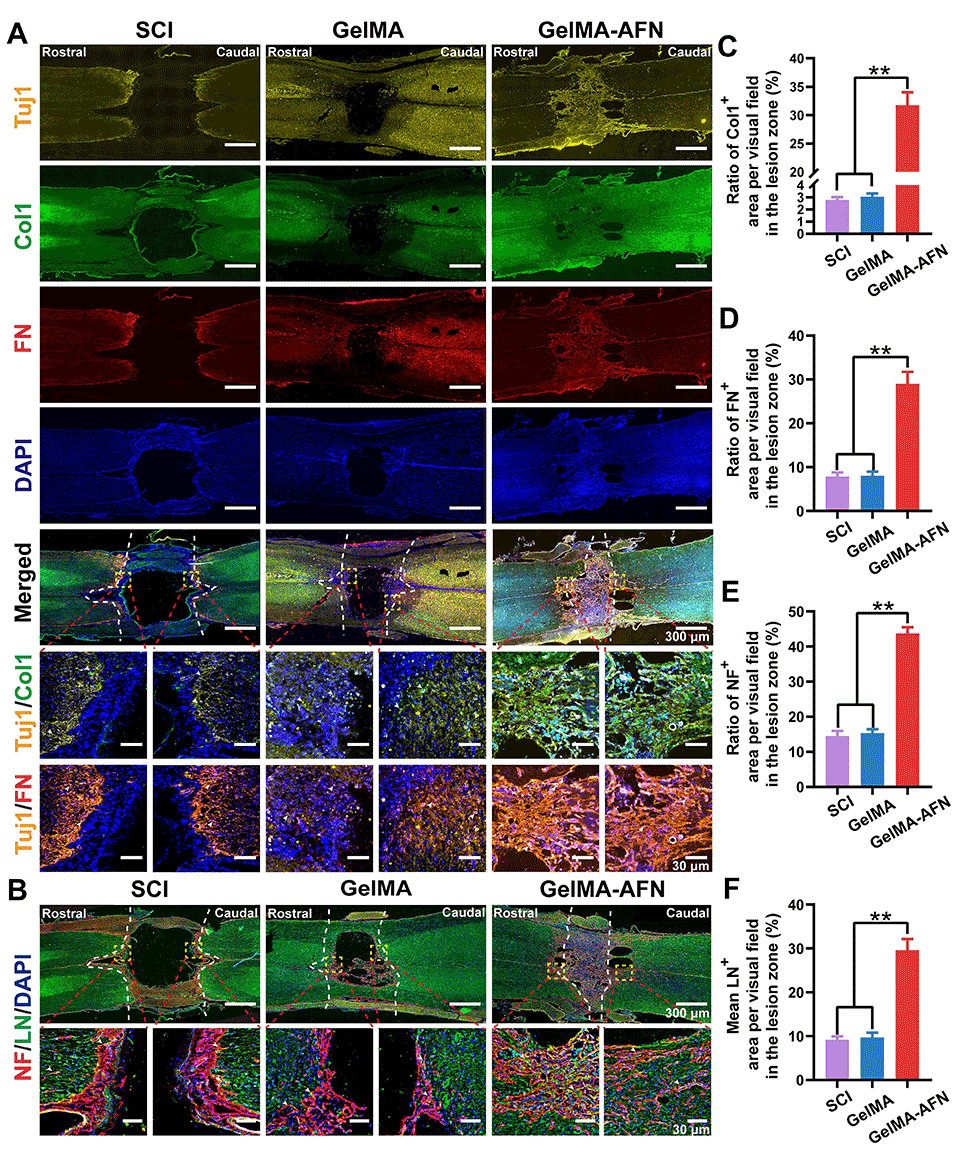
图9:脊髓损伤后8周,GelMA-AFN可增加神经基质含量,并促进神经纤维再生。
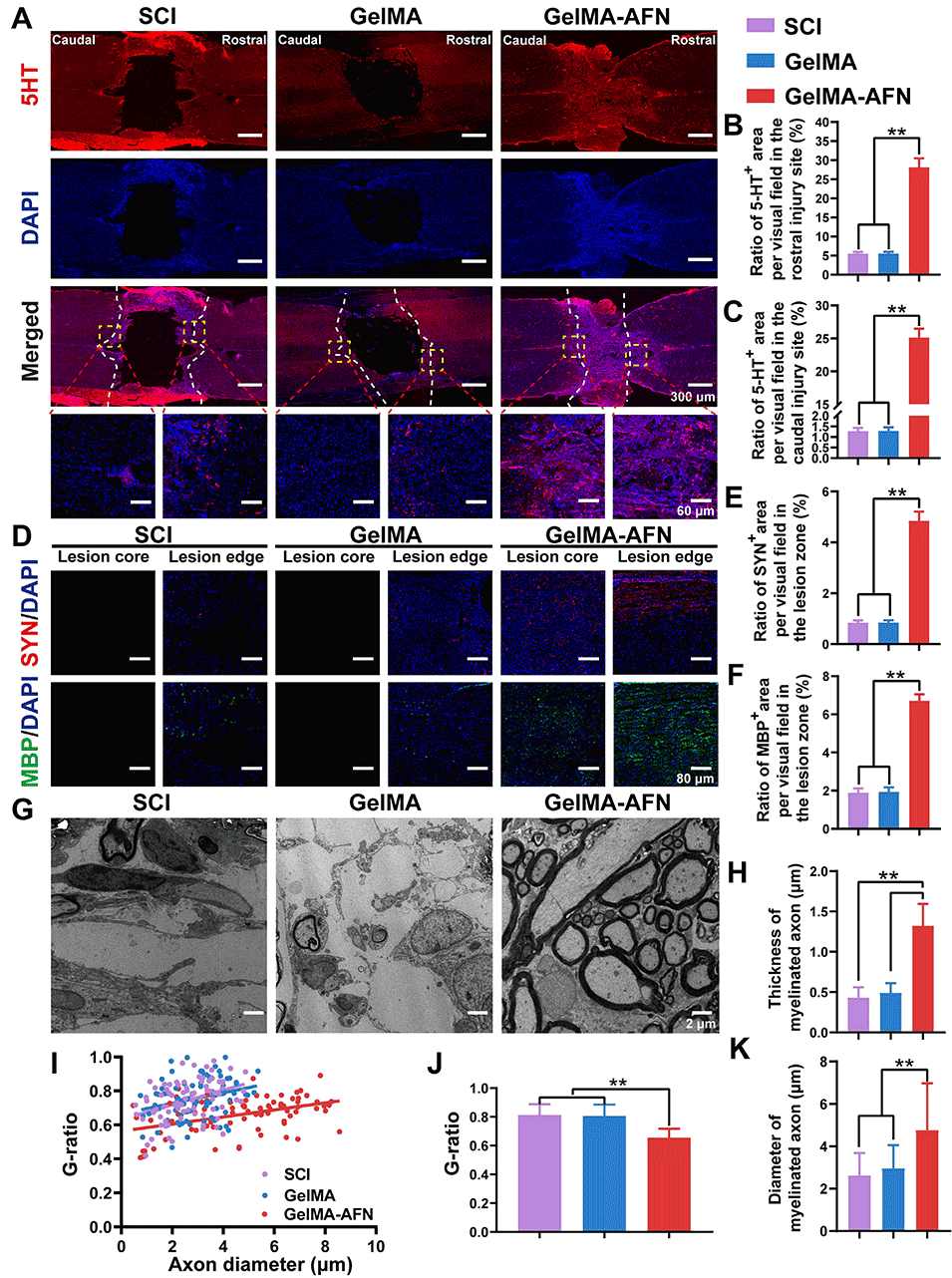
图10:脊髓损伤后8周,移植GelMA-AFN可激活损伤区域的功能性神经元、促进轴突再髓鞘化及突触形成。
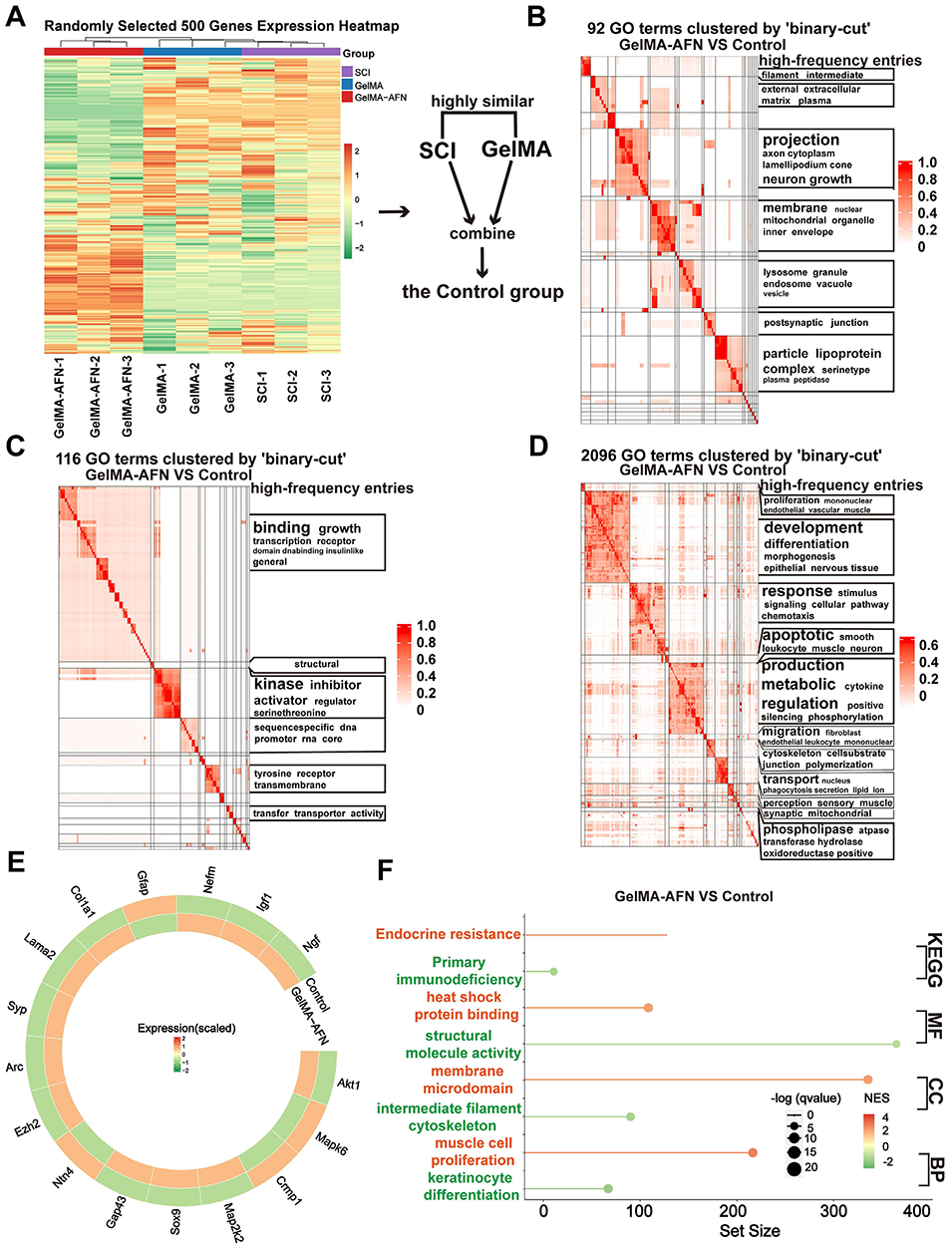
图11:脊髓损伤后8周,GelMA-AFN诱导脊髓组织产生的基因表达变化。
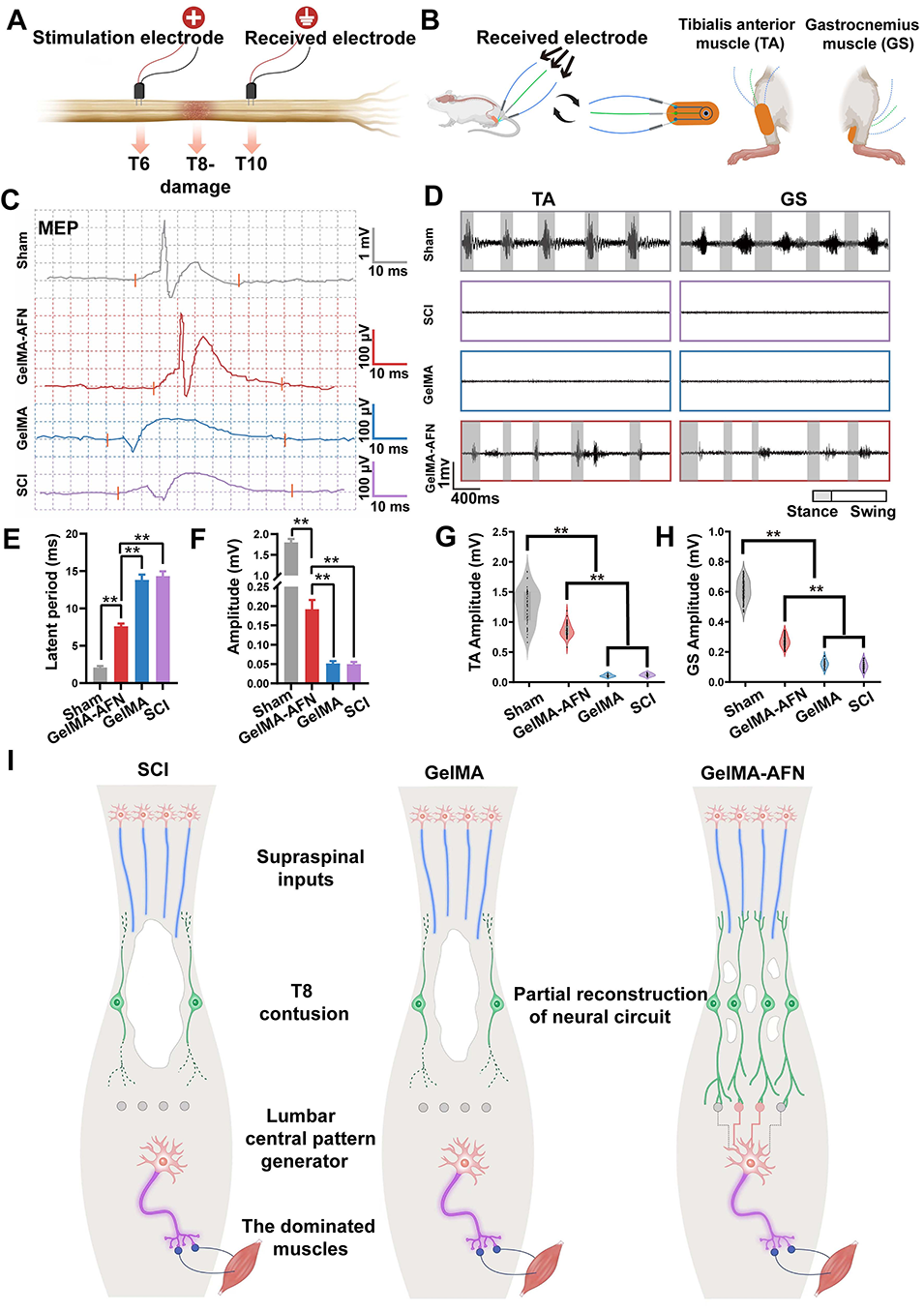
图12:脊髓损伤后8周,移植GelMA-AFN后大鼠的电生理与肌电图改善情况。
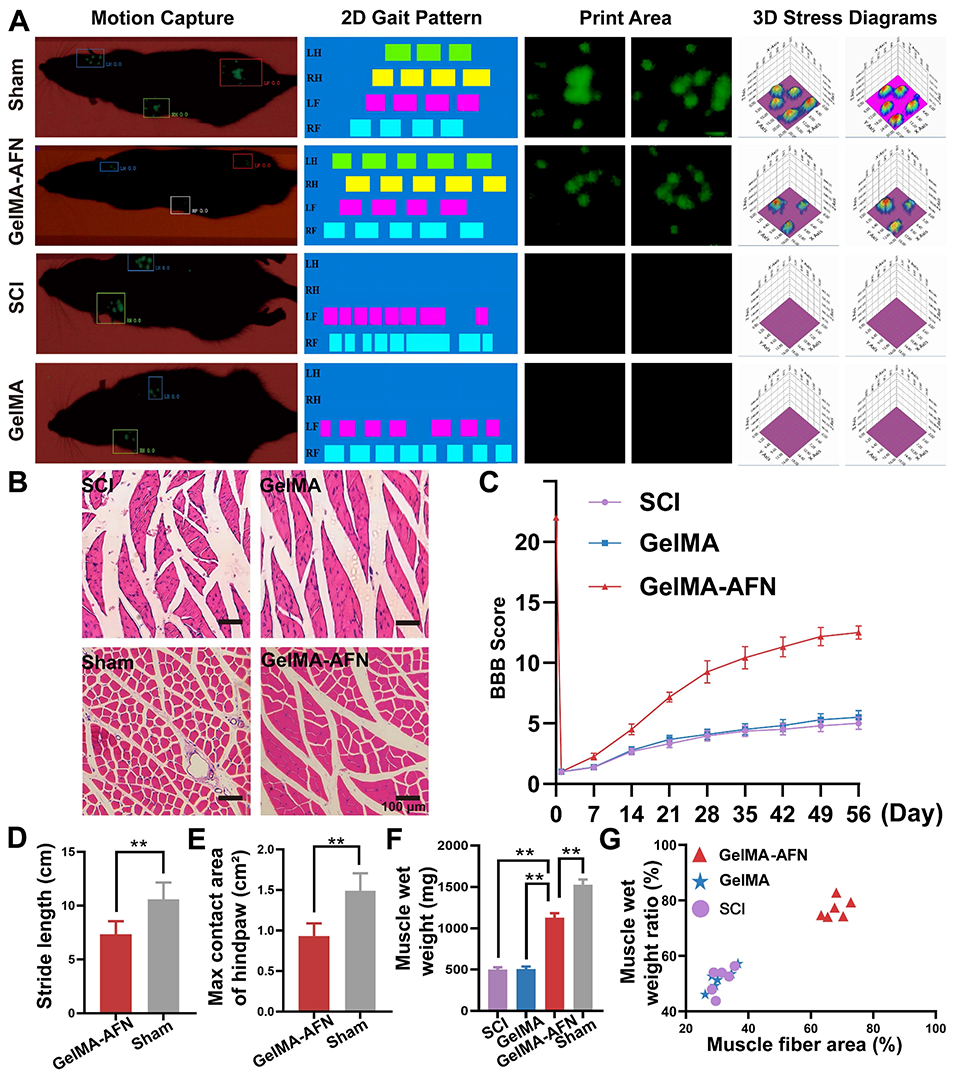
图13:脊髓损伤后8周,GelMA-AFN可改善大鼠运动功能,并减轻骨骼肌萎缩。
论文链接:https://www.thno.org/v16p0483.htm
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














