
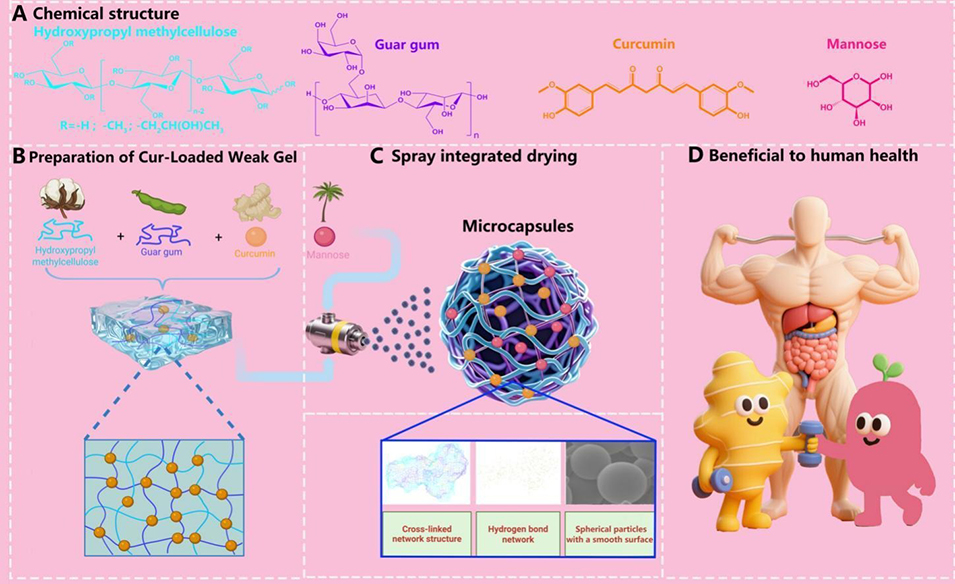
导读:
多糖基递送系统在提升功能性食品中生物活性化合物的生物利用度方面具有显著潜力。近期,天津科技大学生物工程学院李明媛副教授团队以疏水性姜黄素和亲水性甘露糖为模型生物活性物质,通过喷雾干燥技术开发出新型羟丙基甲基纤维素-瓜尔胶微胶囊(CM-HPMC@GG MPs),实现了两种物质的同步肠道靶向释放,同时显著提升了姜黄素的热稳定性与二者的封装效率。相关研究以“HPMC-GG microcapsules for co-delivery of mannose and curcumin: enhanced intestinal targeting in functional foods”为题目,发表在期刊《Food Chemistry》上。
本文要点:
1、本研究开发了基于羟丙基甲基纤维素(HPMC)与瓜尔胶(GG)的微胶囊系统,用于共同递送亲水性甘露糖和疏水性姜黄素。
2、通过喷雾干燥技术制备CM-HPMC@GG微胶囊,HPMC-GG基质形成稳定的三维氢键网络,实现了对两种化合物的无定形封装。
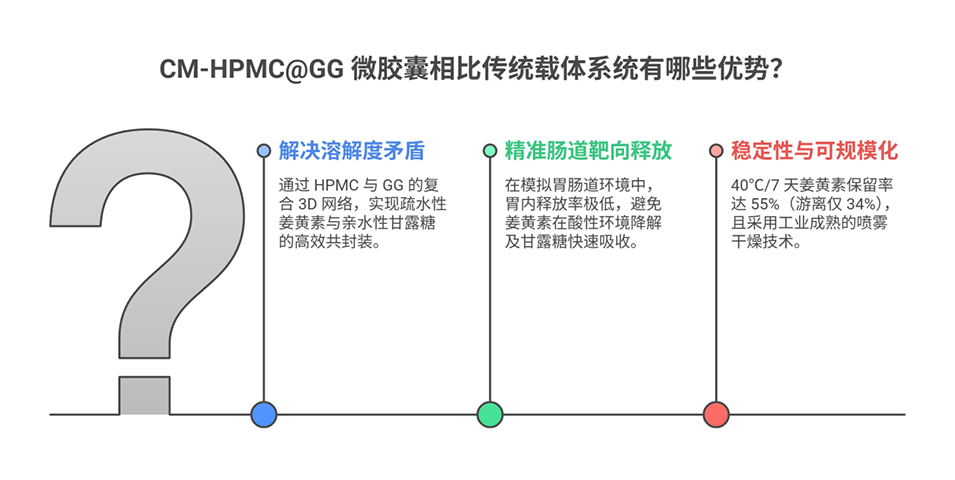
3、优化后的CM-HPMC@GG-1:2微胶囊具有高封装效率(甘露糖84.2%,姜黄素81.9%),并在模拟胃肠液中实现pH响应释放:胃液中释放低(甘露糖<40%,姜黄素<12%),肠液中持续释放(甘露糖66.4%,姜黄素86.6%)。
4、该体系显著提升了姜黄素的热稳定性(40°C储存7天后保留55%,高于游离姜黄素的34%)。
5、分子动力学模拟表明GG主导的氢键与范德华力是稳定与控释的关键机制。本研究为功能性食品中不同溶解度活性成分的共递送提供了可行、可扩展的载体平台。
制备过程关键控制要点
1、温度控制:凝胶制备阶段需精准控制 60℃,确保 HPMC 充分形成凝胶网络且 GG 羟基不被破坏;喷雾干燥进风温度 125℃、出风温度 60-70℃,避免温度过高导致生物活性物质(尤其是姜黄素)降解,或温度过低导致干燥不充分。
2、进料速率与比例:内(甘露糖溶液)、外(凝胶)通道流速严格控制为 1:2,保证芯材(生物活性物质)与壁材(HPMC-GG)比例稳定,提升微胶囊批次一致性。
3、避光操作:姜黄素对光敏感,整个制备过程(尤其是姜黄素溶液配置、滴加、凝胶制备)需在避光条件下进行,防止其光降解影响后续性能测试。
4、真空除乙醇:共载微胶囊制备中,真空辅助自组装需彻底去除乙醇,避免残留乙醇在喷雾干燥时挥发导致微胶囊出现孔隙,影响封装效率与控释性能。
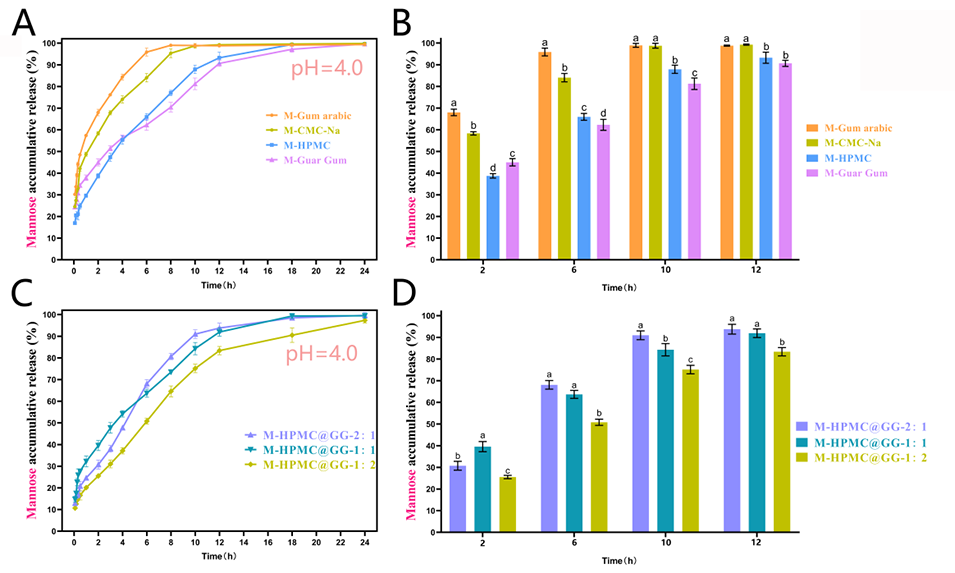
图1:模拟餐后胃部环境(pH 4.0,添加胃蛋白酶)下,不同单一材料中甘露糖的体外累积释放曲线(A, B);模拟餐后胃部环境(pH 4.0,添加胃蛋白酶)下,不同 HPMC:GG 比例的 M-HPMC@GG MPs 中甘露糖的体外累积释放曲线(C, D)。
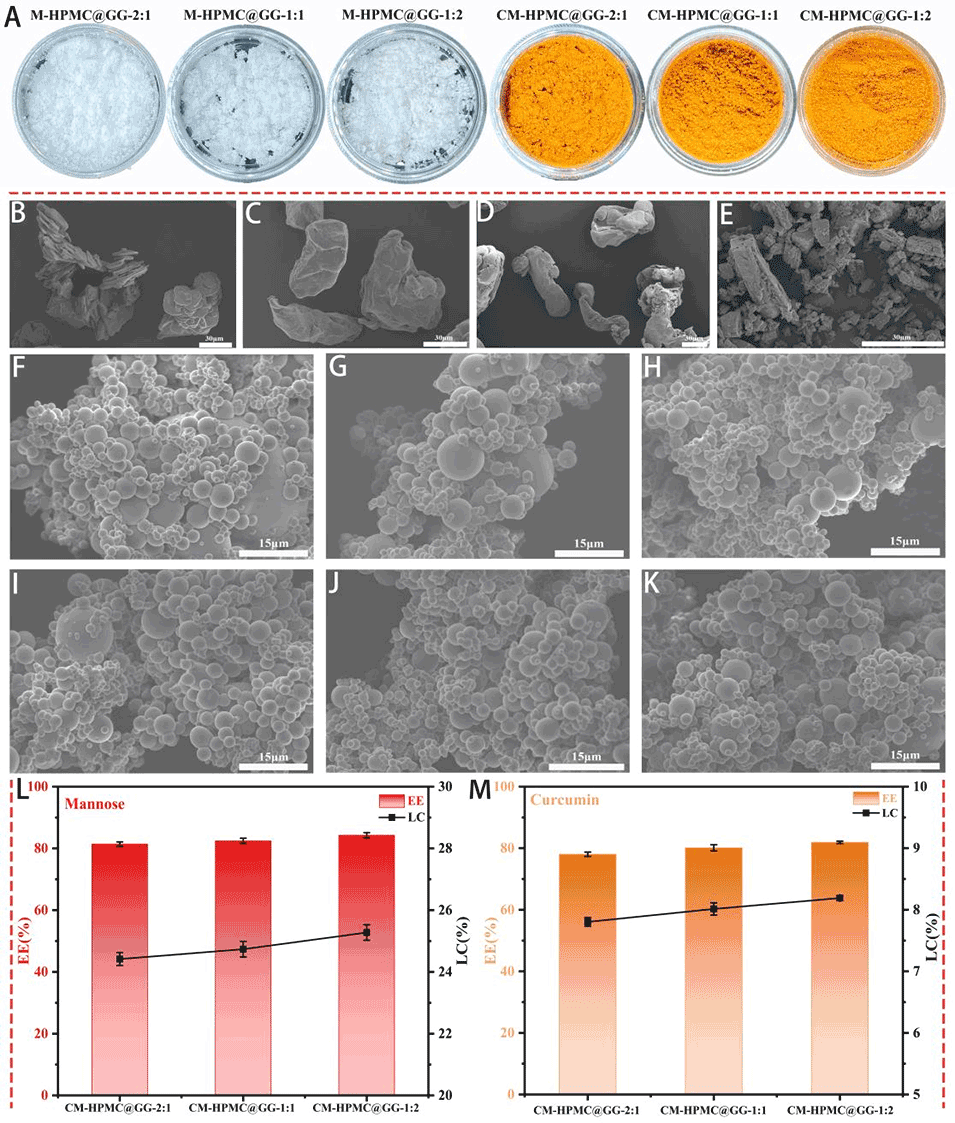
图2:M-HPMC@GG-2:1、M-HPMC@GG-1:1、M-HPMC@GG-1:2、CM-HPMC@GG-2:1、CM-HPMC@GG-1:1 及 CM-HPMC@GG-1:2 MPs 的外观图(A)。通过 SEM 观察到的甘露糖(B)、GG(C)、HPMC(D)、姜黄素(E)、M-HPMC@GG-2:1(F)、M-HPMC@GG-1:1(G)、M-HPMC@GG-1:2(H)、CM-HPMC@GG-2:1(I)、CM-HPMC@GG-1:1(J)及 CM-HPMC@GG-1:2(K)的微观结构。不同比例 CM-HPMC@GG MPs 中甘露糖的包封率(EE)和载药量(LC)如图(L)所示;不同比例 CM-HPMC@GG MPs 中姜黄素的包封率(EE)和载药量(LC)如图(M)所示。比例尺:B-E 为 30 μm,F-K 为 15 μm。
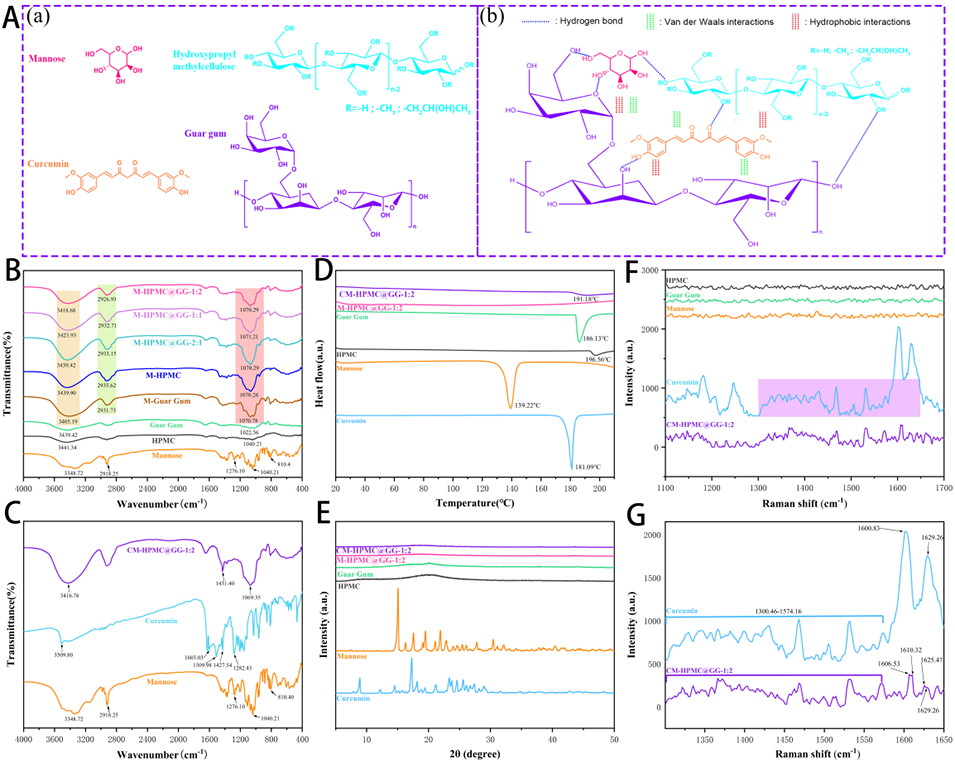
图3:微胶囊中各组分的相互作用(A)(a, b)。M-HPMC@GG-1:2 MP、CM-HPMC@GG-1:2 MP 及其单一组分的傅里叶变换红外(FTIR)光谱(B, C)。姜黄素、甘露糖、HPMC、GG、M-HPMC@GG-1:2 及 CM-HPMC@GG-1:2 MP 的差示扫描量热(DSC)曲线(D)和 X 射线衍射(XRD)图谱(E)。姜黄素、甘露糖、HPMC、GG、CM-HPMC@GG-1:2 MP 的拉曼光谱(F, G)。
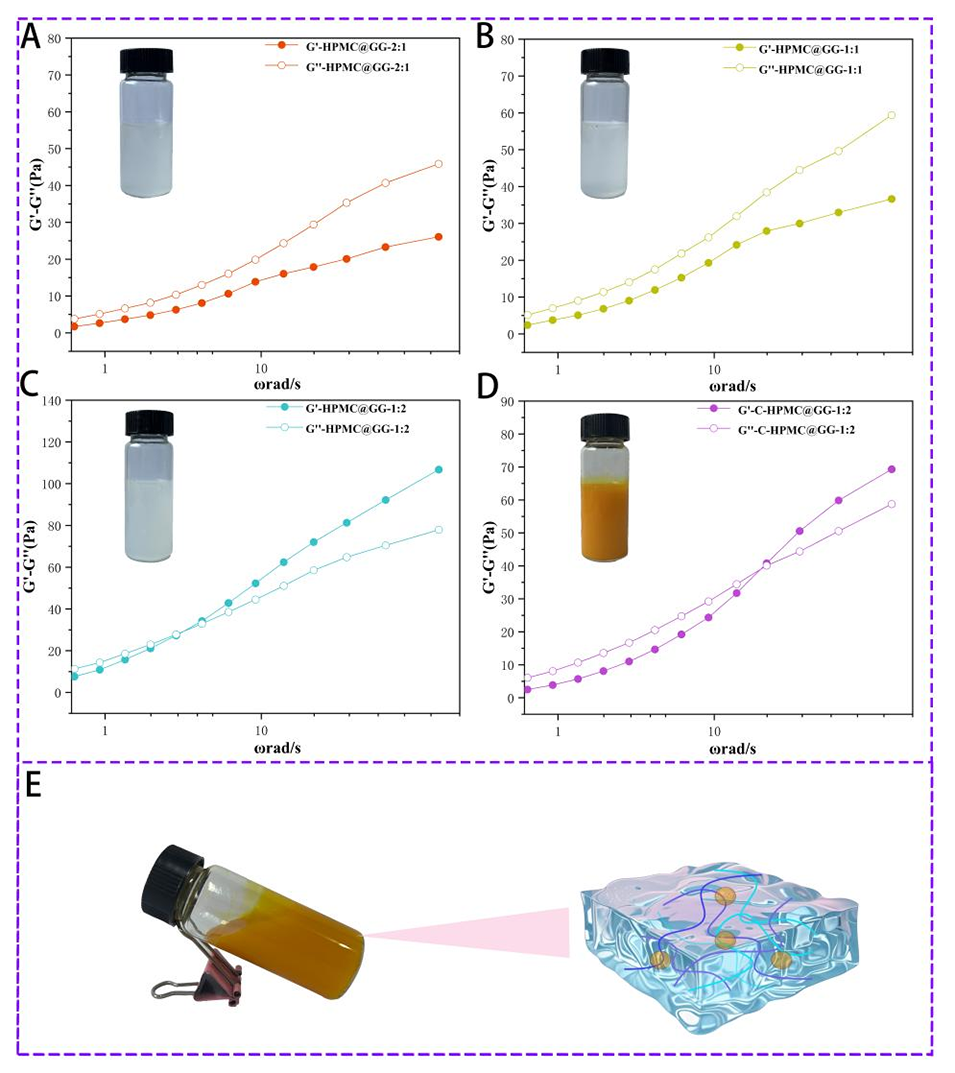
图 4:HPMC@GG-2:1(A)、HPMC@GG-1:1(B)、HPMC@GG-1:2(C)、C-HPMC@GG-1:2(D)在频率扫描中,储能模量 G'(实心圆)和损耗模量 G''(空心圆)随角频率的变化曲线。C-HPMC@GG-1:2 的外观图(E)。
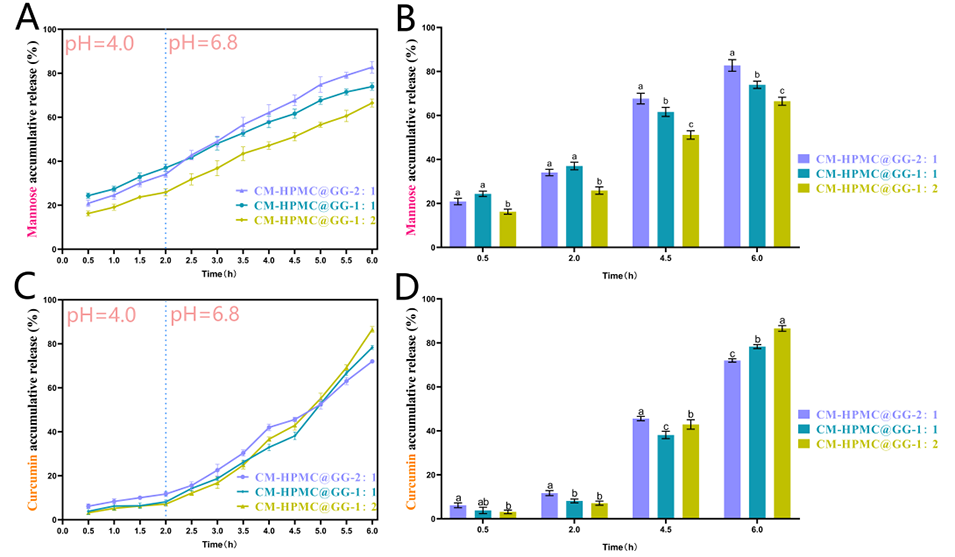
图 5:在序贯模拟胃肠道环境(0-2 h:餐后胃阶段,pH 4.0,添加胃蛋白酶;2-6 h:小肠阶段,pH 6.8,添加胰蛋白酶)下,不同 HPMC:GG 比例的 CM-HPMC@GG MPs 中甘露糖(A, B)和姜黄素(C, D)的体外累积释放曲线。所有实验均通过体外消化进行,各阶段消化后样品中的生物活性物质释放量均经过定量分析。
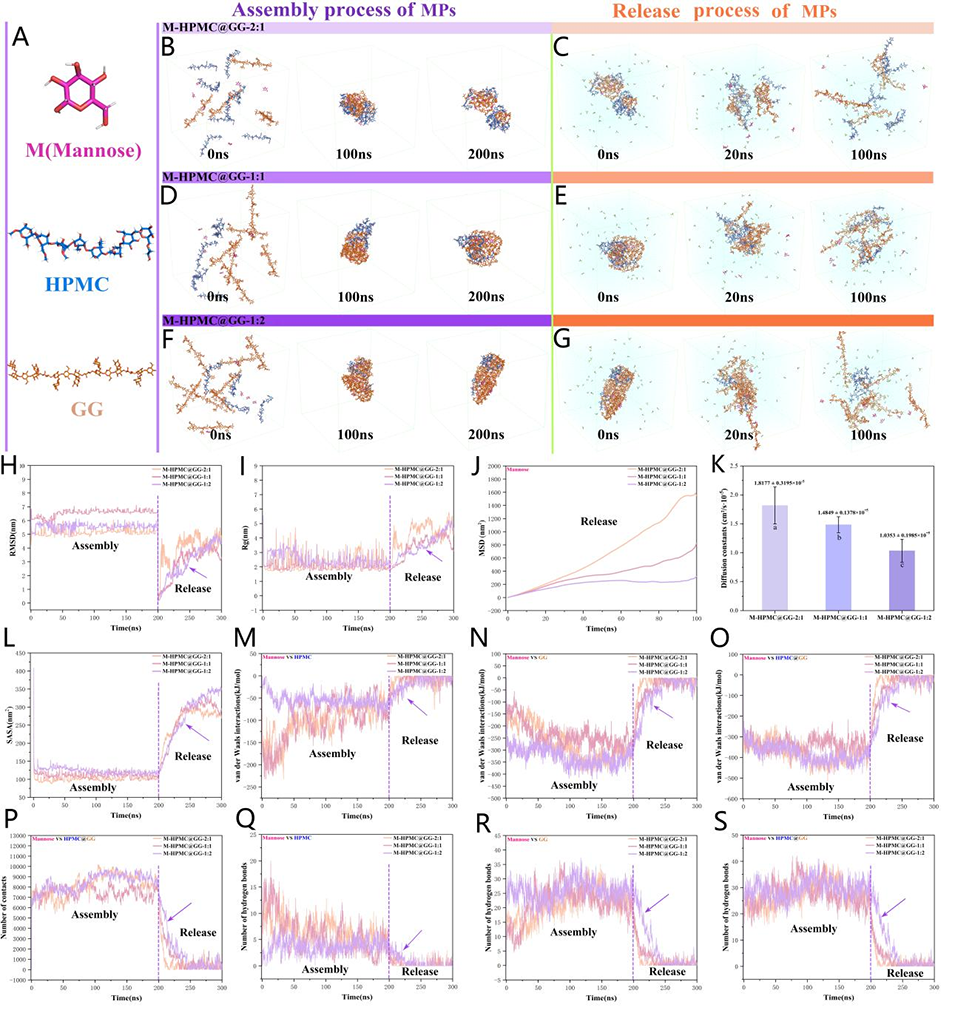
图 6:甘露糖、HPMC 和 GG 的原子分子模型(A)。MPs 的组装与释放过程:CM-HPMC@GG-2:1(B, C)、CM-HPMC@GG-1:1(D, E)、CM-HPMC@GG-1:2(F, G)。MPs 自组装及释放过程中的根均方偏差(RMSD)变化(H)。MPs 自组装及释放过程中的回转半径(Rg)变化(I)。甘露糖的均方位移(MSD)(J)。甘露糖的扩散系数(K)。溶剂可及表面积(SASA)的变化(L)。自组装及释放过程中的范德华(vdW)相互作用:甘露糖与 HPMC(M)、甘露糖与 GG(N)、甘露糖与 HPMC@GG(O)。甘露糖与 HPMC@GG 的接触次数(P)。氢键数量:甘露糖与 HPMC(Q)、甘露糖与 GG(R)、甘露糖与 HPMC@GG(S)。
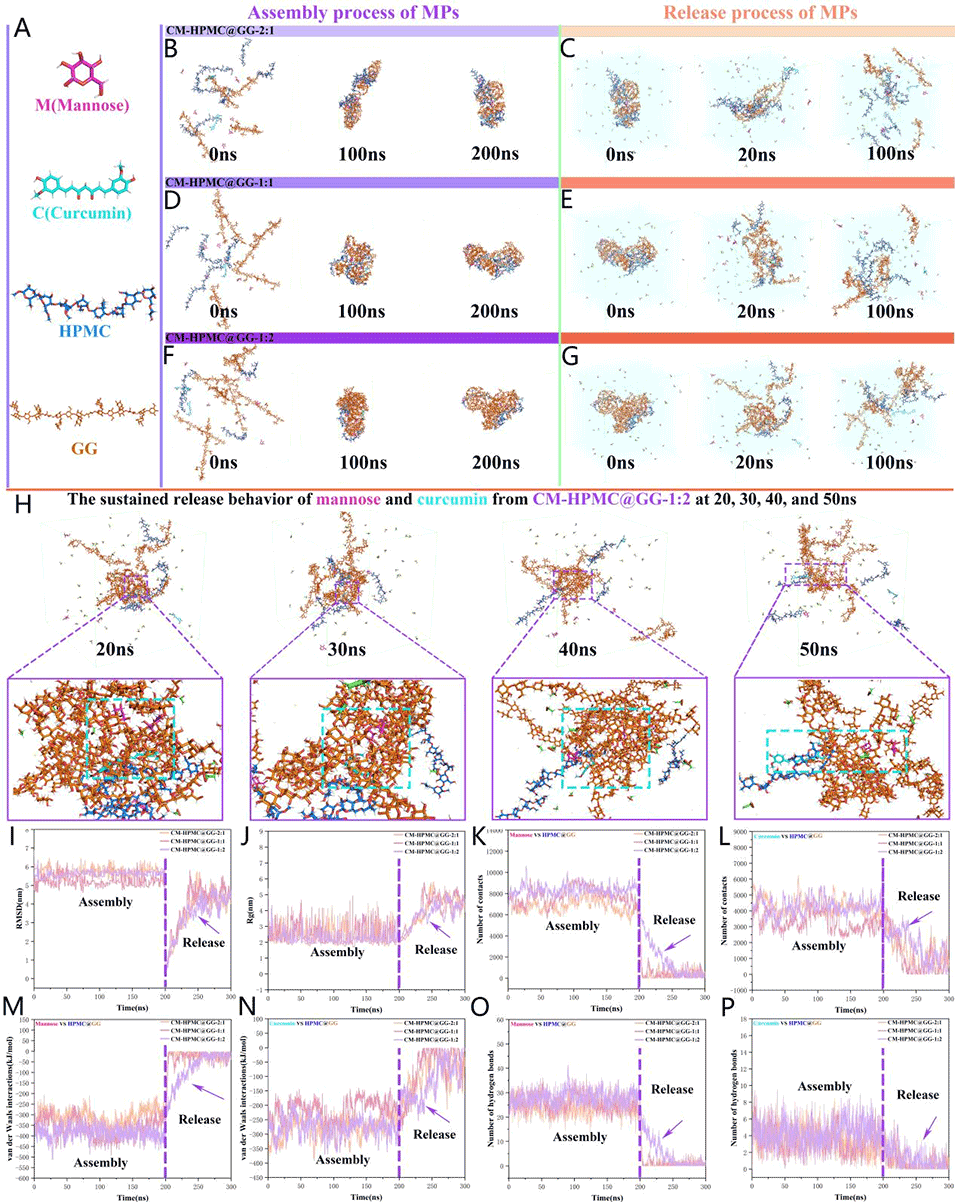
图 7:甘露糖、HPMC 和 GG 的原子分子模型(A)。MPs 的组装与释放过程:CM-HPMC@GG-2:1(B, C)、CM-HPMC@GG-1:1(D, E)、CM-HPMC@GG-1:2(F, G)。50 ns 内,20 ns、30 ns、40 ns 和 50 ns 时 CM-HPMC@GG-1:2 中甘露糖和姜黄素的缓释行为(H)。MPs 自组装及释放过程中的 RMSD 变化(I)。MPs 自组装及释放过程中的 Rg 变化(J)。接触次数:甘露糖与 HPMC@GG(K)、姜黄素与 HPMC@GG(L)。自组装及释放过程中的范德华(vdW)相互作用:甘露糖与 HPMC@GG(M)、姜黄素与 HPMC@GG(N)。氢键数量:甘露糖与 HPMC@GG(O)、姜黄素与 HPMC@GG(P)。
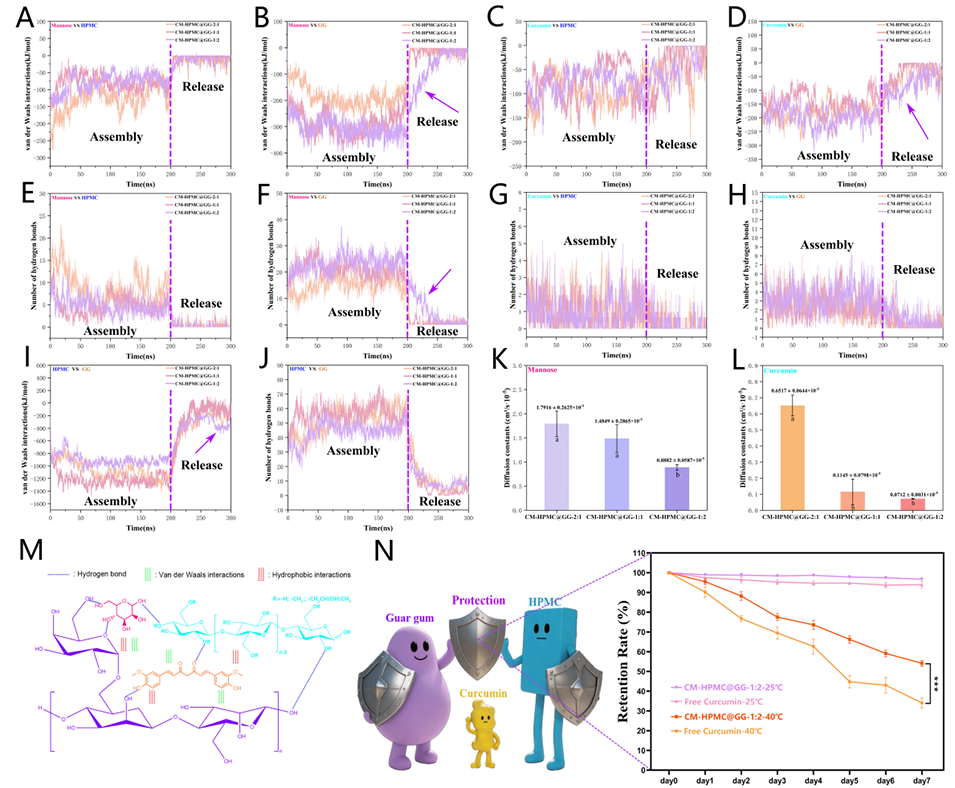
图 8:范德华(vdW)相互作用:甘露糖与 HPMC(A)、甘露糖与 GG(B)、姜黄素与 HPMC(C)、姜黄素与 GG(D)。氢键数量:甘露糖与 HPMC(E)、甘露糖与 GG(F)、姜黄素与 HPMC(G)、姜黄素与 GG(H);HPMC 与 GG 的范德华(vdW)相互作用(I);HPMC 与 GG 的氢键数量(J);甘露糖的扩散系数(K)、姜黄素的扩散系数(L)。多糖 - 生物活性物质的相互作用机制(M);7 天内 40℃和 25℃条件下姜黄素的保留率(N)。
论文链接:https://doi.org/10.1016/j.foodchem.2025.147335
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














