
导读:
近期,意大利都灵理工大学研究人员发表综述,系统梳理了液滴微流控技术(DBM)工程化生物材料的结构设计、制备策略及适配机制。文章详细探讨了如何通过DBM精准构建从纳米颗粒到核壳微胶囊等一系列功能载体,并深入剖析了这些载体在药物递送、单细胞分析和3D组织建模等生物医学领域的应用潜力与当前面临的转化挑战。相关研究成果以“Biomaterials in droplet-based microfluidics: From structural design to biomedical applications”为题目,发表在期刊《Materials Today Advances》上。
本文要点:
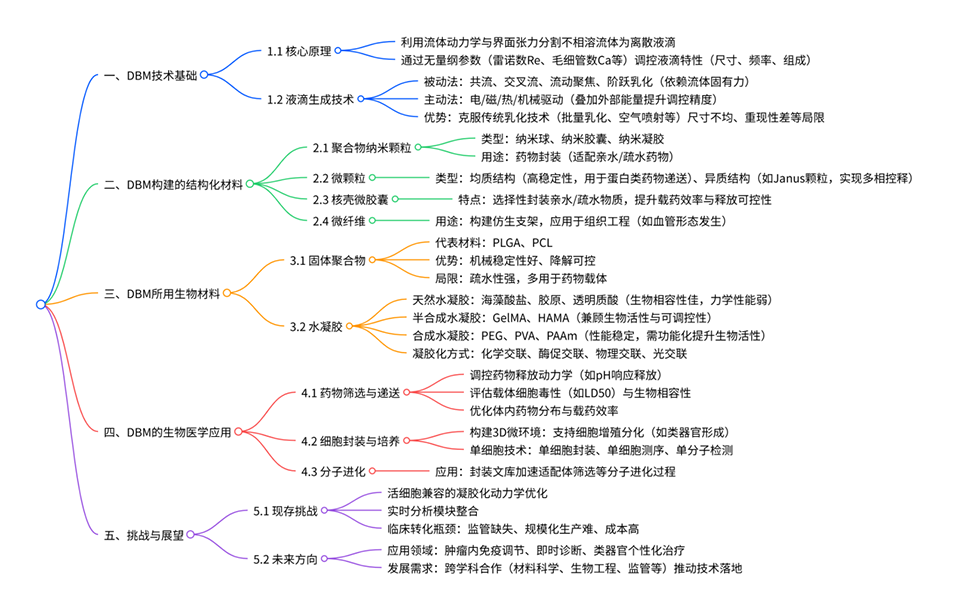
1、本文综述了液滴微流控(DBM)工程化生物材料的结构设计与生物医学应用。
2、首先,文章概述了被动与主动液滴生成技术,以及由此制备的多种微纳结构(如纳米颗粒、微球、核壳微胶囊和微纤维),并阐释了其形态与组成如何调控物质传输、稳定性及释放行为。
3、随后,重点探讨了赋予液滴功能性的关键生物材料,包括天然、半合成及合成水凝胶,以及与其生物活性cargo相容的多种凝胶化方法(如离子、光引发、酶促交联)。
4、在应用方面,着重分析了生物材料选择与交联化学对药物释放动力学、生物相容性和体内分布的影响;同时,也讨论了基于液滴的单细胞封装、3D培养模型及其在生物分析平台中的应用。
5、本文通过阐明从液滴生成技术、材料选择到生物医学性能的完整路径,为设计用于药物递送、组织建模和高通量生物分析的DBM载体与支架提供了系统性指导。
一张图读懂全文
在液滴微流控技术(DBM)中,被动法与主动法液滴生成的核心差异在于驱动力来源与控制精度,具体如下:
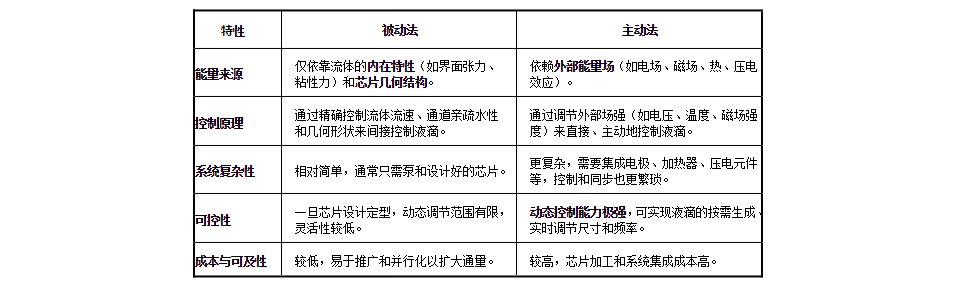
对于活细胞、酶等脆弱生物样本,被动法通常更具优势,是更安全、更普遍的选择。
首先,被动法主要依赖层流与毛细作用力,其产生的流体剪切力通常较低,如同轴流结构能提供对称且渐进的流动,对活细胞等脆弱样本更为友好。
其次,被动法系统封闭,不引入外部能量场,从而避免了电场、热能或化学反应副产物对细胞膜、酶活性等造成的潜在损伤与污染。
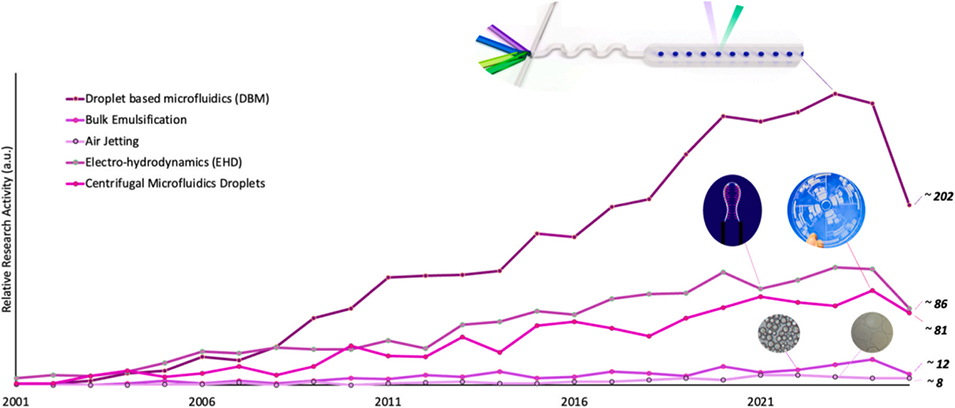
图 1:液滴生成技术的文献发表趋势(2000-2025 年)。该图展示了 PubMed 数据库中收录的、关于批量乳化法、空气喷射法、电流体动力学法(EHD)、离心法以及液滴微流控技术(DBM)的文献数量。与传统方法文献数量相对稳定的情况相比,DBM 相关文献呈现显著增长趋势。图中还包含各技术主要优势与局限性的总结。
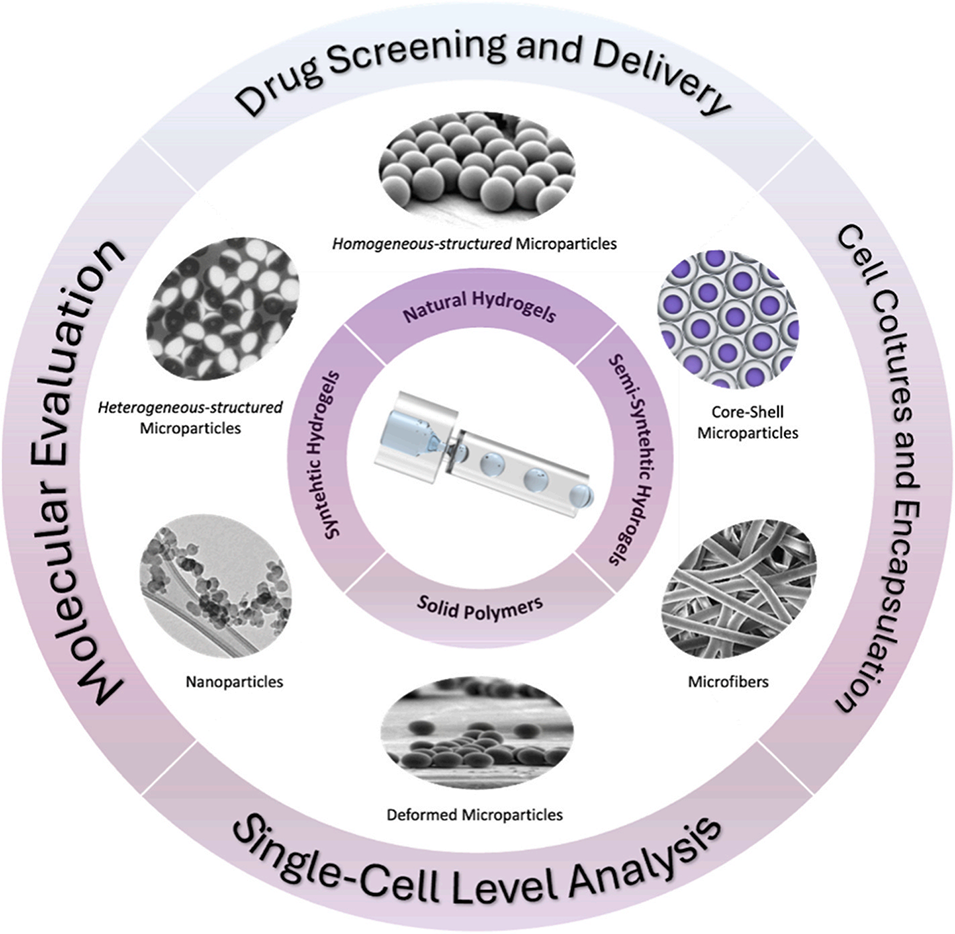
图 2:从中间的液滴微流控器件开始,该图展示了所用生物材料的类型(固体聚合物与水凝胶)、由此形成的颗粒结构及其主要生物医学应用。
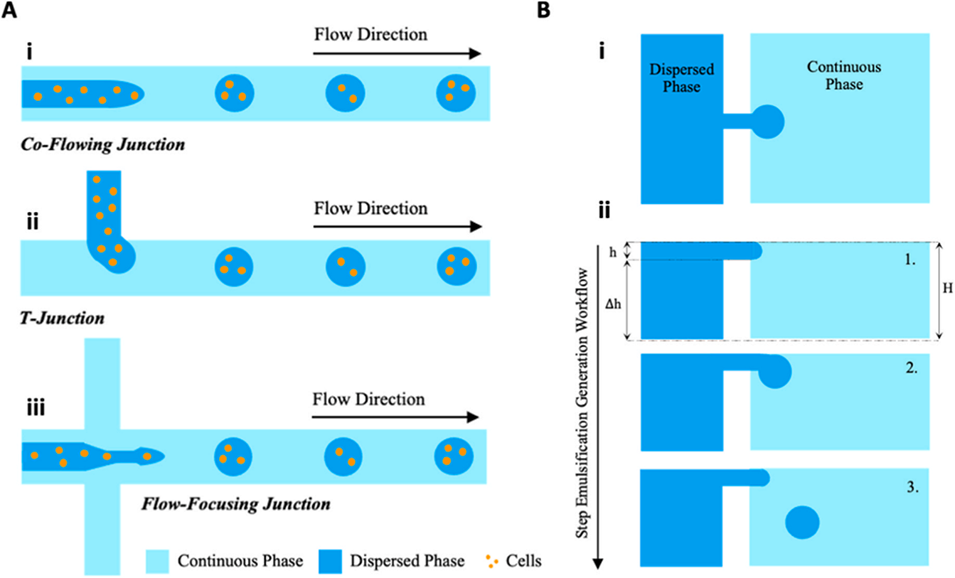
图 3:(A)液滴微流控技术制备载细胞水凝胶微胶囊的示意图。用于细胞封装的微流控器件主要有三种基本类型:(i)同轴型;(ii)T 型结型;(iii)流动聚焦型。(B)阶梯乳化机制的示意图:(i)微流控结构的俯视图,显示分散相通过浅喷嘴流入装有连续相的深储液池;(ii)微流控结构的侧视图,展示两个横向方向上液滴形成的横截面过程。
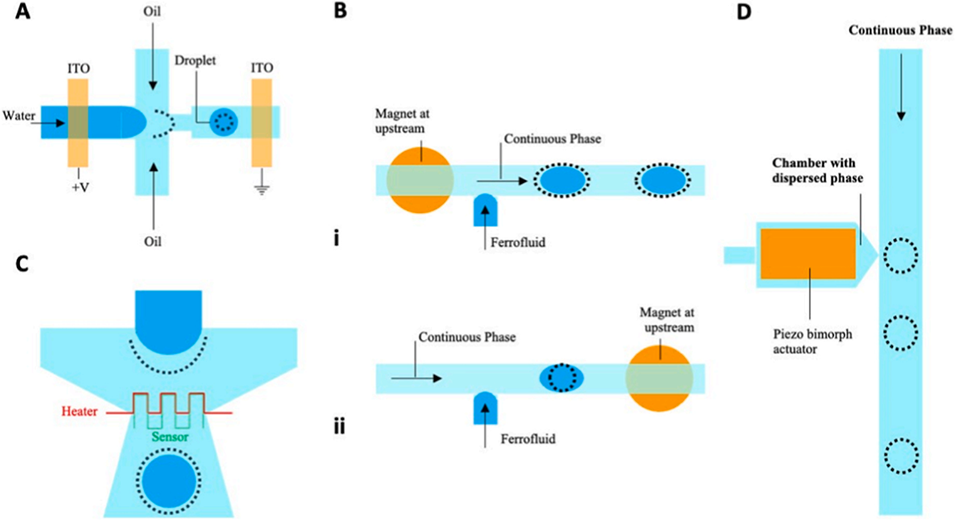
图 4:主动式液滴生成方法。(A)施加直流电压生成液滴;(B)含铁磁流体的 T 型结器件,磁铁分别置于(i)上游位置和(ii)下游位置;(C)用于研究液滴形成过程温度依赖性的微流控器件示意图;(D)按需分配液滴的微流控芯片:压电致动器将水性液滴释放到含不互溶流体的垂直通道中。

图 5:(A)聚合物纳米颗粒的典型结构示意图;(B)聚合物纳米胶囊的典型结构示意图;(C)通过自组装过程获得具有成核位点的纳米凝胶结构示意图。
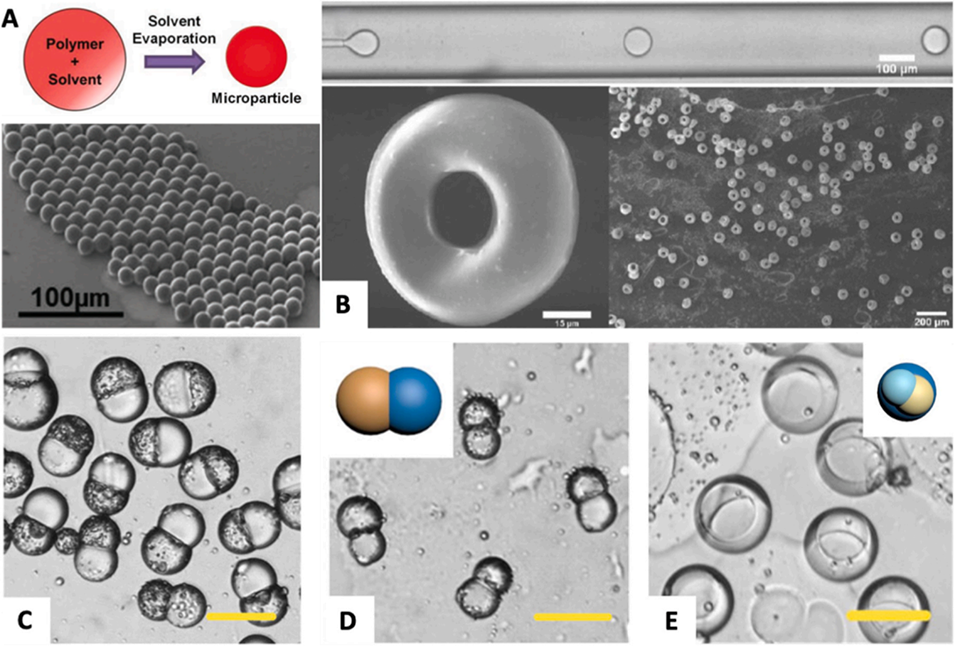
图 6:基于微流控技术生成的、具有均一内部结构和异质内部结构的固体微颗粒。
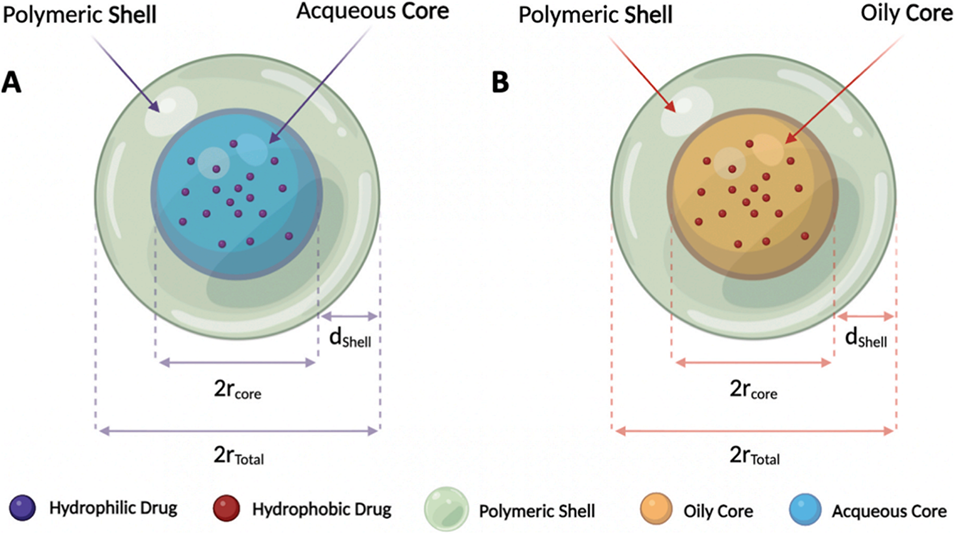
图 7:基于 DBM 技术制备的核壳型微颗粒示意图:(A)水溶性内核颗粒,适用于负载亲水性药物(紫色圆点);(B)油溶性内核颗粒,适用于负载疏水性药物(红色圆点)。
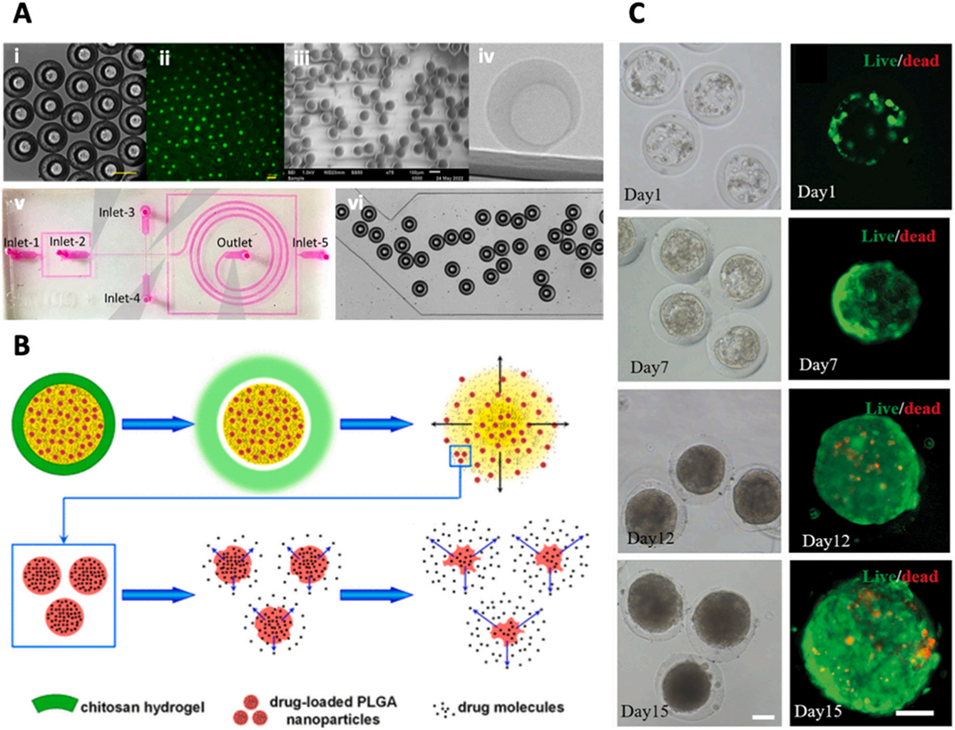
图 8:基于液滴微流控技术生成的核壳型微胶囊,用于药物递送与细胞封装。

图 9:利用多通道微流控器件制备生物活性微纤维的过程。
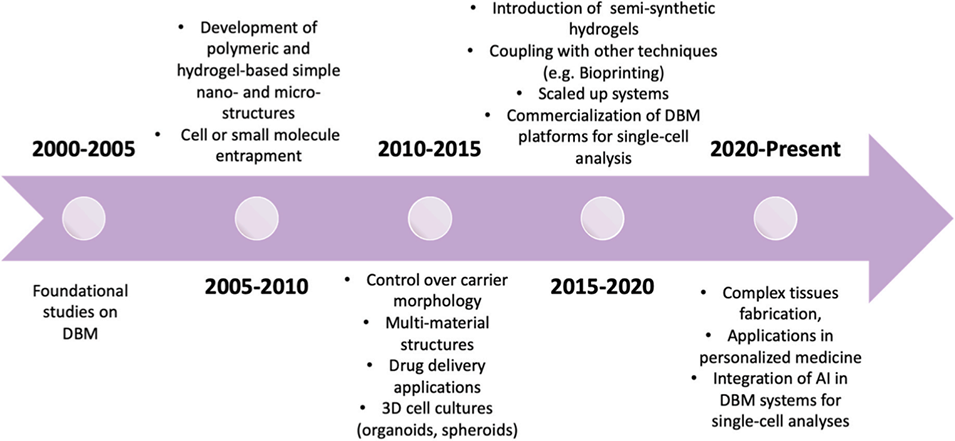
图 10:DBM 技术用于生物材料制备的关键发展里程碑,从早期概念验证研究到生物医学应用的最新进展。
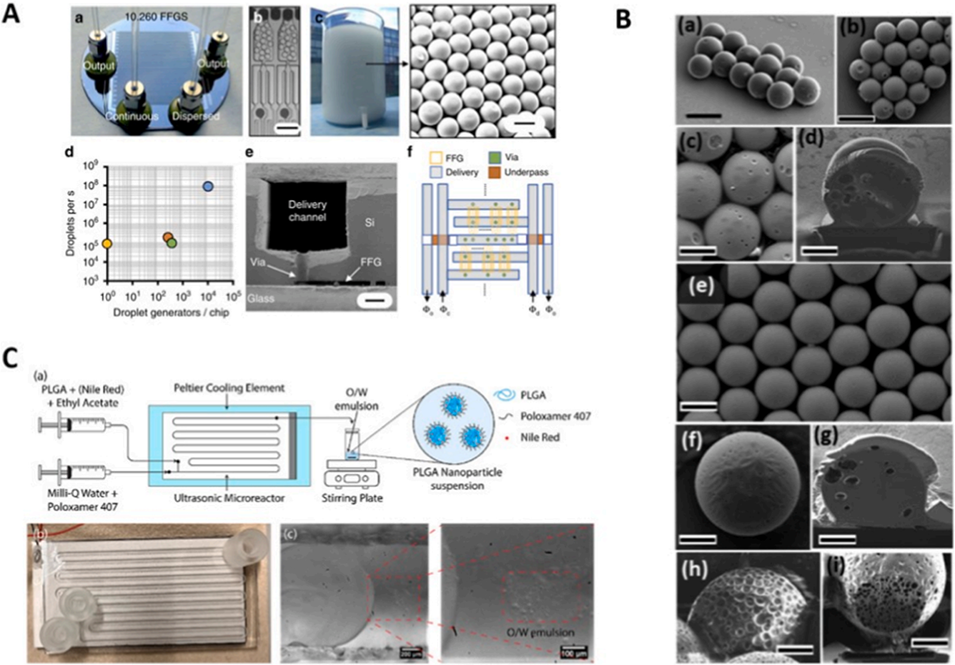
图 11:固体聚合物在 DBM 技术中的应用实例。
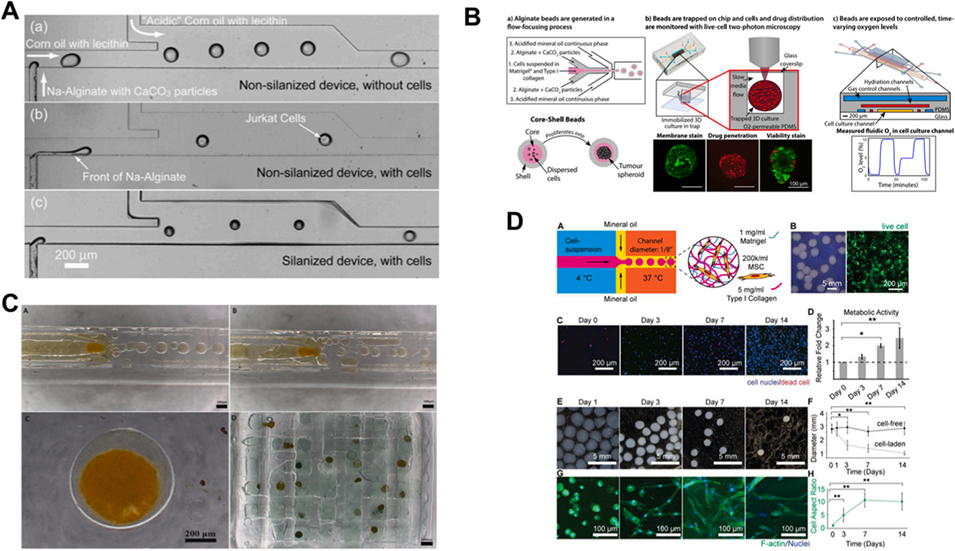
图 12:天然水凝胶在 DBM 技术中的应用实例。
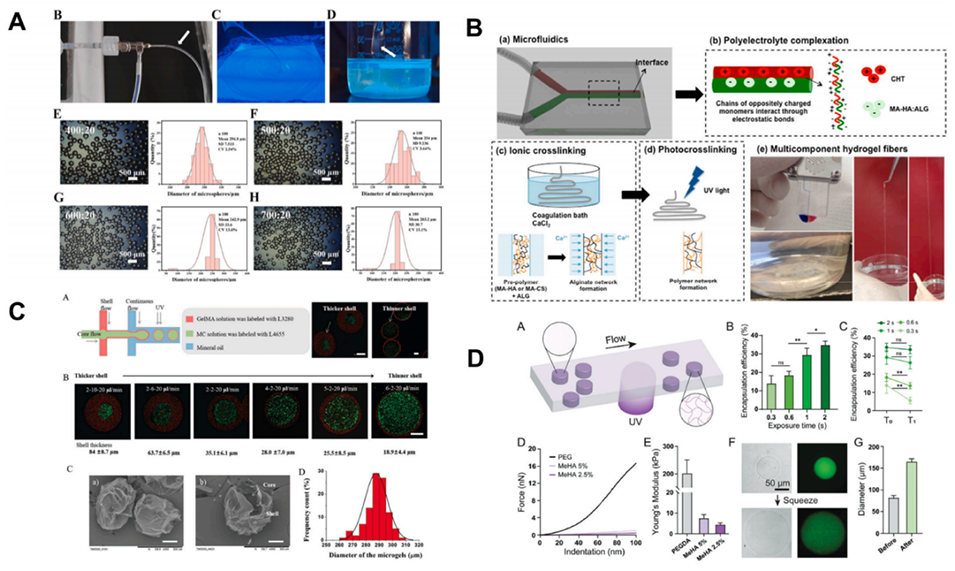
图 13:半合成水凝胶在 DBM 技术中的应用实例。
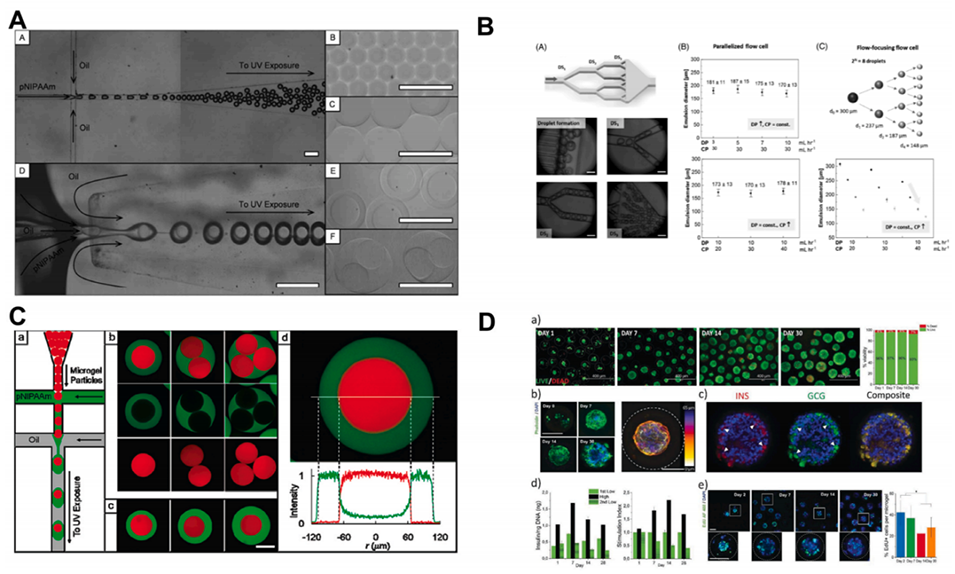
图 14:合成水凝胶在 DBM 技术中的应用实例。
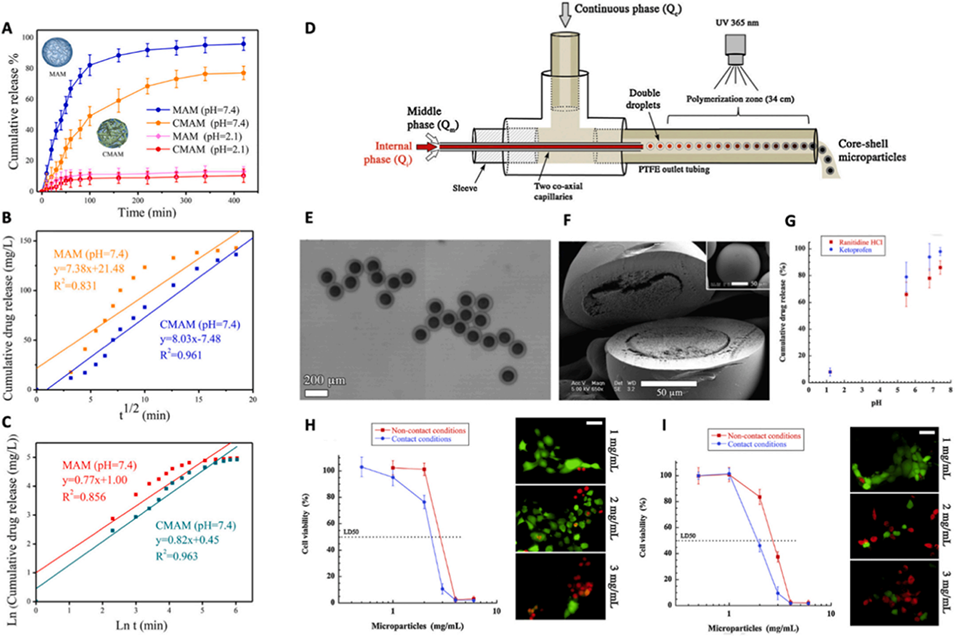
图 15:基于 DBM 技术制备的生物材料微颗粒的药物释放与生物相容性数据。
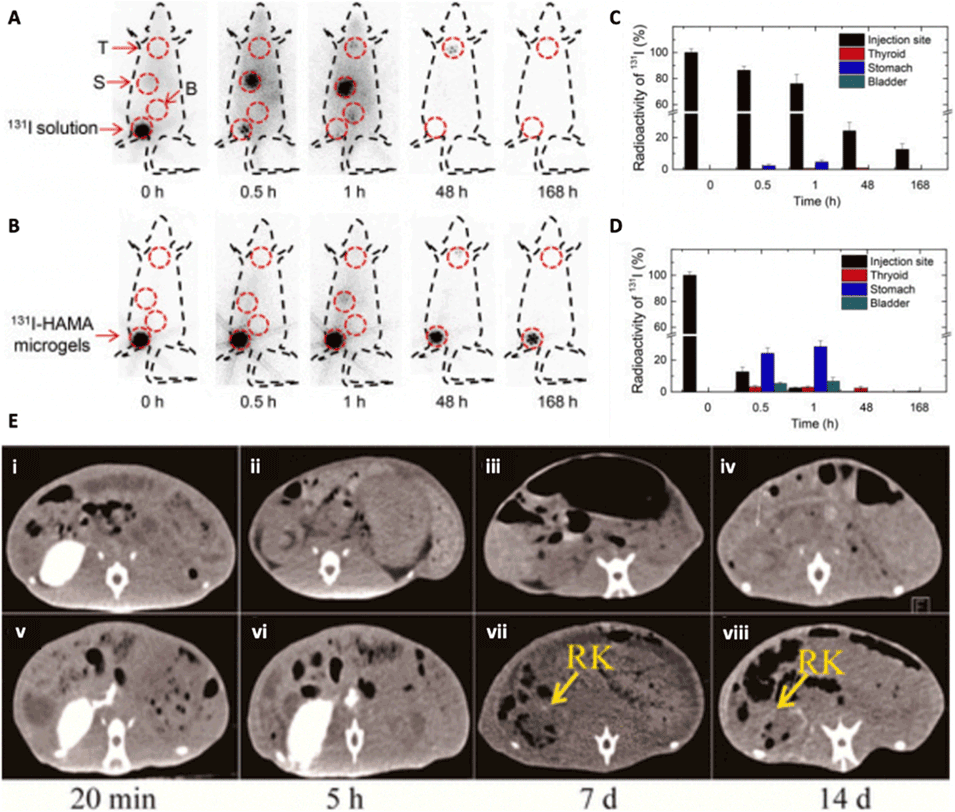
图 16:基于 DBM 技术制备的生物材料载体的体内分布及成像。

图 17:利用液滴微流控技术在水凝胶微环境中实现单细胞封装与培养。
论文链接:https://doi.org/10.1016/j.mtadv.2025.100667
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














