微球(1-1000 μm)可将活性药物成分包封于聚合物基质中,其中PLGA微球广泛用于药物递送领域,包括激素治疗、心血管治疗及化疗。常规方法(溶剂蒸发、喷雾干燥、沉淀)存在尺寸控制有限、包封效果差、批次变异性大等问题,阻碍了规模化生产与重复性。微流控技术可通过优化混合与传质过程,实现微球尺寸均匀性与形态可调性。然而,传统液滴系统仍面临微通道堵塞、生产通量低以及难以满足药品生产质量管理规范(GMP)要求等规模化难题,因此需开发更高效的微球合成工艺。

近期,有研究人员开发了基于连续流微流控技术的聚乳酸-羟基乙酸共聚物(PLGA)微球制备工艺,通过nanomake-L™自动化平台与分裂-重组(SAR)微混合器,结合双乳液溶剂蒸发法实现了微球的自动化、高通量合成,并明确了溶剂类型、乳液比例和总流速为影响微球尺寸的关键因素,为药品规模化生产提供了有力方案。相关研究以“Development of a continuous-flow microfluidic process for microsphere production”为题目,发表在期刊《Materials Letters》上。
本文要点:
1、本研究开发了一种连续流微流控工艺,用于合成尺寸及分布可控的PLGA微球。
2、采用带有分裂-重组微流控芯片的自动化平台(nanomake-L™),通过双乳液溶剂蒸发法制备微球,有效克服了液滴系统在规模化生产方面的局限性。
3、该设备在40mL/min的流速下,混合效率可达91.87%,体积精度高达99.07%。
4、通过确定性筛选设计,确定了溶剂类型、乳液比例和总流速为影响微球尺寸的关键因素。
5、所制备的微球尺寸范围为9.90-85.80 μm(平均值:46.88±2.2 μm),SEM显示高PLGA浓度制备的微球呈光滑球形,低浓度则呈多孔结构,产率为63.02±3.28%。
6、本研究证明了该连续流微流控平台在自动化、高通量、一致性微球生产方面的潜力,为可扩展的药物制造提供了新策略。
本研究选择“分裂-重组”连续流技术路线,主要是为了从根本上解决传统液滴系统在工业化放大过程中的核心瓶颈。具体如下:
1、对抗堵塞,追求稳健性: 传统液滴系统依赖于在狭窄的通道内形成极其精细的液滴,其对通道尺寸、表面性质和流体性质的波动极为敏感,颗粒或微晶的轻微沉积都可能导致致命的堵塞。而“分裂-重组”结构进行的是一种“体相”乳化,通道相对更宽,对堵塞的容忍度更高,工艺稳健性显著增强,这对于需要长时间连续运行且符合GMP要求的药品生产至关重要。
2、突破通量限制: 传统液滴系统的通量通常受限于单个液滴生成单元的频率。虽然可以通过并行化(numbering-up)来提高产量,但这极大地增加了系统的复杂性和成本。“分裂-重组”微反应器通过高流速下的高效混合来制备乳液,其通量可以轻松达到数十mL/min,甚至还有进一步提升的潜力,更易于实现规模化。
3、平衡“质量”与“产能”: 这种连续流微流控工艺在“单分散性”上可能略逊于精密的液滴技术,但换来了在可接受尺寸分布范围内,同时实现高通量、高稳健性和精确控制的巨大优势。这标志着微流控技术从实验室的“精密玩具”向工业界的“实用工具”迈出了关键一步,其目标不是追求极致的均匀,而是为制药行业提供一个可靠、可放大且经济可行的微球生产平台。
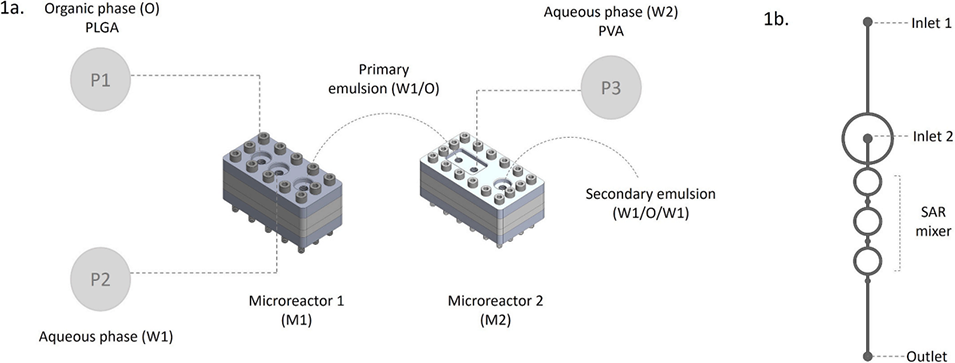
图1. 连续流微流控平台。(a)采用三个自动注射泵(P1、P2、P3)制备双乳液的示意图;(b)分裂-重组(SAR)微混合器。
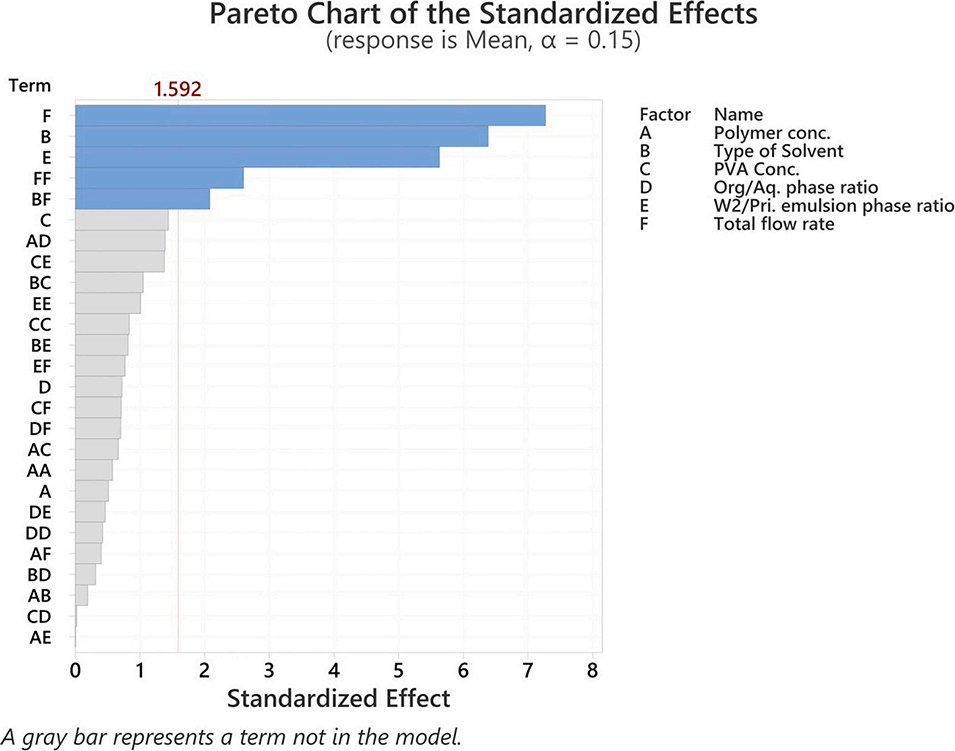
图2. 各因素(A-F)及交互作用对体积加权平均粒径(Vm)标准化影响的帕累托图。竖线代表显著性阈值,用于指示影响Vm的因素。结果显示,总流速(F)、溶剂类型(B)、W2与初级乳液的比例(E)、B与F的交互作用(BF)以及流速的二次项(FF)被确定为具有显著性影响的因素。

图3. 以乙酸乙酯(EA)为溶剂、W2:O/W1为5.474、流速为21.77 mL/min条件下制备的PLGA微球SEM图。(a)PLGA浓度为75 mg/mL时,微球呈现光滑形态(放大800倍);(b)PLGA浓度为25 mg/mL时,微球呈现多孔形态(放大600倍)。
论文链接:https://doi.org/10.1016/j.matlet.2025.139599
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














