
导读:
具有粗糙表面的微粒因其高比表面积,在药物递送、组织粘附和生物传感等领域展现出显著优势,如增强的生物相互作用和载药能力。然而,如何在已完全组装、结构稳定的聚合物膜上可控地构建此类粗糙形貌,仍是当前研究的难点。近期,深圳大学孔湉湉教授、齐成副教授、孔彬助理教授等人开发了一种无溶剂策略,通过在预形成的单宁酸-聚环氧乙烷(TA-PEO)微胶囊中引入牛血清白蛋白(BSA),成功诱导了表面可控的“成芽”现象。这些具有粗糙表面的粘附性微胶囊显著增强了肠道滞留能力,并在炎症性肠病(IBD)模型中展现出优异的益生菌递送与治疗功效。相关研究以“Phase Separation-Induced Surface Protuberances in Hydrogel Particles for Enhanced Intestinal Retention”为题目,发表在期刊《Advanced Healthcare Materials》上。
本文要点:
1、本研究受自然出芽现象启发,开发了一种无溶剂单宁酸-聚环氧乙烷(TA-PEO)微胶囊,其表面粗糙度可通过牛血清白蛋白(BSA)触发的界面不稳定性进行调控。
2、利用微流控平台,通过优化振动频率和流速可精确控制微胶囊尺寸与单分散性。
3、TA-PEO动态氢键网络赋予其pH响应性药物释放能力,可通过调节PEO浓度实现从突释到缓释的转变。
4、BSA在囊膜界面的竞争吸附形成局部“软斑”,在渗透压梯度下引发自发出芽,显著增强肠道粘附性。
5、在DSS诱导的炎症性肠病小鼠模型中,负载益生菌的出芽微胶囊能有效恢复结肠长度、上皮完整性和体重,疗效优于游离益生菌及无出芽对照组。
6、该研究为构建具有粘附性粗糙表面的微胶囊提供了一种无溶剂新策略,在靶向黏膜递送领域与胃肠道疾病治疗中展现出良好应用潜力。
本研究中TA-PEO微胶囊的表面成芽现象是如何实现的?其核心机制与现有成芽技术有何本质区别?
TA-PEO微胶囊的表面成芽由BSA竞争性吸附形成“软斑”+ 渗透压梯度驱动协同实现:①BSA分子与TA形成更强的氢键,竞争性取代TA-PEO间的原有氢键,在胶囊膜局部形成结构薄弱的“软斑”;②膜内外的渗透压梯度使“软斑”区域发生局部膨胀,引发自发成芽。
核心区别在于:现有成芽技术(如溶剂蒸发、脂质双层不稳定)多依赖液滴模板形成过程中的瞬时热力学驱动力(如快速溶剂去除),成芽发生在微粒形成阶段;而本研究的成芽发生在已组装完成的TA-PEO微胶囊膜上,是基于生物大分子BSA与聚合物的特异性相互作用引发的后结构重构,且全程无溶剂,更适合保护敏感载荷(如益生菌)。
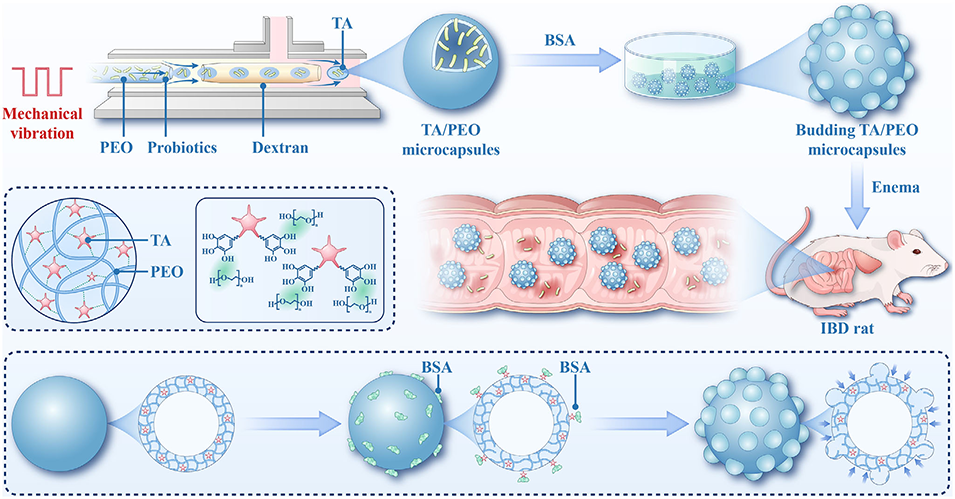
图1. 出芽 TA-PEO 微胶囊的制备及其用于 IBD 治疗的示意图。
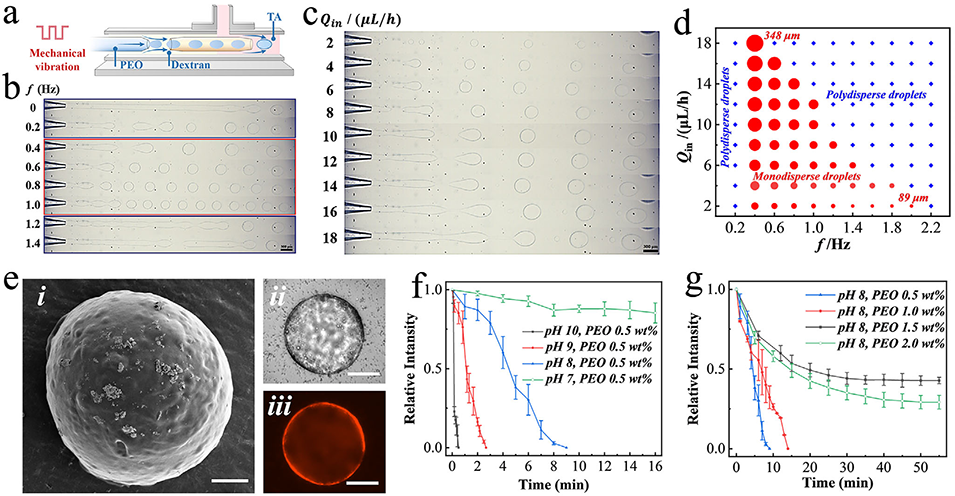
图2. a) 微流控装置示意图。b) 不同振动频率下生成的液滴显微图像。c) 不同内相流速下生成的液滴显微图像。d) 显示液滴直径、振动频率和内相流速之间关系的相图。e) TA-PEO 微胶囊的扫描电子显微镜图像 (i)、光学显微镜图像 (ii) 和荧光图像 (iii)。(i) 中比例尺为 20 μm,(ii, iii) 中为 50 μm。f) 由 0.5 wt.% PEO 制备的微胶囊中包裹的葡聚糖在不同 pH 条件下的释放曲线。(n = 3,生物学独立样本)。数据以平均值 ± 标准差表示。g) 由不同浓度 PEO 在 pH 8 条件下制备的微胶囊中包裹的葡聚糖的释放曲线。(n = 3,生物学独立样本)。数据以平均值 ± 标准差表示。
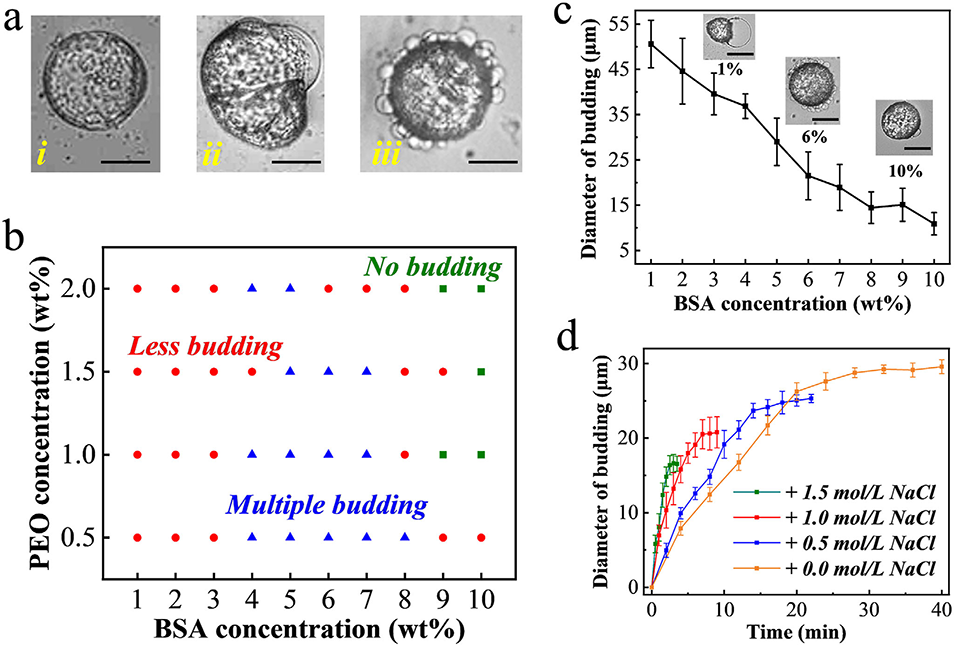
图3. a) 三种类型出芽微胶囊的代表性图像:(i) 无出芽,(ii) 少出芽,和 (iii) 多出芽;比例尺代表 50 μm。b) 显示不同 BSA 和 PEO 浓度对出芽状态影响的相图。c) 不同 BSA 浓度下获得的微胶囊出芽尺寸,并附有出芽微胶囊的代表性图像;比例尺代表 50 μm。(n = 3,生物学独立样本)。数据以平均值 ± 标准差表示。d) 由含不同浓度 NaCl 的 PEO 溶液制备的微胶囊在 BSA 溶液中出芽行为的比较。(n = 3,生物学独立样本)。数据以平均值 ± 标准差表示。
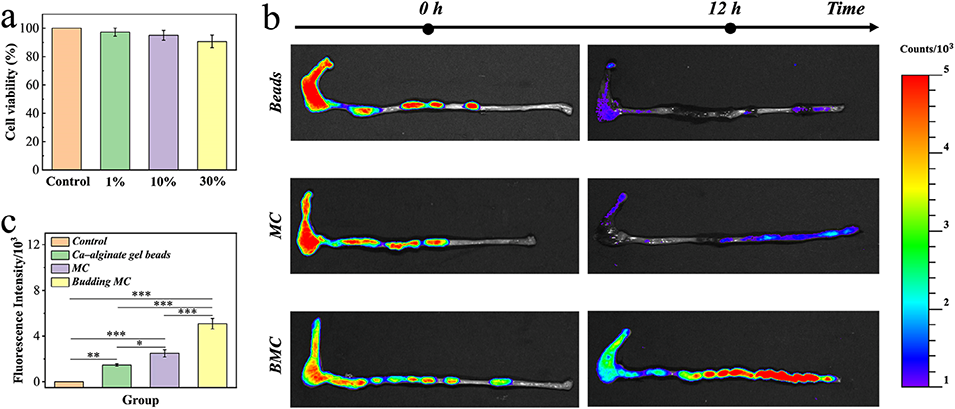
图4. a) 3T3 细胞与不同浓度出芽微胶囊共培养后的存活率。(n = 5,生物学独立样本)。数据以平均值 ± 标准差表示。b) 微球(Beads)、无出芽微胶囊(MC)、出芽微胶囊(BMC)灌肠给药后小鼠结肠的荧光图像。c) 不同组别相应荧光强度的定量分析。(n = 5,生物学独立样本)。数据以平均值 ± 标准差表示。*p < 0.05, **p < 0.01; ***p < 0.001,使用单因素方差分析及事后检验。
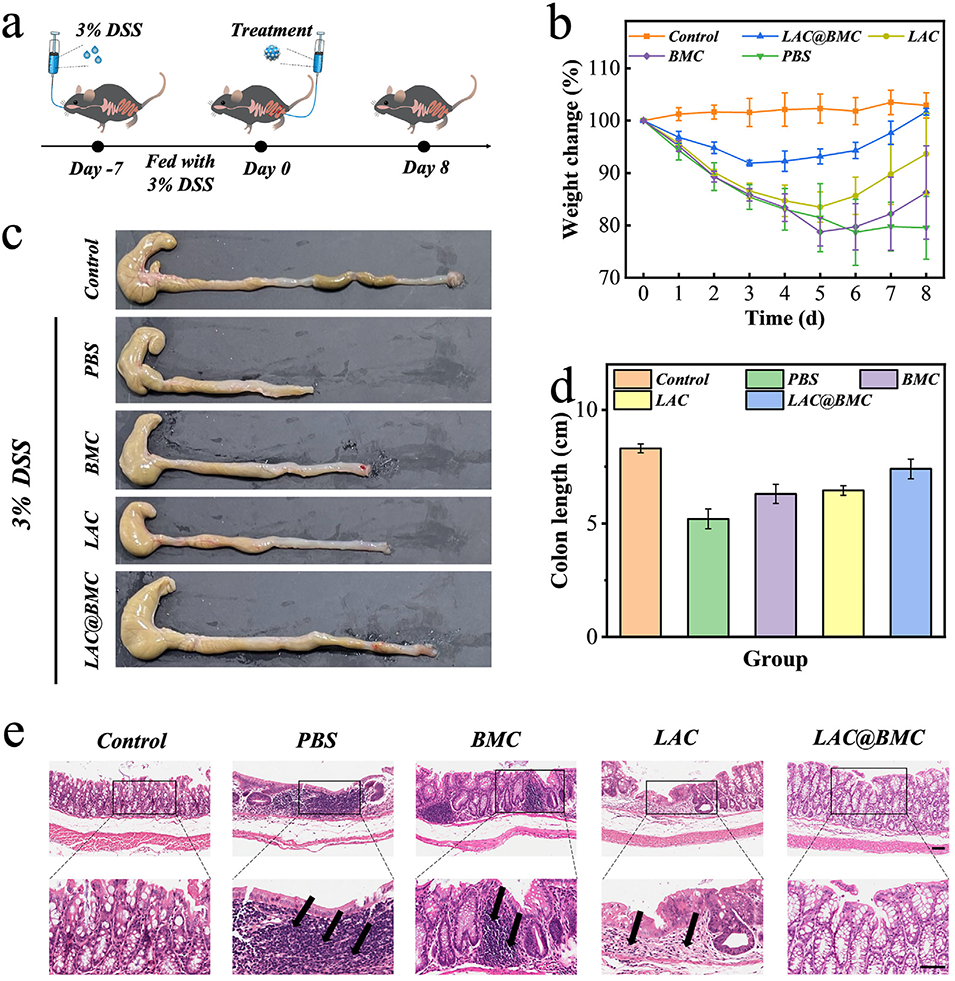
图5. a) IBD 大鼠建模和治疗示意图。b) 对照组、PBS 组、BMC 组、LAC 组和 LAC@BMC 组小鼠的体重变化。(n = 6,生物学独立样本)。数据以平均值 ± 标准差表示。c) 不同组别的结肠实物图。d) 不同组别结肠长度的柱状图。(n = 6,生物学独立样本)。数据以平均值 ± 标准差表示。e) 不同组别结肠切片的代表性 H&E 染色图像。放大图比例尺分别为 100 μm和 50 μm。
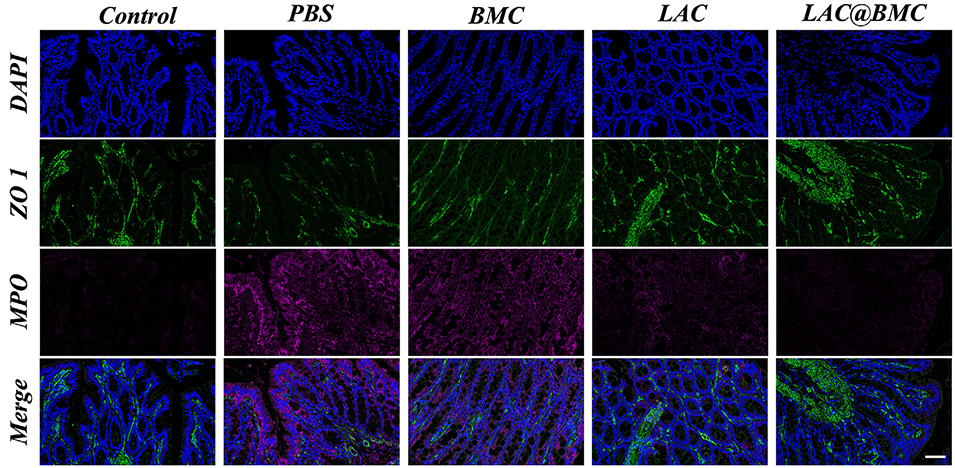
图6. 对照组、PBS 组、BMC 组、LAC 组和 LAC@BMC 组结肠切片的代表性 ZO-1 和 MPO 免疫荧光染色图像。比例尺:50 μm。
论文链接:https://doi.org/10.1002/adhm.202503260
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














