宫腔粘连(IUA)作为继发性女性不孕的主要诱因,其病理核心在于子宫内膜损伤后异常修复引发的纤维化与细胞外基质过度沉积,严重破坏子宫内膜的正常结构与容受性。临床数据显示,该病在不孕女性中发生率达25%-30%,重症患者经传统宫腔镜分离术后粘连复发率高达62.5%,且术后子宫内膜难以恢复胚胎着床所需的 "肥沃土壤",生育结局改善有限。
现有治疗方案存在显著局限:单纯激素治疗易引发内分泌紊乱等副作用,且对中重度损伤修复效果微弱;干细胞移植虽展现出再生潜力,但缺乏有效载体导致细胞易随宫腔液流失,难以在靶区长效发挥作用;常规支架材料虽能固定细胞,却多无法实现 "抗炎 - 修复" 的时序协同调控。

鉴于此,宁波大学附属第一医院妇一科主任管玉涛、浙江省农业科学院蚕桑研究所Lei Yang、安徽省妇幼保健院周曙光教授等人受囊胚结构启发,利用微流控电喷雾技术成功开发出一种核壳微球(HBM),其外壳负载金丝桃苷用于调控早期炎症,内核封装骨髓干细胞以促进组织修复,该双级递送系统在大鼠模型中显著促进了子宫内膜再生与功能恢复。相关研究以“Blastocyst Structure‐Inspired Core–Shell Stem Cell Microspheres with Hyperoside Delivery for Endometrial Regeneration”为题目,发表在期刊《Advanced Healthcare Materials》上。
本文要点:
1、针对子宫内膜损伤及宫腔粘连(IUA)的治疗难题,本研究受囊胚结构启发,开发了一种核壳微球(HBM),用于递送骨髓间充质干细胞(BMSCs)和金丝桃苷(HYP)。
2、该微球采用微流控电喷雾技术制备,外壳为海藻酸钠包裹Fe3O4@MgSiO3磁性纳米颗粒,内核为羧甲基纤维素包封的BMSCs,可实现时序释放。
3、壳层HYP通过促使巨噬细胞向M2表型极化以调控早期炎症;内核BMSCs通过旁分泌促进血管生成与组织修复。体外实验表明HBM可促进内皮细胞增殖、成血管并抑制炎症。
4、在大鼠IUA模型中,HBM显著恢复内膜厚度、增加腺体数量、减少胶原沉积,并改善内膜容受性。转录组分析显示HBM激活了免疫调节与组织修复相关通路。
5、该策略结合免疫调节、干细胞疗法与磁靶向递送,为子宫内膜再生及IUA防治提供了新途径。
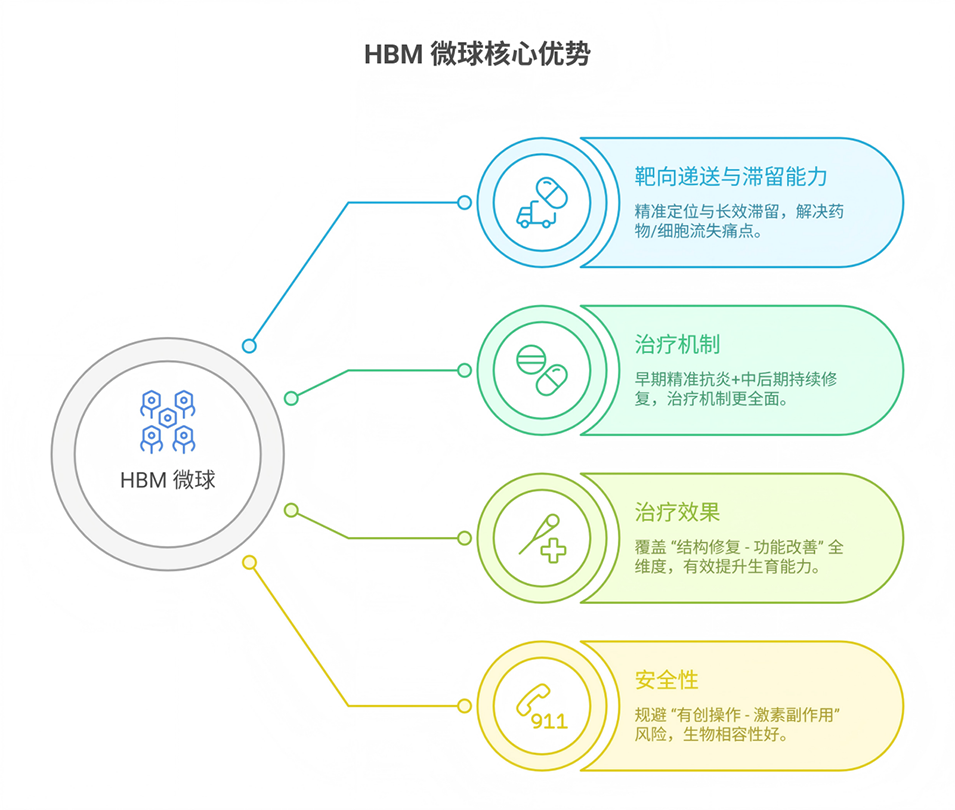
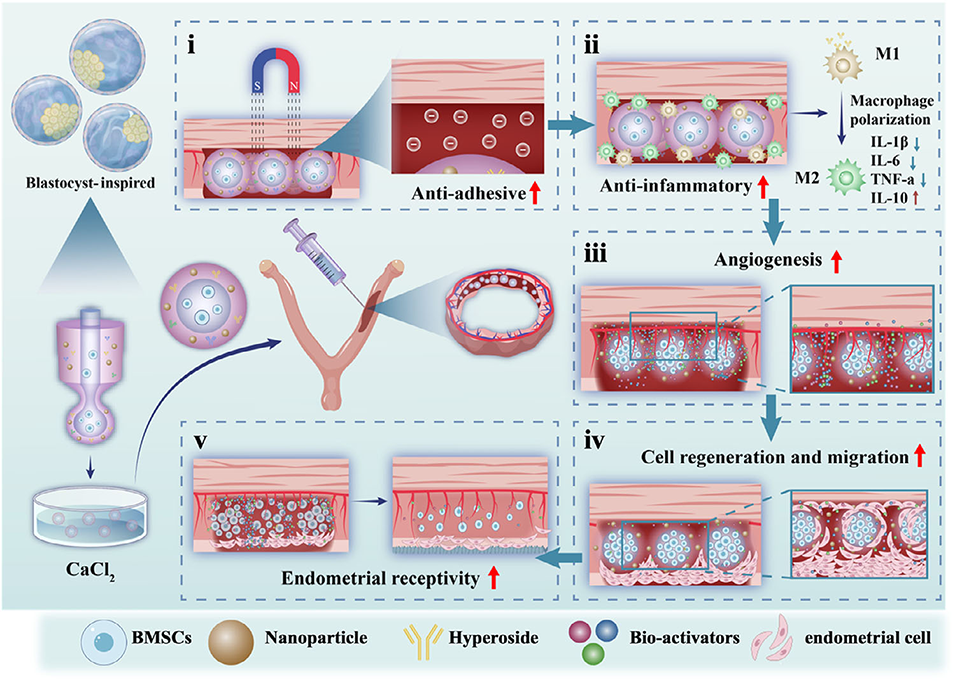
图1. 受囊胚结构启发的核壳微球用于干细胞与药物递送促进子宫内膜再生的示意图
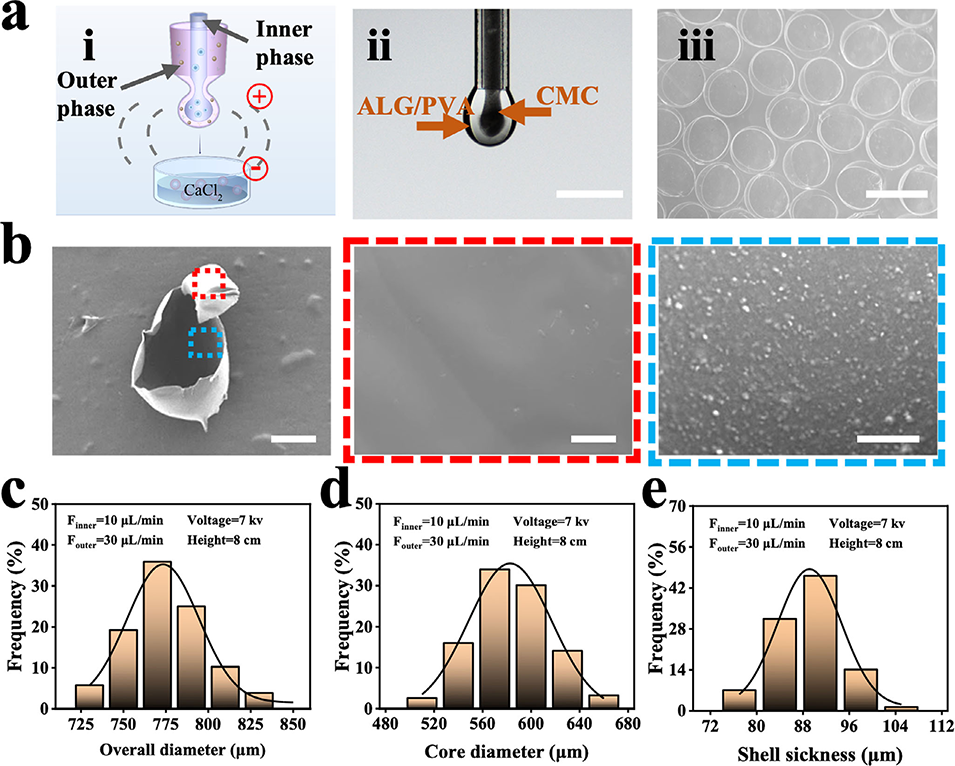
图2. 核壳微球的制备过程

图3. 磁性核壳微球的制备与微观结构

图4. 核壳微球的体外再生能力评估
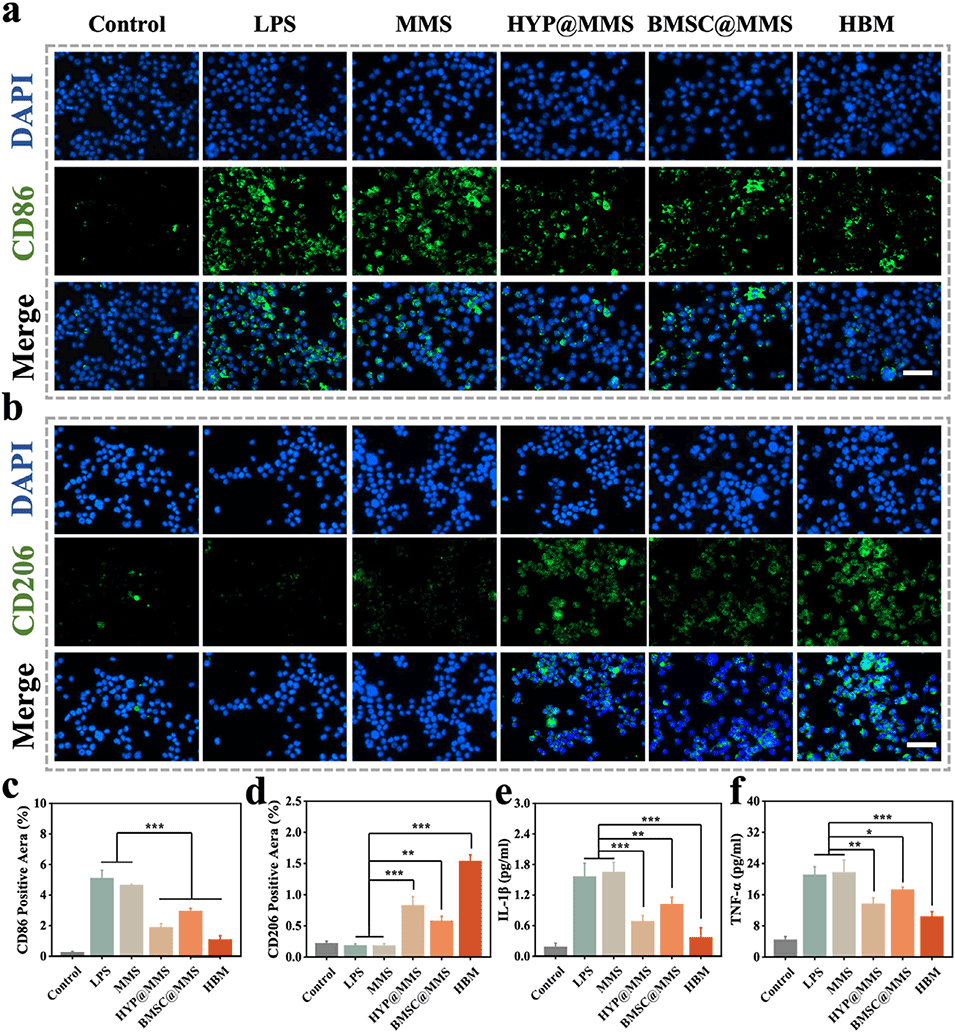
图5. 核壳微球的体外巨噬细胞极化调控作用

图6. 核壳微球在体内的子宫内膜再生能力评估
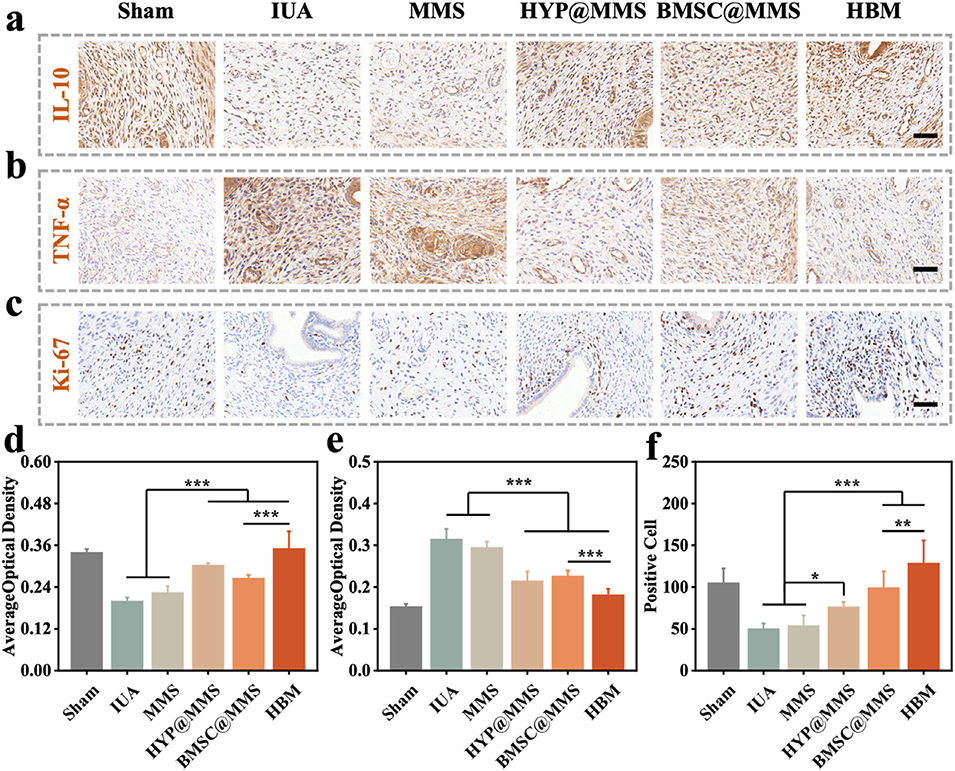
图7. 核壳微球在体内的子宫内膜炎症抑制能力评估

图8. 核壳微球在体内的子宫内膜容受性分析
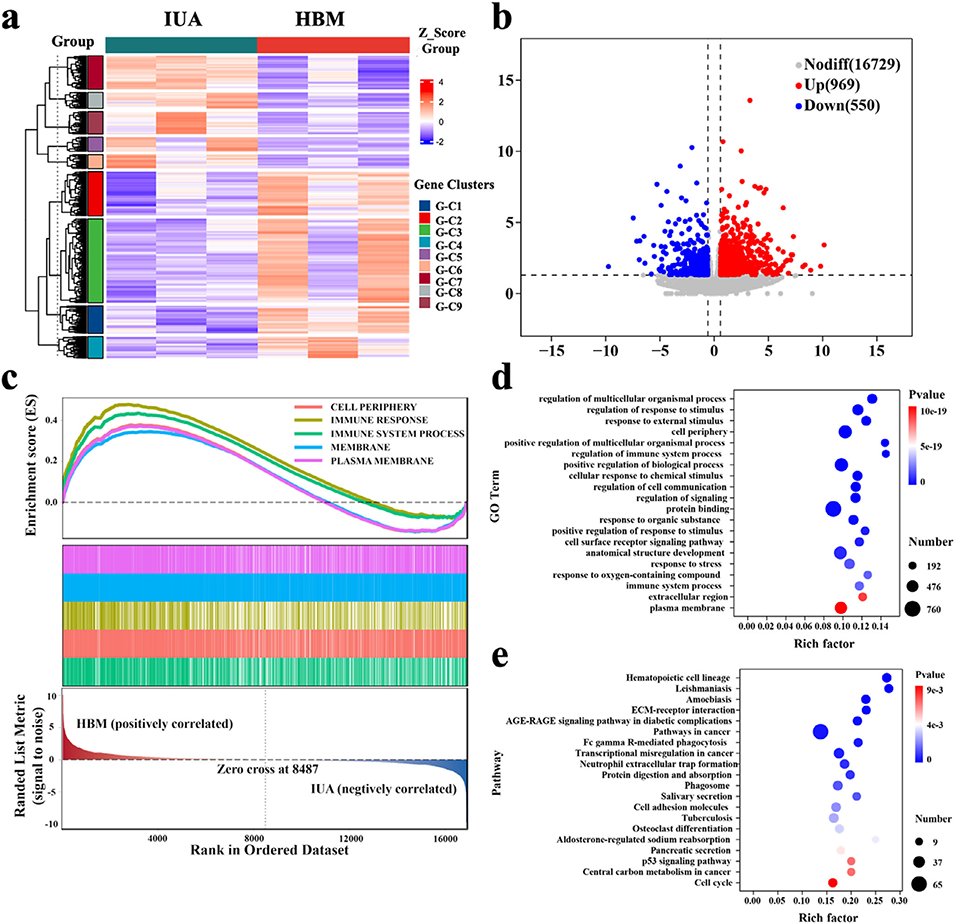
图9. 子宫组织的转录组分析
论文链接:https://doi.org/10.1002/adhm.202502293
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














