T细胞是适应性免疫的核心,通过识别抗原呈递细胞表面的MHC-肽复合物来清除病变细胞。因此,精准鉴定T细胞识别的免疫原性表位,是开发新型疫苗和免疫疗法的关键前提。然而,传统的表位筛选策略存在明显短板:它严重依赖于逐个化学合成候选肽段,并需分别将其“脉冲”至抗原呈递细胞上进行功能验证。这一过程不仅耗时冗长,且随着筛选库规模的扩大,成本急剧攀升,极大地限制了其大规模应用。
尽管利用体外转录翻译系统进行酶法肽合成可降低成本,但现有技术路线仍需多步纯化操作,难以实现自动化与高通量集成。因此,开发一种能够实现快速、低成本、规模化筛选T细胞表位的新技术平台,已成为免疫学研究与应用中一项亟待突破的挑战。

近期,新加坡国立大学Cheow Lih Feng团队开发了一种名为微流控驱动的DNA条形码APC文库(MEDAL)的高通量技术,该技术通过微流控液滴平台整合液滴PCR、体外转录翻译(IVTT)与DNA条形码标记,可在10小时内制备并筛选多达9000种不同的DNA条形码抗原呈递细胞(APCs),有效实现高亲和力肽序列识别与T细胞特异性表位筛选。相关研究以“Microfluidic-Enabled Production of DNA Barcoded APC Library (MEDAL) for High Throughput T Cell Epitope Screening”为题,发表于期刊《Small Methods》。
本文要点:
1、本研究开发了一种微流控驱动的DNA条形码抗原呈递细胞(APC)文库(MEDAL)技术,用于高通量筛选T细胞表位。
2、该方法利用微液滴系统,将编码肽段的DNA池进行数字PCR扩增,并在液滴内通过体外转录翻译合成肽段,同时将抗原呈递细胞与合成的肽段及其编码DNA条形码共同包裹,快速构建DNA条形码APC文库。
3、在10小时内可并行制备多达9000种不同的APC,并通过流式分选和二代测序分析DNA条形码,鉴定出与主要组织相容性复合体(MHC)分子高亲和力结合的肽序列。
4、实验证明,MEDAL平台不仅能高效评估肽-MHC结合亲和力,还可用于T细胞受体(TCR)模拟抗体筛选及T细胞杀伤实验,显著降低了成本和时间,为疫苗开发和个性化免疫治疗提供了有力工具。
MEDAL是基于微流控液滴平台的高通量技术,可大致划分为以下三个核心步骤:
1、液滴PCR扩增:将肽编码DNA库的单个模板包裹进液滴,通过液滴PCR实现克隆扩增;
2、液滴融合合成肽:将含PCR产物的液滴与IVTT试剂液滴融合,酶促合成目标肽,无需纯化;
3、构建条形码APC库:将APCs(采用TAP缺陷型RMA-S细胞,避免内源性肽干扰)与含生物素化PCR产物、IVTT合成肽的液滴融合,使APCs同时携带肽-MHC复合物和对应的DNA条形码,破乳后获得文库。
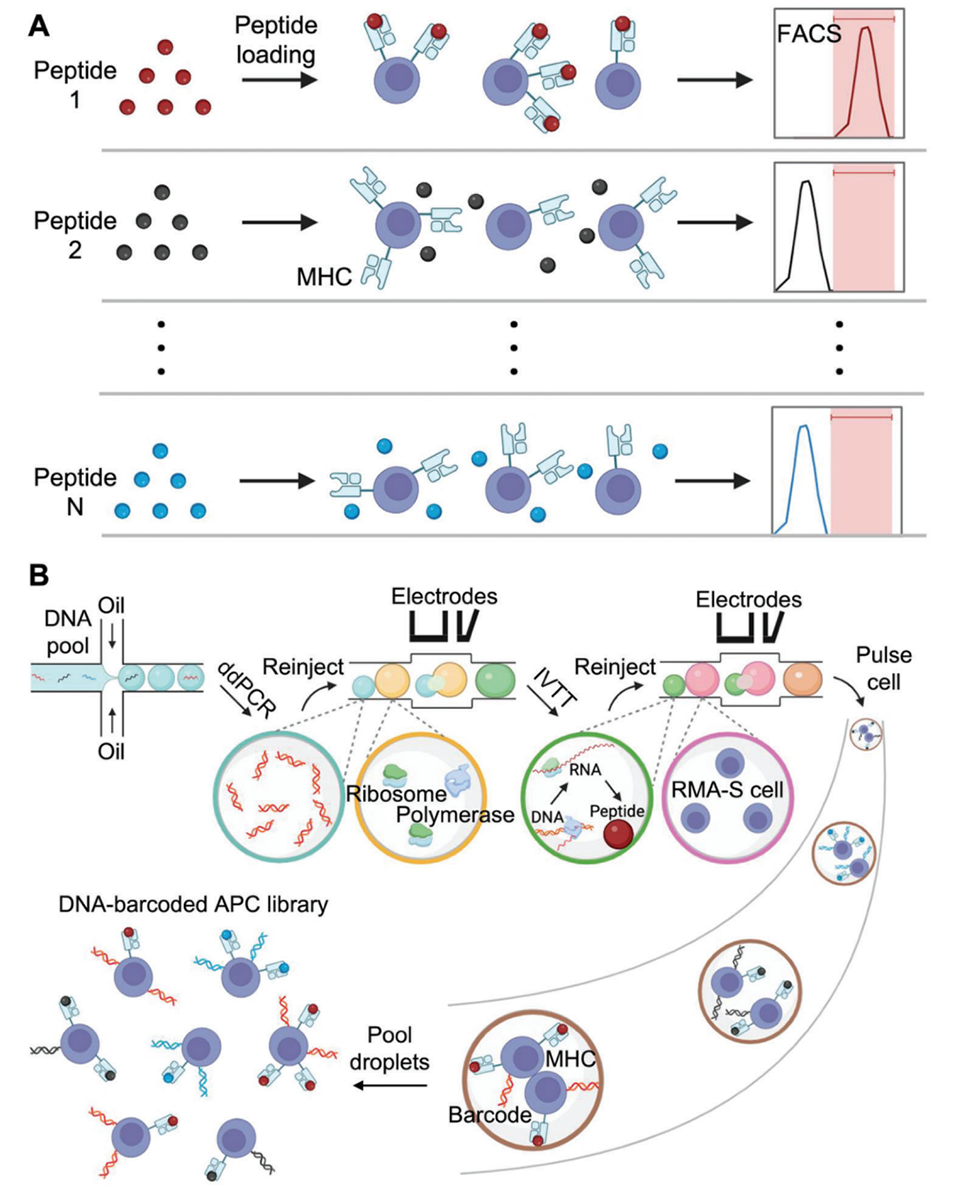
图1. 实验流程示意图。A)传统方法采用荧光激活细胞分选技术(FACS),对经合成肽脉冲处理的抗原呈递细胞(APCs)进行逐一分析。B)MEDAL 实验利用微流控液滴技术构建 DNA 条形码 APC 文库,文库中的 APCs 负载不同肽段。聚合酶链式反应-体外转录翻译(PCR-IVTT)技术可通过酶促反应合成肽段,为肽段制备提供快速、低成本的替代方案。对分选后 APCs 中的 DNA 条形码进行二代测序,可实现多种肽段的亲和力同步分析。
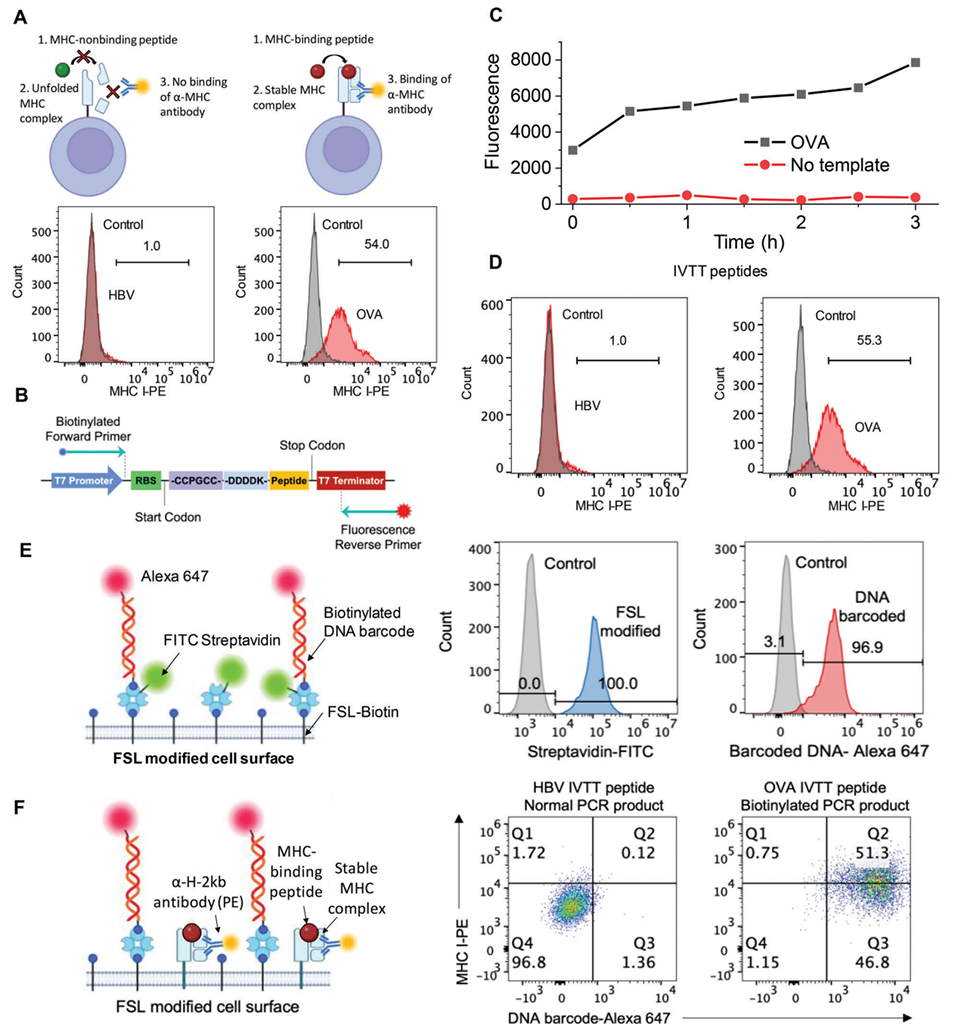
图2. DNA 编码 APC 文库的构建。A)通过肽诱导的 MHC 稳定化实验,验证乙肝病毒(HBV)肽(阴性对照)与卵清蛋白(OVA)肽(阳性对照)在 RMA-S 细胞表面与 H-2Kb MHC 分子的结合情况,本实验使用化学合成肽进行测试。B)用于 PCR-IVTT 反应的 DNA 模板设计图。C)PCR 产物在 IVTT 过程中,ReAsh 荧光信号逐渐累积,表明肽段正在通过酶促反应持续合成。D)在肽诱导的 MHC 稳定化实验中,PCR-IVTT 反应合成的肽段与化学合成肽段效果相当。E)细胞表面 DNA 条形码功能化示意图。直方图显示链霉亲和素与条形码 DNA 几乎完全附着在细胞表面。F)同步检测细胞表面 DNA 条形码与 MHC 分子表达的示意图及结果。
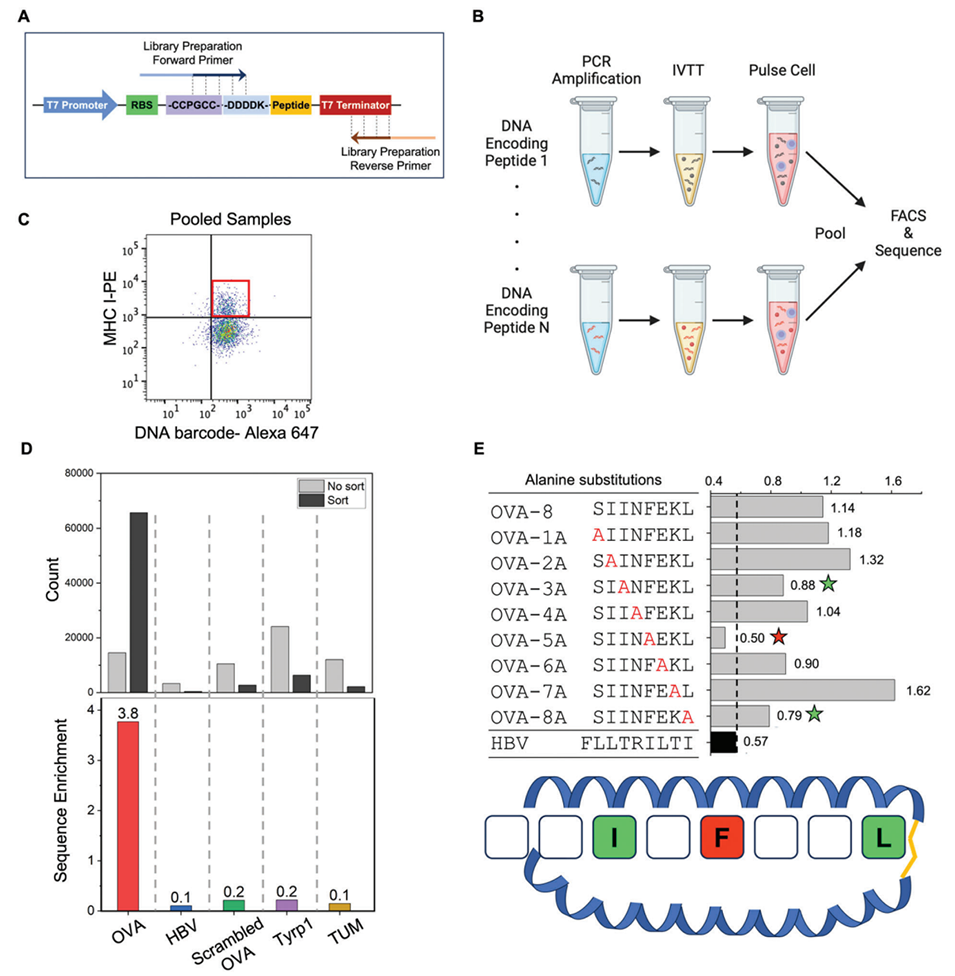
图3. 从 DNA 条形码 APCs 中筛选高亲和力肽段。A)用于从细胞中扩增 DNA 条形码的引物设计图。B)将多组负载肽段的 DNA 条形码 APC 库混合,通过 FACS 分选获得 MHC 高表达的细胞群体。对分选细胞的 DNA 条形码进行二代测序,可筛选出与 APCs 高亲和力结合的肽段序列。C)混合样本中 MHC 高表达的 APCs 亚群。D)分选前后 APC 库中各肽段序列对应的测序读长数。OVA 肽的富集率显著更高,验证其与 H-2Kb 分子的高亲和力。E)在 DNA 条形码 APCs 上进行 OVA 肽丙氨酸扫描的结果。第 5 位苯丙氨酸(F)、第 8 位亮氨酸(L)和第 3 位异亮氨酸(I)的替换会导致肽段与 MHC 分子的亲和力下降。
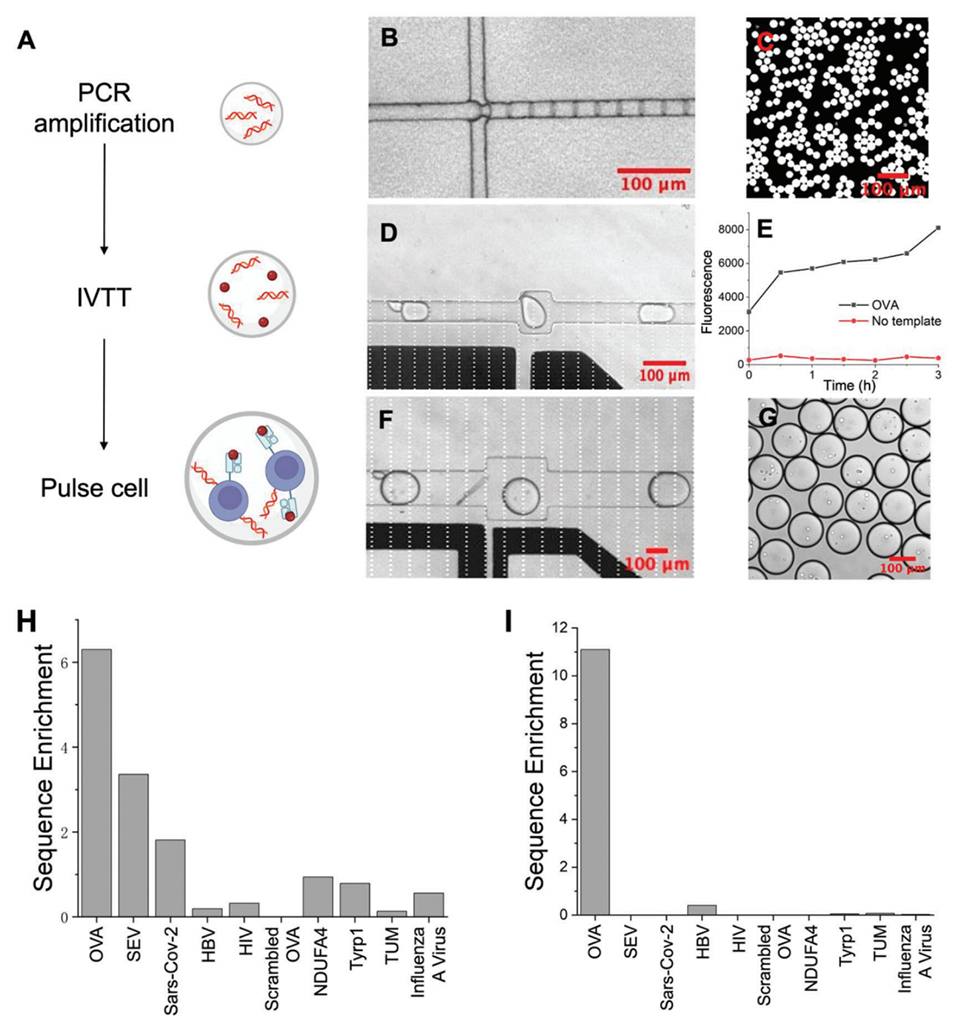
图4. MEDAL 实验验证。A)MEDAL 实验流程示意图。B)液滴 PCR 可实现 DNA 文库在液滴内的数字化扩增。C)显微镜下观察到的经 PCR 扩增后的液滴。D)在电场作用下,PCR 后液滴与 IVTT 试剂液滴发生融合。E)PCR-IVTT 液滴中 ReAsh 染料累积,表明肽段通过酶促反应合成。F)在电场作用下,PCR-IVTT 液滴与含细胞的液滴发生融合。G)融合后,细胞被包裹在含 PCR-IVTT 产物的液滴中。H)利用 MEDAL 对 10 种肽段组成的文库进行同步筛选。Y 轴代表富集率,计算方式为分选后细胞群体与未分选细胞群体的标准化测序读长比值。其中 OVA 肽、仙台病毒(SEV)肽和新冠病毒(SARS-CoV-2)刺突蛋白肽的富集率显著高于其他肽段。I)TCR 模拟抗体(TCRm)与 MEDAL 制备的特定负载肽段 APCs 的结合情况。Y 轴代表富集率,计算方式为分选后细胞群体与未分选细胞群体的标准化测序读长比值。OVA 肽的富集率显著高于其他肽段。
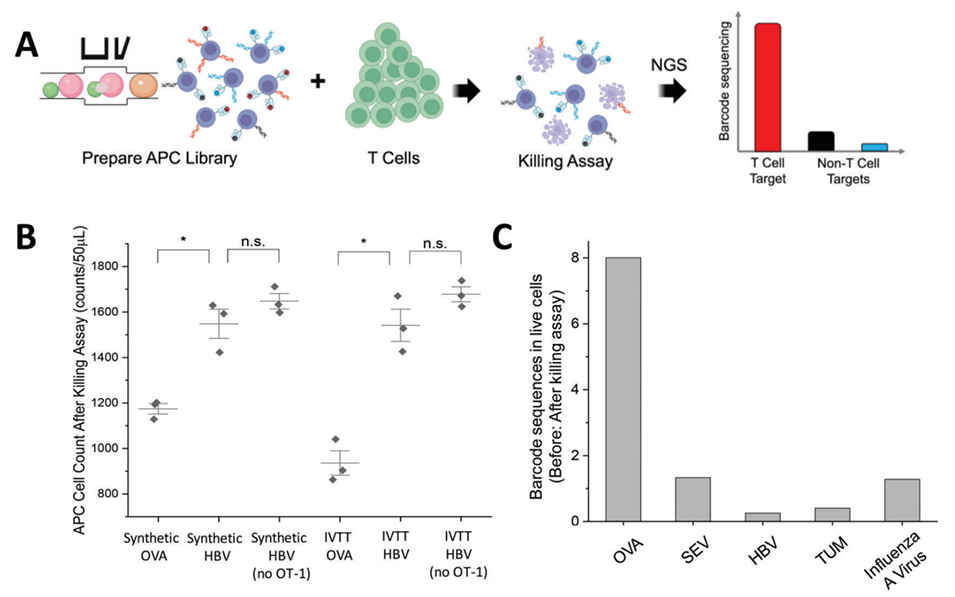
图5. 利用杀伤实验鉴定 T 细胞表位。A)杀伤实验流程示意图。B)杀伤实验的批量验证结果。RMA-S 细胞(即 APCs)经合成肽或 IVTT 合成肽脉冲处理后,与 OT-1 T 细胞共培养。检测培养 4 小时后存活 APCs 的数量。* 表示差异具有统计学意义(p<0.05,单侧 Student t 检验);n.s. 表示差异无统计学意义(p>0.05,单侧 Student t 检验)。C)通过基于液滴的 MEDAL 平台制备含 5 种 APCs 的混合库,将其与 OT-1 T 细胞共培养 4 小时。对杀伤实验前后收集的存活 APCs 进行 DNA 条形码测序。Y 轴代表杀伤前细胞群体与杀伤后细胞群体的标准化测序读长比值。OVA 肽对应的 DNA 条形码比值显著更高,证实在此多重杀伤实验中,负载 OVA 肽的 APCs 被 OT-1 T 细胞特异性杀伤。
论文链接:https://doi.org/10.1002/smtd.202500150
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














