在组织发育过程中存在许多中空结构形态。因此,与适当的天然生物材料组合,以简单、高通量和均质的方式制造中空结构对于发育研究和组织工程具有重要价值,同时也是生物制造领域的重大挑战。

近期,深圳清华大学研究院徐弢教授团队联合加州伯克利大学龚小华教授等人,开发了一种创新的同轴微流控技术。该技术利用牺牲性明胶(液核,负载细胞)和光交联GelMa(凝胶壳)一步生成均一核壳微珠,并通过精确控制尺寸和细胞培养条件,成功引导细胞在壳内表面自组装形成结构完整、具有自修复能力的中空细胞球,为体外构建复杂中空组织模型提供了高效新平台。相关研究以“One-step biofabrication of liquid core—GelMa shell microbeads for in situ hollow cell ball self-assembly”为题发表于期刊《Regenerative Biomaterials》。

1、本研究开发了一种基于同轴共流(coaxial co-flow)毛细管微流控装置的新方法,用于一步法高通量制备中空细胞球模块。
2、利用牺牲性明胶(内层负载细胞)和光交联明胶甲基丙烯酸酯(GelMa,外层)形成均一核壳微珠,其整体及核心尺寸可精确调控。
3、以人脐静脉内皮细胞(HUVECs)为例,随着内核明胶液化,细胞沿GelMa壳内表面自组装,形成具有不对称特征的中空细胞球。
4、移除GelMa壳后,获得独立的中空细胞球,其变形后可自我修复。
5、该平台为体外构建复杂中空组织模型铺平了道路,并可通过调控基质刚度、曲率和生化成分进一步模拟体内微环境。
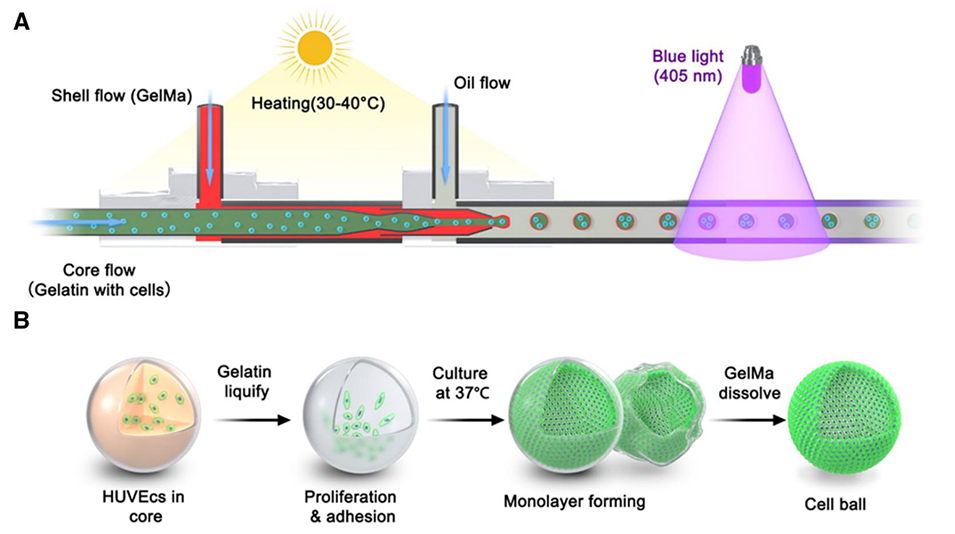
图1.用于制造空心球结构的3D核壳微珠的同轴共流毛细管微流控平台示意图。(A)含有细胞的明胶在毛细管内层流动,GelMa在毛细管中层流动,通过毛细管外层的连续油流,层状流动被打破,形成负载细胞的核壳微珠。(B)在细胞培养过程中,内明胶核在37℃下熔化,然后细胞粘附在核壳微珠的内表面并增殖形成空心细胞片。

图2.流速对核壳微珠尺寸的影响。(A)壳流速=5 μl/min,核流速=1-8 μl/min。(B)核流速=5 μl/min,壳流速=6-10 μl/min。(C)核壳流速比固定为1:1,核壳流量从3 μl/min增加到13 μl/min。将核壳微珠浸泡在PBS中。
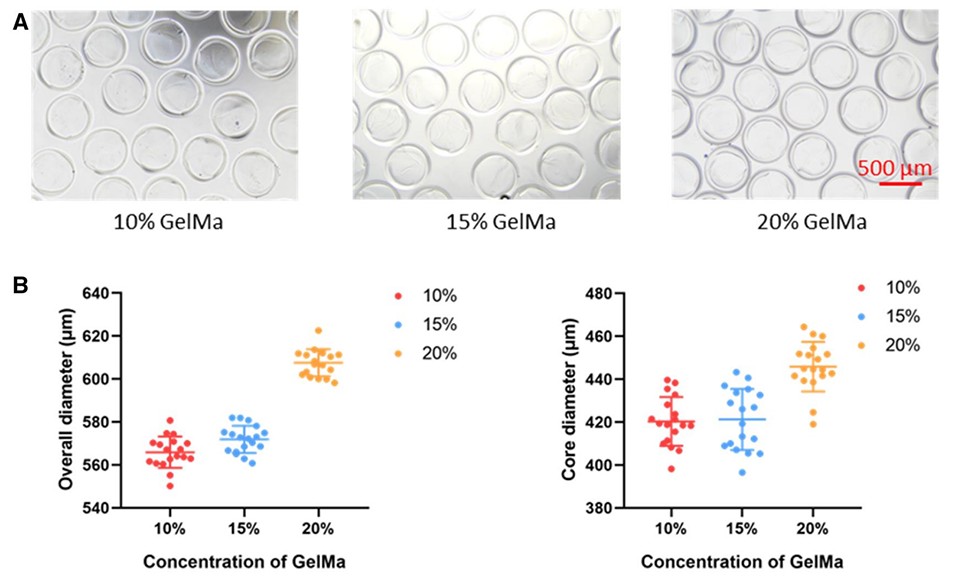
图3.用不同浓度的GelMa制备核壳微珠。(A)浓度分别为10%、15%和20%的核壳微珠的明场图像。(B)不同浓度核壳微珠的尺寸。将核壳微珠浸泡在PBS中。

图4.核壳微珠的形态。(A)荧光图像显示了不同流速下的核壳微珠的结构。(B)不同流速下的广角图像。(C)核壳微珠切割后的SEM图像。每幅图像下分别显示了壳流速(μl/min)、核流速(μl/min)和油流速(ml/min)。核(红)、壳(绿):明胶溶液和GelMA溶液分别用荧光聚苯乙烯纳米颗粒L4655(红)和L3280(绿)标记。
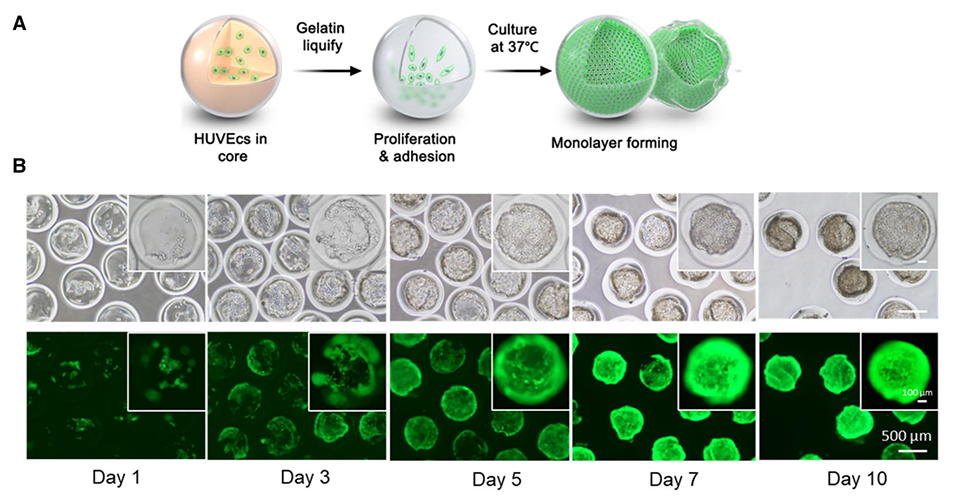
图5.HUVECs在核壳微珠内的生长。(A)HUVECs在核壳微珠内的生长示意图。明胶液化后,HUVECs增殖并粘附在GelMa壳内表面,形成细胞球。(B)第1天,大部分细胞沉入核壳微珠底部,细胞在10多天后增殖并覆盖微珠。本实验使用表达GFP的HUVECs进行观察。
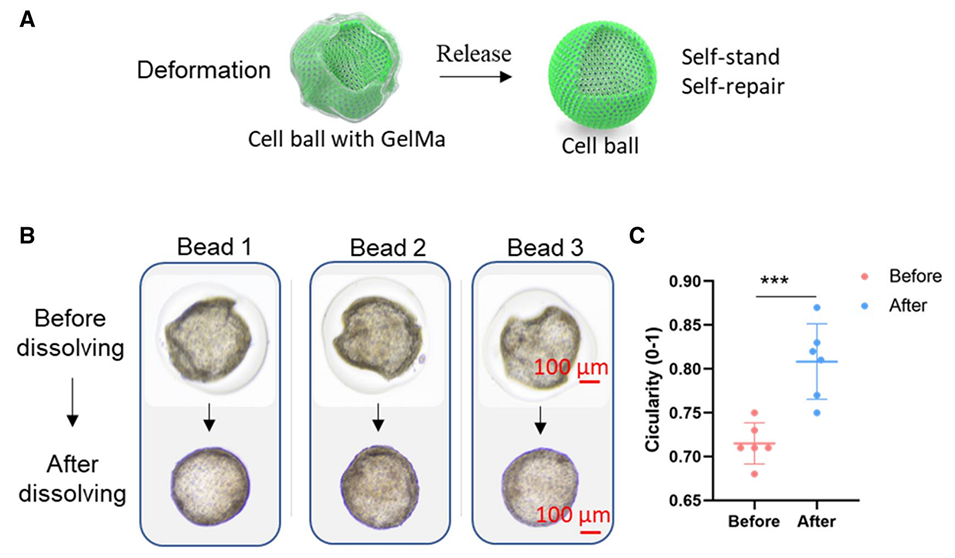
图6.变形细胞球从GelMa壳中释放后可自行支撑且可变形恢复。(A)细胞球从核壳微珠释放的示意图。(B)选择三个具有代表性的变形细胞球进行释放。(C)细胞球在核壳微珠中以及释放后的圆度(0-1)。细胞球在第12天释放。
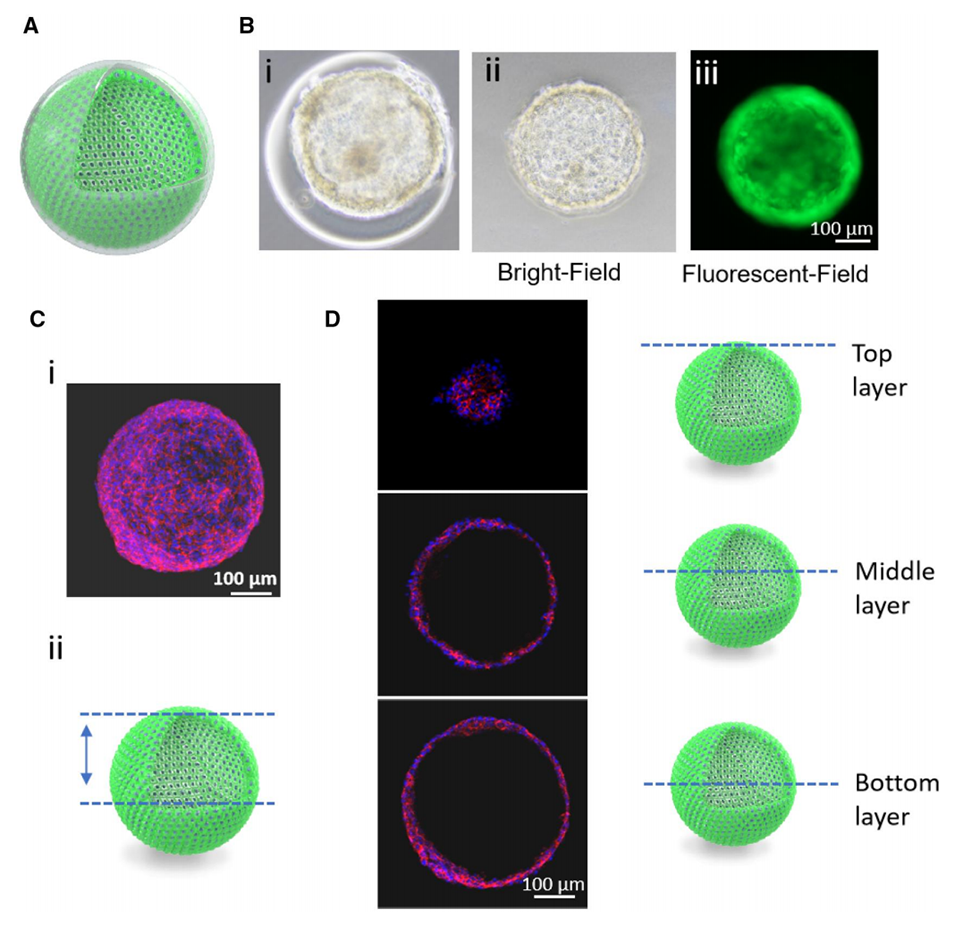
图7.GelMa溶解后形成的空心细胞球。(A)空心细胞球的截面。(B)(i)GelMa溶解前的核壳微珠,(ii)GelMa溶解后GFP-HUVECs球的明场图像和(iii)绿色荧光图像。(C)(i)HUVECs球共聚焦图像的3D结构和(ii)细胞球的扫描区域。(D)左侧为细胞球特定层的扫描图像,右侧为示意图。细胞球用DAPI(蓝)和CD31(红)染色。
论文链接:https://doi.org/10.1093/rb/rbae021














