现有的3D细胞培养模型和精准诊断微流控系统因依赖外部泵、复杂控制及蒸发等问题限制了其广泛应用。

为了应对这些挑战,加拿大卡尔加里大学研究人员开发了一种新型自驱动毛细管微流控系统Cap-Drop,通过结合亲水/疏水材料与被动阀门、压力调节器等创新元件,实现了无泵驱动的均质液滴生成与固定,并成功构建高通量3D细胞培养模型,支持活细胞动态监测与药物筛选研究。相关研究以“Cap‐Drop: A Pre‐Programmed, Self‐Powered Capillary Microfluidic System for Passive Droplet Generation and 3D Cell Culture Modeling”为题目,发表在期刊《Small》上。
本文要点:
1、本研究提出了一种新型毛细管驱动微流控平台Cap-Drop,通过结合亲水/疏水材料和创新毛细元件(如被动通风口、压力减压器、止回阀等),实现了无外部泵驱动的液滴生成与固定。
2、该系统利用毛细力自主操控流体,生成40-500 nL的均质液滴,并将其固定于微孔中,避免移动液滴的追踪难题,同时通过密封设计抑制蒸发和交叉污染。
3、实验表明,Cap-Drop可稳定处理血液、唾液等多种生物流体,并成功用于肠道细胞微凝胶球体的3D培养,支持长达48小时的实时监测。
4、与依赖机器人操作或生物打印的传统系统相比,Cap-Drop简化了流程,成本更低,且具备透明、模块化特性,适用于药物筛选和临床诊断。其自驱动、可扩展设计为微流控技术在生物医学领域的应用提供了新思路。
该系统如何确保生物流体的稳定滴液生成?
1、毛细元件协同控制
止回阀(SV):采用疏水材料通道,通过几何设计(如宽度120 μm)抵抗毛细压力,防止液滴倒流。
压力减压器(PR):在微孔末端设置阶梯结构(L3 < L2),降低液流对SV的冲击,避免阀门失效。
2、被动通风(PV)与延迟通道
PV网络:在加载阶段允许气体排出,完成后自动封闭,防止空气回流。
延迟通道:确保所有微孔填满后PV才关闭,避免未填满导致的液滴不均。
3、亲疏水材料组合
底部/顶部亲水PET层:提供毛细驱动力,加速流体填充。
中间疏水粘合剂层:限制流体扩散,精准控制液滴边界。
4、抗蒸发设计
油相密封:加载后注入矿物油(含Span 20降低表面张力),覆盖主通道(MF)并隔绝空气,减少液滴蒸发(48小时体积损失<5%)。
5、流体参数优化
微孔尺寸控制:宽度0.5–0.7 mm、高度0.3 mm,平衡毛细力与阻力,避免气泡。
动态流量调节:通过Wicking Pad(纤维吸液垫)的毛细压力动态平衡主通道排空速度,确保液滴均匀(CV <7.5%)。
经实验验证,血液样本(黏度≈4 mPa·s)与低黏度唾液(≈1 mPa·s)均生成300 nL液滴,体积变异系数分别为5.33%和5.01%。此外,微孔内细胞分布均匀(CV=8.2%),支持精准单细胞分析。
通过上述设计,Cap-Drop在复杂生物流体的处理中实现了高精度、高稳定性的液滴生成,为微流控技术的临床应用提供了可靠平台。
Cap-Drop系统相较于传统微流控系统具有以下显著优势:
1、无需外部驱动
传统系统依赖主动泵(如注射泵、离心泵)或复杂控制装置,而Cap-Drop通过毛细力自主驱动流体,完全消除外部设备需求,简化操作并降低成本。
2、液滴固定与抗蒸发设计
传统系统因液滴移动导致追踪困难,而Cap-Drop通过密封微孔固定液滴,避免交叉污染,并通过引入不混溶油相抑制蒸发,确保样本稳定性。
3、广泛适用性
可处理血液、唾液、汗液等多种生物流体,兼容不同黏度和性质的样本(如纳米颗粒、细胞悬液),传统系统常受限于流体特性或喷嘴堵塞问题。
4、低成本与可扩展性
采用激光切割和低成本材料(如PET、粘合剂)制造,工艺简单且可大规模生产,而传统系统依赖复杂加工(如PDMS成型或3D打印)。
5、透明模块化设计
系统透明且支持实时光学监测,适用于活细胞成像和动态分析;模块化结构便于集成药物梯度或局部刺激,满足个性化实验需求。
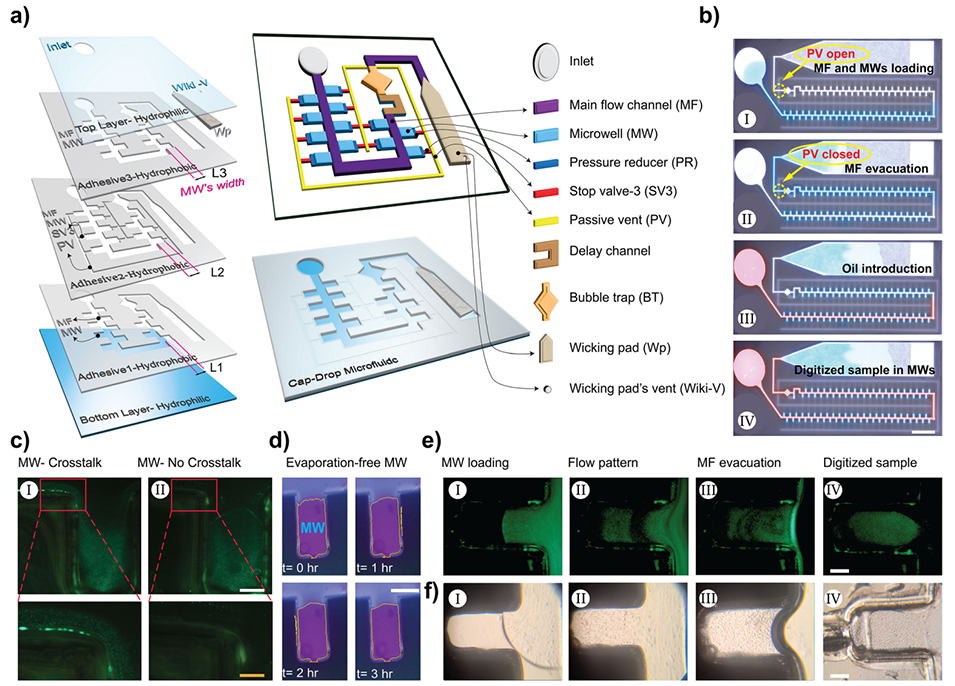
图1.Cap-Drop设计及工作原理。
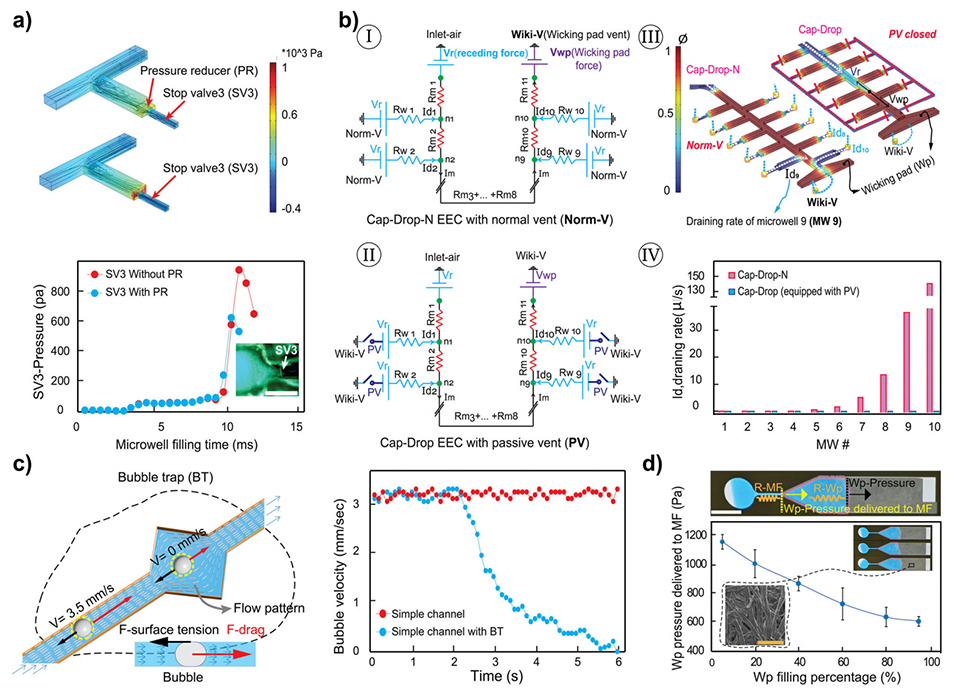
图2.Cap-Drop毛细管元件性能分析。
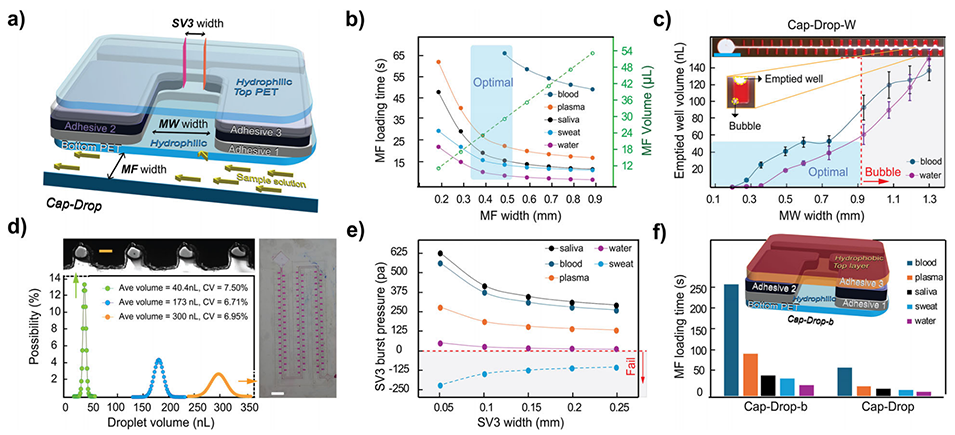
图3.Cap-Drop的参数优化。
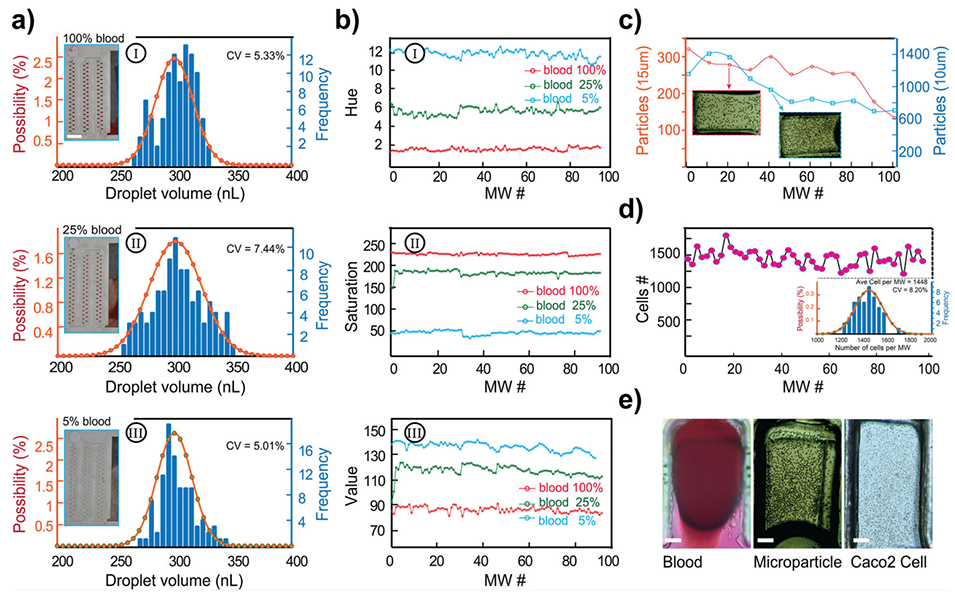
图4.Cap-Drop中的粒子分布。
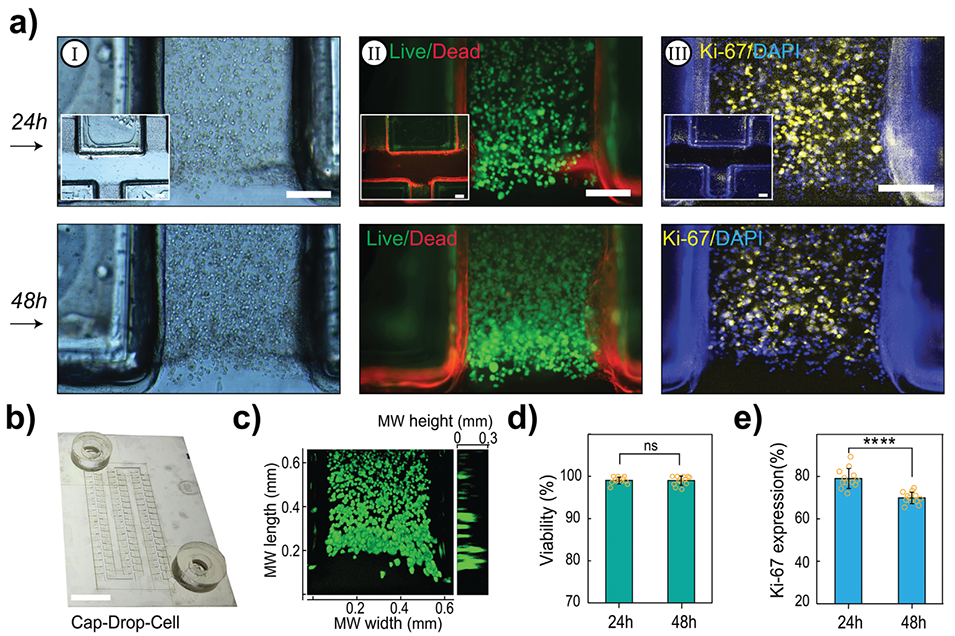
图5.Cap-Drop-Cell内Caco-2细胞的活力和增殖情况。
论文链接:https://doi.org/10.1002/smll.202411997