类风湿性关节炎(RA)是一种以持续滑膜炎症和进行性关节破坏为特征的系统性自身免疫病,影响全球约1%的人口。成纤维样滑膜细胞(FLSs)是RA滑膜炎症的关键驱动因素,也是重要治疗靶点,但现有体外模型难以精准复现RA FLSs病理特征。

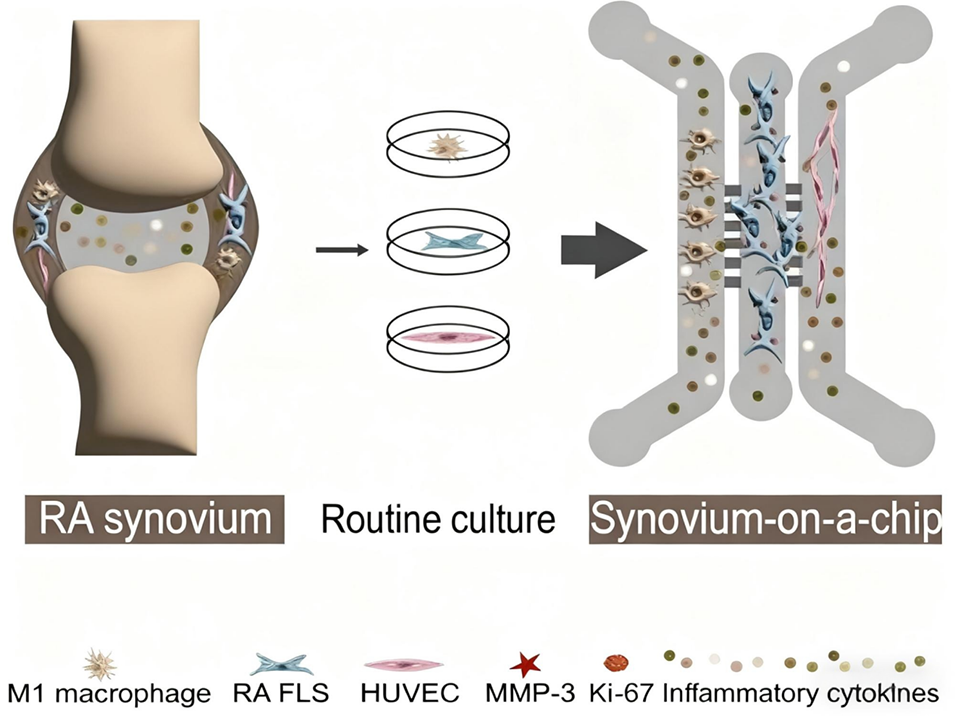
近期,中日友好医院肖诚研究员、中国农业科学院许柠博士等人整合微流控芯片、3D培养与流动培养技术,开发了一种新型血管化滑膜芯片模型。该模型通过将RA患者来源的FLSs与M1型巨噬细胞、人脐静脉内皮细胞在优化比例下进行3D动态共培养,成功模拟了体内滑膜的慢性炎症微环境,并证实其在药物疗效与毒性评估方面的独特优势。相关研究以“Synovium-On-A-Chip: Simulating the Microenvironment of the Rheumatoid Arthritis Synovium via Multicell Interactions to Target Fibroblast-Like Synoviocytes”为题,发表于期刊《Advanced Science》。
本文要点:
1、为构建能精准模拟RA滑膜微环境的体外模型,本研究利用微流控芯片技术,开发了一种包含RA FLSs、M1型巨噬细胞和人脐静脉内皮细胞(HUVECs)的血管化、免疫激活的“滑膜芯片”(SOC)模型。
2、通过系统优化,确定三种细胞的最佳共培养比例为1:1:1(细胞密度为 2×106 cells/mL)。
3、该模型在9天内能持续稳定地高表达IL-6、IL-8等关键炎症因子,并重现了RA FLSs高表达Cadherin-11、MMP-1、MMP-3和Ki-67的侵袭与增殖特性。
4、临床样本分析证实该模型的炎症特征与RA患者高度吻合。应用该模型评估药物雷公藤甲素(TP)和雷公藤红素(CEL)的疗效与毒性,证明了其在预测体内药物反应方面的潜力,为RA的临床前药物评估提供了一个可靠的平台。
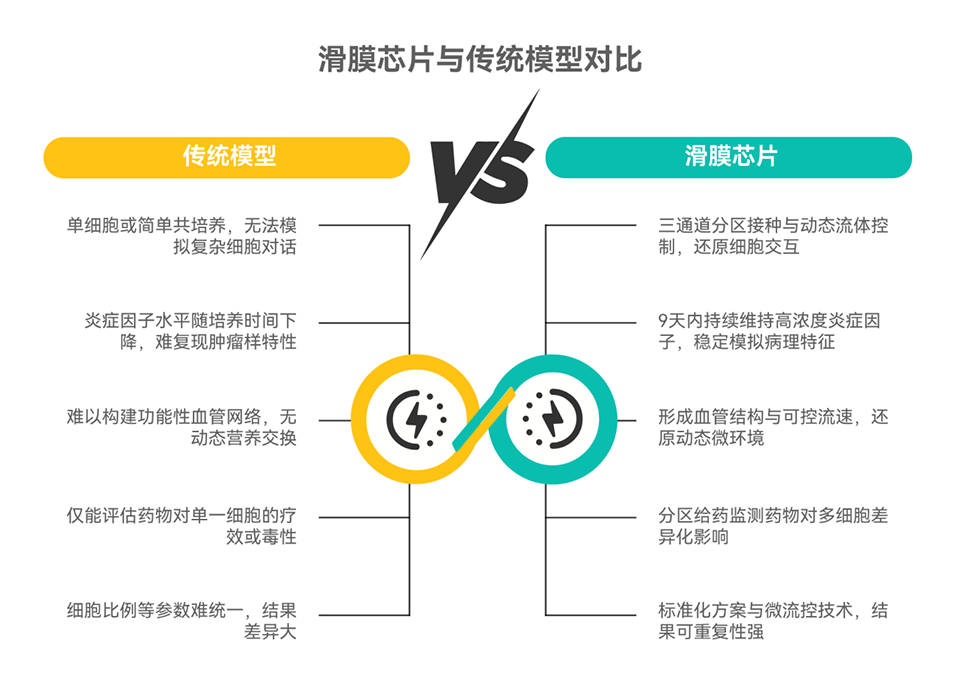
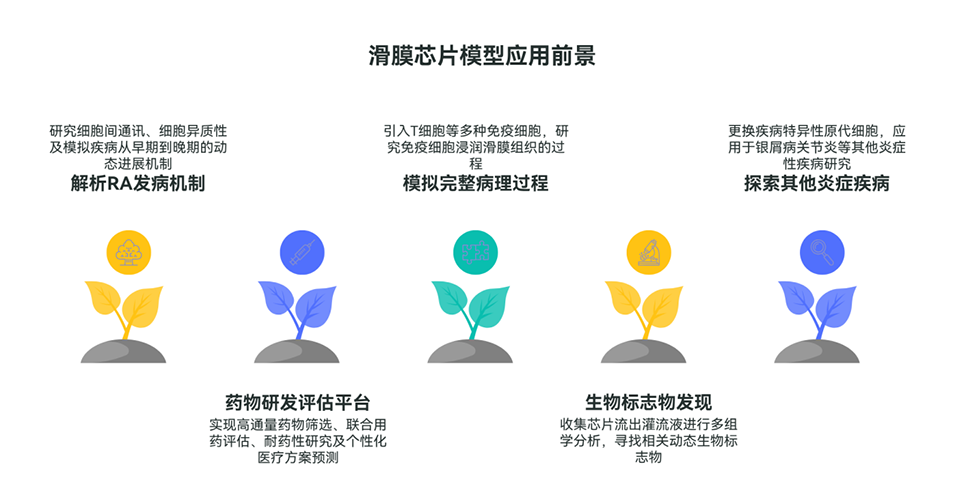
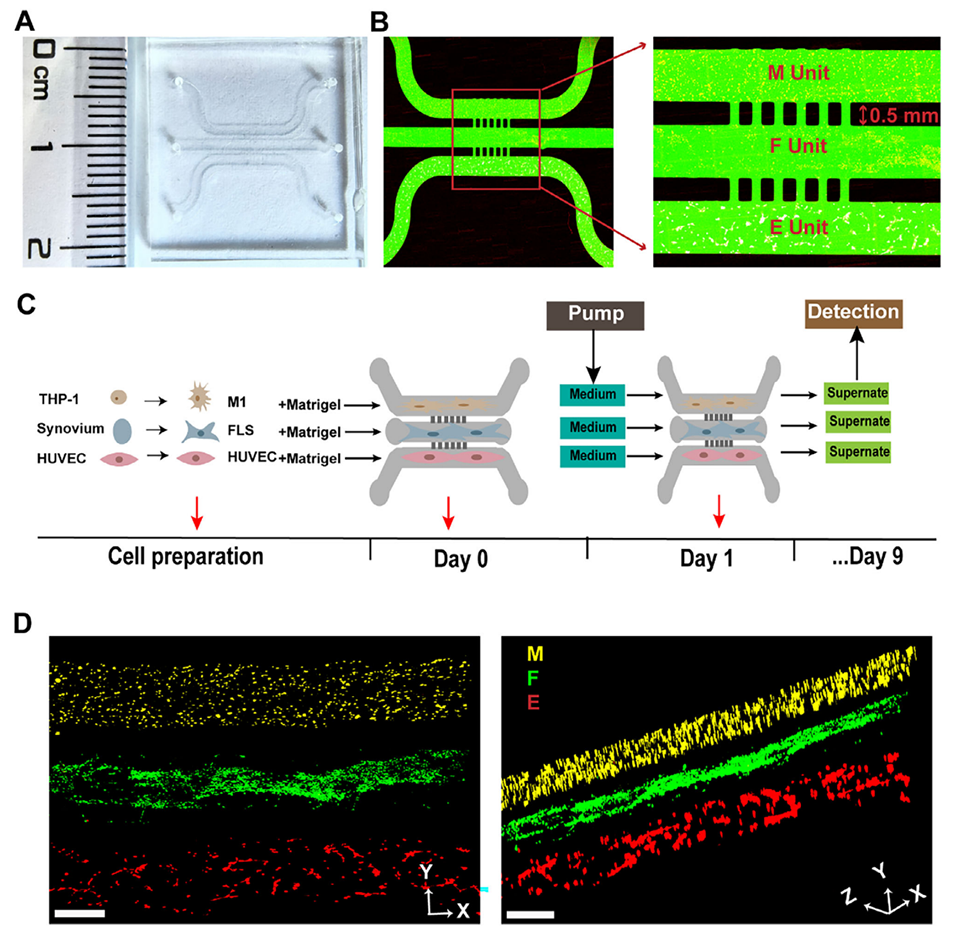
图1:RA滑膜芯片模型的构建。A:芯片的实体照片。B:芯片三个通道的共聚焦显微镜图。中间通道为成纤维样滑膜细胞(FLSs, F单元),两侧通道分别为M1型巨噬细胞(M单元)和人脐静脉内皮细胞(HUVECs, E单元)。C:模型培养示意图。第0天将三种细胞分别接种到对应通道,第1天开始以3 µL/h的流速进行灌注培养。D:三种细胞在芯片内成功进行3D共培养的共聚焦显微镜图像(黄色:M1巨噬细胞,绿色:RA FLSs,红色:HUVECs)。
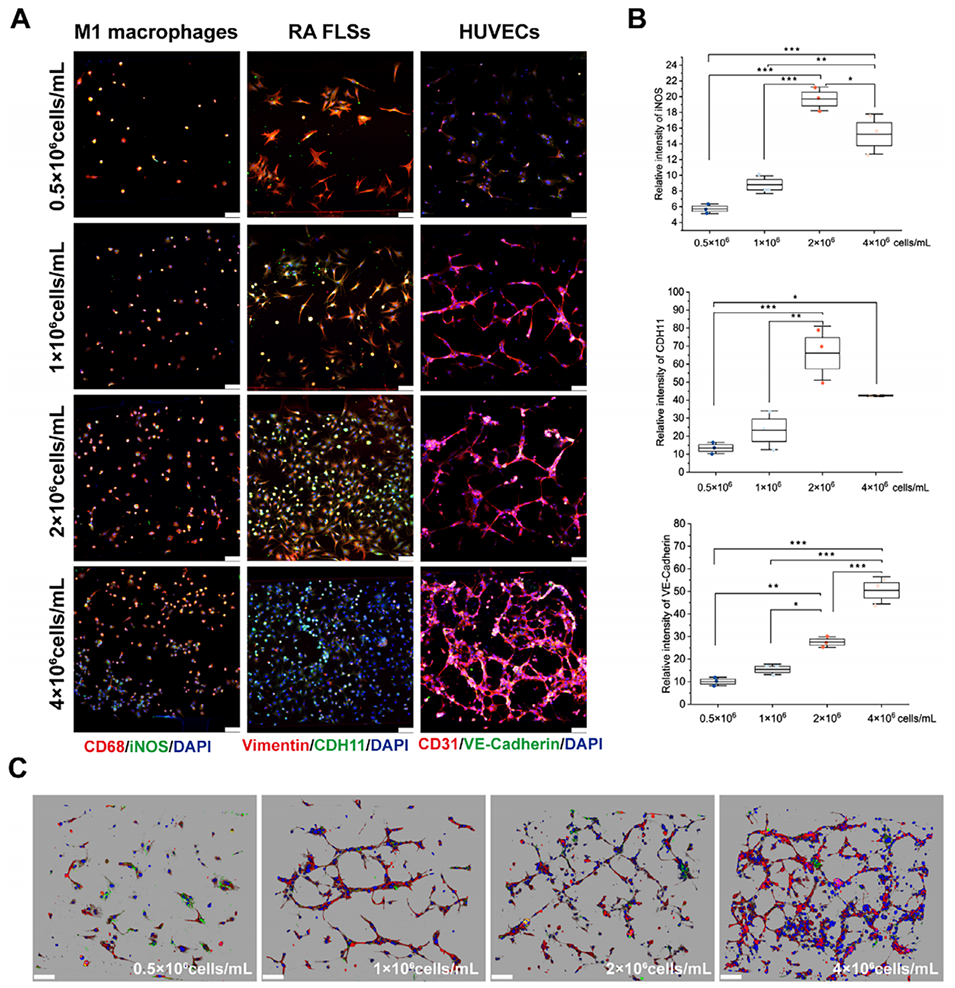
图2:三种细胞接种密度的优化。A-B:通过免疫荧光染色评估不同接种密度下各细胞的功能标志物表达。结果显示,RA FLSs(标志物Cadherin-11)和M1巨噬细胞(标志物iNOS)在密度为 2×106 cells/mL时功能蛋白表达最强。HUVECs(标志物VE-Cadherin)的表达则随密度增加而增强。C:3D成像显示,HUVECs在 0.5×106 cells/mL时无法成管,在 1×106 cells/mL及以上密度时可形成血管网络,且管腔直径随密度增加而减小。最终确定RA FLSs和M1巨噬细胞的优化密度为 2×106 cells/mL。
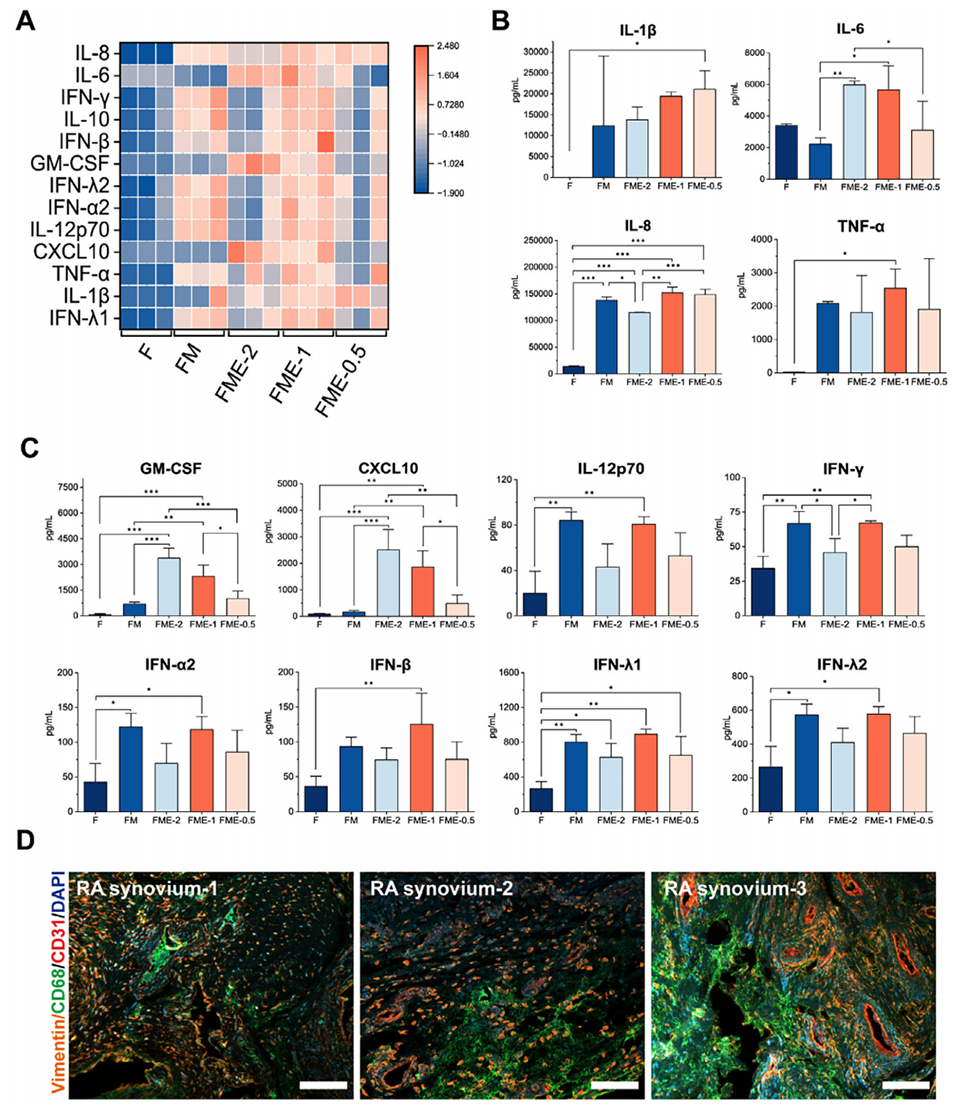
图3:通过炎症特征评估优化三种细胞的接种比例。A-C:检测不同共培养比例组(F单培养、FM 1:1、FME-2 1:1:2、FME-1 1:1:1、FME-0.5 1:1:0.5)的炎症因子水平。发现三细胞共培养(FME)能产生更强的炎症反应。综合考虑IL-6、IL-8等关键因子水平,FME-1(1:1:1)和FME-2(1:1:2)表现出优势。D:对RA患者滑膜组织进行多重免疫荧光染色(Vimentin, CD68, CD31),显示体内三种细胞的相对比例,为确定体外1:1:1的比例提供了临床依据。
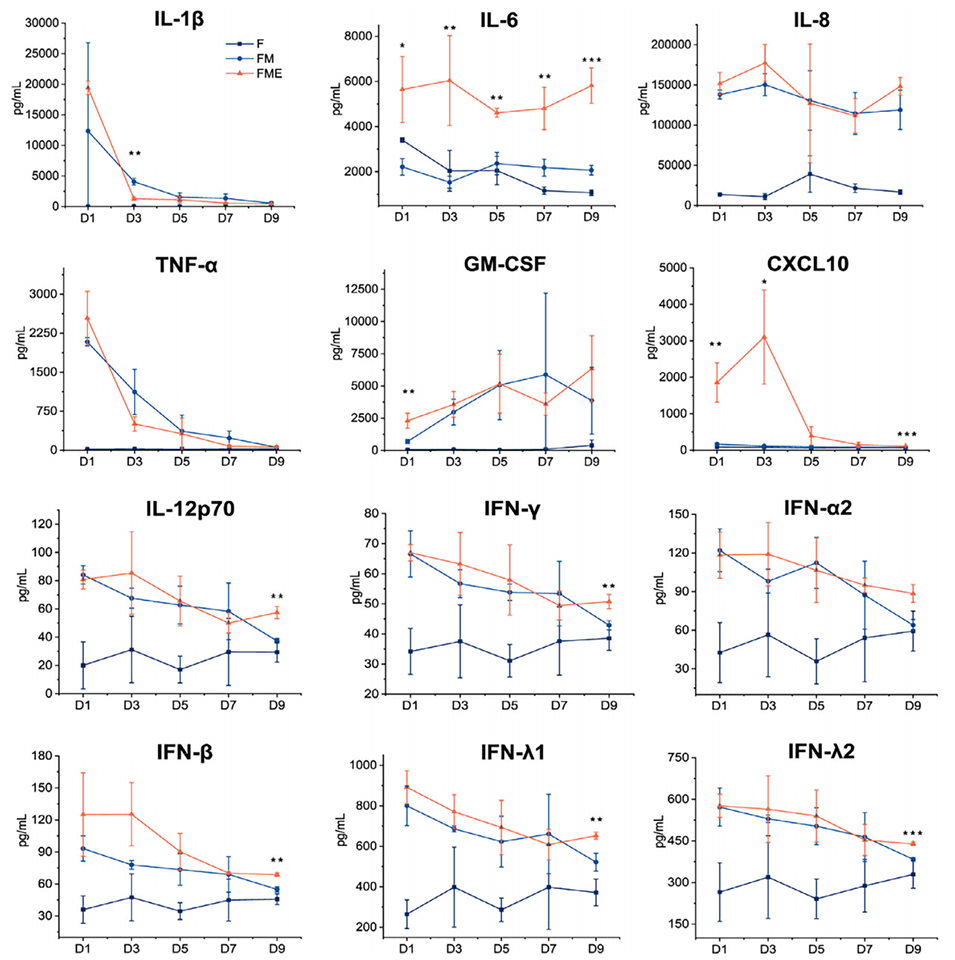
图4:滑膜芯片模型中炎症因子表达的动态分析。该图展示了在9天培养期内,FME三细胞共培养组相比FM两细胞共培养组,能持续维持更高水平的多种炎症因子(如IL-6, IL-8, CXCL10, GM-CSF等),且表达相对稳定,证明了模型可长期保持高炎症状态。
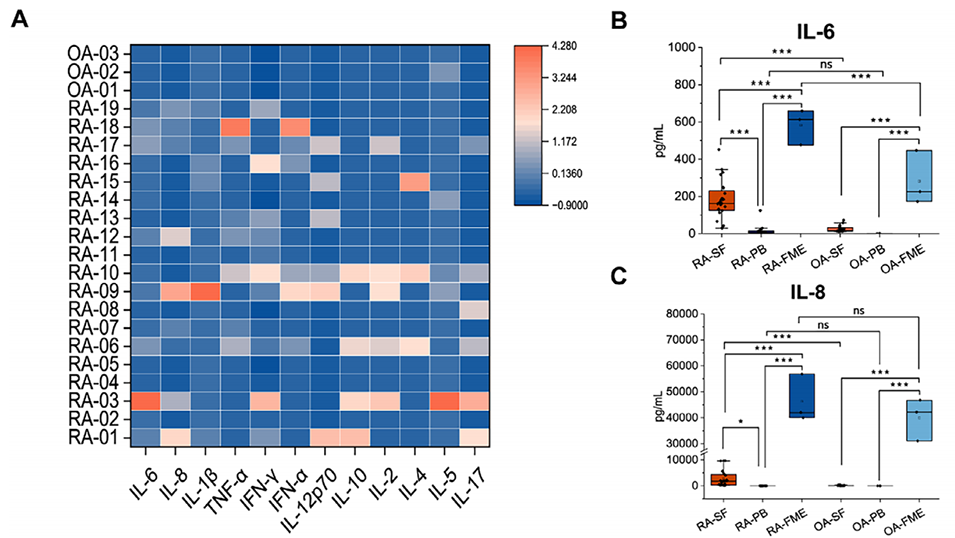
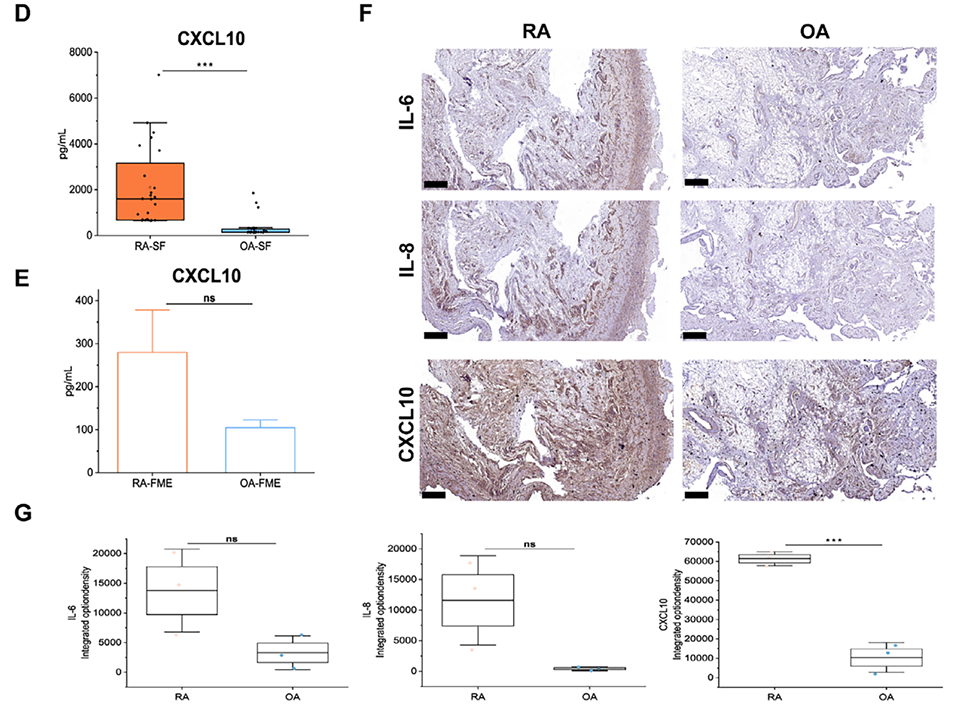
图5:RA与OA患者临床样本中炎症因子水平的分析。A:RA与OA患者外周血中多种炎症因子的热图。B-E:定量分析显示,RA患者滑液(SF)中的IL-6、IL-8和CXCL10水平显著高于其自身外周血(PB)及OA患者的滑液。更重要的是,利用RA患者原代细胞构建的芯片模型(RA-FME)中这些因子的水平甚至高于临床滑液样本。F-G:免疫组化证实IL-6、IL-8和CXCL10在RA患者滑膜组织中的表达显著高于OA组织。
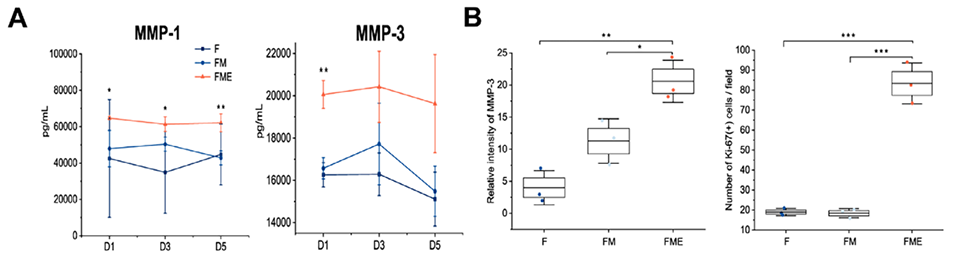
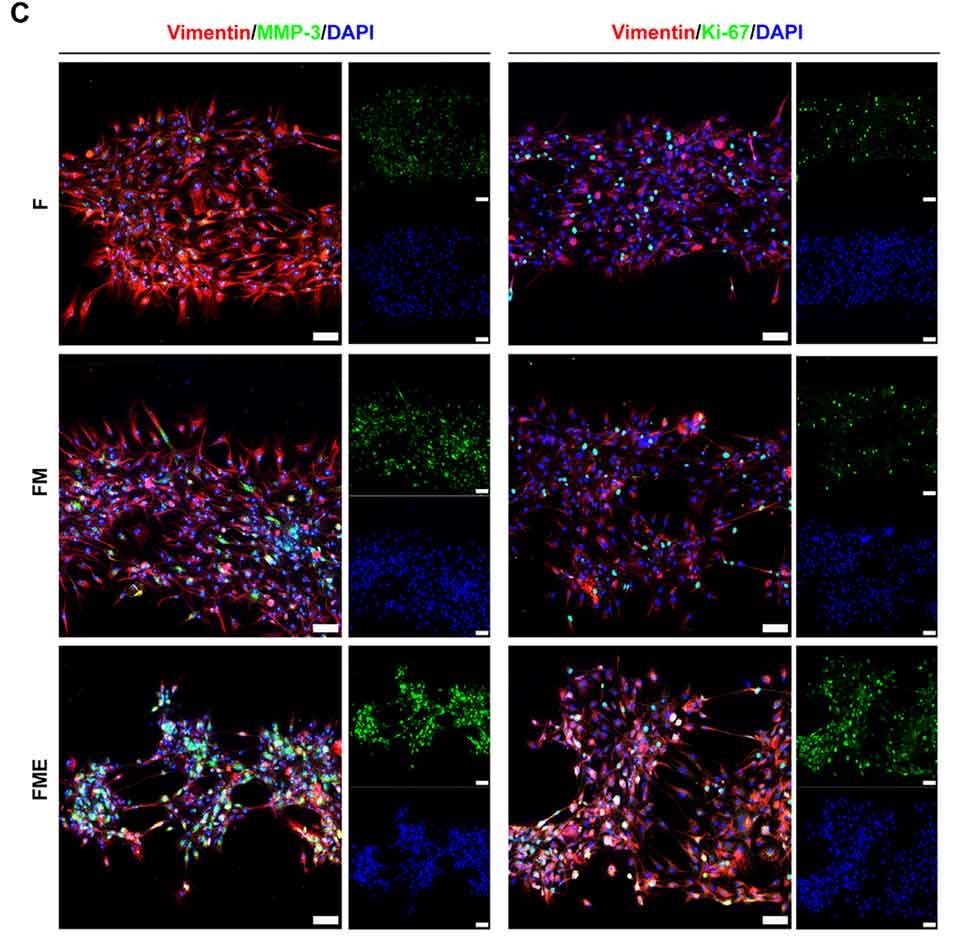
图6:分析RA FLSs在芯片模型中的侵袭能力与增殖特性。A:ELISA检测显示,三细胞共培养组(FME)中基质金属蛋白酶MMP-1和MMP-3的水平显著高于两细胞共培养组(FM),表明其侵袭能力更强。B-C:免疫荧光染色和定量分析进一步证实,RA FLSs的MMP-3(侵袭标志)和Ki-67(增殖标志)表达在FME组中最高,说明M1巨噬细胞和内皮细胞共同增强了RA FLSs的病理特性。
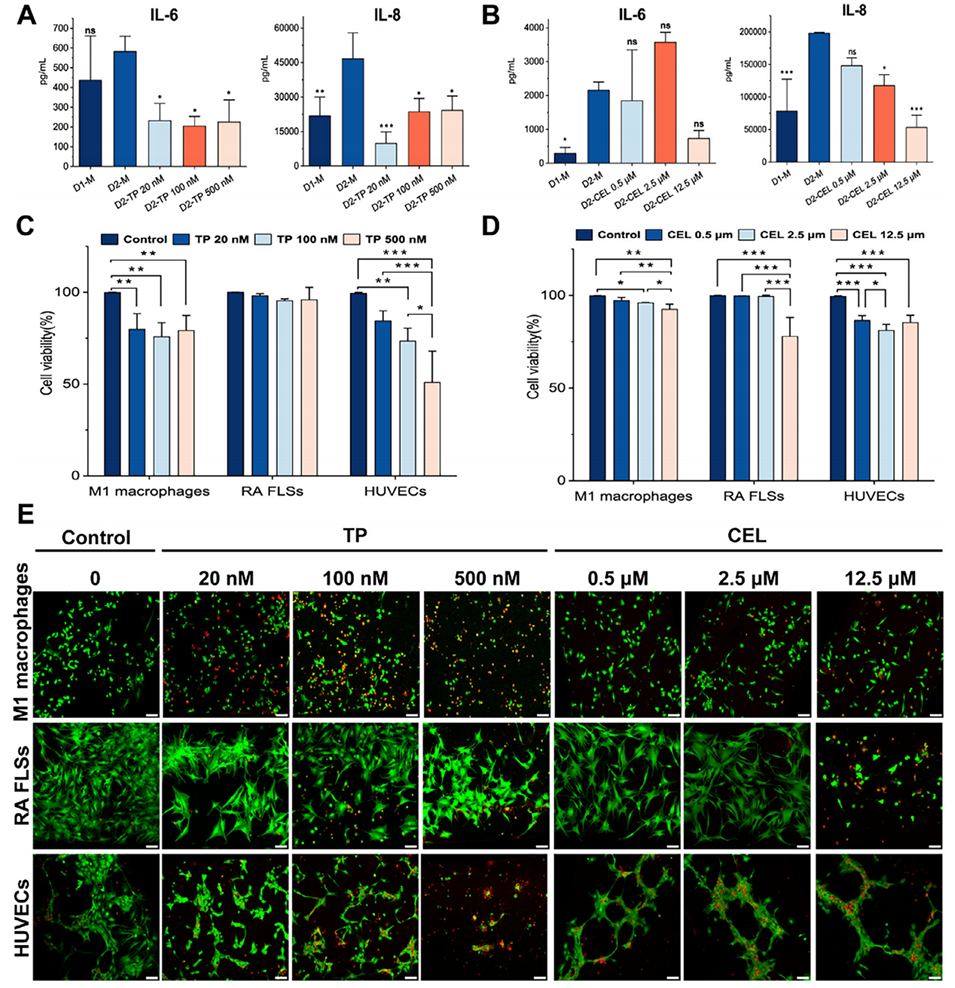
图7:在滑膜芯片模型中评估药物(TP和CEL)的疗效与毒性。A-B:药效评估:TP和CEL能剂量依赖性地显著降低模型中的IL-6和IL-8水平。C-E:毒性评估:活死染色显示,TP对RA FLSs毒性较小,但对M1巨噬细胞和HUVECs有显著毒性;而CEL对三种细胞均有明显毒性。这证明了该模型能够同时且分别评估药物对不同细胞类型的毒性。
论文链接:https://doi.org/10.1002/advs.202511945
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














