
导读:
基于光镊的细胞分选技术因其非接触、低损伤的优势而备受关注,但传统方法依赖检测技术识别细胞类型并需动态移动光镊,限制了通量并增加了系统复杂度。近期,安徽医科大学毛宇昕副教授、周金华副教授和中国科学技术大学潘挺睿教授等人开发了一种基于固定位置光镊的无检测高通量细胞分选技术,通过设计带弧形突起的微流控芯片,借助流体动力与光学力协同作用引导目标细胞,在无需检测模块和光镊动态移动的情况下,将理论分选通量提升至10个细胞/秒,同时降低系统复杂度与成本,在粒子分选和癌细胞-红细胞分离实验中展现出高纯度与良好细胞活性。相关研究以“Detection-free high-throughput cell sorting using fixed-position optical tweezers”为题目,发表在期刊《Sensors and Actuators B: Chemical》上。
本文要点:
1、本研究结合固定位置的光镊与具有弧形突起的微流控芯片,提出一种免检测、高通量的细胞分选新方法。
2、目标细胞在流体动力与光力的共同作用下被引导至收集通道,无需实时检测或光镊重定位,系统理论通量提升至10 cells/s。
3、实验结果显示,该系统可成功分选10 μm与7 μm颗粒,纯度达98.2%;并能从红细胞中分离癌细胞,纯度达95.5%,同时保持高细胞活性(91.5%)。该方法适用于临床诊断、药物筛选及单细胞基因组学等场景。
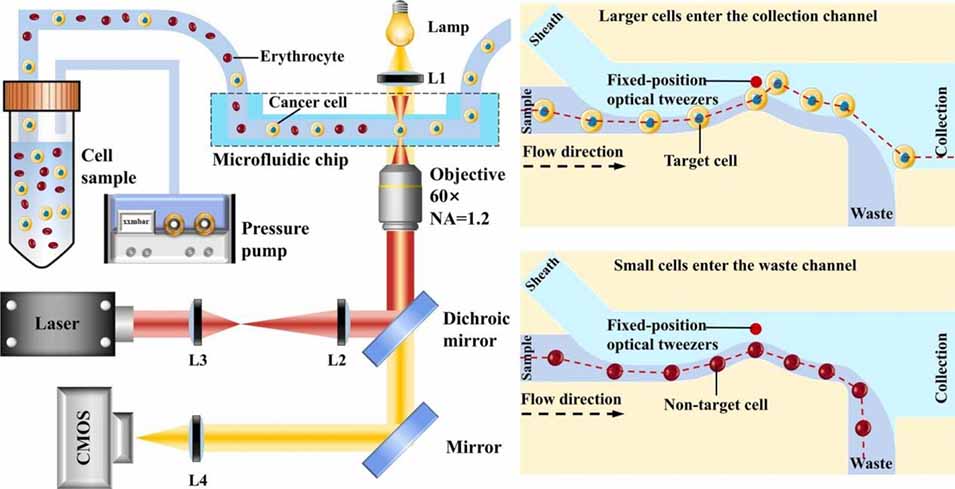
光镊技术分选细胞的核心原理是利用光学梯度力与流体动力的协同作用,通过精准操控细胞受力平衡实现目标细胞与非目标细胞的分离。具体可分为以下三个环节:
1、核心作用力:光学梯度力的选择性操控
光镊通过聚焦激光束形成强光强梯度区域,当细胞(dielectric particles,介电粒子)穿过该区域时,会因光的动量交换产生光学梯度力(Fo) 。该力大小与细胞特性直接相关:细胞体积越大、与周围介质的折射率差异越显著,光学梯度力越强;反之则越弱。公式 Fo=½α∇I(r) 中,α(细胞极化率)体现细胞自身特性,∇I(r)(光强梯度)由激光聚焦状态决定,两者共同决定细胞所受光学梯度力的强弱,这是区分目标与非目标细胞的核心依据。
2、辅助作用力:流体动力的定向输送
分选过程依赖微流控芯片中的流体动力(主要是流体拖曳力 Fv)实现细胞的定向移动。芯片内的样品流与鞘流形成稳定层流,细胞随样品流进入分选区域(如喉部结构)时,会受到鞘流带来的流体拖曳力(公式 Fv=3πμdΔv,μ 为流体黏度,d 为细胞直径,Δv 为细胞与鞘流的相对速度)。对于目标细胞,其受的光学梯度力足以克服流体拖曳力,使其从样品流偏转至鞘流;非目标细胞因光学梯度力弱,无法对抗拖曳力,只能随样品流进入废液通道。
3、固定位置设计:简化操作并提升效率
传统光镊需动态调整位置以追踪细胞,而该研究中光镊固定在鞘流通道内,无需频繁移动。通过芯片的弧形突起、喉部结构等设计,可精准控制细胞与光镊的距离:目标细胞进入光镊作用范围后,被光学梯度力“捕获”并偏转至鞘流,再随鞘流进入收集通道;非目标细胞因距离光镊远、受力不足,直接随样品流排出,最终实现免检测、高通量的细胞分选。
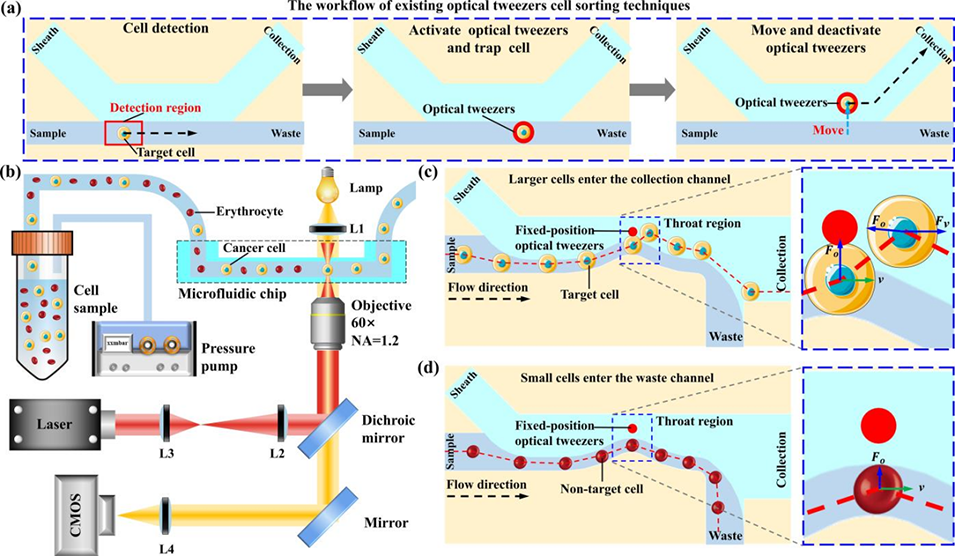
图1:固定位置光镊细胞分选系统示意图。(a) 现有光镊分选方法流程: 需要探测器识别细胞,并动态控制下游光镊进行捕获和移动。(b) 本系统实验装置: 主要由微流控芯片和固定位置的光镊模块组成。(c) 大细胞(目标)进入收集通道: 在流场和光场的共同作用下,大细胞因受到足够的光梯度力而发生偏转,从样品流进入鞘液流,最终进入收集通道。(d) 小细胞(非目标)进入废液通道: 由于尺寸小、离光镊远,所受光学力可忽略,因此留在样品流中进入废液通道。

图2:10μm与7μm颗粒的分选轨迹。(a) 10μm颗粒被分选的过程: 高速相机记录显示,颗粒在喉道区域与光镊相互作用后被成功偏转至收集通道。(b) 7μm颗粒未被分选的过程: 该颗粒因光学力不足,始终沿样品流运动,最终进入废液通道。
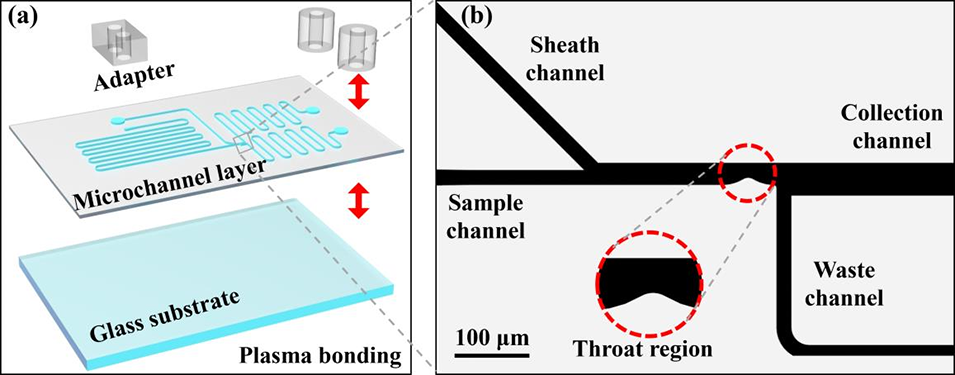
图3:微流控芯片的设计与制造。(a) 芯片结构爆炸图: 芯片由适配器、微通道层和加强层(玻璃基片)通过氧等离子体键合而成。(b) 分选区域结构: 展示了喉道形状的微通道,该设计可缩短细胞与光镊之间的距离,从而增强光学梯度力。
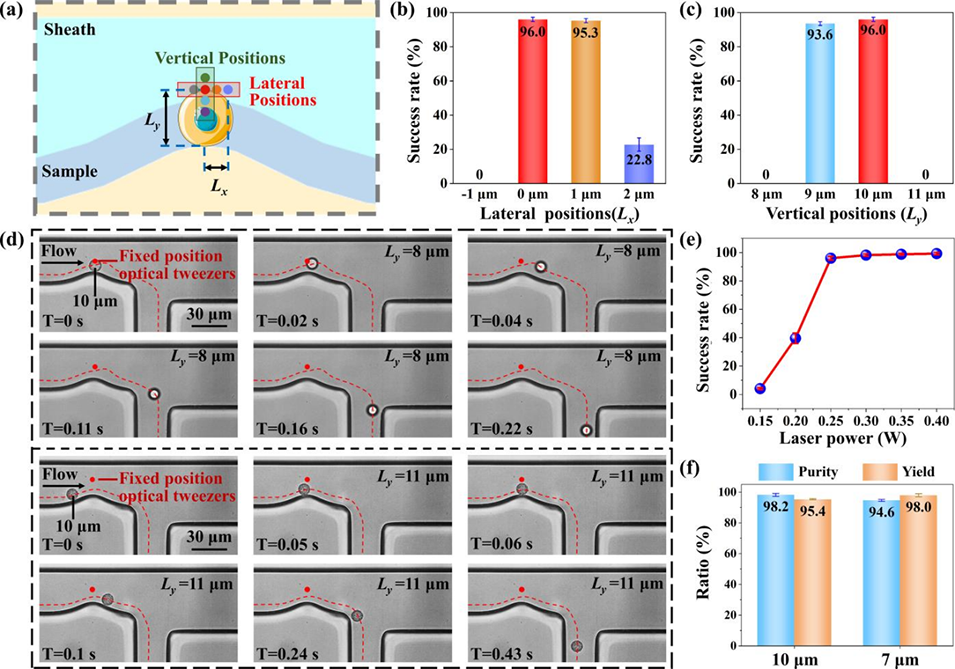
图4:光镊位置和激光功率的优化。(a) 光镊位置定义示意图: 定义了光镊相对于通道边缘的横向(Lx)和纵向(Ly)位置。(b) 横向位置影响: 当Ly固定为10μm时,光镊正对喉道最窄处上方(Lx=0)时分选成功率最高。(c) 纵向位置影响: 当Lx固定为0时,Ly为10μm(等于目标颗粒的最小尺寸)时分选成功率最高。(d) 分选失败案例: Ly太近(8μm)或太远(11μm)都会导致分选失败。(e) 激光功率影响: 功率达到0.25W后,分选成功率趋于稳定。(f) 优化后的分选性能: 在最佳参数下,10μm和7μm颗粒的分选纯度和得率均很高。
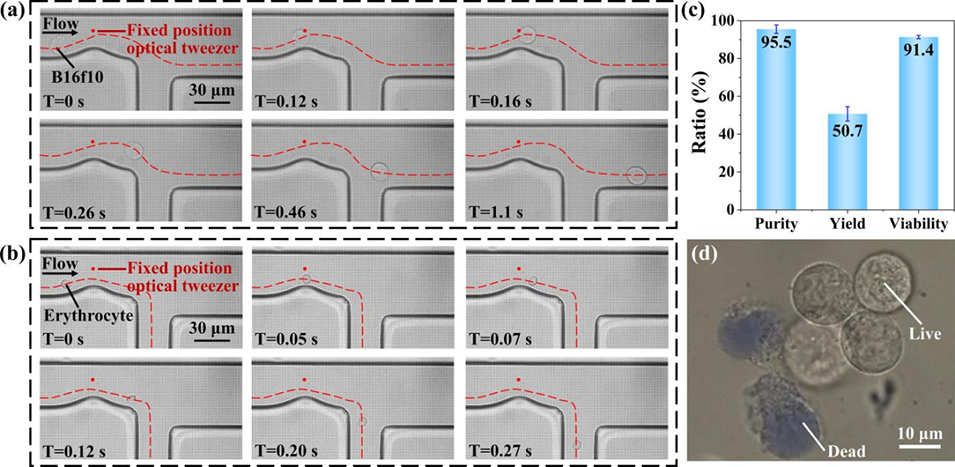
图5:癌细胞与红细胞的分选。(a) B16F10癌细胞(被分选)轨迹: 在光镊和流场作用下,癌细胞被成功引导至收集出口。(b) 红细胞(未被分选)轨迹: 因光学力不足,红细胞直接流入废液出口。(c) 分选纯度、得率和细胞活性: 癌细胞分选纯度达95%,但得率较低(51%);细胞活性保持91%。(d) 台盼蓝染色图: 显示分选后的癌细胞仍保持高活性。
论文链接:https://doi.org/10.1016/j.snb.2025.138824
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














