液滴微流控是一项能够精确操控皮升至纳升级液滴的先进技术,在生物医学领域展现出巨大潜力。该技术通过流动聚焦等方法,可生成尺寸偏差低于5%、频率超每秒10000个的高均匀性液滴,具备高通量、低试剂消耗和防交叉污染等优势,已成为单细胞分析、药物筛选和疾病诊断的重要工具。

近期,中国科学院北京纳米能源与系统研究所程廷海研究员、李恒禹副研究员联合浙江大学韩冬研究员发表综述,系统梳理了液滴微流控技术的液滴生成、操控与检测核心环节,深入探讨其在单细胞分析、3D细胞培养、药物研发及疾病防治等生物医学领域的应用价值,并剖析当前技术挑战与未来发展方向。相关研究成果以“Innovative Advances in Droplet Microfluidics”为题目发表于期刊《Research》。
本文要点:
1、系统综述了液滴的生成、操控与检测方法,包括被动与主动生成策略、多种物理场操控技术,以及光学、质谱、电学和基于摩擦纳米发电机(TENG)的检测手段。
2、重点探讨了其在3D细胞培养、药物开发和癌症研究等前沿生物医学应用中的最新进展。
3、展望了多功能集成、自驱动系统和智能化发展等未来方向,以推动该技术在生物医学领域的更广泛应用。
一张图读懂全文

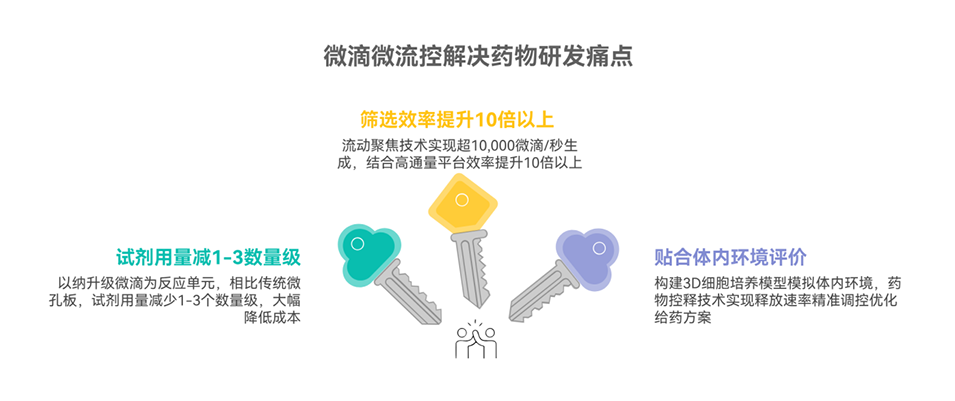
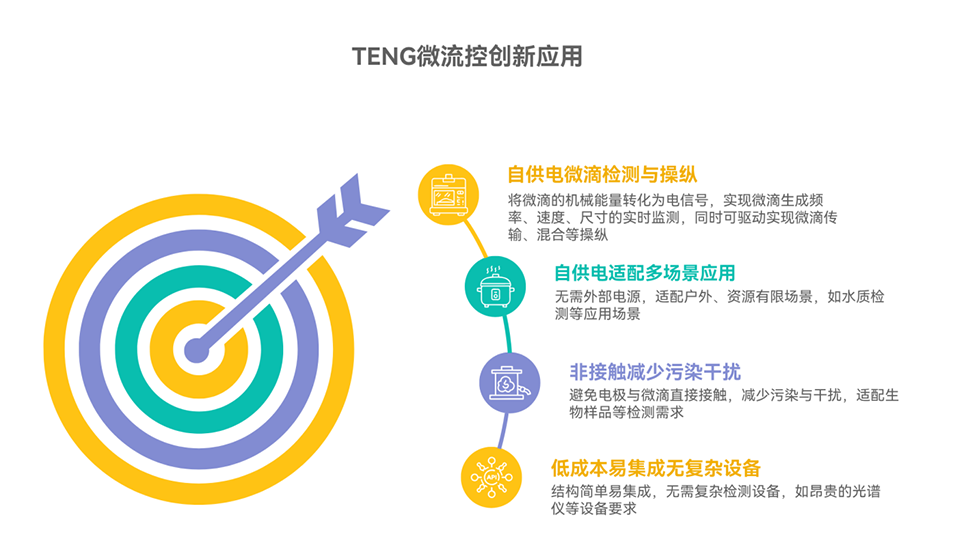
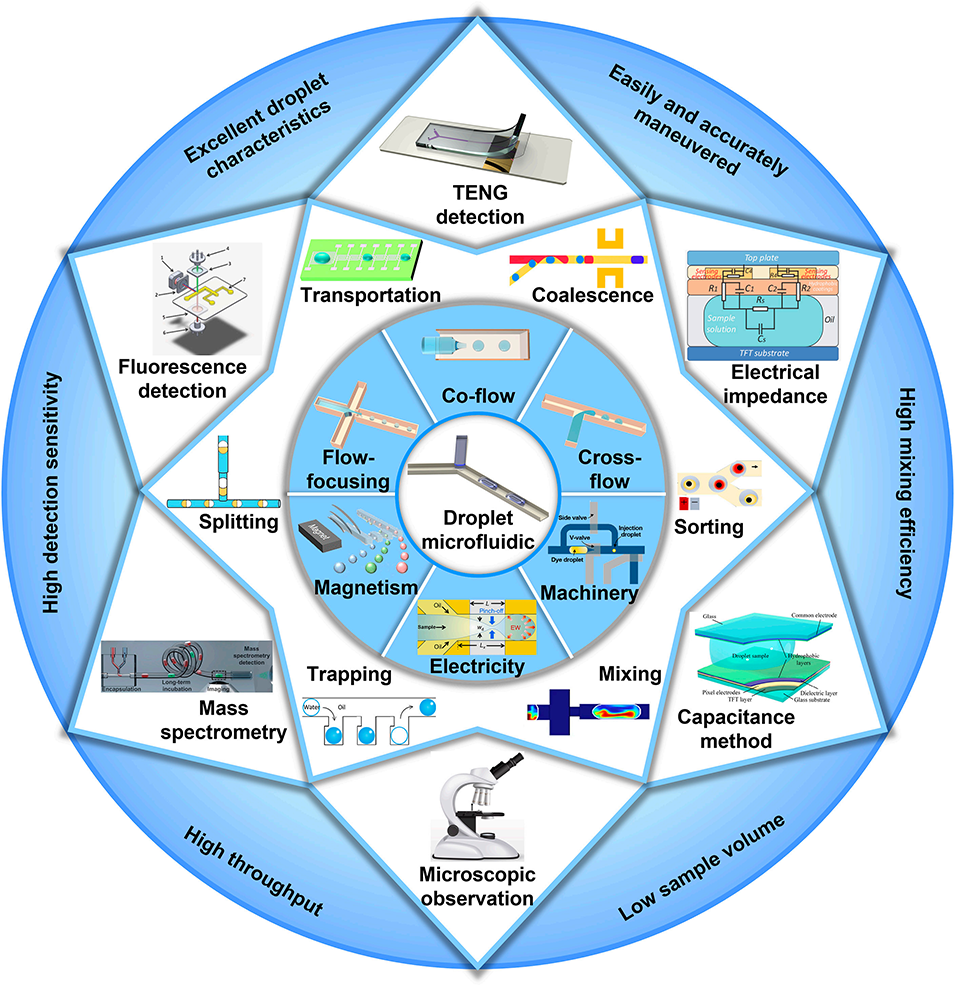
图1: 液滴微流控系统概览。该图展示了液滴微流控系统的完整工作流程和关键技术模块,包括利用磁、电、机械等方法进行液滴生成;在芯片内进行的混合、捕获、分裂、输运、融合、分选等操控;以及基于TENG、电阻抗、电容、质谱、荧光等多种原理的液滴检测技术。
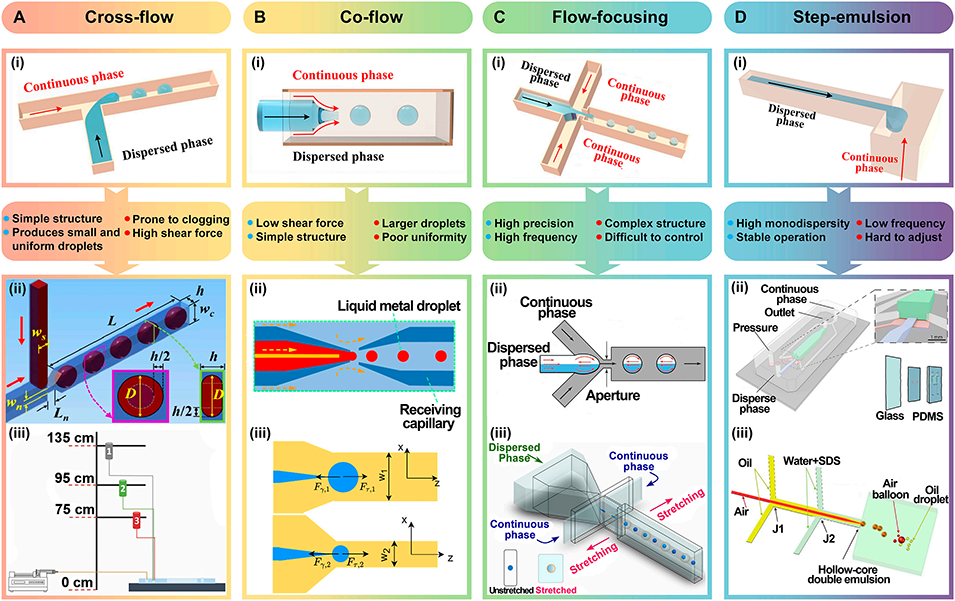
图2: 被动生成方法。展示了四种主要的被动液滴生成技术:A. 交错流:包括基本的T型结、带颈缩结构的T型结以及重力驱动的高通量生成系统。B. 共流:采用同轴通道,利用连续相对分散相的剪切力生成液滴,适用于双乳液液滴。C. 流动聚焦:连续相从两侧挤压分散相,可产生高度均一的微小液滴。D. 阶梯乳化:利用通道突然扩张的几何结构,依靠界面张力驱动液滴断裂,单分散性极佳。
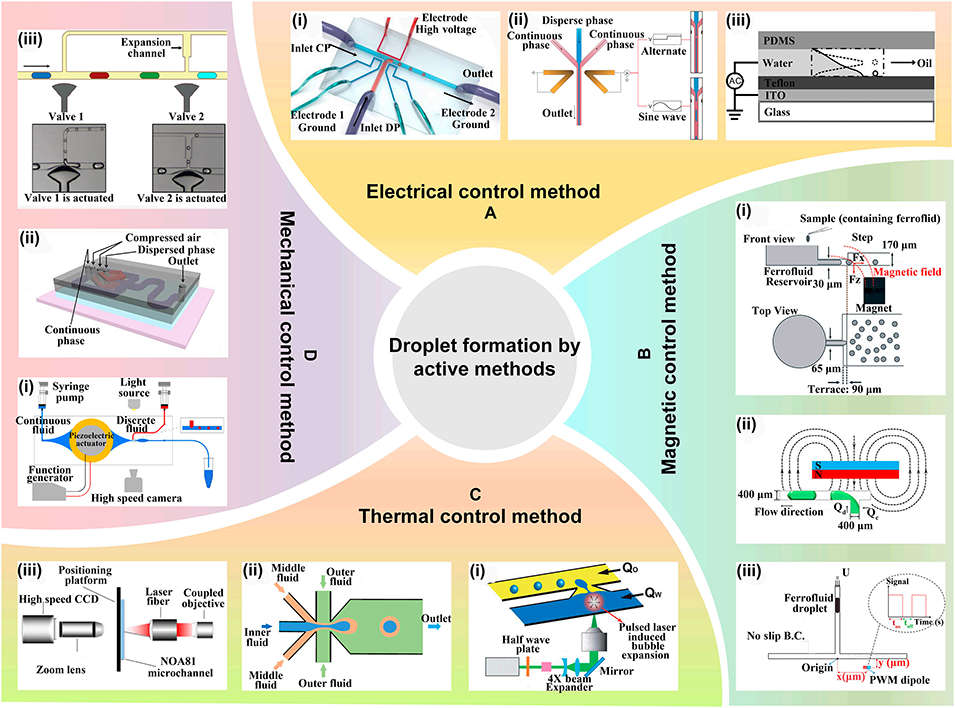
图3: 主动生成方法。展示了利用外部场主动控制液滴生成的方法:A. 电控:通过施加电场或采用电润湿效应控制液滴生成。B. 磁控:利用磁场操控铁磁流体形成液滴。C. 热控:通过激光脉冲或热电冷却器改变温度,影响流体属性以控制生成。D. 机械控制:使用压电驱动器、气动膜阀等机械部件按需生成液滴。
微滴微流控中被动与主动生成方法的核心差异是什么?在单细胞分析场景中应优先选择哪种方法?
其核心差异在于驱动力来源与调控灵活性——被动方法依赖通道几何结构与流体参数(如剪切力、界面张力),无需外部力,优势是结构简单、成本低,但调控灵活性差;主动方法依赖外部力(电/磁/热/机械),可实现可编程、按需生成,调控性强,但结构复杂、部分依赖特殊流体(如磁方法需铁磁流体)。
单细胞分析场景应优先选择被动方法中的阶跃乳化:因其单分散性优异(尺寸变异系数<2%),可确保每个微滴仅封装单个细胞;且低流速需求适配敏感生物样品(避免剪切力损伤细胞),同时兼容数字PCR等下游检测,符合单细胞分析对精准性、低损伤、高均匀性的需求。
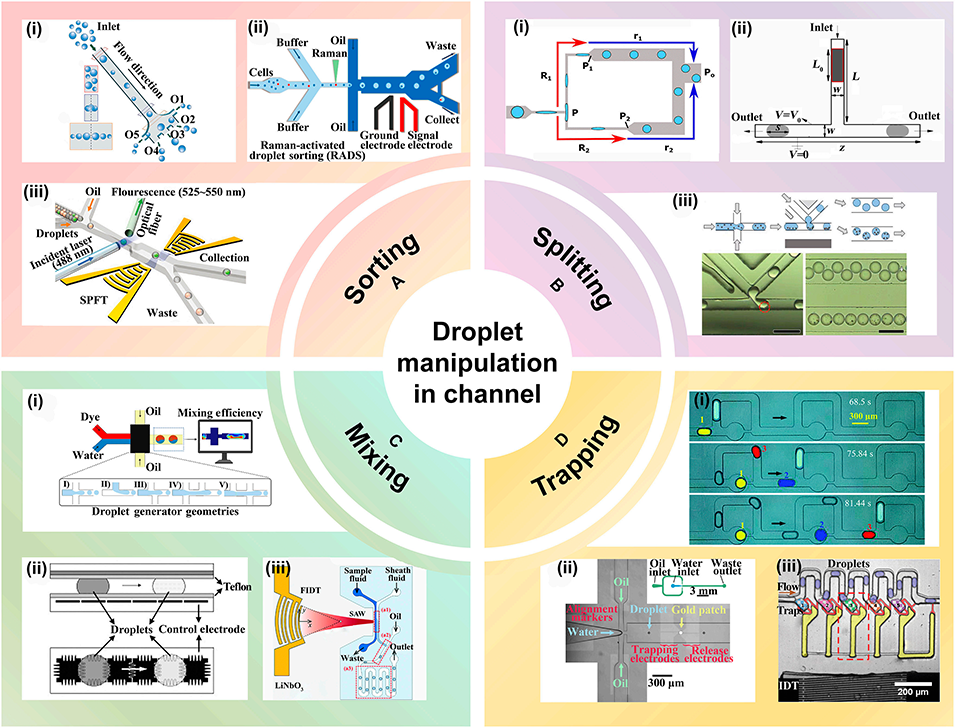
图4: 芯片内的液滴操控。展示了在微流控通道内对液滴进行的多种操作:A. 分选:基于惯性、介电泳或声场等原理将液滴引导至不同路径。B. 分裂:通过拉伸通道结构、不对称电场或磁场将液滴一分为二。C. 混合:采用特殊交叉结构、电润湿或声流效应促进液滴内试剂混合。D. 捕获:利用气泡、电润湿电极或声波产生的气泡将液滴固定在特定位置。
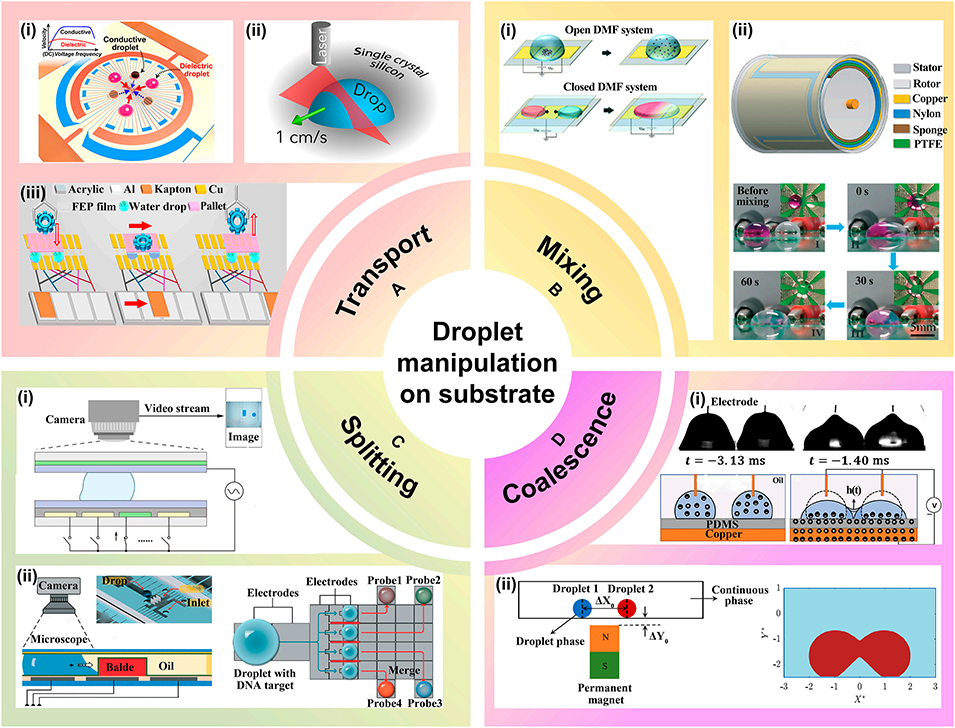
图5: 基底上的液滴操控(数字微流控)。展示了在平面基底上对离散液滴的操控:A. 输运:通过电润湿、光致电润湿或TENG驱动实现液滴的定向移动。B. 混合:利用电致流体动力学或TENG驱动的介电泳实现液滴混合。C. 分裂:采用AI辅助识别或3D微刀片结构进行精确分裂。D. 融合:通过电润湿或磁场诱导液滴合并。
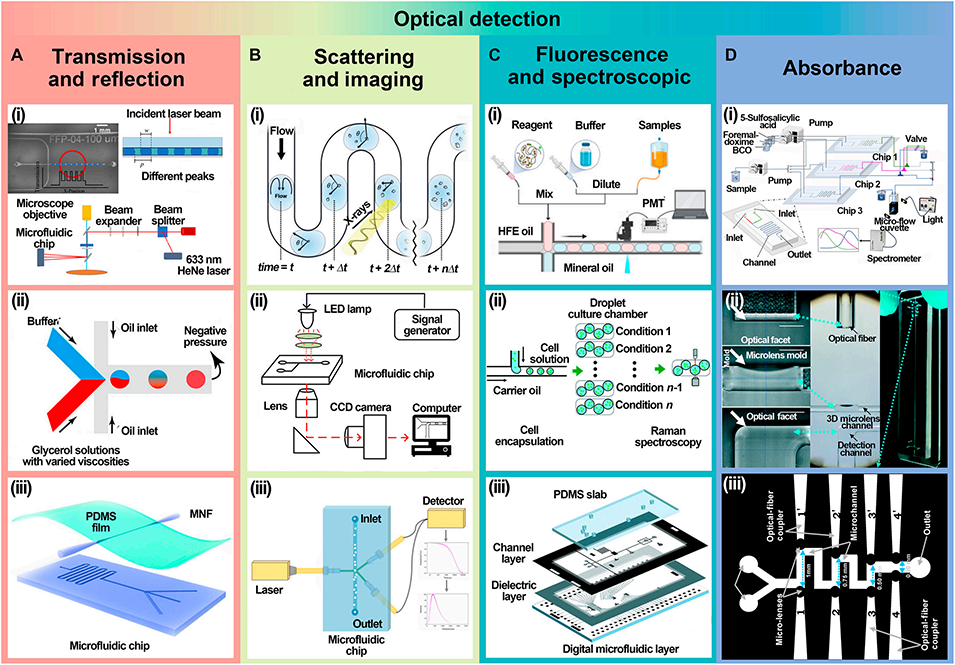
图6: 光学检测方法。总结了各类光学检测技术:A. 透射与反射检测:用于分析液滴内部成分(如凝血检测)或表面特性。B. 散射与成像检测:结合X射线衍射或动态光散射分析颗粒分布与形态。C. 荧光与光谱检测:用于高灵敏度生物标记物检测(如酶活性)和拉曼光谱分析。D. 吸光度检测:基于比尔-朗伯定律对液滴内物质进行定量分析。
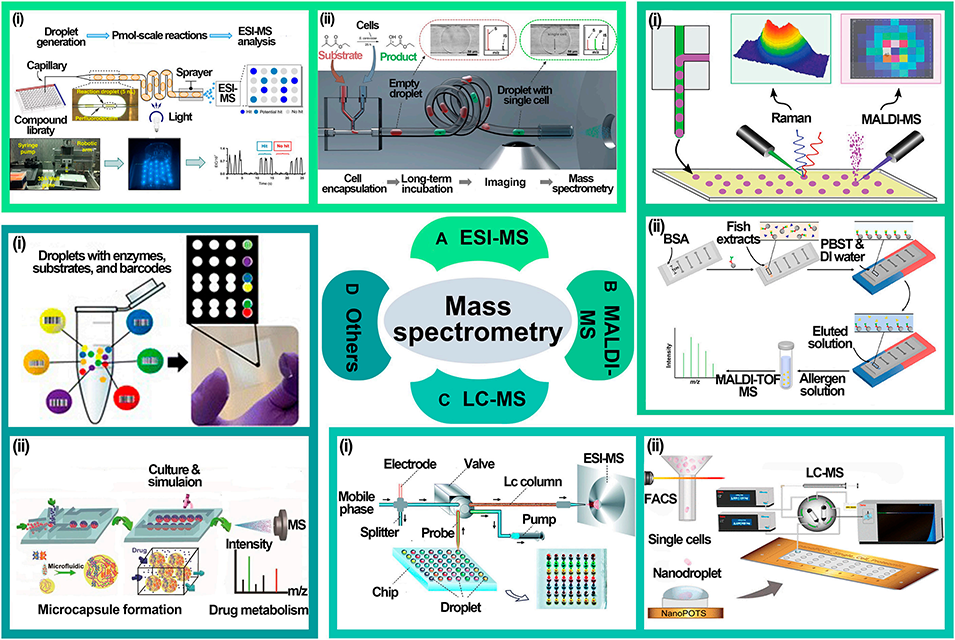
图7: 质谱检测方法。展示了与质谱联用的技术:A. ESI-MS:用于液滴中光化学反应产物、单细胞生物催化转化的高通量分析。B. MALDI-MS:用于神经递质、过敏原等分子的分析。C. LC-MS:用于复杂样品的无标记酶抑制分析、单细胞蛋白质组学。D. 其他质谱方法:如ICP-MS用于单细胞金属元素分析,NIMS用于酶反应筛选。
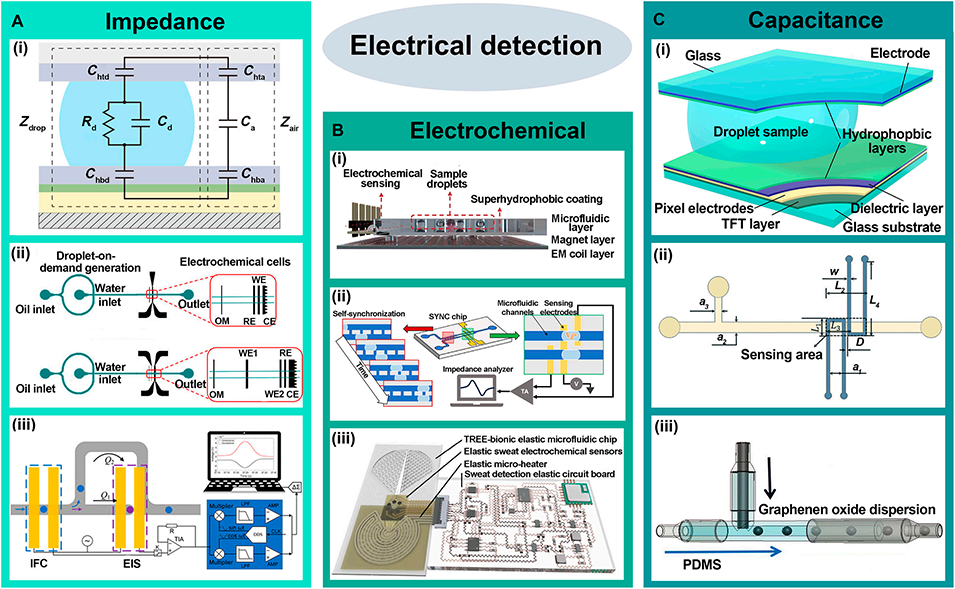
图8: 电学检测方法。总结了基于电信号的检测技术:A. 阻抗检测:用于分析液滴大小、组成和单细胞电特性。B. 电化学检测:用于检测细菌代谢活性、汗液成分等。C. 电容检测:通过测量介电常数变化来监测液滴动态参数。
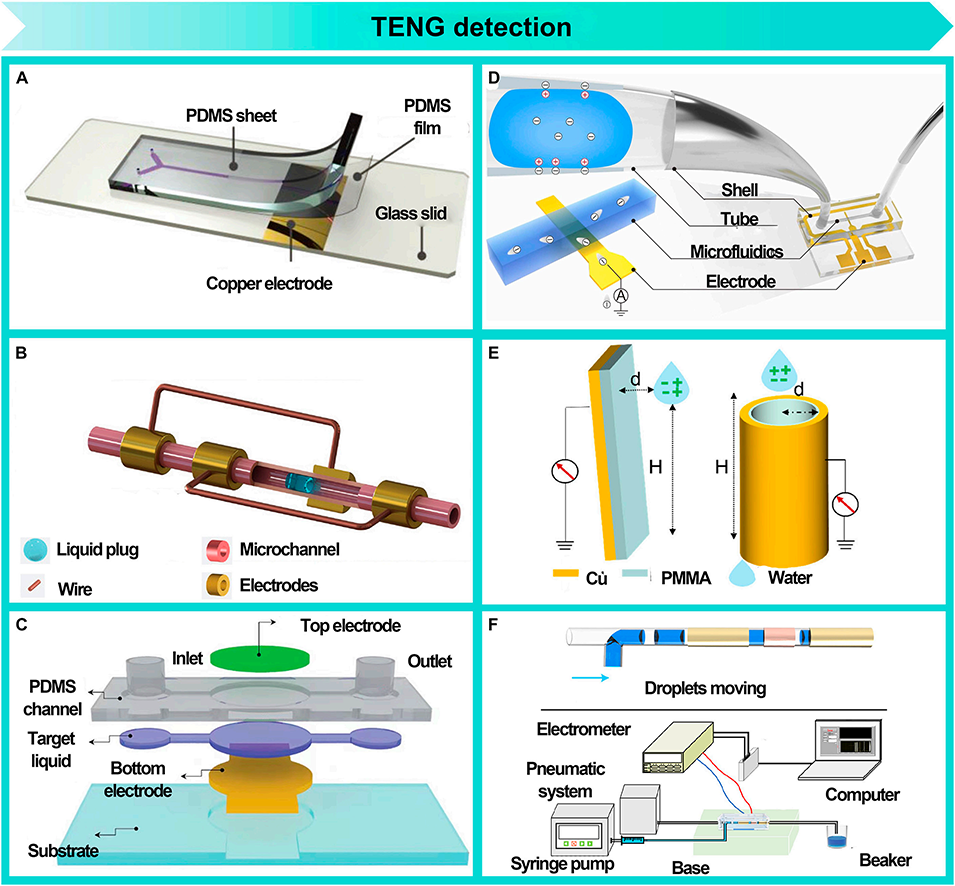
图9: TENG检测方法。展示了基于摩擦纳米发电机的自供能、非侵入式检测技术,能够通过液滴运动产生的电信号实时监测液滴的生成频率、长度、速度、类型和浓度等参数。
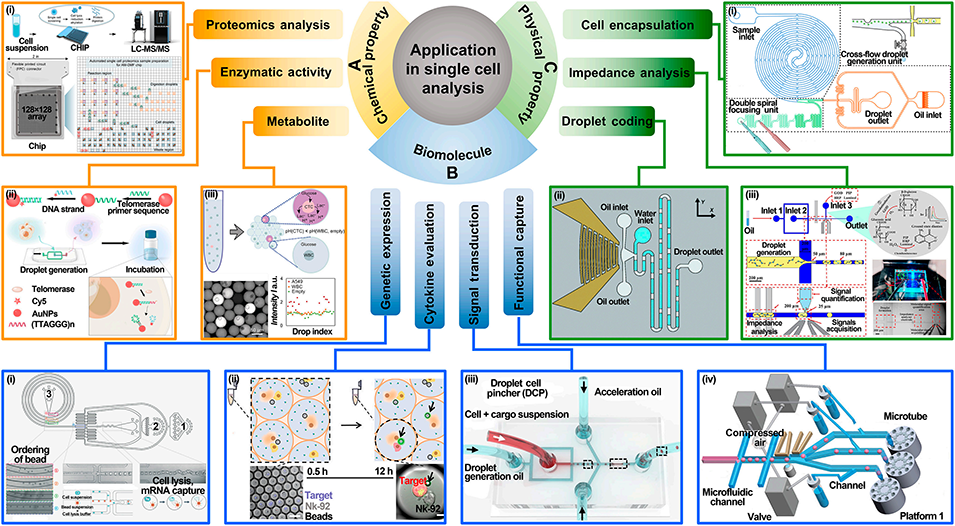
图10: 在单细胞分析中的应用。A. 化学特性:分析单细胞蛋白质组、酶活性(如端粒酶)、代谢物。B. 生物分子:进行单细胞RNA测序、细胞因子释放分析、CRISPR基因递送。C. 物理特性:实现细胞封装、液滴编码、通过阻抗分析测量细胞物理属性。
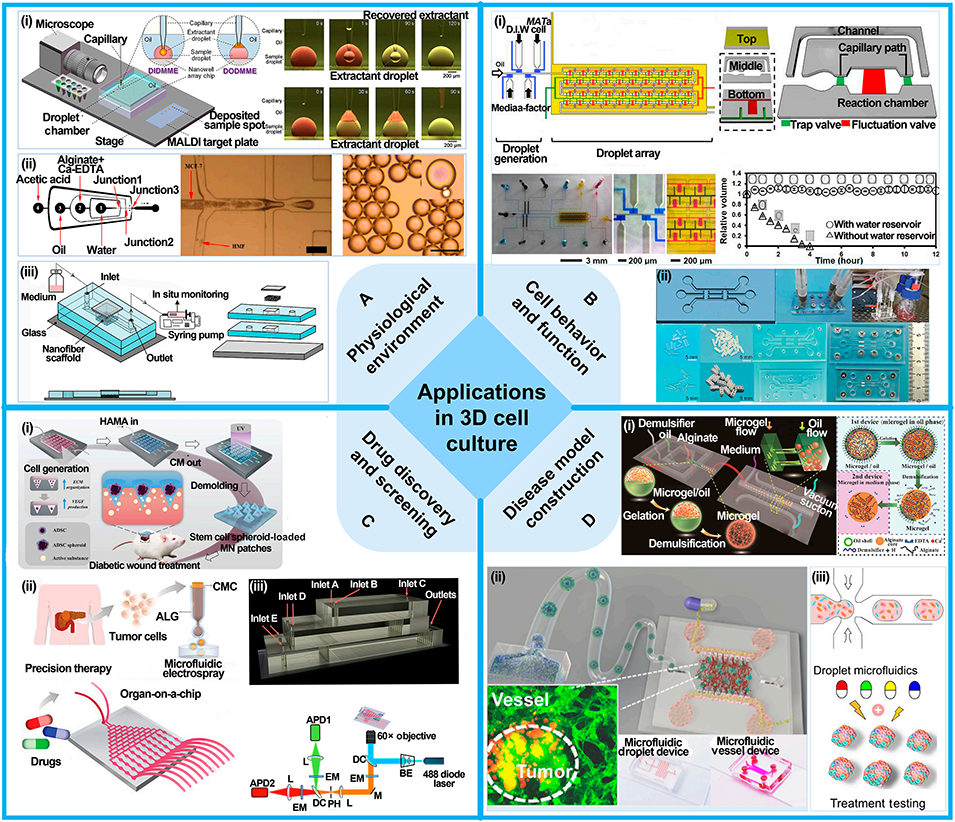
图11: 在3D细胞培养中的应用。A. 生理环境:模拟体内环境,如进行液滴微萃取、生成核壳颗粒、集成纳米纤维支架。B. 细胞行为与功能:实时监测细胞间通讯和细胞迁移。C. 药物发现与筛选:用于3D肿瘤球培养、高通量药物评估。D. 疾病模型构建:构建血管化肿瘤模型、生成均一肿瘤球体。
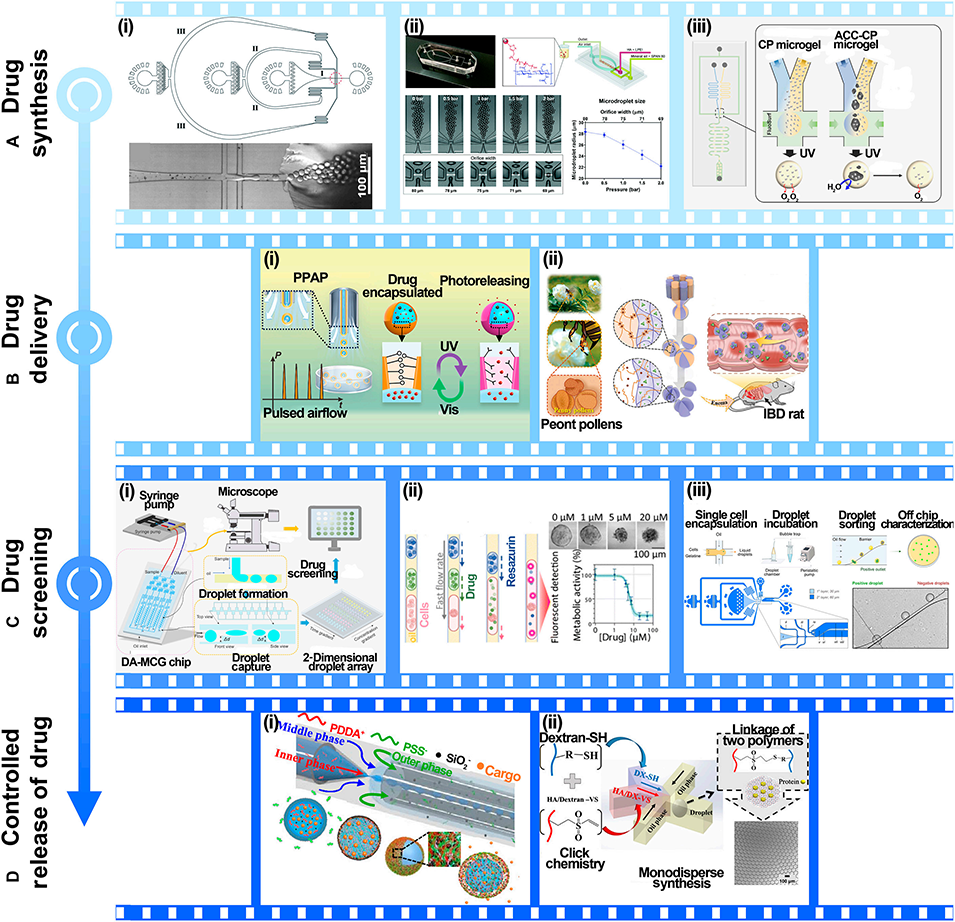
图12: 在药物开发中的应用。A. 药物合成:制备智能响应型纳米药物微胶囊、单分散纳米粒、释氧微凝胶。B. 药物递送:制造光控微胶囊、花粉状多叶形粘附微粒用于靶向给药。C. 药物筛选:利用浓度梯度液滴阵列、自动化平台进行高通量筛选。D. 药物控制释放:制备能响应pH、渗透压等刺激的微胶囊和水凝胶微球。
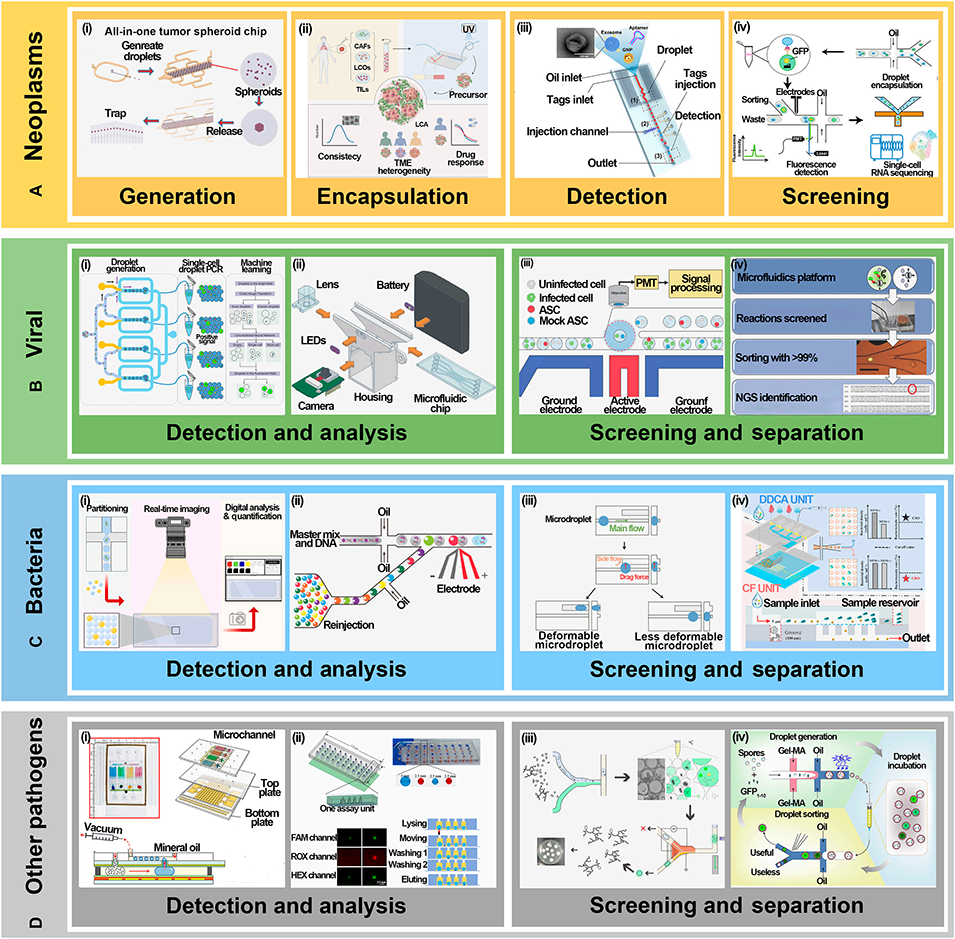
图13: 在疾病防治中的应用。A. 肿瘤:用于生成3D肿瘤球、构建患者特异性肿瘤模型、检测外泌体、筛选抗原特异性T细胞。B. 病毒:进行单细胞多重HPV检测、高通量病毒中和抗体筛选、单病毒颗粒分析。C. 细菌:实时监测活菌、CRISPR快速检测、基于变形性筛选细菌。D. 其他病原体:集成化检测芯片用于多重核酸分析、真菌酶活性筛选。
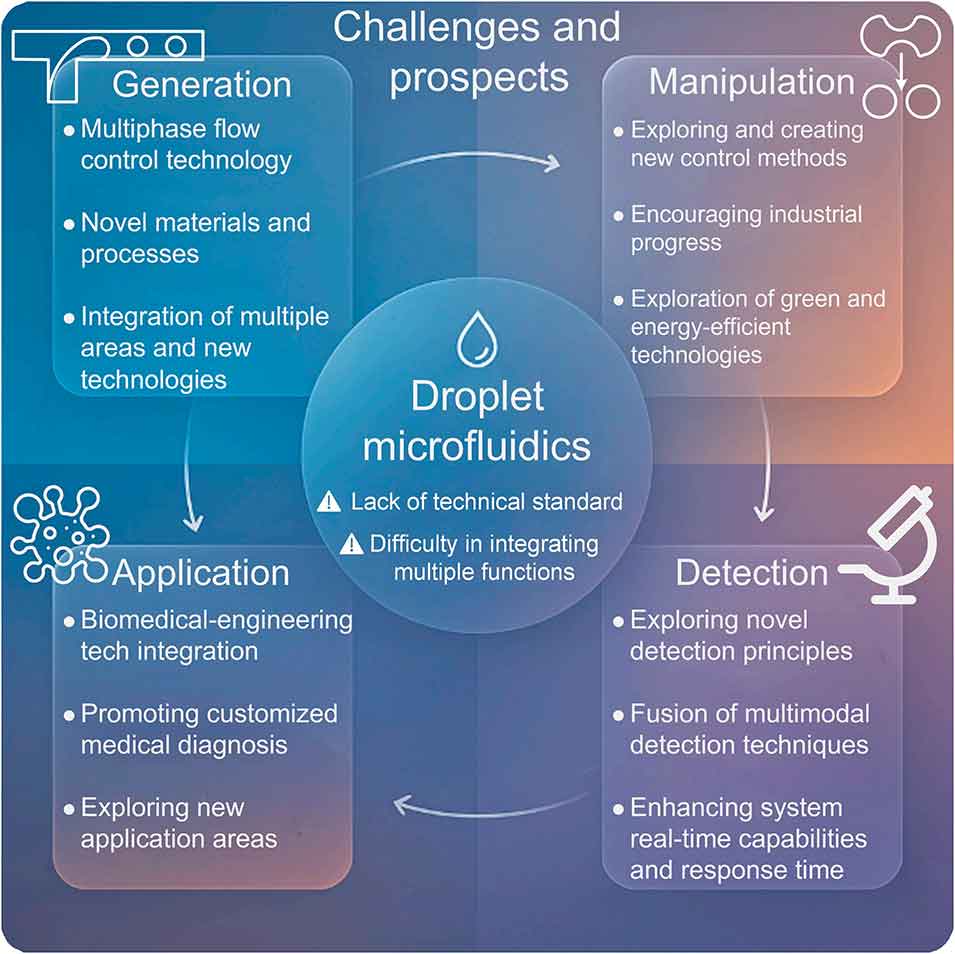
图14: 挑战与展望。该图总结了液滴微流控技术面临的挑战(如多功能集成困难、检测灵敏度与实时性不足)和未来的发展前景(如多功能集成、自驱动系统、智能化与自动化、应用领域拓展)。
论文链接:https://doi.org/10.34133/research.0856
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














