
导读:
骨关节炎(OA)是一种常见的退行性关节疾病,早期诊断和有效治疗对于控制其进展至关重要。近期,武汉理工大学材料科学与工程学院戴红莲研究员团队成功开发了一种负载聚集诱导发光(AIE)纳米胶束的微流控水凝胶微球系统,用于骨关节炎的诊疗一体化研究。该系统通过叶酸靶向与缓释调控,有效抑制M1巨噬细胞极化并促进软骨修复,同时实现了关节炎症部位的持续荧光成像。相关研究以“Microfluidic Microspheres Loaded with Aggregation‐Induced Emission Nanomicelles for Theranostic Applications in Osteoarthritis”为题目,发表于期刊《Advanced Healthcare Materials》。
本文要点:
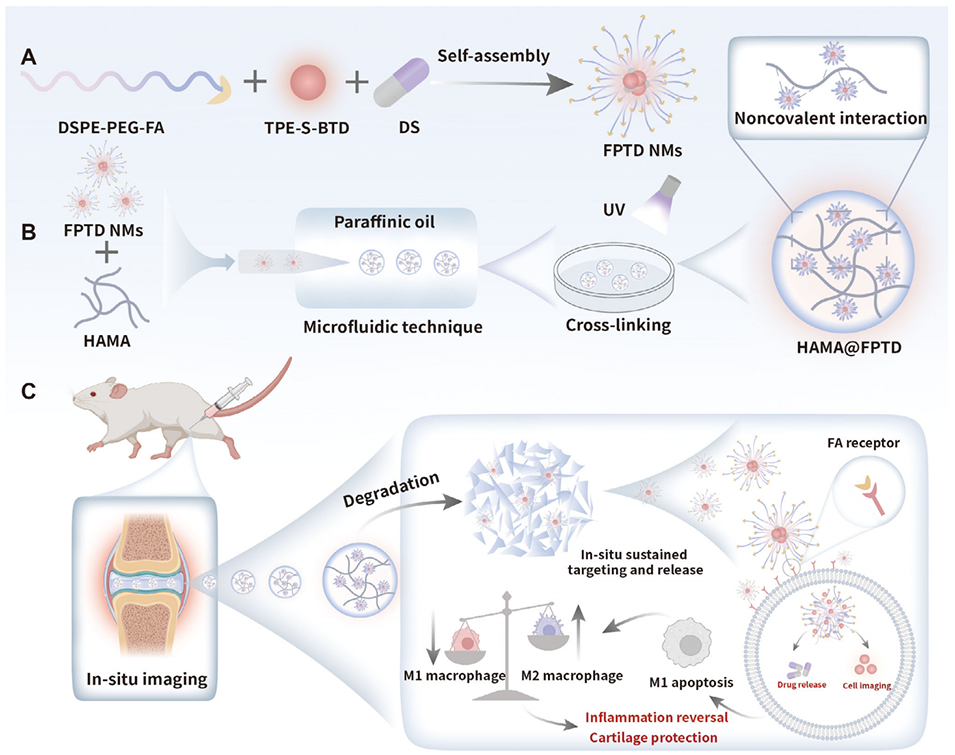
1、本研究开发了一种基于聚集诱导发光(AIE)探针TPE-S-BTD的纳米胶束-水凝胶微球复合系统(HAMA@FPTD),用于骨关节炎(OA)的诊断与治疗。
2、该系统通过微流控技术将载有TPE-S-BTD和抗炎药双氯芬酸钠(DS)的叶酸修饰纳米胶束封装于甲基丙烯酰化透明质酸(HAMA)微球中,实现关节腔内持续药物释放与荧光成像。
3、叶酸受体介导的靶向作用使纳米胶束特异性识别M1型巨噬细胞,调控M1/M2极化比例,减轻炎症并促进软骨修复。
4、体内外实验表明,该系统具有良好的生物相容性、靶向性和治疗潜力,为OA的微创诊疗提供了新策略。
本研究构建的“纳米胶束-水凝胶微球”复合系统(HAMA@FPTD)在技术设计上为何要采用复杂的双重包载策略?与单一载体系统相比,其核心优势究竟何在?
这种看似复杂的双重包载策略并非多余,而是为了解决单一载体系统在时空控制上的固有缺陷,是实现“长效缓释”与“精准靶向”协同作用的精妙设计。
单一水凝胶微球(HAMA)虽具良好缓释性和润滑作用,但难以有效负载疏水药物,且缺乏细胞靶向性。单一纳米胶束(FPTD)可高效包载疏水药物并通叶酸修饰实现主动靶向,但在关节腔内易被清除,作用时间短。
HAMA@FPTD系统的核心优势在于:
时空分级控制:该系统实现了对药物的两次控制。第一级(空间控制):水凝胶微球作为“仓库”,将大量纳米胶束锚定在关节腔内,防止其被快速清除,极大地延长了药物作用的总时间(释放周期延长至21天)。第二级(时间控制):从水凝胶中缓慢释放出的FPTD纳米胶束,再执行其靶向细胞的任务。这种“先蓄力,再精准打击”的策略确保了药物在正确的地点(关节腔)、足够长的时间尺度上持续作用。
功能分离与整合:水凝胶主要负责宏观的滞留与缓释,而纳米胶束主要负责微观的靶向与递送。二者各司其职,又整合为一体,实现了1+1>2的效果。
本研究通过巧妙的材料组合和层级结构设计,协同解决了药物溶解度、体内滞留时间、细胞靶向性和可控释放等多重挑战。未来的药物递送系统设计应更多地考虑这种“多功能集成”和“分级控制”的思路。
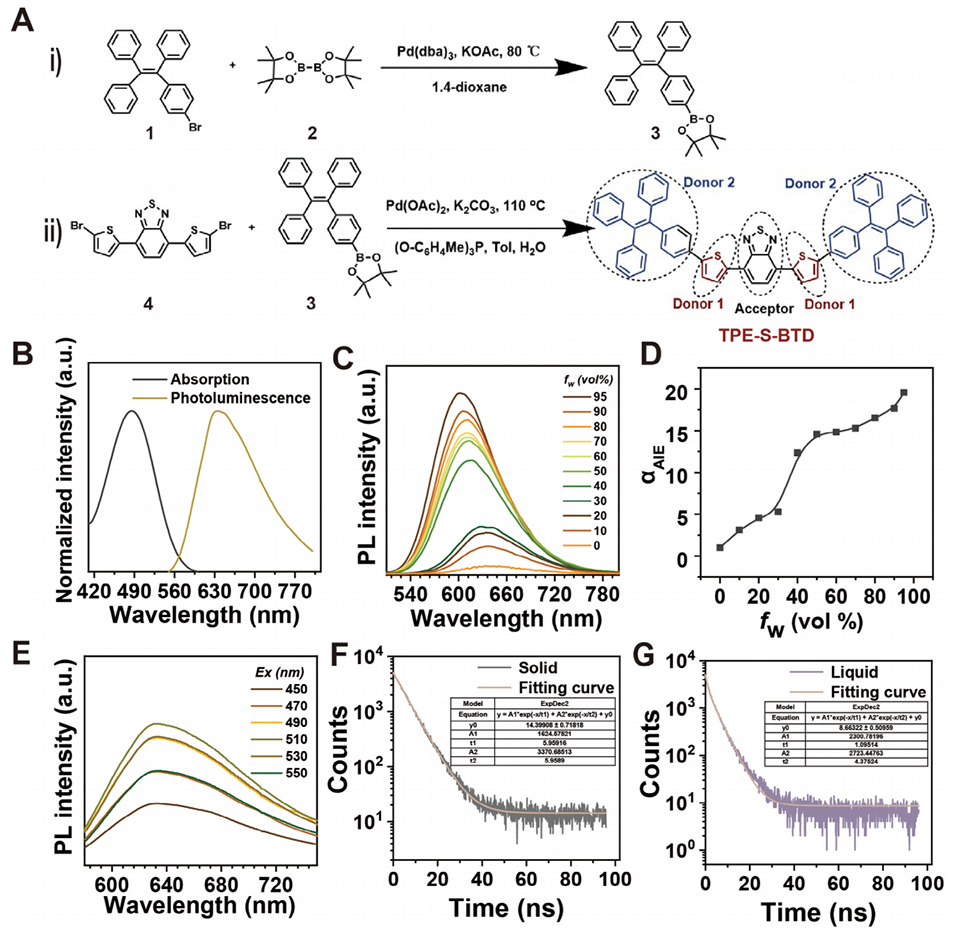
图1. TPE-S-BTD 的合成与表征。A)TPE-S-BTD 的合成流程。B)TPE-S-BTD 在四氢呋喃(THF)中的吸收光谱与光致发光光谱,浓度 c=1×10-5 M。C)TPE-S-BTD 在 THF 及不同 H2O 体积分数的 THF/H2O 混合体系中的光致发光(PL)光谱。激发波长:485 nm,TPE-S-BTD 浓度 = 1.0×10-6 M。D)不同 THF/H2O 混合体系中 αAIE 的荧光强度比。E)TPE-S-BTD 在不同激发波长下的 PL 光谱。F)TPE-S-BTD 固态下的荧光寿命曲线。G)TPE-S-BTD 液态下的荧光寿命曲线。
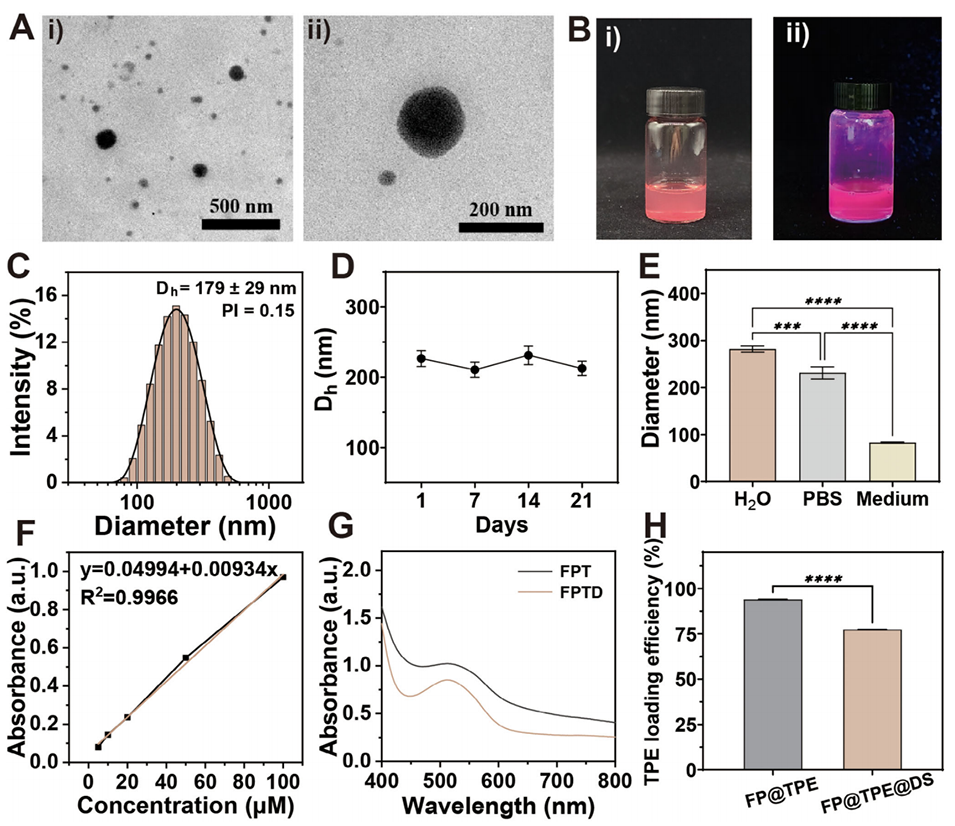
图2. FPTD 纳米胶束的表征。A)纳米胶束的透射电子显微镜(TEM)图像:(i)分散态纳米胶束,(ii)单个纳米胶束。B)FPTD 纳米胶束溶液在不同条件下的宏观外观:i)自然光下;ii)紫外光照射下。C)FPTD 纳米胶束的粒径分布。D)FPTD 纳米胶束在不同天数下的粒径变化(n=3)。E)FPTD 纳米胶束在不同介质中的粒径变化(n=3)。F)TPE-S-BTD 的标准曲线。G)FPT 与 FPTD 的吸收光谱。H)FPT 与 FPTD 纳米胶束中 TPE-S-BTD 的负载效率(LE%)(* 表示 P<0.05)。
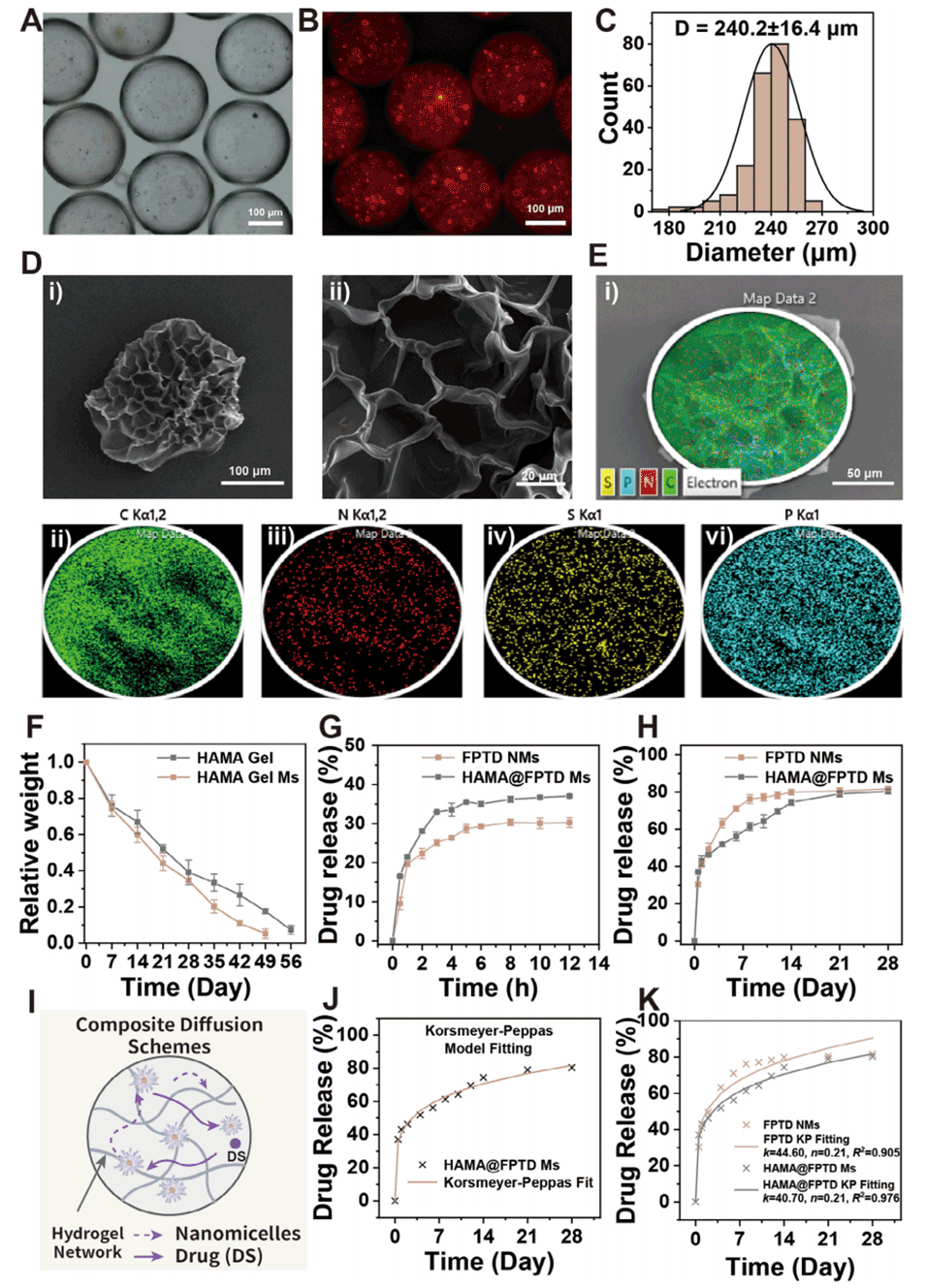
图3. HAMA@FPTD 微球(HAMA@FPTD Ms)的物理表征。A)HAMA@FPTD 微球的明场显微镜图像。B)荧光显微镜图像显示 FPTD 纳米胶束(FPTD NMs)在 HAMA 微球(HAMA Ms)中的分布。C)通过 Image J 统计得到的纳米胶束 - HAMA 微球的粒径分布。D)HAMA@FPTD 微球的扫描电子显微镜(SEM)图像(左图:比例尺 = 100 μm;右图:比例尺 = 20 μm)。E)HAMA@FPTD 的元素分析(比例尺 = 50 μm)。F)HAMA 块状水凝胶与水凝胶微球的体外降解曲线(n=3)。G)FPTD 与 HAMA@FPTD 在 12 小时内的双氯芬酸钠(DS)药物释放曲线(n=3)。H)FPTD 与 HAMA@FPTD 在 28 天内的 DS 药物释放曲线(n=3)。I)DS 在 HAMA@FPTD 中的复合扩散示意图。J)HAMA@FPTD 的药物释放动力学拟合曲线(Korsmeyer-Peppas 模型)。K)FPTD 与 HAMA@FPTD 的药物释放动力学对比拟合曲线。
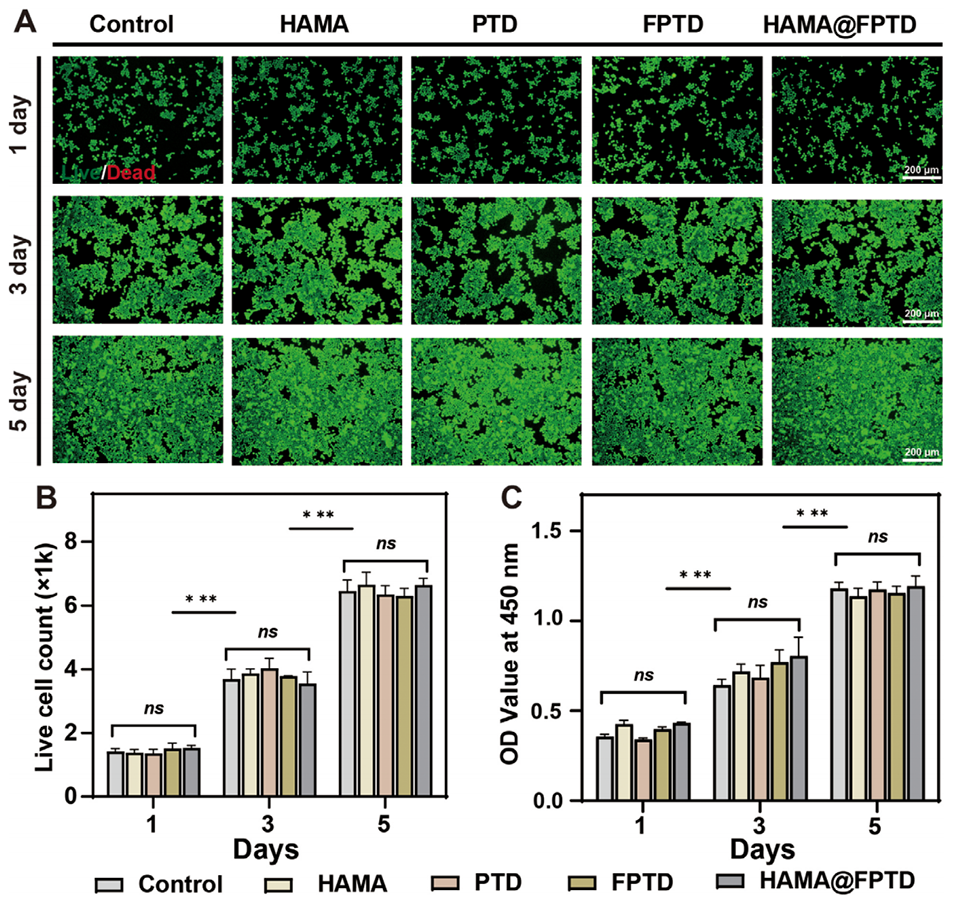
图4. HAMA@FPTD 水凝胶微球的生物相容性。A)培养 1、3、5 天的活/死(绿色/红色)荧光染色结果(比例尺 = 200 μm)。B)由活/死染色实验得到的活细胞计数结果。C)培养 1、3、5 天的 CCK-8 实验结果。OD:光密度值。(ns:无统计学意义,* 表示 P<0.05)。
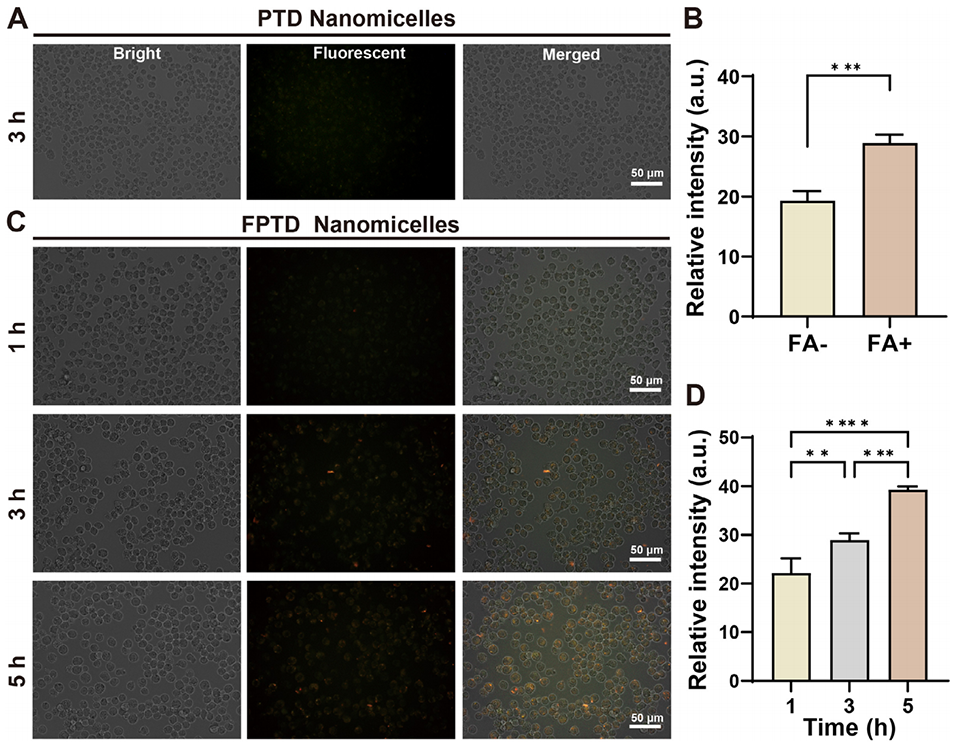
图5. FPTD 纳米胶束对 M1 型巨噬细胞的靶向能力。荧光图像显示活化的 RAW 264.7 巨噬细胞在指定时间点对 PTD(A)和 FPTD(C)的内吞情况。纳米胶束:红色。B)3 小时时 PTD 与 FPTD 的细胞内荧光强度对比。D)1、3、5 小时时的细胞内相对荧光强度(* 表示 P<0.05)。
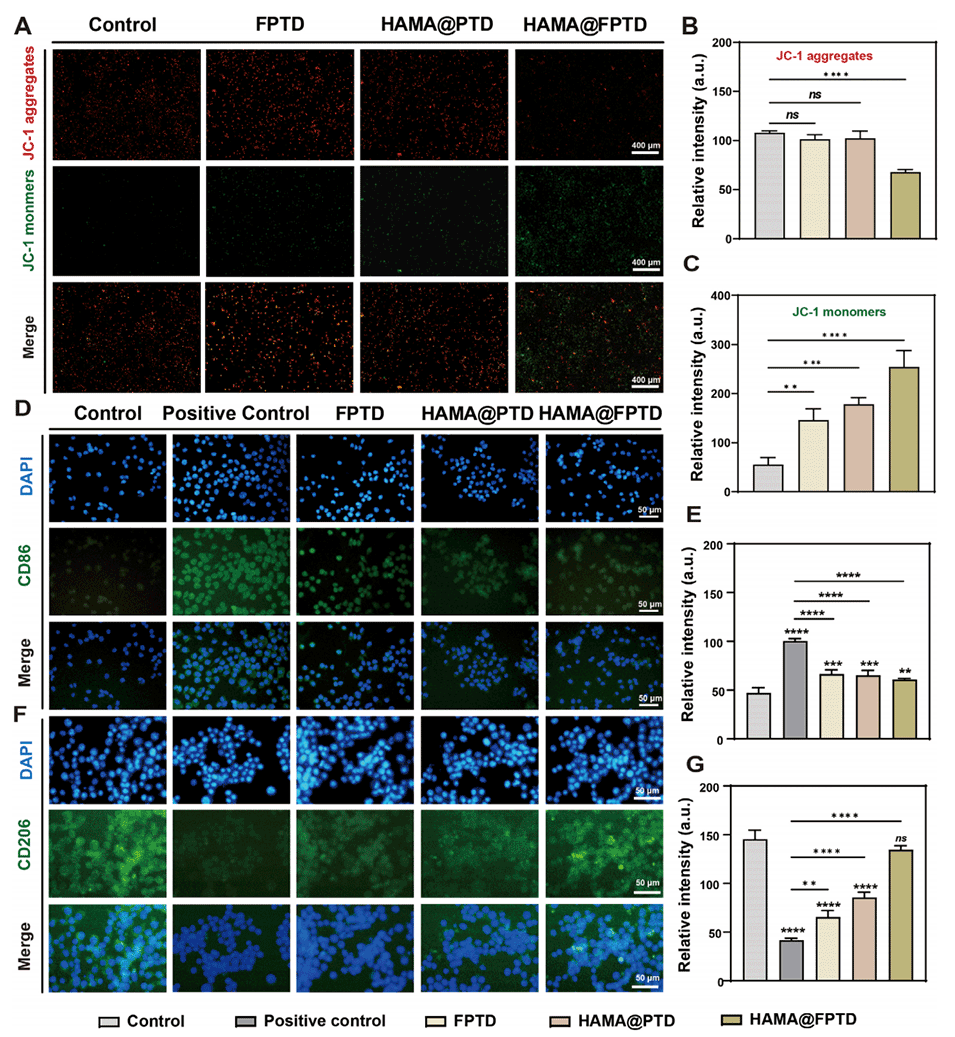
图6. HAMA@FPTD 诱导 M1 型巨噬细胞凋亡及抑制其极化能力的评估。A)不同组别的线粒体膜电位代表性荧光图像。B)各组中 JC-1 聚集体的相对强度。C)各组中 JC-1 单体的相对强度。D)各组 RAW 264.7 巨噬细胞 CD86 的代表性荧光图像。F)各组 RAW 264.7 巨噬细胞 CD206 的代表性荧光图像。细胞核:蓝色。E)各组 CD86 的相对荧光强度。G)各组 CD206 的相对荧光强度(ns:无统计学意义,* 表示 P<0.05)。
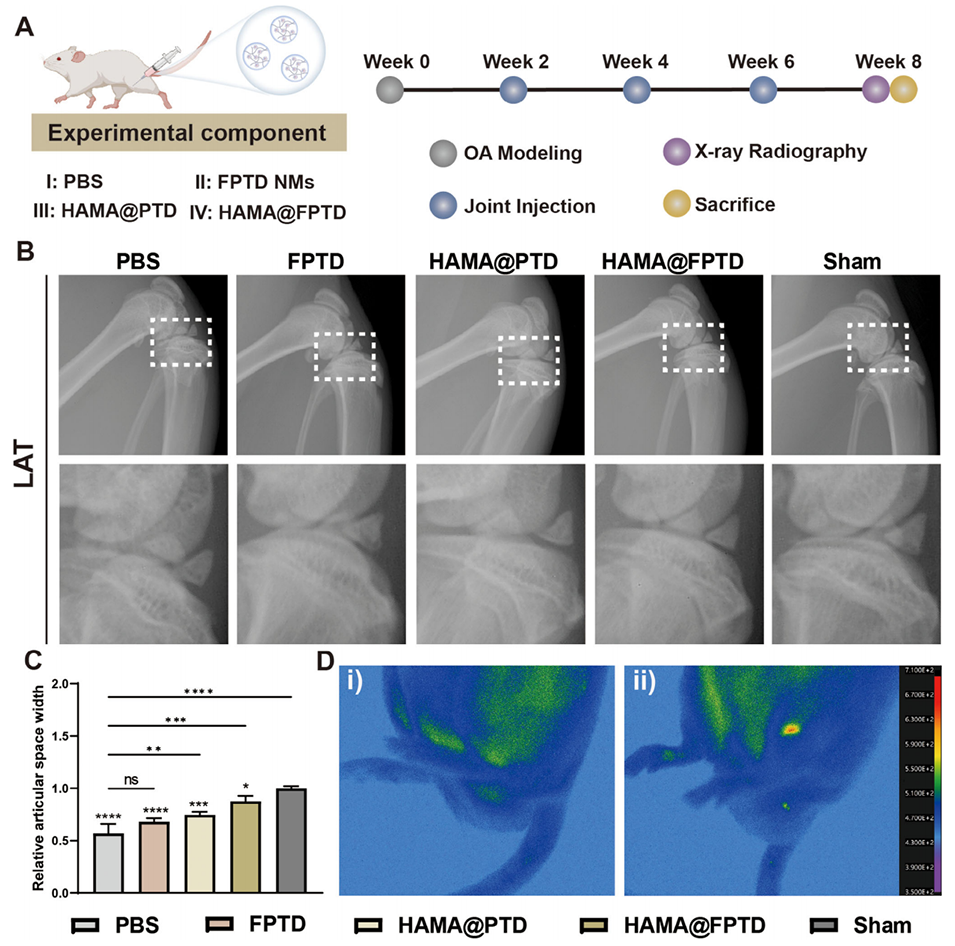
图7. X 线与活体成像系统(IVIS)评估。A)治疗流程示意图。B)不同组别膝关节的代表性 X 线图像。LAT:侧位。C)关节间隙宽度的定量分析结果(ns:无统计学意义,* 表示 P<0.05)。D)磷酸盐缓冲液(PBS)组(i)与 HAMA@FPTD 组(ii)的代表性 IVIS 图像。
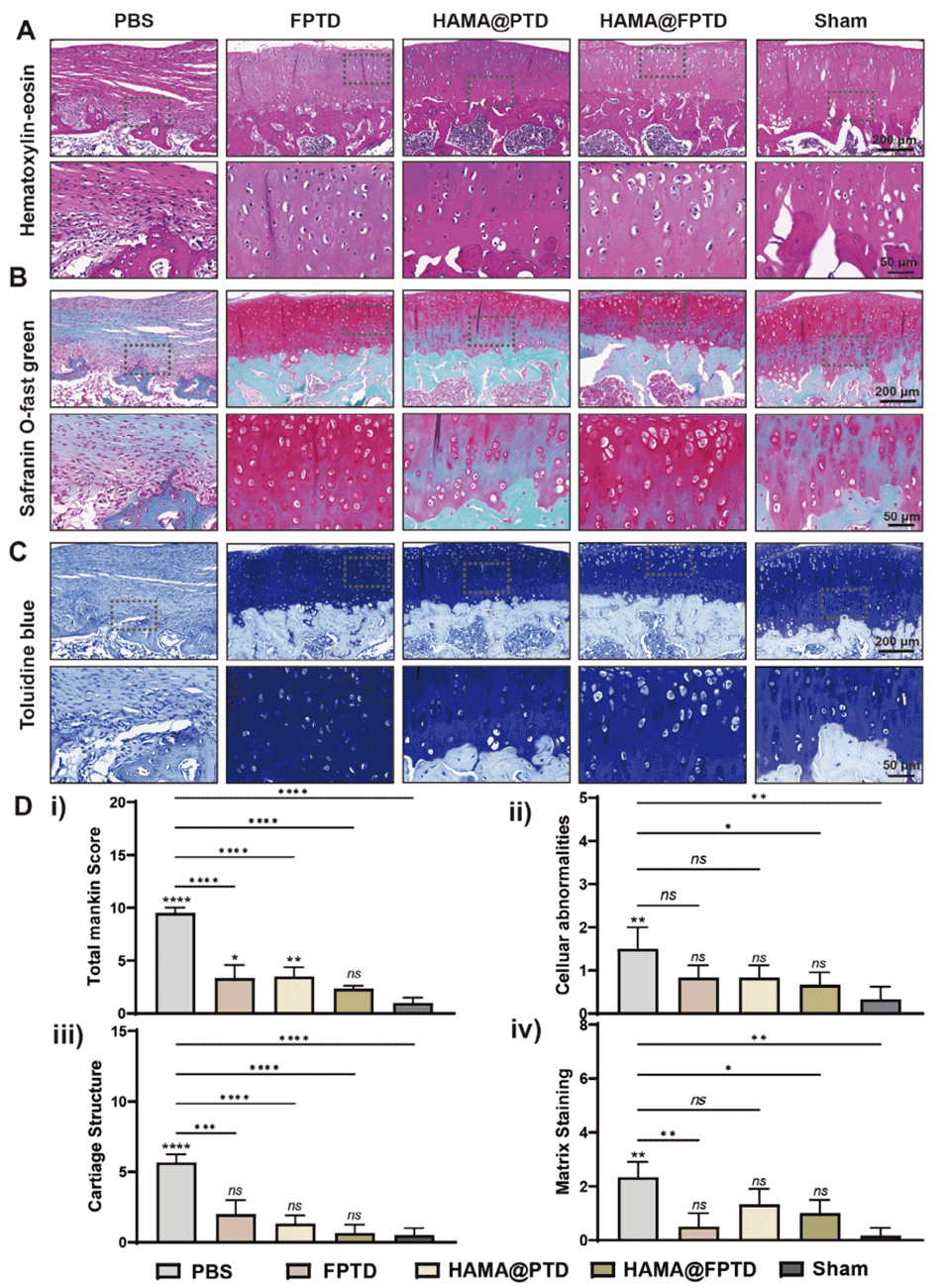
图8. 组织学染色。A)各组的苏木精-伊红(HE)染色代表性图像。B)各组的番红 O - 固绿染色代表性图像。C)各组的甲苯胺蓝染色代表性图像。D)关节软骨的组织学评分:(i)总 Mankin 评分;Mankin 评分细分项包括(ii)细胞异常、(iii)软骨结构、(iv)基质染色(ns:无统计学意义,* 表示 P<0.05)。
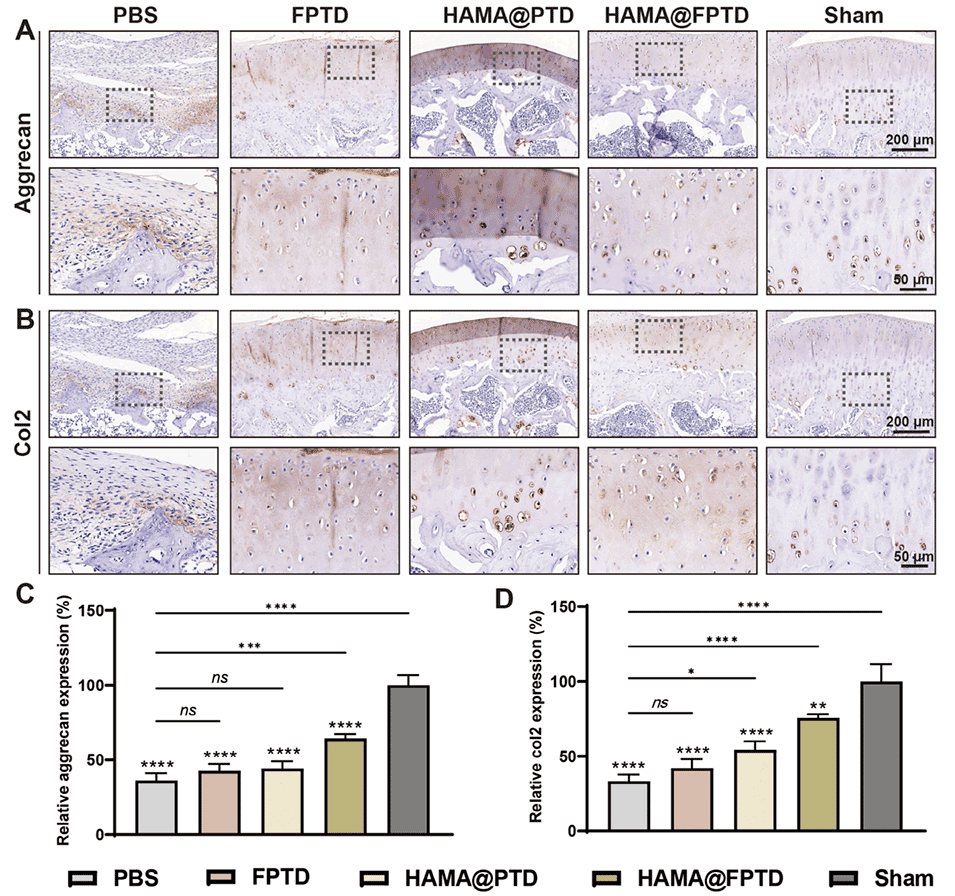
图9. 免疫组织化学染色。A)聚集蛋白聚糖(aggrecan)免疫组织化学染色的代表性图像。B)Ⅱ 型胶原(Col2)免疫组织化学染色的代表性图像。C)聚集蛋白聚糖相对表达量的定量分析。D)Ⅱ 型胶原相对表达量的定量分析(ns:无统计学意义,* 表示 P<0.05)。
论文链接:https://doi.org/10.1002/adhm.202503349
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














